核糖核酸(ribonucleic acid,RNA)提取和纯化是分子生物学研究的基础内容,在进行体外反转录、RNA序列分析、基因克隆等研究时都需要完整性好、纯度高的RNA。酿酒酵母(Saccharomyces cerevisiae)作为重要的模式生物,也是最早被研究的生物之一[1],它的RNA提取实际上是酵母菌细胞壁和细胞膜破裂后释放出其中的营养物质[2],通过不同的方法去除细胞中的其他内含物,如糖类、脂类和蛋白质等杂质,最后得到高质量RNA的过程。然而酿酒酵母细胞壁呈甘露聚糖-蛋白质-葡聚糖的三明治结构[3-4],成分复杂,细胞壁坚韧且厚[5],如果破壁效果不佳,胞内产物就不能完全释放,从而干扰RNA的提取。细胞壁的破碎方法有很多[6-9],按是否存在外加作用力,分为两种:机械法[10-12](超声破碎法、磁珠法、高压均质化法等)和非机械法[13-15](酶解法[16]、反复冻融法、自溶法、碱法等),无论哪种方法,都有自身的局限性和不足。目前人们用酶法对酵母细胞壁优化条件的研究很多,但用酶法提取酵母总RNA最优条件的选择还在探索之中。商安全等[17]选用改良TRIzol试剂破壁法及溶菌酶破壁法提取白假丝酵母菌的总RNA,结果显示改良TRIzol试剂破壁法提取获得的白假丝酵母菌总RNA浓度及纯度均显著高于溶壁酶(lyticase)破壁法(P<0.05)。张金桃等[18]通过加入2.5%蜗牛酶并伴随超声波混合处理4 h,以去除酵母菌细胞壁。许甘霏等[19]使用TRIzol试剂裂解联用研磨珠破碎法、单酶酶解法、双酶酶解法、液氮研磨法4种细胞壁破碎方法提取表皮葡萄球菌总RNA,结果显示双酶酶解法和液氮研磨法提取的总RNA完整性好,质量高。
虽然有研究利用酵母破壁酶和蜗牛酶辅助破壁来提高RNA的提取效率[20-21],尚鲜见将两者放在同一体系下进行比较。本研究采用酵母破壁酶和蜗牛酶辅助破壁,并对这两种酶在不同提取温度、提取时间、加酶量进行优化,再利用TRIzol试剂法提取总RNA,通过对提取的总RNA进行浓度和纯度分析,比较酶处理条件对酵母菌总RNA提取的影响,为酵母菌总RNA的提取提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株酿酒酵母(Saccharomyces cerevisiae)GGSF16:广西科技大学发酵工程研究所。
1.1.2 试剂
蜗牛酶(破壁率90%),酵母破壁酶溶液:北京索莱宝科技有限公司;TRIzol试剂:赛默飞世尔科技公司;焦炭酸二乙酯(分析纯):上海吉至生化科技有限公司;β-巯基乙醇(分析纯):上海索莱宝生物科技有限公司;山梨醇(分析纯):天津市大茂化学试剂厂。
1.1.3 培养基及试剂配方
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L,115 ℃灭菌20 min。
0.1%焦炭酸二乙酯(diethyl pyrocarbonate,DEPC)处理水:取1 mL DEPC溶液,用超纯水定容至1 L,处于振荡状态下过夜放置,121 ℃灭菌40 min。
1 mol/L山梨醇缓冲液:取1.8217 g山梨醇溶于10 mL 0.1%DEPC处理水中,用0.45 nm的滤膜进行过滤。
蜗牛酶溶液的配制:取相应质量的蜗牛酶溶于1 mL 1 mol/L山梨醇溶液中。
1.2 仪器与设备
H2100R低温高速离心机:湖南湘仪离心机仪器有限公司;HH系列数显恒温水浴锅:金坛市科析仪器有限公司;B-500超微量分光光度计:上海元析仪器有限公司;JY02S紫外分析仪:北京君意东方电泳设备有限公司;ZWYR-C2402C叠式恒温调速摇床:上海智诚分析仪器制造有限公司;DYY-6D电泳仪:北京市六一仪器厂;BHC-1300 IIA2生物安全柜:阿尔泰实验室设备(北京)有限公司;LDZH-100KBS立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 实验器材预处理
在本次实验中,所有实验器材均用含有0.1%DEPC水过夜浸泡,121 ℃灭菌40 min。在整个实验操作中始终佩戴一次性手套,并及时更换,以避免RNA污染。
1.3.2 酿酒酵母的种子液活化及生长曲线绘制
从YPD平板上挑取酿酒酵母GGSF16单菌落到YPD培养基中,30 ℃、160 r/min培养10 h,按10%接种量接种至YPD培养基中,30 ℃、160 r/min继续培养至OD600nm值为1.0,此为酵母菌菌悬液。
1.3.3 酶处理条件优化
取750μL酵母菌菌悬液,12 000 r/min、4 ℃条件下离心2 min,弃去上清液,保留菌体。
(1)提取温度
①酵母破壁酶:向菌体中加入25 μL酵母破壁酶,470 μL山梨醇缓冲液,5 μL β-巯基乙醇,用移液枪轻轻吹打均匀后,分别置于27 ℃、30 ℃、33 ℃、37 ℃恒温水浴锅中处理45 min,期间每隔15 min上下颠倒混匀。
②蜗牛酶:向菌体中加入250μL30mg/mL蜗牛酶,2.5μL β-巯基乙醇,用移液枪轻轻吹打均匀后,分别置于33 ℃、37 ℃、40 ℃、43 ℃恒温水浴锅中处理1 h,期间每隔15 min上下颠倒混匀。
(2)提取时间
①酵母破壁酶:向菌体中加入25 μL酵母破壁酶,470 μL山梨醇缓冲液,5 μL β-巯基乙醇,用移液枪轻轻吹打混匀,选取酵母破壁酶的最适提取温度,置于恒温水浴锅中分别处理15 min、30 min、45 min、60 min、75 min,期间每隔15 min上下颠倒混匀。
②蜗牛酶:向菌体中加入250 μL 蜗牛酶,2.5 μL β-巯基乙醇,用移液枪轻轻吹打混匀,选取蜗牛酶的最适提取温度,置于恒温水浴锅中分别处理30 min、45 min、60 min、75 min、90 min,期间每隔15 min上下颠倒混匀。
(3)加酶量
①酵母破壁酶:向菌体中分别加入0、12.5 μL、25.0 μL、37.5 μL酵母破壁酶,对应加入495 μL、482.5 μL、470.0 μL、457.5 μL山梨醇缓冲液,再各加5 μL β-巯基乙醇,选取酵母破壁酶最适提取温度及最适提取时间。
②蜗牛酶:向菌体中分别加入250μL10mg/mL、20mg/mL、30 mg/mL、40 mg/mL蜗牛酶,再加2.5 μL β-巯基乙醇,选取蜗牛酶最适提取温度及最适提取时间。
1.3.4 RNA提取
分别向酵母破壁酶及蜗牛酶处理后的样品中加入750μL TRIzol试剂,按商品提供的说明书抽提总RNA。
1.3.5 分析检测
(1)总RNA浓度及纯度检测
利用超微量分光光度计测定总RNA溶液的质量浓度及在波长260 nm、280 nm处的吸光度值,以A260nm/A280nm(评估蛋白质污染),A260nm/A230nm(评估有机溶剂残留)的大小判断RNA样品的纯度。
(2)总RNA完整性检测
取1 μL提取得到的RNA,经1%琼脂糖凝胶电泳(180 V、10 min),用紫外分析仪观察RNA浓度及降解情况。
2 结果与分析
2.1 酿酒酵母GGSF16生长曲线
为探究酿酒酵母GGSF16的生长情况,选取最佳的接种时间,使用分光光度计测定样品在波长600 nm处的吸光度值,结果见图1。
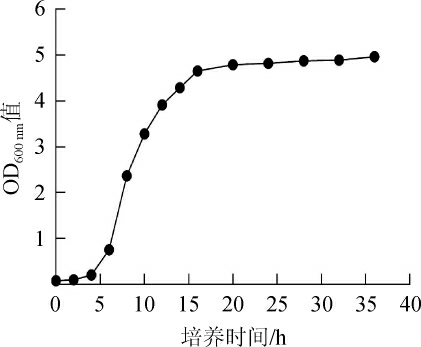
图1 酿酒酵母GGSF16的生长曲线
Fig.1 Growth curve of Saccharomyces cerevisiae GGSF16
由图1可以看出,酿酒酵母GGSF16在6~16 h处于对数生长期,选取10 h的菌体进行扩大培养。
2.2 不同提取温度对酵母总RNA提取的影响
取750 μL酿酒酵母培养液,按1.3.3所述的方法分别提取酵母总RNA,并进行浓度、纯度和电泳分析,结果分别见表1和图2。
表1 不同提取温度获得的RNA浓度和纯度
Table 1 RNA concentration and purity obtained at different extraction temperature
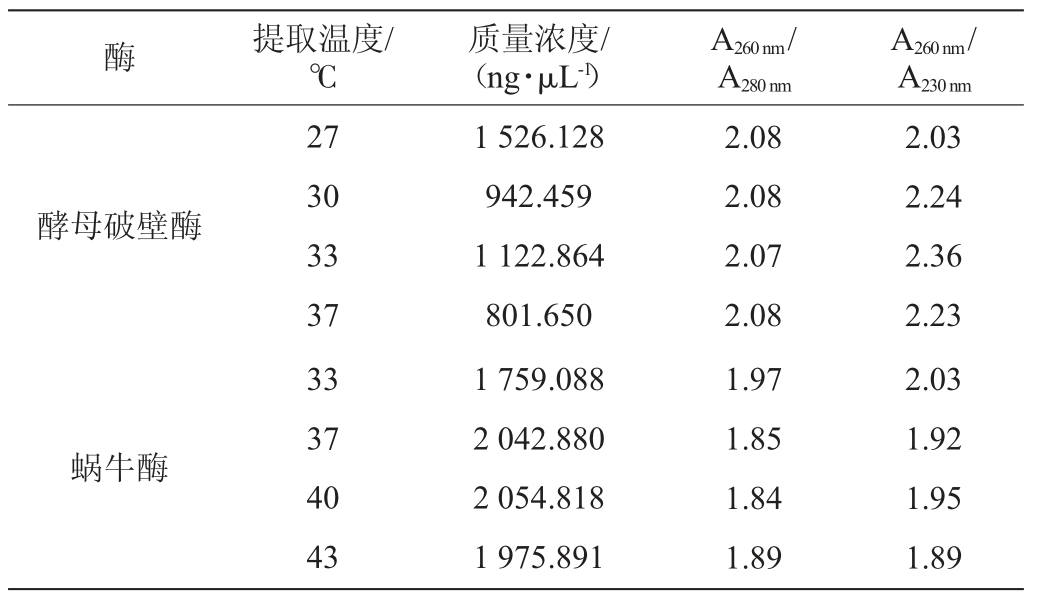
酵母破壁酶是蜗牛酶、纤维素酶等多种酶的混合酶。根据酵母破壁酶的说明书,建议在不超过5×107的酵母培养物离心后加入25 μL酵母破壁酶,30 ℃处理1~2 h,因此,设置酵母破壁酶的温度为27~37 ℃。由图2可以看出,泳道1,2,3均有两条明显的28S rRNA和18S rRNA条带,但也伴有轻微的小片段RNA弥散带,泳道4的两条条带几乎不可见,RNA降解严重。综合表1可以看出,用酵母破壁酶处理后提取的RNA质量浓度较高,均在800 ng/μL以上,A260nm/A280nm均在2.0左右,说明蛋白质或酚类物质污染小,RNA的纯度较高。根据核酸的质量浓度,当提取温度为27 ℃时,核酸质量浓度最高为1 526.128 ng/μL。综合图2和表1,酵母破壁酶的最适提取温度为27 ℃。
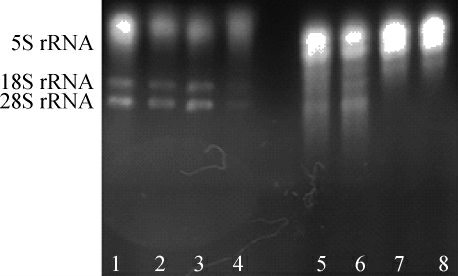
图2 不同提取温度提取酵母总RNA电泳图
Fig.2 Electrophoretogram of total RNA extracted from yeast with different extraction temperature
泳道1~4:酵母破壁酶温度分别为27 ℃,30 ℃,33 ℃,37 ℃;泳道5~8:蜗牛酶温度分别为33 ℃,37 ℃,40 ℃,43 ℃。
蜗牛酶是蜗牛消化液中的一种混合酶制剂,主要含有纤维素酶、蛋白水解酶和果胶酶等二、三十种酶。根据蜗牛酶的说明书,建议每克细胞经30~40 mg酶在37 ℃保温1 h即可溶解酵母细胞壁,因此,设置蜗牛酶的处理温度为33~43 ℃。由表1可以看出,蜗牛酶处理后的核酸浓度很高,在2 000 ng/μL左右,A260nm/A280nm在2.0以下,说明有蛋白质污染,A260nm/A230nm在2.0范围,说明几乎没有其他盐类或杂质的污染。综合图2的电泳图可以看出,泳道5中RNA降解严重,仅能看到28S rRNA,泳道6可以看到较为清晰的28S rRNA和18S rRNA条带,但也出现了降解现象,泳道7,8仅出现了5S rRNA,说明温度太高,RNA已经完全降解。综合图2和表1,蜗牛酶的最适提取温度为37 ℃。
2.3 不同提取时间对酵母总RNA提取的影响
取750 μL酿酒酵母培养液,按1.3.3所述的方法分别提取酵母总RNA,并进行浓度、纯度和电泳分析,结果分别见表2和图3。
根据酵母破壁酶说明书,酵母破壁酶的最佳温育时间为1~2 h,而在预实验中发现当设置为45 min~2 h时,RNA浓度变化不大,但随着时间的延长,RNA降解严重。因此,适当调整温育时间为15~75 min。从表2可以看出,经酵母破壁酶处理后,不同酶处理时间下提取的RNA浓度均很高,在1 500 ng/μL以上,A260nm/A280nm和A260nm/A230nm均在2.0左右,说明基本无蛋白质或其他盐类等杂质污染。综合图2,泳道1,2,3均有亮度较高,条带较好的28S rRNA和18S rRNA条带,而泳道4,5可能由于酶处理时间太长,RNA降解,从而导致电泳图中几乎无条带出现。由于延长酶处理时间可能会使RNA降解,综合图3和表2,当酵母破壁酶处理15 min时RNA浓度和纯度均很高,因此,酵母破壁酶的最适提取时间为15 min。
表2 不同提取时间获得的RNA浓度和纯度
Table 2 RNA concentration and purity obtained with different extraction time
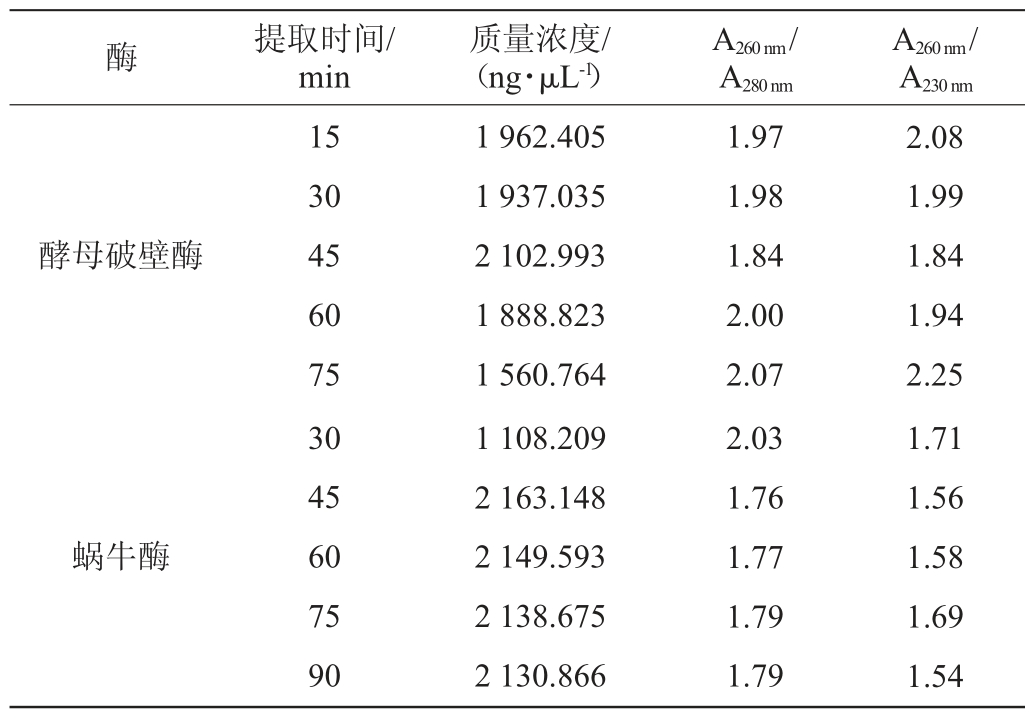
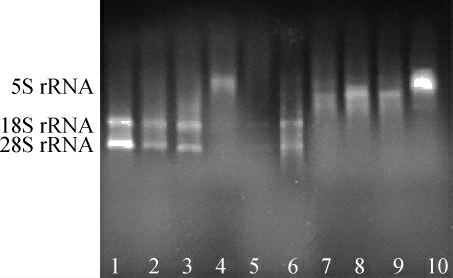
图3 不同提取时间提取酵母总RNA电泳图
Fig.3 Electrophoretogram of total RNA extracted from yeast with different extraction time
泳道1~5:酵母破壁酶时间分别为15 min,30 min,45 min,60 min,75 min;泳道6~10:蜗牛酶时间分别为30 min,45 min,60 min,75 min,90 min。
根据蜗牛酶的说明书,蜗牛酶温育1 h即可溶解酵母细胞壁,因此,设置蜗牛酶的温育时间为30~90 min。由表2可以看出,蜗牛酶处理后的核酸浓度很高,当提取时间>45 min时,核酸质量浓度在2 000 ng/μL以上,但A260nm/A280nm和A260nm/A230nm却不理想,均在2.0以下,说明有蛋白质或其他盐类等杂质污染,导致泳道7~10只有5S rRNA条带。当蜗牛酶的处理时间为30 min时,虽然核酸浓度相对较小,为1 108.209 ng/μL,但泳道6有28S rRNA和18S rRNA条带,只不过条带中伴随有小片段RNA的弥散带,可能是由于A260nm/A230nm在2.0以下,有其他裂解液杂质的残留造成的。综合图3和表2,蜗牛酶的最适提取时间为30 min。
2.4 不同加酶量对酵母总RNA提取的影响
取750 μL酿酒酵母培养液,按1.3.3所述的方法分别提取酵母总RNA,并进行浓度、纯度和电泳分析,结果见表3和图4。
表3 不同加酶量获得的RNA浓度和纯度
Table 3 RNA concentration and purity obtained with different enzyme addition
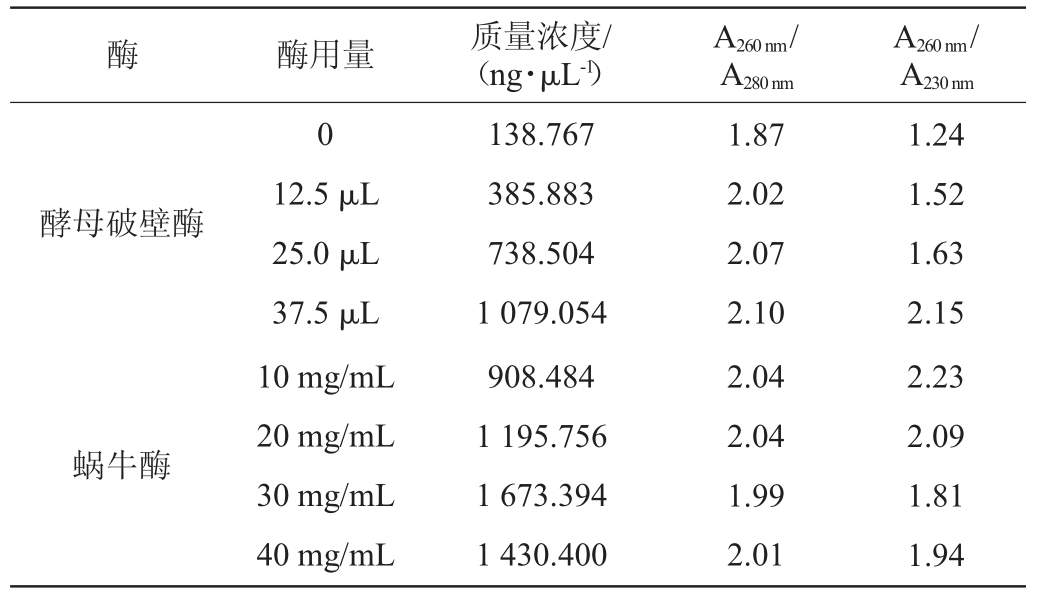
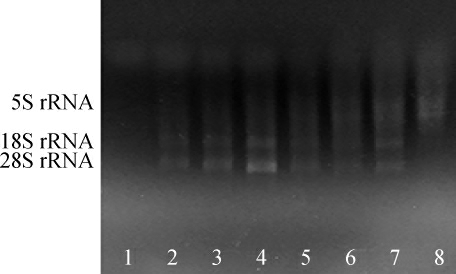
图4 不同加酶量提取酵母总RNA电泳图
Fig.4 Electrophoretogram of total RNA extracted from yeast with different enzyme addition
泳道1~4:酵母破壁酶用量分别为0,12.5 μL,25.0 μL,37.5 μL;泳道5~8:蜗牛酶用量分别为10 mg/mL,20 mg/mL,30 mg/mL,40 mg/mL。
根据酵母破壁酶的说明书,建议在不超过5×107的酵母培养物离心后加入25 μL酵母破壁酶即可溶解酵母细胞壁,因此,设置酵母破壁酶的用量为0~37.5 μL。由图4可以看出,泳道2,3,4有28S rRNA和18S rRNA两条条带,且泳道4的条带相对较亮,综合表3可以看出,随着酵母破壁酶用量的增加,核酸的浓度也在不断的增大,A260nm/A280nm基本在2.0左右,说明无蛋白质或酚类物质污染,而A260nm/A230nm除了酶用量在37.5 μL时为2.0左右,其他酶用量下均在2.0以下,说明只有酵母破壁酶用量在37.5 μL时,基本无其他裂解液杂质的污染。综合图4和表3,酵母破壁酶的最适加酶量为37.5 μL。
根据蜗牛酶的说明书,建议每克细胞经30~40 mg酶处理即可溶解酵母细胞壁,因此,设置蜗牛酶的用量为10~40mg/mL。由图4的电泳图可以看出,泳道5,6的两条28SrRNA和18S rRNA条带基本降解完全,泳道8只有5S rRNA条带,提取效果不佳,而泳道7可以看出,有较为明显的28S rRNA和18S rRNA条带,综合表3,当蜗牛酶的用量为30 mg/mL时,核酸质量浓度达到最大值为1 673.394 ng/μL,此时的A260nm/A280nm为1.99,说明RNA中基本无蛋白质污染。因此,蜗牛酶的最适加酶量为30 mg/mL。
3 结论
在本次实验中酵母破壁酶的最佳提取条件为加酶量37.5 μL,提取温度27 ℃,提取时间15 min;蜗牛酶的最佳提取条件为加酶量30 mg/mL,提取温度37 ℃,提取时间30 min。这次实验表明利用酵母破壁酶辅助破壁可以提取到高质量的酵母总RNA,而利用蜗牛酶辅助破壁只能提取到高浓度的RNA而并不能提取到高质量的RNA,说明蜗牛酶可以较好的破除酵母细胞壁,但不适合利用蜗牛酶辅助破壁提取酵母总RNA,可能不同来源的蜗牛酶及其酶活力,操作过程中酶的添加顺序等都会影响酵母总RNA的提取。
[1]白逢彦.酿酒酵母属的分类学研究进展[J].微生物学通报,2000,17(2):139-142.
[2]ISLAM M S,ARYASOMAYAJULA A,SELVAGANAPATHY P R.A review on macroscale and microscale cell lysis methods[J]. Micromachines,2017,8(3):83-109.
[3]WANG J J,LI M Q,ZHENG F Y,et al.Cell wall polysaccharides:before and after autolysis of brewer's yeast[J].World J Microbiol Biotechn,2018,34(9):137-144.
[4]LESAGE G,BUSSEY H.Cell wall assembly in Saccharomyces cerevisiae[J].Microbiol Mol Biol R,2006,70(2):317-343.
[5]MORENO I,TUTRONE N,SENTANDREU R,et al.Saccharomyces cerevisiae Rds2 transcription factor involvement in cell wall composition and architecture[J].Int Microbiol,2008,11(1):57-63.
[6]康洁.营养型酵母细胞破壁方法的研究[J].商丘师范学院学报,2018,34(6):33-39.
[7]朱晓丽,刘口妍,任峰,等.金黄色葡萄球菌总RNA 提取的研究[J].智慧健康,2018,4(30):20-21.
[8]SHEDLOVSKIY D,SHCHERBIK N,PESTOV D G.One-step hot formamide extraction of RNA from Saccharomyces cerevisiae[J].RNA Biol,2017,14(12):1722-1726.
[9]易弋,容元平,程谦伟,等.不同破壁方法提取酵母菌总RNA 的比较[J].食品科学,2011,32(11):161-164.
[10]VERDUYN C,SUKSOMCHEEP A,SUPHANTHARIKA M.Effect of high pressure homogenization and papain on the preparation of autolysed yeast extract[J].World J Microbiol Biotechn,1999,15(1):57-63.
[11]BYSTRYAK S,SANTOCKYTE R,PESHKOVSKY A S.Cell disruption of S.cerevisiae by scalable high-intensity ultrasound[J].Biochem Eng J,2015,99:99-106.
[12]徐栋,王春维.高压均质与酶法破碎酵母细胞壁的工艺条件研究[J].饲料工业,2009,30(12):48-51.
[13]TAKALLOO Z,NIKKHAH M,NEMATI R,et al.Autolysis plasmolysis and enzymatic hydrolysis of baker's yeast (Saccharomyces cerevisiae):a comparative study[J].World J Microbiol Biotechn,2020,36(5):1-14.
[14]石豪磊,赵国正,孔祥君,等.碱法破壁-酶法提取葡萄酒废酵母细胞壁多糖的工艺研究[J].中国酿造,2018,37(12):88-92.
[15]相晨曦,王安利,廖绍安,等.不同破壁方法获取海洋毕赤酵母提取物及其应用[J].华南师范大学学报,2018,50(6):66-73.
[16]王志博,潘军,张永根,等.用酶法对啤酒酵母细胞破壁优化条件的研究[J].东北农业大学学报,2008,39(3):76-79.
[17]商安全,魏军,王微微,等.改良破壁法提取白假丝酵母菌总RNA 的应用评价[J].临床检验杂志,2016,34(7):552-554.
[18]张金桃,周传云,侯爱香.提高酵母菌原生质体制备的方法研究[J].酿酒科技,2008(5):56-58.
[19]许甘霏,官妍.表皮葡萄球菌总RNA 小量提取方法比较[J].生物学杂志,2017,34(6):101-104.
[20]王静,潘孝明,刘宇,等.酶法合成RNA 的相关技术研究进展[J].生物技术通报,2016,32(3):44-51.
[21]贾艳萍,魏群,赵军.对酵母细胞酶法破壁的研究[J].中国酿造,2005,24(9):11-13.