葡萄酒的风味物质主要来源于葡萄本身的香气和由酵母发酵产生的代谢产物[1-3]。为获得优质葡萄酒,发挥各葡萄品种的优良品质,选用合适的酵母菌十分重要[4-7]。一般都采用商业化酵母进行葡萄酒发酵,商业化酵母的使用与传统的自然发酵相比有明显的优势,可以提高葡萄酒生产的安全性,发酵过程容易控制,保证葡萄酒最终的质量[4]。然而商业化酵母的使用,使葡萄酒产区风格特征不明显,产品同质化严重。本土酵母已适应本地的微环境,易于在葡萄酒发酵中起到主导作用,更重要的是,使用本土酵母酿造的葡萄酒可以保证产区的典型特色[5]。
宁夏贺兰山东麓作为中国主要的葡萄酒产区之一,拥有典型的气候特征、独特的地理环境,蕴藏着丰富的酵母资源,已有大量研究人员在贺兰山东麓葡萄产区的酵母菌资源分离、鉴定方面开展了一定的研究工作[8-13],但贺兰山产区酵母资源数量庞大、种类丰富,仍存在很多未知、待开发的优良酵母。因此,开展对宁夏贺兰山产区葡萄酒酵母的分离、鉴定及多样性分析对展现宁夏产区葡萄酒的地域特征将具有重要意义。
为了分析宁夏贺兰山东麓葡萄自然发酵液中酵母多样性,本研究拟从宁夏贺兰山东麓不同产区(广夏、立兰、银川和红寺堡)葡萄酒自然发酵不同阶段分离酵母菌,并采用WL培养基与26S rDNA D1/D2序列分析法对分离酵母菌株进行鉴定,并对发酵过程中的酵母多样性进行分析。宁夏贺兰山东麓葡萄自然发酵汁中酵母的多样性分析不仅为该产区酵母的开发利用奠定基础,也将为其他产区酵母筛选提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料葡萄样品:采集于贺兰山东麓产区(广夏、立兰、银川和红寺堡)四个不同葡萄种植基地。
1.1.2 化学试剂
酵母浸粉、蛋白胨、琼脂粉、胰蛋白胨(均为生化试剂)、葡萄糖、磷酸二氢钾、氯化钾、氯化钙、硫酸镁、氯化铁、硫酸锰、溴甲酚绿(均为化学纯):国药集团化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose agar,YPDA)培养基:酵母浸粉10 g/L,蛋白胨20 g/L,葡萄糖20 g/L,琼脂粉1.50 g/L,自然pH值,蒸馏水1 L。121 ℃湿热灭菌20 min。
WL营养琼脂培养基配制:
母液:胰蛋白胨5 g/L,酵母浸粉4 g/L,葡萄糖50 g/L,琼脂20 g/L。
储液A:磷酸二氢钾5.5 g,氯化钾4.25 g,氯化钙1.25 g,硫酸镁1.25 g,溶于200 mL蒸馏水,高压灭菌后4 ℃保存。使用时按2 mL/100 mL加入。
储液B:氯化铁0.25 g,硫酸锰0.25 g,溶于100 mL蒸馏水,高压灭菌后4 ℃保存。使用时按100 μL/100 mL加入。
储液C:0.088 g溴甲酚绿溶解于4 mL体积分数为50%乙醇溶液中(配制体积分数为50%乙醇溶液时所用的器皿和蒸馏水都需要高压灭菌),使用时按100 μL/100 mL加入。
按比例将储液A和储液B加入母液中,pH 6.5左右,121℃灭菌20min,冷却至65℃加入储液C,混匀倒平板备用。
1.2 仪器与设备
SW-CJ-IF超净工作台:苏中净化设备有限公司;GI80TR立式灭菌锅:美国致微仪器有限公司;SZ-93自动双重纯水蒸馏器:上海亚荣生化仪器厂;WD-9413B凝胶成像分析仪、DYY-8C型电泳仪:北京六一生物科技有限公司;T960型聚合酶链式反应(polymerase chain reaction,PCR)仪;杭州博日科技有限公司。
1.3 实验方法
1.3.1 葡萄酒的自然发酵
将采集的葡萄进行破碎、除梗,送入130 L发酵罐后开始低温浸渍12 h,后在28 ℃静置发酵,待残糖降至4 g/L时,即主发酵结束。
1.3.2 不同产区葡萄自然发酵液中酵母菌的分离
在自然发酵葡萄汁中,分别取发酵初期、中期、晚期的发酵液,采用稀释涂布法将发酵液涂布于YPDA培养基上,28 ℃培养3 d,随机挑取20~30个菌落,划线分离单菌株后转接至YPDA斜面培养基,4 ℃保藏备用。同时用体积分数20%甘油保藏酵母液体培养液,-80 ℃冰箱保存。
1.3.3 酵母菌株的初步形态分类
将保藏的酵母菌株接种于YPDA培养基上,28 ℃静置培养2 d,挑取单菌落,并划线接种于WL培养基上,28 ℃静置培养4~6 d后观察并记录菌落颜色和形态,对菌株进行初步分类。
1.3.4 酵母菌株基因组DNA提取
根据WL培养基的初步形态分类结果,在每一类型中随机挑选1~3株酵母菌,制备PCR的脱氧核糖核酸(deoxyribonucleic acid,DNA)模板,提取方法参照石英砂振荡破壁法[14-15]。
1.3.5 酵母菌株26S rDNA D1/D2区序列分析
采用正向引物NL-1(5'-GCATATCAATAAGCGGAGGAAAAG-3'),反向引物NL-4(5'-GGTCCGTGTTTCAAGACGG-3')扩增26S rDNA D1/D2区序列。26S rDNA D1/D2区扩增体系50 μL:引物NL-1,NL-4(10 μmol/L)各3 μL,10×PCR缓冲液(含Mg2+)5.0 μL,脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTP)(2.5 mmol/L)4.0 μL,Taq DNA 聚合酶0.5 U,DNA模板(250 ng/μL)1 μL,最后加双蒸水定容至50 μL[16]。
PCR 扩增程序:95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸2 min;扩增35个循环;72 ℃延伸10 min。
将PCR 扩增产物通过1.5%琼脂糖凝胶电泳验证目标条带,若在600 bp左右出现目标条带,则将PCR扩增产物送到上海生工生物工程有限公司进行纯化和测序。将测序得到的序列对照序列图谱进行人工校正,校正后的序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI),在Genbank核酸序列数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源序列比对,找出相似性较高的核酸序列,确定与模式菌种相匹配的供试菌株的种类。
1.3.6 数据处理及分析
实验采用Microsoft Office 2016和GraphPad Prism 6.0对数据进行整理统计和作图。
2 结果与分析
2.1 酵母菌株的形态分类
从不同产区葡萄自然发酵过程中共分离316株酵母,统计结果见表1。不同酵母菌在WL培养基(28 ℃培养4~6 d)上的菌落形态差异显著,具体见图1。根据所分离酵母菌在WL培养基上的颜色和形态的差异,可将这316株酵母菌初步分为14种,每种的菌落形态描述见表2。
表1 不同产区的葡萄自然发酵过程中分离酵母菌的数量
Table 1 Number of yeast strains isolated from spontaneous fermentation processes in different grape regions

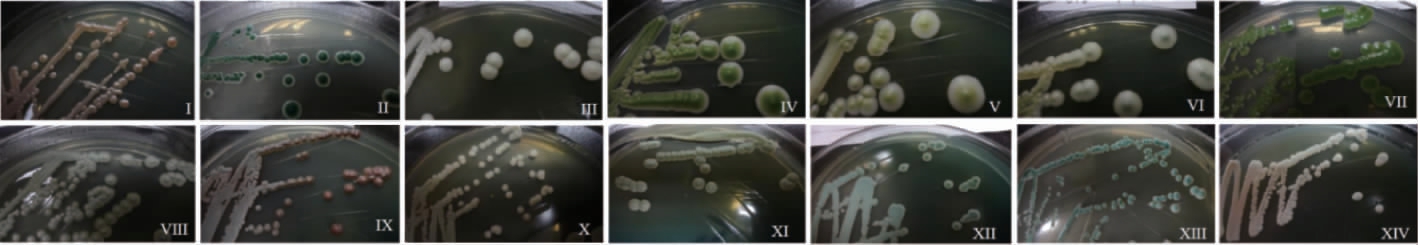
图1 自然发酵液中分离到的酵母菌在WL培养基上的形态
Fig.1 Colony morphology of yeasts isolated from spontaneous fermentation grape juice on WL medium
表2 自然发酵葡萄汁中分离到的酵母在WL培养基上的菌落形态描述
Table 2 Description of colony morphology of yeasts isolated from spontaneous fermentation grape juice in WL medium

2.2 酵母菌株26S rDNA D1/D2区序列分析
随机挑选表2中每种类型的酵母1~3株,共挑取31株酵母。按照方法1.3.4和1.3.5分别提取基因组、扩增26S r DNA D1/D2序列,扩增产物进行1.5%琼脂糖凝胶电泳验证,结果见图2,扩增产物的测序和分析比对结果见表3。由图2可知,31株酵母的26Sr DNA D1/D2序列碱基大小为500~750 bp。
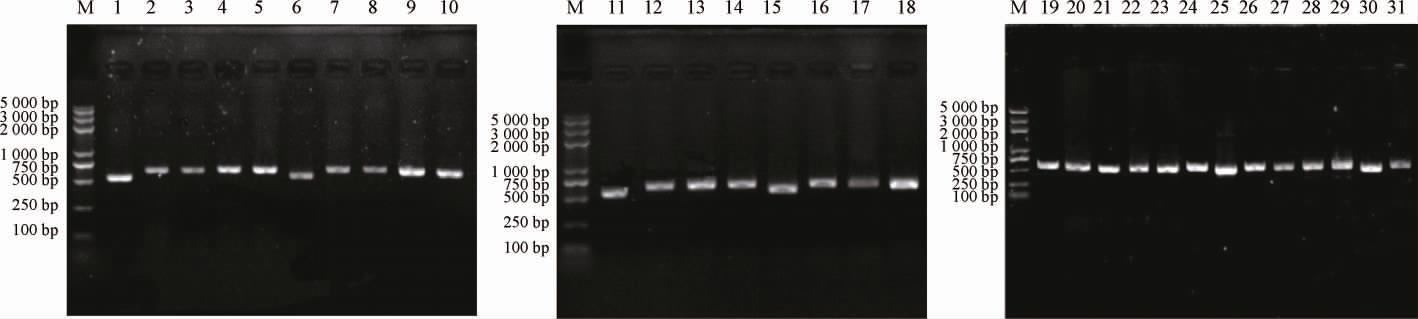
图2 酵母菌株26S rDNA D1/D2区序列扩增产物验证
Fig.2 Validation of amplification products of 26S rDNA D1/D2 region sequence of yeast strains
M为DNA Marker,1~31号泳道依次为上述31株酵母扩增产物的电泳验证情况。
表3 葡萄自然发酵中酵母菌的26S rDNA D1/D2序列分析结果
Table 3 Analysis results of 26S rDNA D1/D2 sequence of the yeast isolated from spontaneous fermentation of grape

由表3可知,在WL培养基上显示菌落形态不同的14种类型的酵母菌,经26S rDNA D1/D2区基因序列验证被归为6个属的9个种。形态I和形态IX在WL培养基上颜色相同,形态略有差别,形态I表面光滑,而形态IX表面褶皱,鉴定结果显示两者均为美极梅奇酵母(Metschnikowia pulcherrima)。形态II中随机挑选的4株酵母菌,经分子鉴定后均为Candida zemplinina,形态与分子鉴定结果较一致。另外,形态VII、VIII、X、XII和XIV的分子鉴定结果分别为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、克鲁维毕赤酵母(Pichia kluyveri)、Candida californica和Pichia galeiformis。形态III、IV、V、VI和XIII经序列比对后同属酿酒酵母(Saccharomyces cerevisiae)。然而,从形态XI中随机挑选的3株酵母菌,经序列比对后,其中两株同属酿酒酵母(S.cerevisiae),而另一株则鉴定为戴尔有孢圆酵母(Torulaspora delbrueckii)。
2.3 不同产区葡萄自然发酵过程中酵母菌动态分析
为了探讨不同酵母在不同产区自然发酵汁中的动态变化,对已鉴定的9种酵母在不同产区、不同发酵时间的分离比例进行了统计分析,结果见图3。
由图3A可知,在广夏产区葡萄自然发酵过程中共分离到4种酵母菌,分别为C.zemplinina、有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)和酿酒酵母(S.cerevisiae),它们都出现于发酵的第1天,随着发酵时间的延长,到发酵第3天未分离到美极梅奇酵母(M.pulcherrima)。同样地,C.zemplinina和有孢汉逊酵母(H.uvarum)的生长分别在第5天和第7天被明显抑制,直至发酵结束也未分离到。C.zemplinina、有孢汉逊酵母(H.uvarum)和美极梅奇酵母(M.pulcherrima)主要存在于发酵前期,并且以有孢汉逊酵母(H.uvarum)为优势菌种,酿酒酵母(S.cerevisiae)存在于整个发酵过程中,并且在发酵中期和后期占主导地位,且酿酒酵母(S.cerevisiae)在发酵第7天的分离比例达到100%,直至发酵结束,这与张春芝等[9]的报道结果一致。
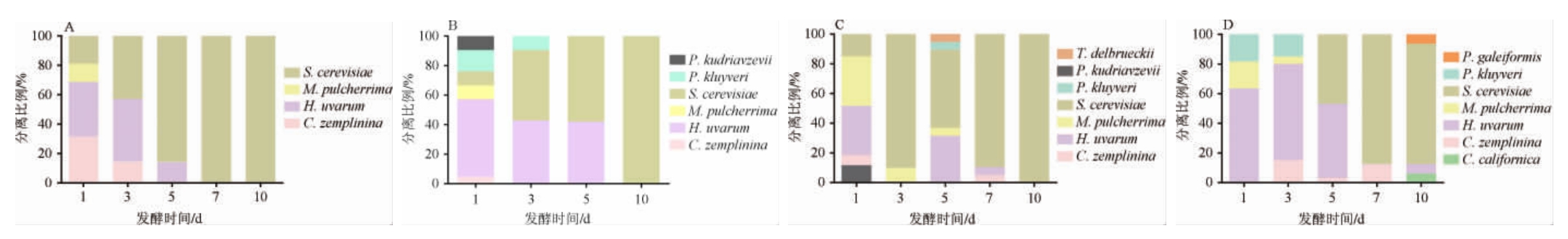
图3 不同产区葡萄自然发酵过程中酵母菌种类及分离比例
Fig.3 Yeast species and its isolation proportion during spontaneous fermentation of grape in different wineries
A表示广夏产区,B表示立兰产区,C表示银川产区,D表示红寺堡产区。
由图3B可知,在立兰产区葡萄自然发酵过程中共分离到6种酵母菌,分别为C.zemplinina、有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)、克鲁维毕赤酵母(P.kluyveri)、库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)和酿酒酵母(S.cerevisiae)。发酵第1天,共分离到6个种的酵母菌,其中以有孢汉逊酵母H.uvarum为优势菌种;从发酵第3天的不同菌株的分离比例可以看出,有孢汉逊酵母(H.uvarum)和酿酒酵母(S.cerevisiae)成为此时发酵液中的优势菌种。随着发酵时间的延长,酿酒酵母(S.cerevisiae)逐渐显示出比有孢汉逊酵母(H.uvarum)更强的生长优势,发酵结束,发酵液中只分离到酿酒酵母(S.cerevisiae)。
由图3C可知,在银川产区葡萄自然发酵过程中共分离到7种酵母菌,分别为C.zemplinina、有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)、克鲁维毕赤酵母(P.kluyveri)、库德里阿兹威氏毕赤酵母(P.kudriavzevii)、酿酒酵母(S.cerevisiae)和戴尔有孢圆酵母(T.delbrueckii)。在第1天的发酵液中分离到5个种的酵母菌,分别为C.zemplinina、有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)、库德里阿兹威氏毕赤酵母(P.kudriavzevii)和酿酒酵母(S.cerevisiae),其中以有孢汉逊酵母(H.uvarum)和美极梅奇酵母(M.pulcherrima)为优势菌种。到发酵第5天又新增克鲁维毕赤酵母(P.kluyveri)和戴尔有孢圆酵母(T.delbrueckii),此时发酵液中的优势菌种为有孢汉逊酵母(H.uvarum)和酿酒酵母(S.cerevisiae)。随着发酵时间的延长,酿酒酵母(S.cerevisiae)逐渐占据主导地位,直至发酵结束,酿酒酵母(S.cerevisiae)的分离比例达到100%。
由图3D可知,在红寺堡产区葡萄自然发酵过程中共分离到7种酵母菌,分别为C.californica、C.zemplinina、有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)、毕赤酵母(P.galeiformis)、克鲁维毕赤酵母(P.kluyveri)和酿酒酵母(S.cerevisiae)。在第1天的发酵液中分离到有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)和克鲁维毕赤酵母(P.kluyveri),其中以有孢汉逊酵母(H.uvarum)为优势菌种。发酵第3天新增C.zemplinina,此时有孢汉逊酵母(H.uvarum)仍然是优势菌种。发酵第5天开始分离到酿酒酵母(S.cerevisiae)并成为后期的优势酵母。SAEZ J S等[17]在检测出现异味的葡萄酒中的腐败酵母物种时,发现P.galeiformis能够产生高浓度挥发酚,降低葡萄酒的品质。TRISTEZZA M等[18]还在葡萄酒发酵过程中检测到P.galeiformis能够产生组胺和尸胺,破坏葡萄酒。因此,P.galeiformis被认为是葡萄酒中的腐败酵母,在筛选适用于葡萄酒酿造的酵母菌种时应当将其剔除。
葡萄自然发酵过程中酵母菌的种类及比例总体呈现一个此消彼长的动态过程。从4个不同产区的葡萄发酵过程中均分离到有孢汉逊酵母(H.uvarum)、美极梅奇酵母(M.pulcherrima)、C.zemplinina和酿酒酵母(S.cerevisiae)这4种酵母菌,其中在发酵前期以有孢汉逊酵母(H.uvarum)为优势菌种,随着发酵时间的延长,酿酒酵母(S.cerevisiae)在发酵中占主导地位,甚至到发酵结束时分离比例达到100%。有孢汉逊酵母(H.uvarum)是葡萄酒自然发酵初期存在最为广泛的一种酵母菌,KATHARINA Z等[19-20]均从葡萄酒自然发酵过程中分离到该菌。此外,在立兰、银川和红寺堡产区均分离到克鲁维毕赤酵母(P.kluyveri),而库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)仅存在于立兰和银川产区。除了上述分离比例相对较高的几种酵母菌外,在银川产区葡萄自然发酵液中还分离到戴尔有孢圆酵母(T.delbrueckii),在红寺堡产区葡萄汁自然发酵液中分离到C.californica和P.galeiformis。
3 结论
从广夏、立兰、银川和红寺堡四个产区的葡萄自然发酵过程中共分离到316株酵母菌,采用WL培养基形态分类和26S rDNA D1/D2区序列分析进行菌种鉴定。将其归为9个种,分别为美极梅奇酵母(M.pulcherrima)、C.zemplinina、库德里阿兹威氏毕赤酵母(P.kudriavzevii)、克鲁维毕赤酵母(P.kluyveri)、C.californica、P.galeiformis、戴尔有孢圆酵母(T.delbrueckii)、有孢汉逊酵母(H.uvarum)和酿酒酵母(S.cerevisiae)。各产区的酵母种类和数目均有一定的差异性。而在自然发酵的整个过程中有孢汉逊酵母(H.uvarum)和酿酒酵母(S.cerevisiae)占据主导地位。有孢汉逊酵母(H.uvarum)是发酵前期的优势菌种,酿酒酵母(S.cerevisiae)在发酵中后期逐渐占据主导地位直至发酵结束。了解葡萄产区不同来源酵母的分布及在发酵不同时期的分离情况进行动态分析对葡萄酒的酿造具有重要指导意义,今后可对分离的酵母菌株进行发酵性能测定,筛选出适用于酿酒的优良酵母,更好地服务于葡萄酒产业。本试验已经为广夏、立兰、银川和红寺堡四个产区本土化酵母菌的筛选和发酵过程的动态分析进行初步研究,这不仅为宁夏贺兰山东麓葡萄产区酵母的开发利用奠定了基础,也将为其他产区酵母筛选提供参考依据。
[1]MINAS M,DIMITRIOS T.Contribution of yeast in wine aroma and flavour[M]//MORATA A,LOIRA I.Yeast-industrial applications.Republic of Croatia:Intech Open,2017:115-134.
[2]ALEXANDRE P,LUCILE A,ARMIN S,et al.What is the expected impact of climate change on wine aroma compounds and their precursors in grape[J].Int J Vine Wine Sci,2017,51(2):141-146.
[3]ZHU F M,DU B,LI J.Aroma compounds in wine[M].Republic of Croatia:Intech Open,2016:273-283.
[4]王佳,胡兰兰,张军翔,等.高产β-葡萄糖苷酶野生酵母的筛选及产酶能力差异性分析[J].中国酿造,2018,37(2):50-53.
[5]谢林君,温韬,成果,等.桂葡3 号干白葡萄酒香气特征分析[J].中国酿造,2020,39(2):195-199.
[6]ŠURANSKA H,VRANOVA D,OMELKOVA J.Isolation,identification and characterization of regional indigenous Saccharomyces cerevisiae strains[J].Brazil J Microbiol,2016,47(1):181-190.
[7]MAURIZIO C,FRANCESCA C.Non-Saccharomyces wine yeasts have a promising role in biotechnological approaches to winemaking[J]. Ann Microbiol,2011,61(1):25-32.
[8]王慧,张立强,刘天明,等.葡萄果粒表皮酵母菌多样性研究[J].微生物学通报,2008,35(1):10-14.
[9]张春芝,莫寅斌.宁夏产区酿酒葡萄酵母菌初步分类鉴定及多样性研究[J].中国酿造,2014,33(10):49-54.
[10]冯涛,王旭增,王一非,等.葡萄园土壤中酿酒酵母的分离鉴定及其发酵葡萄酒香气成分分析[J].食品科学,2018,39(14):213-220.
[11]高晓航,李雪雁,孙春丽.贺兰山东麓葡萄酒产区酿酒酵母的分离及其主要特性研究[J].食品与发酵工业,2016,42(6):62-66.
[12]王志恒,刘雅琴,冯翠娥,等.宁夏贺兰山东麓酿酒酵母分离筛选及菌株鉴定[J].食品研究与开发,2017,38(11):176-180.
[13]刘爱国.宁夏贺兰山东麓葡萄酿酒酵母菌的分离及其分类鉴定[D].杨凌:西北农林科技大学,2008.
[14]周小玲,沈微,饶志明,等.一种快速提取真菌染色体DNA 的方法[J].微生物学通报,2004,31(4):89-92.
[15]KANG M J,CHOI Y S,KIM S.A comparison of the ability of fungal internal transcribed spacers and D1/D2 domain regions to accurately identify candida glabrata clinical isolates using sequence analysis[J]. Biomed Sci Lett,2018,24(4):430-434.
[16]FELL J W,BOEKHOUT T,FONSECA A,et al.Biodiversity and systematics of basidiomycetous yeasts as determined by large-subunit rDNA D1/D2 domain sequence analysis[J].Int J Syst Evolut Microbiol,2000,50(3):1351-1371.
[17]SAEZ J S,LOPES C A,KIRS V E,et al.Production of volatile phenols by Pichia manshurica and Pichia membranifaciens isolated from spoiled wines and cellar environment in Patagonia[J].Food Microbiol,2011,28(3):503-509.
[18]TRISTEZZA M,VETRANO C,BLEVE G,et al.Biodiversity and safety aspects of yeast strains characterized from vineyards and spontaneous fermentations in the Apulia Region,Italy[J]. Food Microbiol,2013,36(2):335-342.
[19]KATHARINA Z,CECILE M S,OLIVIER C,et al.Dynamics and diversity of non-Saccharomyces yeasts during the early stages in wine making[J].Int J Food Microbiol,2008,125(2):197-203.
[20]刘树文,常亚维,胡廷,等.不同树龄葡萄自然发酵过程中酵母菌的研究[J].西北农林科技大学学报(自然科学版),2008,36(7):51-56,63.