白酒风味成分多达上百种,与白酒品质优劣密切相关[1-2]。酱香型白酒采用的高温曲是以小麦为原料制成,小麦本身含有大量的酶和蛋白质,在制曲过程中淀粉转化为糖,蛋白质分解成氨基酸,加上堆积发酵的高热能条件下氨基酸和还原型单糖发生美拉德反应而生成酱香物质[3]。
白酒中1%~2%的微量成分是其风味的主要来源。其中,甜味是一种能让人愉悦的口感,特别是在高酒精度的白酒中,微甜味能使酒体更绵柔[4]。酵母菌在酿造过程中,生成酒精的同时能够发酵糖产生多元醇,由于糖不能进入白酒中[5-6],因此多元醇是白酒中甜味物质的主要来源,甜度随羟基数增多而增强[7]。筛选产多元醇的酵母菌,并采用生物转化来完成D-阿拉伯糖醇的生产成为现在比较热门的研究方向[8-9]。本课题组前期从酿造酱香型白酒的大曲和酒醅中筛选出多株产多元醇类物质比较高的酵母菌株,其中Debaryomyces coudertii FBKL2.0130 D-阿拉伯糖醇产量最高,为(12.047±0.85)g/L[10]。在自然界中以天然状态存在的D-阿拉伯糖醇仅在蘑菇和地衣中被发现[11-12],因其含量太少,不能满足人们的需求[13]。
本研究以Debaryomyces coudertii FBKL2.0130为出发菌株,根据酵母中D-阿拉伯糖醇前体物D-核酮糖的代谢途径(见图1)[14-15],利用聚合酶链式反应(polymerase chain reaction,PCR)从中扩增出编码D-阿拉伯糖醇脱氢酶的基因ARD,构建重组质粒Yep-PAK,并将其转入酿酒酵母(Saccharomyces cerevisiae)W303-1A中,得到重组菌株W303-ARD并成功表达,同时,对该重组酶的酶活及酶学性质进行测定,研究该基因对多元醇生成量的影响,为研究构建高产多元醇的酵母工程菌株奠定一定理论基础。
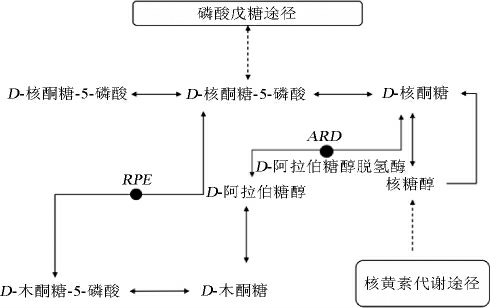
图1 D-核酮糖在酵母中的代谢途径
Fig.1 Metabolic pathways of D-ribulose in yeast
1 材料与方法
1.1 材料与试剂
1.1.1 菌种和质粒
Debaryomyces coudertii FBKL2.0130为贵州大学酿酒与食品工程学院保藏的野生型菌株;酿酒酵母(Saccharomyces cerevisiae)W303-1A及大肠杆菌(Escherichia coli)JM109均保藏于天津科技大学天津市工业微生物重点实验室;pUG-6质粒:宝生物工程(大连)有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:蛋白胨2%,酵母粉1%,葡萄糖2%。pH值自然,固体培养基中加2%琼脂,115 ℃高压灭菌20 min。
LB培养基:蛋白胨1%,酵母粉0.5%,氯化钠1%。pH值自然,固体培养基中加2%琼脂,121 ℃高压灭菌20 min。
模拟酒精发酵培养基[16]:蛋白胨2%,酵母粉1%,葡萄糖14%。pH值自然,115 ℃高压灭菌20 min。
1.1.3 化学试剂
限制性内切酶(10 U/μL)、脱氧核糖核酸(deoxyribonucleic acid,DNA)连接酶(5 U/μL)、Pyrobest高保真DNA聚合酶(5 U/μL):日本TaKaRa公司;质粒小量快速提取试剂盒、DNA胶回收试剂:美国OMEGA公司;一步法定向无缝克隆试剂盒:南京诺唯赞生物科技有限公司;遗传霉素(G418)(100 mg/mL)、氨苄青霉素(100 mg/mL):北京索莱宝科技有限公司;引物合成及基因组测序分析由苏州金唯智生物科技有限公司完成。
1.2 仪器与设备
ZXDP-A2050恒温培养箱:上海智城仪器厂;SS-325型全自动灭菌锅:日本TOMY公司;TGL-16C台式离心机:上海安亭科技仪器厂;Nexus SX1型PCR仪:德国Eppendorf公司;Gellogic212型全自动凝胶成像仪:美国SYNGENE公司;1645050型电泳仪:美国Bio-Rad公司。
1.3 方法
1.3.1 引物设计
参考京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)公布的汉氏德巴利氏酵母(Debaryomyces hansenii)DEHA2A12144g中D-阿拉伯糖醇的代谢关键基因ARD基因序列,采用Primer5.0软件设计用于扩增ARD1基因的引物对ARD1-F和ARD1-R,设计用于扩增与载体Yep-PGK质粒序列Bgl II酶切位点同源的引物ARD-U和ARD-D。根据pUG6质粒序列,采用Primer5.0软件设计用于扩增KanMX抗性基因序列的引物K-Yep-U和K-Yep-D。同时设计用于目的基因验证的引用PGK-F、PGK-R、ARD-F、ARD-R,具体引物信息见表1。
表1 本研究所用PCR扩增引物序列
Table 1 Sequences of PCR primers used in the study

1.3.2 ARD基因的PCR扩增及验证
采用石英砂研磨法[17]提取Debaryomyces coudertii FBKL 2.0130的基因组,以其为模板,使用引物ARD1-F和ARD1-R进行PCR扩增。PCR扩增体系:10×PCR Buffer 2.0 μL;脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)(2.5 mmol/L)1.5 μL;上游引物(10 μmol/L)1.0 μL;下游引物(10 μmol/L)1.0 μL;模板:1.0 μL;酶:0.5 μL;双蒸水(ddH2O)补充至20 μL。PCR扩增条件:95 ℃预变性10 min;95 ℃变性30 s,58 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。使用PCR终延伸加A尾,然后与T载体过夜连接,转化至大肠杆菌JM109,涂布于含100 μg/mL氨苄青霉素的LB固体平板上,37 ℃条件下培养12 h。随机挑取阳性转化子,提取质粒,进行PCR验证,并测序分析。
1.3.3 重组质粒Yep-PAK的构建
以Debaryomyces coudertii FBKL2.0130的基因组为模板,使用引物ARD-U和ARD-D对目的基因ARD(897 bp)进行PCR扩增,切胶回收PCR扩增产物。采用Bgl II单酶切PCR扩增产物和表达质粒Yep-PGK并纯化回收。回收产物进行连接,构建重组质粒Yep-PA。以质粒pUG6为模板,PCR扩增得到两端都含有Sma I酶切位点的KanMX抗性基因片段(1 613 bp),将质粒Yep-PA及KanMX抗性基因用Sma I单酶切后并纯化后进行连接,构建重组质粒Yep-PAK。重组质粒Yep-PAK构建的具体流程见图2。
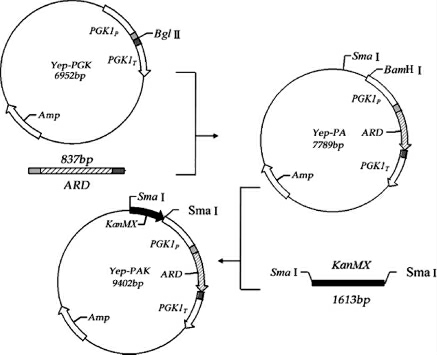
图2 重组质粒Yep-PAK的构建流程
Fig.2 Construction process of recombinant plasmid Yep-PAK
1.3.4 重组质粒Yep-PAK的转化和重组菌W303-ARD的验证
将构建好的重组质粒Yep-PAK转入大肠杆菌JM109感受态中,涂布于含100 μg/mL氨苄青霉素的LB固体平板上,37 ℃条件下培养12 h后随机挑选阳性转化子进行PCR扩增及Bgl II单酶切验证。将重组质粒Yep-PAK经醋酸锂转化法[18]导入酿酒酵母W303-1A中,得到重组菌W303-ARD,涂布于含有900 mg/L G418的YPD固体培养基,30 ℃条件下培养24 h,随机挑取正常生长的转化子,提取质粒并进行PCR扩增及Sma I单酶切验证。使用引物对PGK-F和ARD-R对重组菌W303-ARD进行PCR验证。
1.3.5 重组D-阿拉伯糖醇脱氢酶的表达
取重组菌W303-ARD和亲本菌W303-1A各一环分别接种于5 mL的YPD液体培养基中,30 ℃、200 r/min条件下培养24 h。然后取1.0 mL种子液分别接种于50 mL的模拟酒精发酵培养基中,相同条件下培养6 d,参照文献[19-21]测定D-阿拉伯糖醇脱氢酶活力。
D-阿拉伯糖醇脱氢酶酶活力单位定义:在30 ℃、pH 9.6条件下每分钟氧化1 μmol 烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NAD(P))或还原1 μmol 还原型烟酰胺腺嘌呤二核苷酸磷酸(NAD(P)H)所需要的酶量为一个酶活力单位(U)。
1.3.6 重组菌W303-ARD生长性能的测定
取重组菌株W303-ARD和亲本菌株W303-1A各一环分别接种于YPD液体培养基,装液量50 mL/250 mL,30 ℃条件下静置培养7 h后,每隔2 h取样,采用紫外分光光度计在波长600 nm处测定菌液的OD600nm值。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标,绘制菌株的生长曲线。
1.3.7 重组D-阿拉伯糖醇脱氢酶的酶学性质研究
最适作用温度及热稳定性:以5 ℃为温度梯度,在20~55 ℃范围内测定重组D-阿拉伯糖醇脱氢酶活力,考察其最适作用温度,将酶活最高值定为100%,计算在其他条件下的相对酶活力。以5 ℃为温度梯度,将酶液分别置于不同温度(20~55 ℃)条件下保温2 h后测定酶活,考察其温度稳定性,将酶活力最高值定为100%,计算在其他条件下的相对酶活力。
最适作用pH值及pH稳定性:在最适温度条件下,分别以1.0为pH值梯度,在pH 5.0~11.0范围内测定重组D-阿拉伯糖醇脱氢酶活力,考察其最适作用pH值,将酶活最高值定为100%,计算在其他条件下的相对酶活力。将酶液加入不同pH的缓冲液中在最适温度保温2 h后测定酶活。将最高的酶活力为100%,计算在其他条件下的相对酶活力。
金属离子对重组酶D-阿拉伯糖醇脱氢酶活力的影响:以不加金属离子酶液为对照(CK),在反应液中分别加入10 mmol/L CuSO4、MgCl2、KCl、BaCl2、CaCl2、MnCl2、FePO4、ZnCl2,测定重组D-阿拉伯糖醇脱氢酶活力,考察金属离子(Cu2+、Mg2+、K+、Ba2+、Ca2+、Mn2+、Fe3+、Zn2+)对其活性的影响。将原酶液活力定为100%,计算加入金属离子溶液后的相对酶活。
2 结果与分析
2.1 D-阿拉伯糖醇脱氢酶基因ARD的获得
以Debaryomyces coudertii FBKL2.0130的基因组为模板,使用引物对ARD1-F和ARD1-R PCR扩增得到D-阿拉伯糖醇脱氢酶基因ARD,采用0.8%琼脂糖凝胶电泳检测,结果见图3。
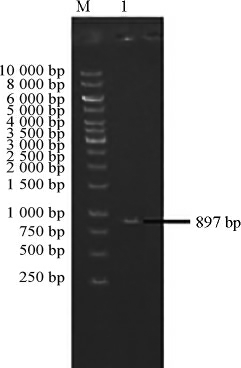
图3 D-阿拉伯糖醇脱氢酶基因ARD PCR扩增产物琼脂糖凝胶电泳结果
Fig.3 Results of agarose gel electrophoresis of PCR product of D-arabinitol dehydrogenase gene ARD
M:DL10 000 DNA Marker;1:ARD基因。
由图3可知,PCR扩增产物碱基长度在750~1 000 bp之间,与预期结果相符,扩增出的条带单一,说明成功获得目的基因ARD。将PCR扩增产物送去测序,测序结果显示,克隆得到的ARD基因由837个碱基组成,编码278个氨基酸。将氨基酸序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)利用BLAST搜所对不同来源的D-阿拉伯糖醇脱氢酶氨基酸序列进行比对分析,结果见图4。
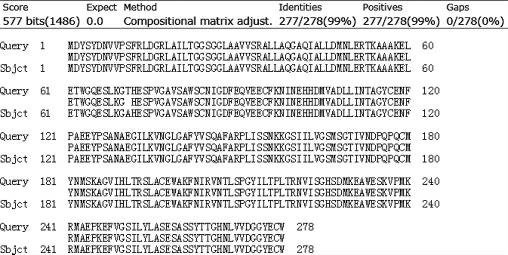
图4 不同菌株D-阿拉伯糖醇脱氢酶氨基酸序列比对结果
Fig.4 Alignment results of amino acid sequences of D-arabinitol dehydrogenase from different strains
由图4可知,克隆得到的D-阿拉伯糖醇脱氢酶氨基酸序列与Debaryomyces hansenii DEHA2A12144g的氨基酸序列相似性最高,为99%。
2.2 D-阿拉伯糖醇脱氢酶基因的异源表达
2.2.1 目的基因片段的扩增
以Debaryomyces coudertii FBKL2.0130基因组为模板,使用引物ARD-U和ARD-D进行PCR扩增,得到两端各含15 bp与PGK序列Bgl II酶切位点同源序列的ARD基因片段,碱基长度为837 bp。
2.2.2 重组质粒的验证
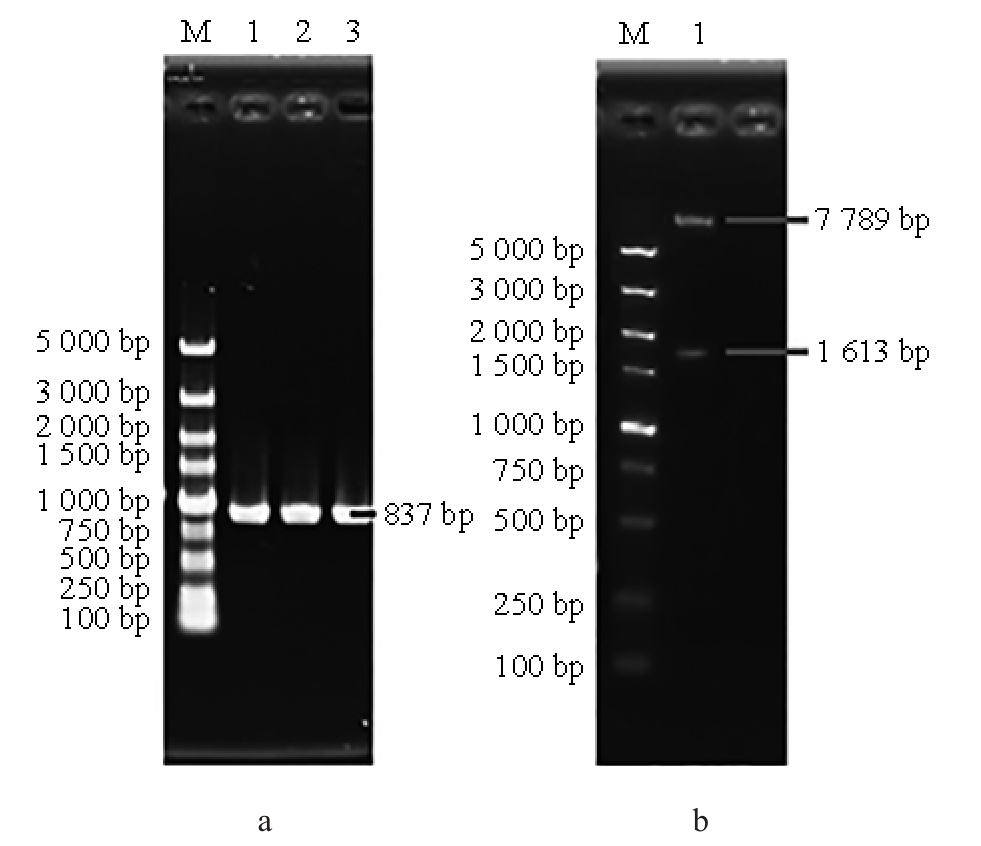
图5 重组质粒Yep-PA(a)和Yep-PAK(b)的验证结果
Fig.5 Verification results of recombinant plasmid Yep-PA (a) and Yep-PAK (b)
图a中M为10k bp DNA Marker,1、2、3为ARD基因;图b中M为5k bp DNA Marker,1为重组质粒Yep-PAK Sma I单酶切产物。
由图5a可知,以重组质粒Yep-PA为模板,PCR扩增ARD基因,可得到碱基大小为837bp的基因片段。通过测序,结果显示质粒Yep-PA构建成功。由图5b可知,对重组质粒Yep-PAK进行Sma I单酶切,可得到碱基大小为7 789 bp和1 613 bp的基因片段,电泳鉴定结果与预期结果均一致,证明重组质粒Yep-PAK构建成功。
2.2.3 重组菌W303-ARD的PCR验证
以重组菌W303-ARD的质粒为模板,用PGK-F和ARD-R引物对进行PCR扩增验证,结果见图6。
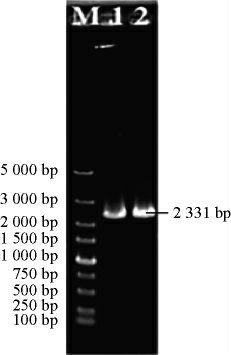
图6 ARD基因异源表达重组菌株W303-ARD的PCR验证
Fig.6 PCR verification of mutant strain W303-ARD with gene ARD heteroexpression
M:5k bp DNA Marker;1、2:PCR扩增产物。
由图6可知,通过PCR扩增可分别获得碱基大小为2331bp的基因片段,与预期结果一致,说明ARD基因异源表达重组菌株W303-ARD构建成功。
2.3 重组菌W303-ARD生长性能的测定
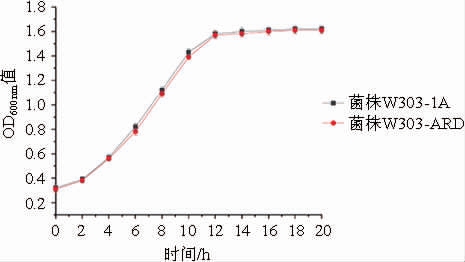
图7 重组菌株W303-ARD及亲本菌株W303-1A的生长曲线
Fig.7 Growth curves of recombinant strain W303-ARD and parent strain W303-1A
由图7可知,重组菌株W303-ARD与亲本菌株的生长趋势基本一致,说明导入外源质粒并且异源表达ARD基因的重组菌株的生长性能没有受到影响。
2.4 重组菌W303-ARD D-阿拉伯糖醇脱氢酶活力的测定
表2 D-阿拉伯糖醇脱氢酶活力测定结果
Table 2 Determination results of D-arabinitol dehydrogenase activity

由表2可知,D-阿拉伯糖醇脱氢酶的氧化还原活力均得到显著提升,与亲本菌株相比,重组菌株的D-阿拉伯糖醇脱氢酶的还原活力从(32.7±0.803)U/mL提高至(122.4±1.012)U/mL,氧化活力从(18.46±0.105)U/mL提高至(97.30±0.826)U/mL。
2.5 重组D-阿拉伯糖醇脱氢酶酶学性质研究
2.5.1 最适作用温度及热稳定性
由图8(a)可知,在25~35 ℃之间D-阿拉伯糖醇脱氢酶的氧化、还原活力均在60%以上,且在30 ℃时,酶活力均达到最大,之后随温度的上升而下降。由图8(b)可知,在25 ℃、30 ℃、35 ℃、40 ℃恒温2 h之后,其残余的氧化、还原活力都保持在80%左右。而温度上升至45 ℃之后,D-阿拉伯糖醇脱氢酶氧化、还原活力的稳定性均呈迅速下降趋势。由此可知,D-阿拉伯糖醇脱氢酶的最适作用温度为30 ℃,在25~40 ℃范围内,D-阿拉伯糖醇脱氢酶氧化、还原活力的稳定性较好。
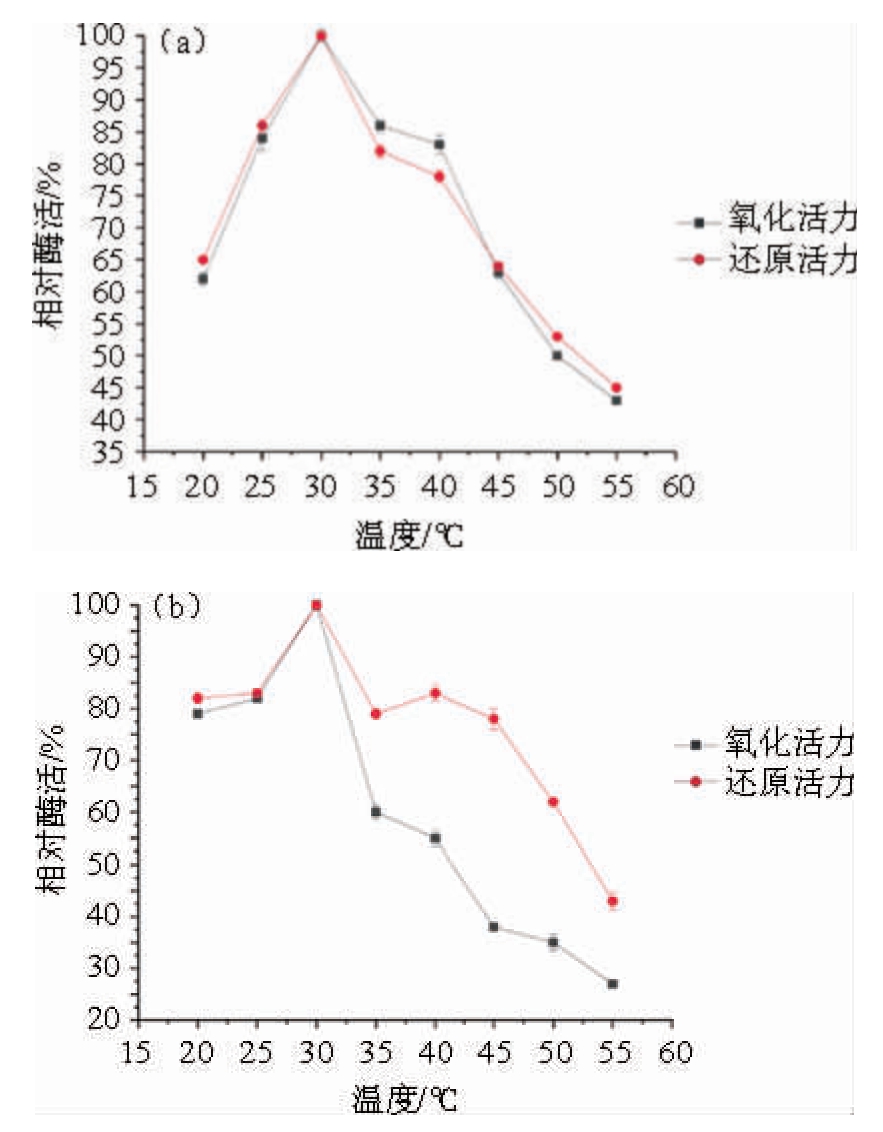
图8 重组D-阿拉伯糖醇脱氢酶的最适温度(a)及温度稳定性(b)
Fig.8 Optimal temperature (a) and temperature stability (b) of recombinant D-arabinitol dehydrogenase
2.5.2 最适作用pH及pH稳定性
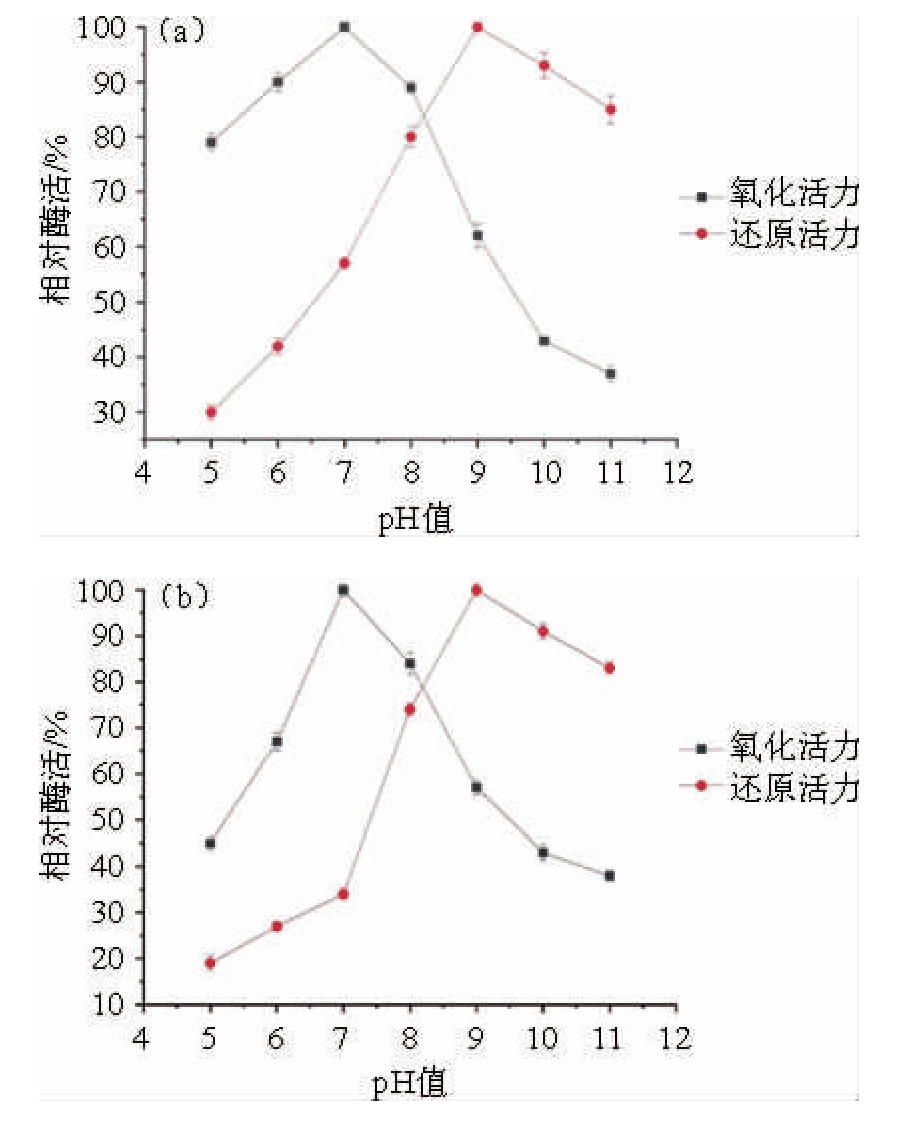
图9 重组D-阿拉伯糖醇脱氢酶的最适pH值(a)及pH稳定性(b)
Fig.9 Optimal pH (a) and pH stability (b) of recombinant D-arabinitol dehydrogenase
由图9(a)可知,重组D-阿拉伯糖醇脱氢酶催化D-核酮糖还原的最适pH值为9.0,且在pH值9~11之间,能保持80%以上的相对活力;以D-阿拉伯糖醇为底物的最适pH值为7.0,该酶的氧化活性在pH值6.0~8.0之间能够保持85%以上的相对活力。因此,重组D-阿拉伯糖醇脱氢酶还原反应的最适pH值为9.0,氧化反应的最适pH值为7.0。由图9(b)可知,恒温2 h之后重组D-阿拉伯糖醇脱氢酶在pH 9.0~11.0范围内残余的还原活性都在80%以上,氧化活性在pH 7.0~8.0的范围内重组D-阿拉伯糖醇脱氢酶的氧化活性能够保持在一个较高水平。
2.5.3 金属离子对D-阿拉伯糖醇脱氢酶活力的影响
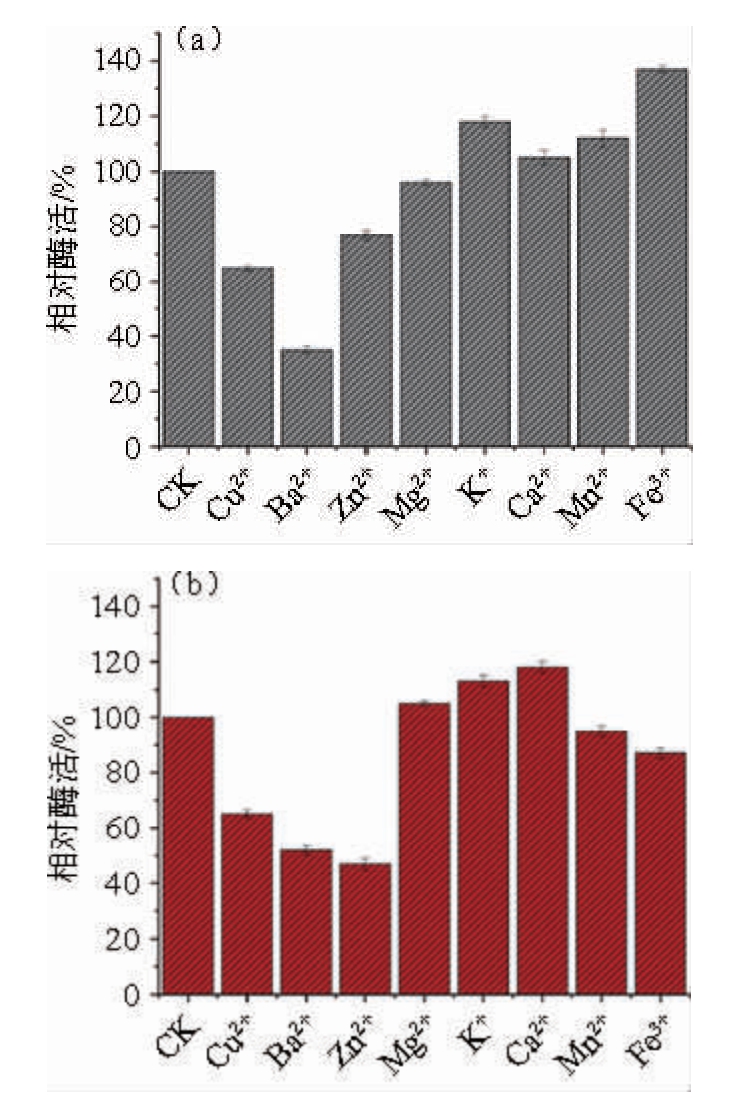
图10 金属离子对重组D-阿拉伯糖醇脱氢酶活性的影响
Fig.10 Effect of metal ions on recombinant D-arabinitol dehydrogenase activity
由图10可知,重组D-阿拉伯糖醇脱氢酶的氧化活性和还原活性均受到Cu2+、Ba2+、Zn2+的显著抑制,其中Ba2+的抑制作用最明显;Mg2+对重组D-阿拉伯糖醇脱氢酶的氧化还原活性没有明显的影响;Ca2+、Mn2+、Fe3+均能提高重组D-阿拉伯糖醇脱氢酶活力,其中Fe3+使D-阿拉伯糖醇脱氢酶相对氧化活力达到137%。
3 结论
本研究从Debaryomyces coudertii FBKL2.0130中克隆D-阿拉伯糖醇脱氢酶基因ARD,在酿酒酵母W303-1A中表达,构建重组菌株W303-ARD。结果表明,与亲本菌株相比,重组菌株的D-阿拉伯糖醇脱氢酶的还原活力从(32.7±0.803)U/mL提高至(122.4±1.012)U/mL,氧化活力从(18.46±0.105)U/mL提高至(97.30±0.826)U/mL。重组D-阿拉伯糖醇脱氢酶的最适反应温度为30 ℃,在25~40 ℃范围内氧化、还原活力稳定性均较好。还原反应的最适pH值为9.0,在pH 9.0~11.0 范围内比较稳定;氧化反应的最适pH值为7.0在pH 7.0~8.0的范围内能够保持较高水平。Cu2+、Ba2+、Zn2+均能抑制重组D-阿拉伯糖醇脱氢酶活力;Mg2+对重组D-阿拉伯糖醇脱氢酶活力没有明显的影响;Ca2+、Mn2+、Fe3+均能提高重组D-阿拉伯糖醇脱氢酶活力。
[1]孙时光,左勇,张晶.酱香型白酒中的风味物质及功效[J].中国酿造,2017,36(12):10-13.
[2]王晓欣.酱香型和浓香型白酒中香气物质及其差异研究[D].无锡:江南大学,2014.
[3]黄亚娟.酱香型白酒主要风味成分的分析[J].科技与创新,2019(13):131-132.
[4]牛之瑞,王秀君,于毅涛,等.液相色谱-质谱联用同时测定白酒中8种甜味剂[J].食品科学,2016,37(2):178-181.
[5]王景.白酒中违禁添加剂及特征成分的多种质谱检测技术研究[D].北京:北京化工大学,2015.
[6]国家卫生和计划生育委员会.GB/T 2760—2014 食品安全国家标准食品添加剂使用标准[S].北京:中国标准出版社,2011.
[7]LARA T,PIERGIORGIO C,IVA S,et al.Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J].Food Chem,2004,93(2):361-369.
[8]张丽丽.高产D-阿拉伯糖醇酵母菌株的筛选及其发酵条件的研究[D].无锡:江南大学,2009.
[9]李泽.产D-阿拉伯醇酵母菌株的筛选及发酵条件研究[D].济南:山东轻工业学院,2012.
[10]白小燕,邱树毅,雷安亮,等.酱香白酒酿造过程中产多元醇功能酵母的筛选[J].中国酿造,2017,36(5):58-62.
[11]FRER EJACQUE M.Presence of D-arabitol in Fistulina hepatica[J].CR Biol,1939,208:1123-1124.
[12]LINDBERG B,MISIORNY A,WACHTMEISTER C A,et al.Studies on the chemistry of lichens.IV.investigation of the low-molecular carbohydrate constituents of different lichens[J].Acta Chem Scand,1953,7(7):591-595.
[13]黄魏,王晓丹,李豆南,等.微生物发酵产D-阿拉伯糖醇的研究进展[J].中国酿造,2017,36(9):6-10.
[14] WONG B,MURRAY J S,CASTELLANOS M,et al.D-arabitol metabolism in Candida albicans:studies of the biosynthetic pathway and the gene that encodes NAD-dependent D-arabitol dehydrogenase[J].J Bacteriol,1993,175(19):6314-6320.
[15]ZHANG G Q,LIN Y P,HE P,et al.Characterization of the sugar alcoholproducing yeast Pichia anomala[J].J Ind Microbiol Biotechnol,2014,41(1):41-48.
[16]石钰,陈叶福,肖冬光.LEU1 基因缺失对酿酒酵母高级醇生成量的影响[J].酿酒科技,2015(2):12-16.
[17]余海霞,罗聪,徐趁,等.一种简单高效提取高质量转基因拟南芥和烟草DNA 的方法[J].分子植物育种,2016,14(6):1436-1440
[18]GIETZ R D,SCHIESTL R H.High-efficiency yeast transformation using the LiAc/SS carrier DNA/PEG method[J].Nat Protoc,2007,2(1):38-41.
[19] WONG B,LEESON S,GRINDLE S,et al.D-arabitol metabolism in Candida albicans:construction and analysis of mutants lacking D-arabitol dehydrogenase[J].J Bacteriol,1995,177(11):2971-2976.
[20]SHI N Q,PRAHL K,HENDRICK J,et al.Characterization and complementation of a Pichia stipitis mutant unable to grow on D-xylose or L-arabinose[J].Appl Biochem Biotech,2000,84-86(1-9):201.
[21]罗艳.Gluconobacter thailandicus D-阿拉伯糖醇脱氢酶和木糖醇脱氢酶基因的克隆及协同表达[D].镇江:江苏大学,2016.