硒是人体所必需的微量元素,机体长期缺硒会导致克山病、糖尿病、大骨节病、心脑血管病、神经退行性疾病等多种疾病的发生[1]。自然界中硒以无机硒和有机硒的形式存在,与无机硒相比,有机硒的生物利用率高,易于动物吸收利用,且毒性低,适量补充有机硒对人体健康极为重要[2-3]。硒酵母是目前应用最为广泛的一种食品级有机硒补充剂[4],由酵母在生长过程中将外源无机态的硒转化为菌体有机态的硒而获得,其核心品质是富含高水平的有机硒[5-6]。因此,筛选出高水平将无机硒转化为有机硒的富硒酵母菌株对富硒酵母的生产至关重要。
目前,富硒酵母菌株的筛选国内外都是采用含高浓度无机硒的培养基直接对自然来源的菌株或物理化学诱变的菌株进行驯化分离以获得目的菌株[7-9],所分离出的菌株常常表现出在高浓度无机硒下生长良好,但有机硒积累水平不高的现象[10],从而增加反复筛选的工作强度[11-12],且极少探讨菌株富硒能力与有机硒合成相关酶表达的关系。在富硒酵母中,硒蛋白是有机硒的一种主要存在形式,其含量高低不仅是富硒酵母品质的一个重要指标,同时也反映出富硒酵母将无机硒转化为有机硒的能力[13]。大量研究揭示,在硒蛋白的生物合成中,硒磷酸合成酶(selenophosphate synthetase,SPS)为限速酶,它在腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的参与下催化无机硒生成硒代磷酸,由于硒代磷酸是硒蛋白合成的活性硒供体,所以SPS催化硒代磷酸生成的活性高低决定了硒蛋白的合成水平[14-16]。有研究表明,SPS对H2O2敏感,一定浓度的H2O2可显著抑制SPS活性,进而抑制硒代磷酸的生成和硒蛋白的合成,降低细胞富集有机硒的能力[15-16]。因此,本研究将以酿酒酵母(Saccharomyces cerevisiae)为出发菌株、以H2O2为选择压力进行高富硒酵母菌株的诱变筛选和富硒特性分析,以期为富硒酵母的选育提供新的思路,为富硒酵母的生产提供优良的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母(Saccharomyces cerevisiae):中国工业微生物菌种保藏管理中心(馆藏号:1412)。
1.1.2 化学试剂
Na2SeO3、NaN3、Na2MoO4、NaOH、甲酸、浓氨水、甲苯、浓硫酸、高氯酸:上海国药集团化学试剂有限公司;H2O2:广东恒健制药有限公司;盐酸羟胺、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)-2Na:上海阳光生物科技有限公司;3,3'-二氨基联苯胺(3,3'-diaminobenzidine,DAB):华中海威(北京)基因科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒:上海碧云天生物技术有限公司;酵母蛋白提取试剂盒:江苏凯基生物技术股份有限公司;微生物硒磷酸合成酶SeP酶联免疫吸附测定(enzyme-linkedimmunosorbentassay,ELISA)试剂盒:上海酶联生物科技有限公司。实验所用试剂均为分析纯和生化试剂。
1.1.3 化学试剂
液体培养基:麦芽膏粉130 g/L、氯霉素0.1 g/L,121 ℃灭菌20 min。
固体培养基:麦芽膏粉130 g/L、氯霉素0.1 g/L、琼脂15 g/L,培养基使用时加入定量蒸馏水溶解、调节pH分别至pH 5.6±0.2和pH 6.0±0.2,经121 ℃灭菌20 min[17]。
1.2 仪器与设备
HQ45Z恒温摇床:中国科学院武汉科学仪器厂;SKP-02电热恒温培养箱:湖北省黄石市医疗器械厂;DGF30/7-I电热鼓风干燥箱:南京实验仪器厂;V1100可见光分光光度计:上海美谱达仪器有限公司;CT15RT高速冷冻离心机:上海天美科学仪器有限公司;MDF-U73V超低温冰箱、MLS-3750高压灭菌锅:日本SANYO公司。
1.3 实验方法
1.3.1 菌种的活化与摇瓶培养
菌种固体斜面活化24 h后,挑取一环于装液量为50 mL/250 mL麦芽汁液体培养基摇瓶中,在28 ℃、180 r/min条件下振荡培养24 h作为活化的菌种。取活化的菌种以10%的接种量接种到装液量为50 mL/250 mL摇瓶中振荡培养,培养温度为28 ℃,振荡转速为180 r/min[18]。
1.3.2 菌株生长曲线的测定
采取分光光度法测定菌种的生长曲线。活化的菌种在摇瓶培养过程中每隔4 h于波长560 nm条件下测定培养液的OD560nm值,绘制菌株的生长曲线[19]。
1.3.3 NaN3和H2O2处理条件的确定
活化的出发菌株经摇瓶培养至6 h时,取培养液加入终浓度为10 moL/L的NaN3,分别诱变处理0、10 min、20 min、30 min、40 min、50 min、60 min后,8 000 r/min离心10 min,弃上清并经无菌蒸馏水离心洗涤两次,取诱变的菌体转入50 mL无菌水的摇瓶中振荡20 min(28 ℃、180 r/min),用涂片计数法在显微镜下计数并调整菌悬液至相同的浓度。取上述菌悬液1 mL按照10倍稀释法逐级稀释至10-3,取该菌悬液0.1 mL移入平板培养基上,无菌玻璃棒涂布,在28 ℃下静置培养48 h后进行菌落计数,计算诱变处理后的每mL菌液内的活菌数,确定NaN3的诱变条件。
取经摇瓶培养6 h的出发菌株,分别加入1 mL含量为0.25%、0.50%、0.75%、1.00%、1.50%、2.00%、2.50%、3.00%的H2O2后继续培养至24 h,同前法测定菌体的生长,确定H2O2的筛选条件。
1.3.4 菌株的诱变与筛选
活化的出发菌株经摇瓶培养至6 h时,加入终浓度为10 mol/L的NaN3诱变处理40 min,经无菌蒸馏水离心洗涤2次后,转入新的液体培养基中摇瓶培养(28 ℃、180 r/min)6 h,加入1 mL含量为2.50%的H2O2,继续培养至24 h,再经无菌蒸馏水离心洗涤2次,用50 mL无菌蒸馏水振荡20 min,制备菌悬液;取菌悬液1 mL按照10倍稀释法逐级稀释至10-3,取稀释的菌悬液0.1 mL移入平板培养基上,无菌玻璃棒涂布后,在28 ℃条件下静置培养48 h,获得存活菌株的单菌落。挑取单菌落用2.50%~3.00%的H2O2进行复筛,并在加入1 mL H2O2(2.50%)的摇瓶中连续传代培养6次,进行菌株的H2O2耐受稳定性测定。
1.3.5 菌株的富硒培养
将活化的出发菌种、诱变菌种摇瓶培养,分别在6 h时加入终质量浓度为25 μg/mL的Na2SeO3溶液,继续培养至48 h,取酵母培养液于8 000 r/min下离心10 min收集菌体,用去离子水离心洗涤2~3次后,菌体于60 ℃烘干至恒质量,留待测定硒的含量[20]。
1.3.6 硒的测定
样品中总硒和无机硒的测定按文献方法进行,有机硒为总硒中减去无机硒的含量[21]。蛋白硒含量测定时,按照文献的方法[13],取干燥的样品加入定量的去离子水,用NaOH溶液调节pH至11,冰浴超声2 h、37 ℃条件下振荡保温2 h后,于4 ℃、10 000 r/min离心10 min,取上清加硫酸铵至饱和,经4 ℃过夜、离心取沉淀、透析、冷冻干燥得蛋白样品,同前法测定样品中总硒的含量,计算每克蛋白的硒含量。
1.3.7 硒磷酸合成酶活性的测定
将活化的出发菌种、诱变菌种摇瓶培养,分别在6 h时加入终质量浓度为25 μg/mL的Na2SeO3溶液后继续培养。培养过程中,定时取酵母培养液,采用酵母蛋白提取试剂盒提取酵母蛋白、BCA蛋白定量试剂盒测定蛋白质含量、微生物硒磷酸合成酶SeP试剂盒测定硒磷酸合成酶活性。
1.3.8 数据统计与分析
实验数据均以平均值±标准差表示,采用Origin 8.6软件绘制图表,利用SPSS17.0软件进行数据统计处理,应用One-way方差分析(anaylsis of variance,ANOVA)比较不同试验组间的差异。
2 结果与分析
2.1 诱变与筛选条件的确定
2.1.1 菌株生长曲线

图1 出发菌株的生长曲线
Fig.1 Growth curve of the starting strain
由图1可知,将活化的出发菌株接入未加硒的液体培养基中振动培养,在0~4 h期间菌株生长缓慢,为滞缓期;4~16 h菌株生长加快,菌体浓度快速增加,为对数生长期;16~48 h菌体浓度基本保持不变,为稳定期。因此,选择生长6 h的出发菌株进行诱变和筛选。
2.1.2 NaN3诱变处理
NaN3是一种引发基因点突变的化学诱变剂,诱变谱带宽、诱变效率高[22],本研究采用NaN3对酵母菌株进行诱变,结果见图2。由图2可知,当固定NaN3终浓度为10 μmol/L时,随着NaN3诱变时间的增加,菌株的存活率相应逐渐下降,当诱变时间为40 min时,菌株的致死率接近80%,再增加诱变时间菌体的存活率很低将不利于筛选。因此,采用终浓度为10 μmol/L的NaN3溶液处理菌株40 min为诱变条件。
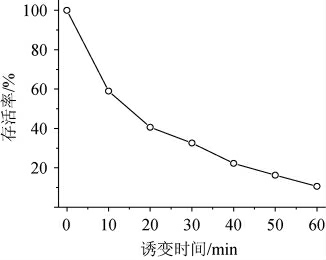
图2 NaN3诱变处理对菌株存活的影响
Fig.2 Effect of NaN3 mutagenize on the strain survival
2.1.3 H2O2处理诱变处理
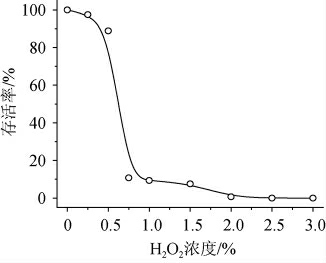
图3 H2O2处理对菌株生长的影响
Fig.3 Effect of H2O2 treatment on the strain growth
由图3可知,出发菌株对低浓度的H2O2具有一定的耐受,当加入H2O2浓度在0.50%~0.75%时,菌株的生长急剧下降,H2O2浓度达到0.75%,菌株的生长仅有未处理菌株的10.8%,当H2O2浓度>2.00%时,菌株全部死亡,因此确定2.50%的H2O2浓度为菌株生长的致死浓度。因此,选择2.50%的H2O2作为选择压力对诱变后的菌株进行筛选。
2.2 富硒酵母菌株的筛选与鉴定
2.2.1 富硒酵母菌株的初筛
摇瓶培养6 h的出发菌株用10 μmol/L NaN3溶液诱变处理40 min后,经摇瓶恢复培养、2.50%的H2O2筛选和平板涂布培养,结果见图4。由图4可知,可得到两个单菌落,而未经诱变的出发菌株经H2O2筛选、平板涂布培养未见生长的菌落。
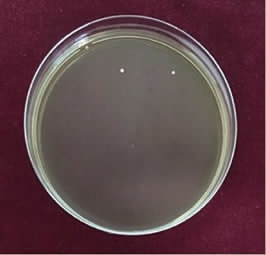
图4 平板培养基上的菌株初筛结果
Fig.4 Primary screening results of strain growth on plate medium
2.2.2 富硒酵母菌株的复筛及抗性稳定性
将初筛获得的两个菌株分别命名为HXS-01和HXS-02,进行H2O2复筛,结果见图5。由图5A可知,两个菌落在H2O2加入浓度为2.50%~3.00%的摇瓶中生长良好,与无H2O2存在的摇瓶培养相比,它们的生长仅有10%~20%的下降,表明这两个菌落对致死浓度(2.50%)的H2O2具有抗性,且对更高浓度(3.00%)的H2O2具有较好的耐受。由图5B可知,在含H2O2的摇瓶中进行连续6次的传代培养,结果表明其对致死浓度(2.50%)的H2O2具有稳定的抗性。
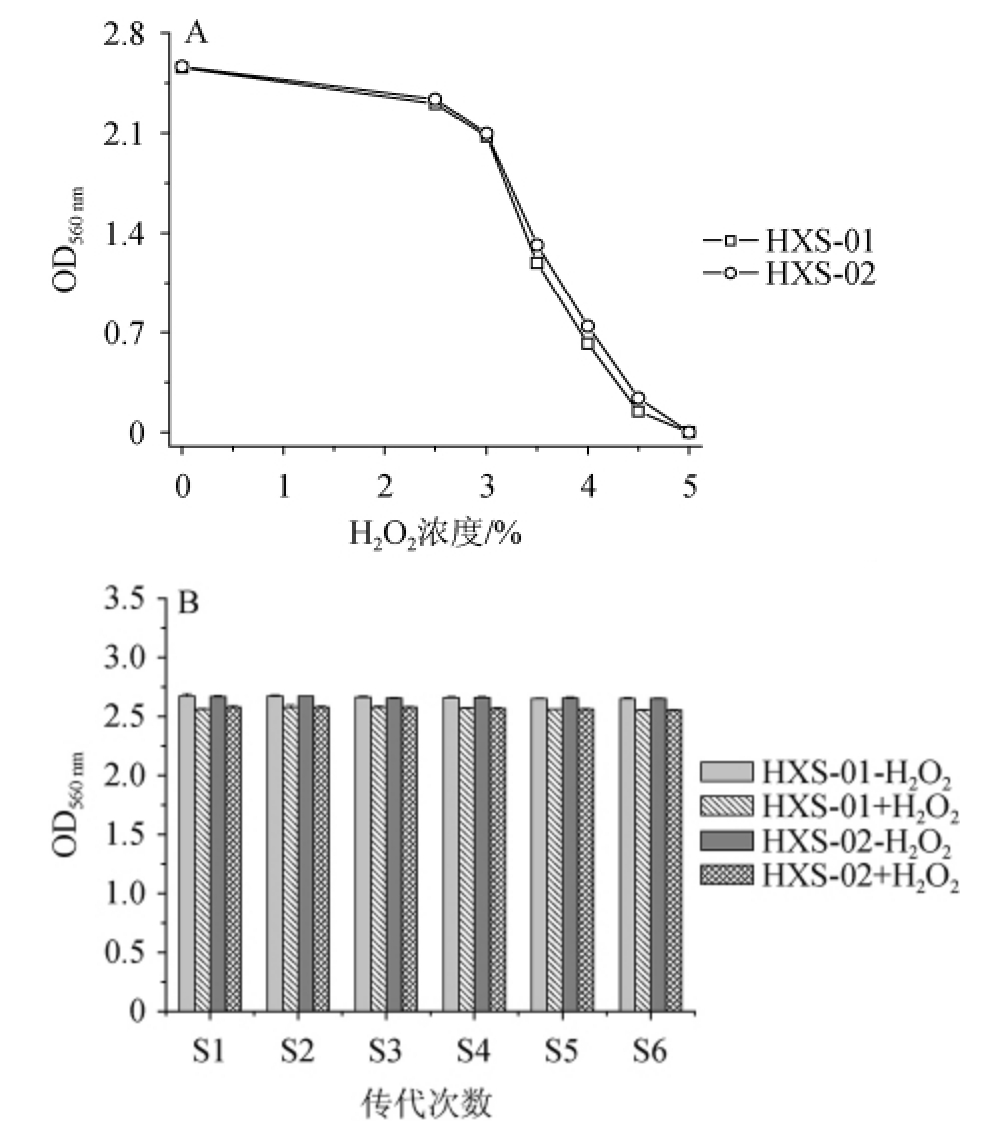
图5 筛选菌株对不同H2O2浓度的耐受性(A)及传代稳定性(B)
Fig.5 Tolerance of screened strains to different H2O2 concentrations(A) and genetics stability (B)
2.2.3 富硒酵母菌株的富硒特性
为了鉴定筛选出的菌株是否具有高富硒能力,将出发菌株和HXS-01、HXS-02菌株分别进行摇瓶富硒培养,48 h后收集菌体,测定菌体的生物量、总硒及有机硒含量与产率,结果见表1。
由表1可知,与出发菌株相比,菌株HXS-01和HXS-02在含Na2SeO3的培养基中生长相对较慢,培养48 h后两者的生物量分别是出发菌株的88.8%和89.6%,但它们的总硒含量及总硒产率均显著高于出发菌株(P<0.05),菌株HXS-01和HXS-02的总硒含量分别是出发菌株的4.4倍和4.7倍、总硒产率分别是出发菌株的3.9倍和4.2倍,并且菌株HXS-01和HXS-02的有机硒转化能力较高,两者的有机硒含量分别是出发菌株的4.7倍和5.0倍、有机硒产率分别是出发菌株的4.1倍和4.5倍,有机硒占总硒的百分比均超过97.5%,而出发菌株有机硒占总硒的百分比仅为92.6%。结果显示,以NaN3为诱变剂、H2O2为选择压力可以有效筛选出高富硒能力的酵母菌株,所筛选出的菌株HXS-01和HXS-02无论是总硒、有机硒含量方面,还是总硒、有机硒产率方面都优于出发菌株,且菌株HXS-02富硒及有机硒转化能力优于菌株HXS-01。
表1 出发菌株与菌株HXS-01及HXS-02的富硒能力比较
Table 1 Comparison on selenium enrichment potential between the original strain,strain HXS-01 and HXS-02

注:同列数据间,不同上标字母表示有显著性差异(P<0.05)。
2.2.4 富硒酵母菌株的富硒稳定性分析
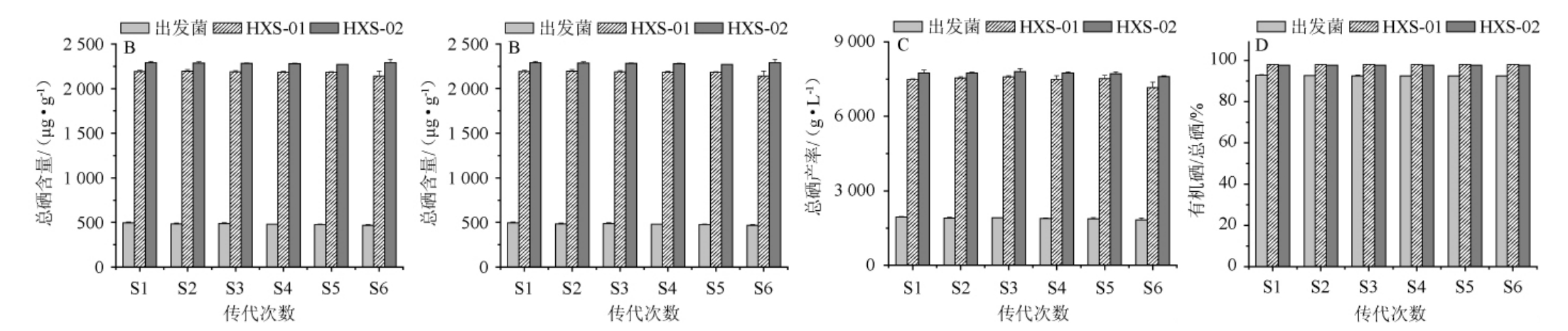
图6 出发菌株与菌株HXS-01及HXS-02的富硒能力稳定性比较
Fig.6 Comparison of the stability of selenium-enriched ability of the original,strains HXS-01 and HXS-02
将菌株HXS-01和HXS-02在含Na2SeO3的培养基中进行连续6代摇瓶培养,结果见图6。由图6可知,两个菌株的干质量(见图6A)、菌体的总硒含量(见图6B)和总硒产率(见图6C)均保持较好的稳定性,有机硒占总硒的百分比稳定在97%以上(见图6D),而出发菌株虽然生长高于菌株HXS-01和HXS-02,但其总硒含量和总硒产率远低于菌株HXS-01和HXS-02,且有机硒占总硒的百分比一直维持在92%左右。6次连续传代培养后,菌株HXS-01和HXS-02的平均总硒含量、有机硒含量、总硒产率、有机硒产率分别是2 138.68 μg/g和2 290.74 μg/g、2 195.11 μg/g和2 236.49 μg/g、7155.22μg/L和7606.98μg/L以及7009.47μg/L和7426.77μg/L,为出发菌株的3.9~5.2倍。结果表明,菌株HXS-01和HXS-02具有稳定的高富硒和高有机硒转化的能力。
2.3 富硒酵母菌株的SPS活性和蛋白硒含量分析
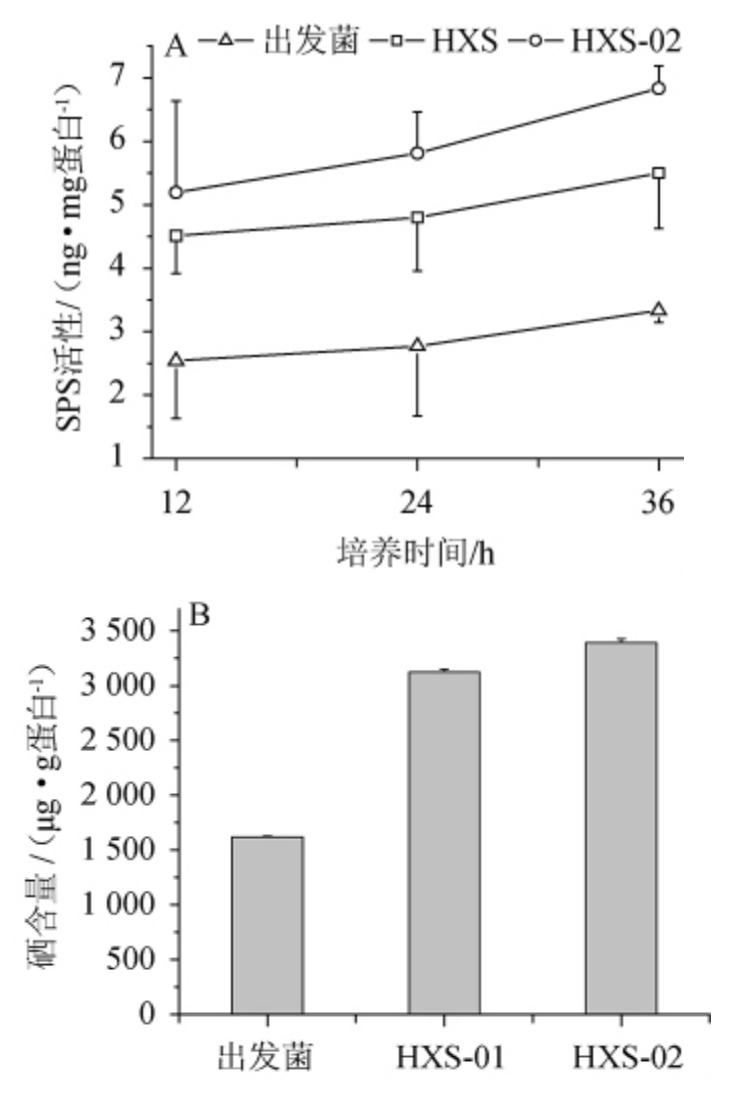
图7 菌株HXS-01和HXS-02硒磷酸合成酶活性(A)及蛋白硒的含量(B)
Fig.7 Activities of selenophosphate synthetase (A) and contents of selenium in proteins(B)of strains HXS-01 and HXS-02 strains
由图7A可知,在摇瓶富硒培养阶段,出发菌株和菌株HXS-01、HXS-02的SPS活性呈现相似的缓慢增加趋势,菌株HXS-01和HXS-02的SPS活性均显著高于出发菌株,且菌株HXS-02的SPS活性总体上高于菌株HXS-01。由图7B可知,菌株HXS-01、HXS-02的摇瓶富硒培养后的菌体蛋白硒含量分别是出发菌株的1.9倍和2.1倍。结果表明,经H2O2筛选出的诱变菌株具有高SPS活性,由于SPS为硒蛋白生物合成的限速酶,因此可以推测高SPS活性赋予了诱变菌株具有高水平的蛋白硒合成能力[10,15-16]。
3 结论
本研究以酿酒酵母为出发菌株,以NaN3(10 μmol/L、处理40 min)为诱变剂、H2O2(2.50%)为选择压力,成功筛选出2株可高水平将无机硒转化为有机硒的富硒酵母菌株HXS-01和HXS-02。富硒特性分析表明,菌株HXS-01和HXS-02的总硒和有机硒含量分别比出发菌株高3.4~3.7倍和3.7~4.0倍,均在2 100 μg/g以上,48 h摇瓶富硒培养的总硒和有机硒产率分别比出发菌株高2.9~3.2倍和3.1~3.5倍,均在7 000 μg/L以上,有机硒占总硒的百分比均超过97%,经连续6次传代后它们仍保持稳定的富硒和转化有机硒的能力,且它们的硒磷酸合成酶活性和蛋白硒含量均显著高于出发菌株,菌株HXS-02的富硒能力优于菌株HXS-01。结果表明,耐H2O2的诱变菌株不仅具有高的富硒及转化无机硒为有机硒的能力,而且具有高的SPS活性,提示它们的高富硒能力与高SPS活性相关,鉴于SPS是硒蛋白合成的关键酶且H2O2可抑制其活性,可以说明耐H2O2的菌株具有高的SPS活性,而高SPS活性的菌株具有高水平富集、转化无机硒为有机硒的能力。利用H2O2作为一种新的选择压力可以有效筛选出具有高SPS活性的富硒酵母菌株,并可用于生产实际。
[1]陈析羽,张浩,汤虎,等.富硒食品的研究进展与展望[J].中国食物与营养,2018,24(6):11-14.
[2]王丹,夏险,王革娇,等.微生物对硒的还原及其产物的应用研究进展——纪念硒发现200 周年[J].微生物学通报,2017,44(7):1728-1735.
[3]李思源,刘淑杰,邓波,等.有机硒的生物学功能及在畜牧领域的研究应用[J].浙江农业科学,2019,60(10):1850-1853,1856.
[4]朱慧,邵雷,陈代杰,等.富硒酵母中硒赋态的研究[J].工业微生物,2016,46(6):59-64.
[5]朱威,高兆建,李勇,等.富硒酵母菌的筛选及其富硒条件的优化[J].安徽农业科学,2017,45(33):87-89,92.
[6]朱燕云,吴文良,赵桂慎,等.硒在动植物及微生物体中的转化规律研究进展[J].农业资源与环境学报,2018,35(3):189-198.
[7]邹艳,李俊杰,夏诗棋,等.高生物量富硒产朊假丝酵母菌株的选育[J].中国酿造,2017,36(5):85-89.
[8]曾礼华,马平美,李维,等.高富硒酵母菌诱变选育研究[J].食品与生物技术学报,2013,32(10):1085-1090.
[9]娄兴丹,张根林,叶邦策.高富硒酵母的筛选及富硒强化研究[J].生物技术通报,2017,33(12):132-137.
[10] KIELISZEK M,BLAZEJAK S,GIENTKA I,et al.Accumulation and metabolism of selenium by yeast cells[J].Appl Microbiol Biotechn,2015,99(13):5373-5382.
[11]崔云前,吴梓萌,苏文超,等.发酵环境变化对酵母生长和成品啤酒的影响[J].中国酿造,2019,38(11):16-19.
[12]蔡飞,高飞飞,王斌,等.富硒酵母的分离鉴定及富硒条件的优化[J].中国酿造,2018,37(6):103-108.
[13]王菲,李梦一,叶淑红,等.富硒酵母中硒蛋白的抗氧化性质[J].大连工业大学学报,2014,33(5):325-327.
[14]王开拓.人类硒代磷酸合成酶及大肠杆菌LepA 蛋白的结构生物学研究[D].北京:北京大学,2010.
[15] VERES Z,KIM I C,SCHOLZ T D,et al.Selenophosphate synthetase:enzyme properties and catalytic reaction[J].J Bio Chem,1994,269(14):10597-10603.
[16] TOBE R,MIHARA H.Delivery of selenium to selenophosphate synthetase for selenoprotein biosynthesis[J].Biochim Biophy Acta,2018,1862(11):2433-2440.
[17]孙平平.富硒酵母的选育、发酵条件优化及其应用研究[D].芜湖:安徽工程大学,2011.
[18]王犁烨,陈新军,卢丕超,等.紫外诱变选育高产酒精及酸的酿酒酵母[J].中国酿造,2019,38(1):104-108.
[19]马勇,季祥,蔡禄.2 种测定产油酵母菌生长曲线方法的比较[J].安徽农业科学,2011,39(14):8202-8203,8233.
[20]刘碧容.平菇液体发酵富硒菌丝体培养研究[D].长沙:湖南农业大学,2005.
[21]蒋卓儒,蒋益中.3,3'-二氨基联苯胺分光光度法水质总硒测定的方法验证[J].中国检验检测,2018,26(3):11-15.
[22]钱玉源,韩轩,刘祎,等.叠氮化钠(NaN3)诱变在作物性状改良中的应用[J].安徽农业科学,2017,45(35):136-138,141.