四川泡菜是我国传统发酵蔬菜的代表之一,目前,四川泡菜的生产模式由作坊式生产逐渐转变为工业化生产,工业泡菜多是用食盐直接腌渍新鲜蔬菜而成,而豇豆泡菜有所不同,工业豇豆泡菜是通过泡菜母水泡制而成,且豇豆泡菜因其口感爽脆、咸酸可口、富含维生素C(vitamin C,VC)和氨基酸等特点深受消费者喜爱[1-2]。
泡菜的品质及独特风味与微生物代谢密切相关,泡菜中微生物种类丰富,包括乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、乳球菌属(Lactococcus)、肠球菌属(Enterococcus)、片球菌属(Pediococcus)和链球菌属(Strep-tococcus)等[3-4],而不同地域,蔬菜原料以及发酵工艺等对泡菜微生物菌群均有一定影响,目前已有的报道多是对不同地域成熟泡菜[5]和不同品种成熟泡菜[6]的对比研究,而针对不同工厂的泡菜在发酵过程中微生物的种类及动态变化的比较还较少。
近年来,随着分子生物学的发展,高通量测序技术已经广泛用于发酵食品中微生物群落分析。王勇等[7]运用高通量测序技术分析了大曲的微生物多样性;尚雪娇等[8]通过高通量测序技术对梅干菜中细菌多样性进行了研究。因此,本实验利用高通量测序技术探究不同工厂豇豆泡菜发酵过程中的细菌群落结构及优势菌属的动态变化规律,同时对其发酵过程中理化指标进行测定,比较不同工厂豇豆泡菜发酵过程中菌群和理化特性的异同,以期为优化工业豇豆泡菜发酵过程,提高泡菜产品质量提供一定理论基础。
1 材料与方法
1.1 材料与试剂
豇豆泡菜液样品:采集自四川省眉山市J泡菜厂和W泡菜厂;氢氧化钠(分析纯):成都科龙化工试剂厂;HiPure Stool脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒:广州Magen公司;AxyPrep DNA凝胶回收试剂盒:美国Axygen Biosciences公司。
1.2 仪器与设备
PHS-3C酸度计:上海仪电科学仪器股份有限公司;WS202盐度计:上海民仪电子有限公司;LC-2030高效液相色谱仪:日本岛津公司;MyCyclerTMThermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Bio-Rad公司;DYY-5琼脂糖凝胶电泳仪:中国北京市六一仪器厂;Legend Micro 17R高速冷冻离心机、ABI Step OnePlus实时荧光定量PCR:美国赛默飞公司;Illumina HiSeq 2500测序平台:美国Illumina公司。
1.3 方法
1.3.1 泡菜发酵工艺与样品采集
J厂的发酵工艺为:将新鲜豇豆浸泡在含盐量约为10%的泡菜母水中,用木棍压实,在相对开放的环境中发酵。W厂采用含盐量约15%的泡菜母水腌制新鲜豇豆,木棍压实,最上层用沙石封住发酵池,在相对封闭的环境中进行发酵。采用四角取样法采集样品,3个月发酵期内,每15 d取样一次,发酵时间90 d,取样后冰袋运回实验室置于-80 ℃冰箱备用。
1.3.2 理化指标分析检测
采用pH计和盐度计分别测定pH值和盐度;参照国标GB/T 12456—2008《食品总酸的测定》[9]测定样品中总酸含量。
采用高效液相色谱法测定有机酸含量。样品处理:在4 ℃条件下以8 000×g离心10 min,上清液稀释5倍,用0.22 μm水系滤膜过滤。高效液相色谱法测定色谱条件:色谱柱为Carbomix H-NP(7.8 mm×300 mm,5 μm),以0.25 mol/L H2SO4作为流动相,流速0.6 mL/min,柱温55 ℃,进样量10 μL。紫外检测器波长210 nm,通过与标准品的保留时间和峰面积的比较,对其进行定性和定量。用SPSS 24.0进行统计分析,所有实验均重复3次,结果用“平均值±标准差”表示。
1.3.3 DNA提取及测序
采用HiPure Stool DNA试剂盒提取样品的DNA。引物341F(5'-CCTACGGGNGGCWGCAG-3'),806R(5'-GGACTACHVGGGTATCTAAT-3')扩增细菌16S rDNA V3-V4区。PCR扩增体系:5 μL 10×KOD缓冲液,1 μL KOD DNA聚合酶,5 μL脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)(2.5 mmol/L),1.5 μL正反向引物(5 μmol/L),100 ng DNA模板。PCR扩增条件:95 ℃预变性2 min,98 ℃变性10 s,62 ℃退火30 s,68 ℃延伸30 s,循环27次,最后68 ℃再延伸10 min。PCR扩增产物经2%琼脂糖凝胶电泳检测。采用AxyPrep DNA凝胶回收试剂盒中纯化回收PCR产物,用ABI Step OnePlus Real-Time PCR System进行检测定量,送至广州基迪奥生物公司进行测序,测序平台为Illumina HiSeq 2500。
1.3.4 测序数据分析
对测序原始数据进行拼接和质控后获得有效序列。利用UPARSE[10]软件按97%相似度划分操作分类单元(operational taxonomic unit,OTU),并挑选代表序列。按核糖体数据库项目(ribosomal database project,RDP)classifier 贝叶斯算法[11]将每个OTU代表序列与SILVA[12]数据库比对,获得细菌分类学注释。用QIIME[13]计算Alpha多样性,利用R软件对细菌群落结构的相似性进行了基于OTUs的主成分分析(principal component analysis,PCA)。
2 结果与分析
2.1 工业豇豆泡菜发酵过程的理化指标变化
总酸和pH值是衡量泡菜发酵的重要指标[14]。J厂和W厂豇豆泡菜发酵过程中理化指标变化见表1。由表1可知,发酵前15 d,两家工厂豇豆发酵液pH值均迅速下降,随后基本维持稳定,J厂和W厂最终pH值分别为3.51和3.99;发酵前30 d,J厂总酸含量从1.78 g/kg显著增加至9.96 g/kg,随后逐渐下降至发酵90 d的8.01 g/kg,而W厂的总酸含量随着发酵的进行从2.71 g/kg逐渐增加至5.57 g/kg。乳酸是豇豆泡菜主要的风味物质,与总酸的变化趋势相似,J厂的乳酸的含量迅速增加到9.07 g/L,随后逐渐下降至5.22 g/L,W厂的乳酸含量逐渐增加到4.65 g/L。总的来说,在整个发酵过程中两厂的草酸含量均随着发酵进行逐渐下降而乙酸含量明显升高。随着发酵进行,新鲜豇豆和泡菜母水中存在的乳酸菌等微生物生长代谢活跃,产生大量乳酸和乙酸使得总酸含量明显增加,pH值快速下降,而J厂发酵30 d后乳酸和总酸含量下降是由于乳酸积累过量抑制了乳酸菌代谢,且乳酸被部分微生物消耗以克服乳酸胁迫作用。豇豆中的草酸会被微生物利用生成其他物质导致含量降低。盐度是影响乳酸菌生长代谢的重要因素[15],为防止腐败,工业泡菜一般用高盐腌制。W厂中的盐度从17%逐渐下降至15.57%,盐分随着发酵时间的延长逐渐渗透进豇豆中使得泡菜液中的盐度逐渐降低,而由于J厂未完全封池,水分蒸发从而使得盐度从11.1%逐渐上升到13%。在整个发酵过程中W厂的盐度始终高于J厂,而盐度过高会抑制乳酸菌的代谢,盐度较低,乳酸菌代谢更活跃,因此,J厂的总酸和乳酸含量高于W厂。
表1 工业豇豆泡菜发酵过程中理化指标变化
Table 1 Changes of physicochemical indexes of industrial cowpea paocai during fermentation process

2.2 Alpha多样性分析
J厂和W厂细菌OTU总数范围分别为1 392~1 683、1 438~1 741,两家工厂豇豆泡菜发酵过程中微生物群落的Alpha多样性指数结果见表2。
表2 工业豇豆泡菜样品中细菌Alpha多样性指数分析
Table 2 Analysis of bacterial Alpha diversity indexes of industrial cowpea paocai samples
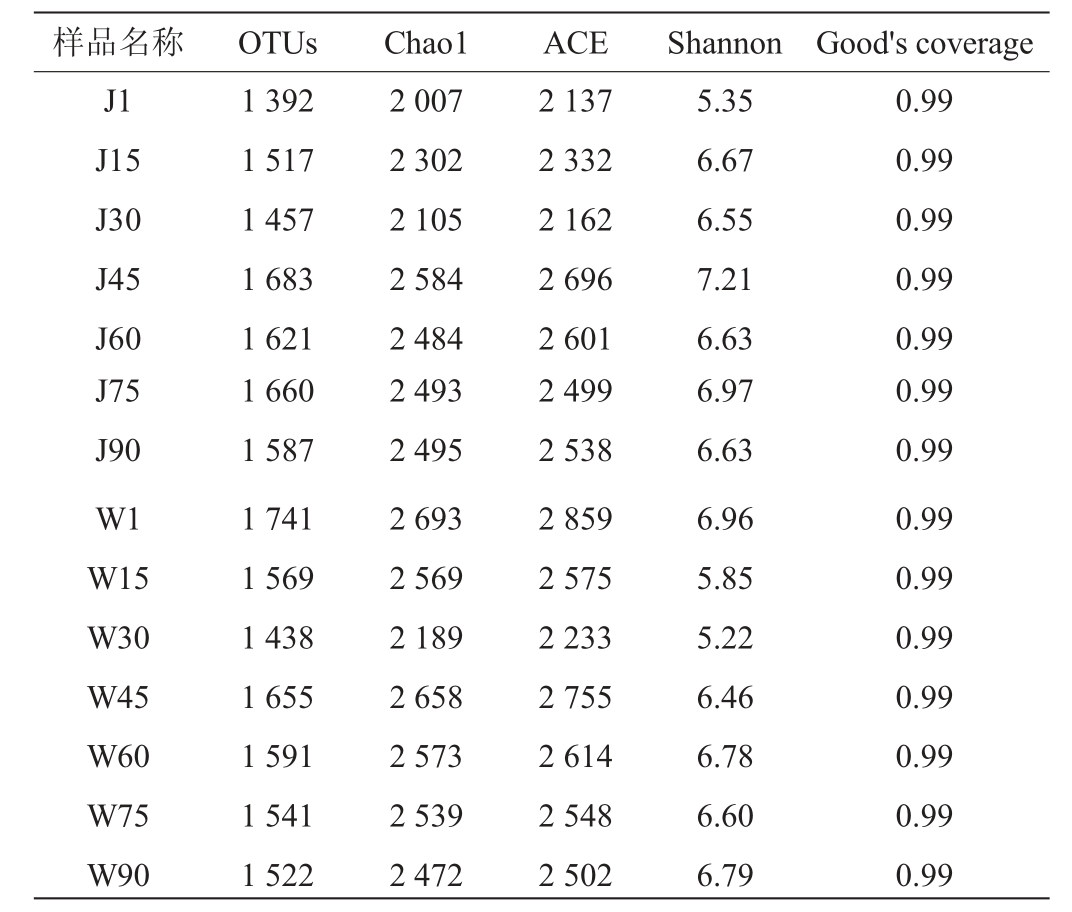
由表2可知,发酵前期W厂的OTU数高于J厂,这是由于两厂泡菜母水微生物组成的差异引起的,而随着发酵的进行,两厂泡菜液中的菌群逐渐变得相似,到发酵结束时OTU数相差较小。所有样品的Good's Coverage指数均为0.99,说明样品文库中序列的覆盖率高,本次测序可反映泡菜发酵过程中菌群组成的真实情况。Chao1指数和ACE指数可衡量物种丰度,Shannon 指数可衡量物种多样性和均匀度[16]。J厂发酵第1天的Chao1和ACE指数在整个发酵过程中最小,随后波动上升,而W厂发酵第1天的Chao1和ACE指数最大且高于J厂,随后波动下降,表明W厂在发酵第1天细菌群落丰富度最高,经过发酵作用菌群丰富度有所降低,而J厂在发酵第1天细菌群落丰富度最低,经过发酵作用菌群丰富度上升,发酵90 d时,两厂的Chao1和ACE指数相近。与Chao1和ACE指数趋势类似,J厂Shannon指数值波动上升而W厂波动下降,但发酵90 d后两厂的Shannon指数值相差较小。
2.3 细菌群落多样性
基于门水平及属水平上工业豇豆泡菜样品中细菌群落结构见图1。由图1A可知,在门水平上,J厂发酵第1天,变形菌门(Proteobacteria,77.22%)是绝对优势菌门,随后,变形菌门(Proteobacteria)的相对丰度下降而厚壁菌门(Firmicutes)(66%~91%)主导了整个发酵过程,而厚壁菌门(Firmicutes)在W厂的整个发酵过程中一直是绝对优势菌门,其相对丰度为71%~88%。由图1B可知,在属水平上,变形菌门的弧菌属(Vibrio)以61.27%的相对丰度主导J厂发酵第1天,然后迅速下降至1%以下。而弧菌属(Vibrio)在W厂发酵第1天相对丰度仅占4%,这是泡菜母水和新鲜豇豆表面的弧菌的含量差异导致的。发酵第1天,J厂仅有3%的乳杆菌属(Lactobacillus)被检出,发酵第15天,其相对丰度迅速上升至56.24%,成为优势菌属,随着发酵的进行波动上升至发酵90 d的74%,主导着J厂的发酵过程直至发酵结束。而在W厂的发酵过程中,乳杆菌属(Lactobacillus)的相对丰度从55%逐渐增加至发酵45 d时的76%,随后波动下降至73%,乳杆菌属(Lactobacillus)始终是绝对优势菌属。这与以往对家庭泡菜和榨菜的研究一致[17-18]。乳杆菌属(Lactobacillus)在发酵第15~30天迅速增加,代谢产生大量乳酸和乙酸,在此期间两厂豇豆泡菜pH迅速下降且总酸迅速上升。
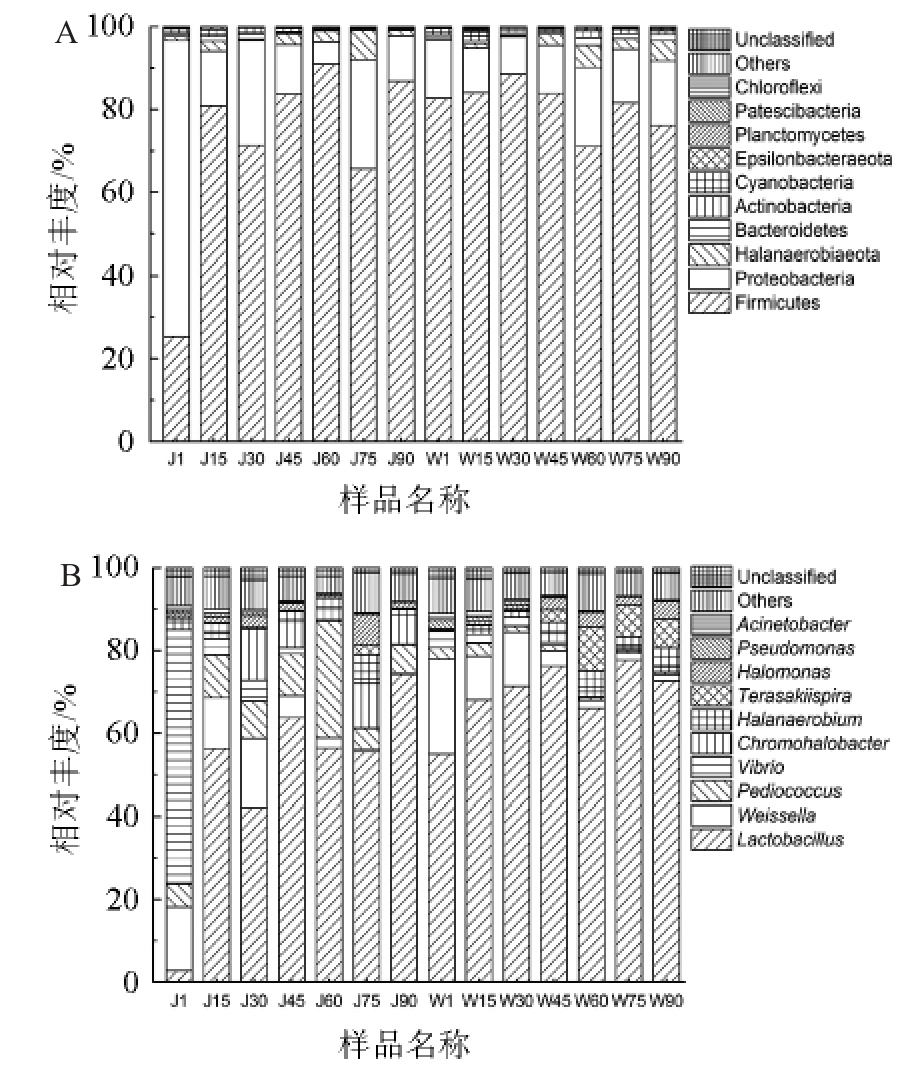
图1 门水平(A)及属水平(B)上工业豇豆泡菜样品中细菌群落结构
Fig.1 Bacterial community structure of industrial cowpea paocai samples based on phylum (A) and genus (B) level
总的来说,W厂中乳杆菌属(Lactobacillus)的相对丰度始终高于J厂,这是由于初始泡菜母水和豇豆中乳杆菌属(Lactobacillus)相对丰度差异导致的,但与W厂相比,J厂中乳杆菌属(Lactobacillus)的相对丰度增加更显著,推测W厂中的高盐度抑制了乳杆菌属(Lactobacillus)的生长代谢,从而在整个发酵过程中,J厂的乳酸、总酸、pH变化幅度也较W厂的变化幅度更大。魏斯氏菌属(Weissella)(12.36%~16.53%)和片球菌属(Pediococcus)(10.2%~28.35%)分别是J厂发酵第1~30天和第45~60天的第二优势菌属,但魏斯氏菌属(Weissella)和片球菌属(Pediococcus)的相对丰度随后迅速下降,在发酵90 d时分别为0.47%和6.7%,与J厂一样,魏斯氏菌属(Weissella)在W厂发酵第1~30天也是主要菌属,其相对丰度为10.50%~22.95%,随后迅速下降至1.5%,但片球菌属(Pediococcus)在W厂发酵过程中并不是主要菌属,在W厂发酵第60~90天中,Terasakiispira(7%~10%)是主要菌属之一,但其在J厂发酵后期几乎未被检出,有关Terasakiispira的报道较少,在豇豆泡菜中的作用有待进一步分析。魏斯氏菌属(Weissella)是腌制类发酵食品中重要的微生物之一,可代谢生成乳酸、乙酸、短链脂肪酸和胞外多糖,对泡菜的风味和营养有重要贡献[19-20],在两厂发酵前中期均检测到相对较高的魏斯氏菌属而随后开始下降,魏斯氏菌属可能是工业豇豆泡菜发酵启动菌。另外,在两厂发酵过程中,由于高盐环境,还检测到了色盐杆菌属(Chromohalobacter)、盐单胞菌属(Halomonas)和盐厌氧菌属(Halanaerobium)等嗜盐菌属,但色盐杆菌属(Chromohalobacter)是J厂中的主要嗜盐菌属而W厂中主要是盐单胞菌属(Halomonas),这是可能是由于两者盐度差异造成的。在两厂发酵前中期还检测到少量会导致腐败的假单胞菌属(Pseudomonas),可能来源于新鲜豇豆和陈年泡菜母水,但发酵结束时均未检测到。整体而言,由于发酵初期泡菜母水中的微生物群落不同以及发酵条件的不同,两厂发酵过程中微生物组成存在一定差异,但随着发酵进行,乳杆菌属(Lactobacillus)都是豇豆泡菜发酵中后期的绝对优势菌。
2.4 细菌群落结构相似性分析
采用PCA对J厂和W厂发酵过程中的细菌群落结构的相似性进行分析,结果见图2。由图2可知,第一主成分(PC1)和第二主成分(PC2)的方差贡献率分别为60.35%和19.97%,两个主要成分能够解释80.32%的细菌OTU差异。J1和W1距离较远,表明两厂在发酵第1天细菌群落结构有较大差异,两厂发酵15 d和30 d的样品各自聚在一起,说明发酵15 d和30 d的细菌群落组成较为相似,但两厂之间在此发酵阶段仍有较大差异,发酵45~90 d的样品相距较近,且两厂在此阶段的样品距离也较近,表明发酵45~90 d的细菌群落较为相似并且两厂在发酵后期的细菌群落组成较为相似。随着发酵时间的延长,乳杆菌属(Lactobacillus)逐渐成为绝对优势菌属,豇豆泡菜液中细菌组成逐渐趋于稳定,样品中细菌群落结构相似性逐渐增加。

图2 工业豇豆泡菜样品中细菌群落结构主成分分析
Fig.2 Principal component analysis of bacterial community structure of industrial cowpea paocai samples
3 结论
以豇豆泡菜为研究对象,通过高通量测序技术探究了两个不同工厂豇豆泡菜发酵过程中细菌多样性,其中,弧菌属(Vibrio)和魏斯氏菌属(Weissella)主导了J厂发酵第1天而乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)是W厂发酵第1 天的主要菌属,但随着发酵进行,发酵15 d后,乳杆菌属(Lactobacillus)在两家工厂均成为绝对优势菌属直至发酵结束。另外,对豇豆泡菜发酵过程中的理化变化也进行了分析,总体而言,两家工厂豇豆泡菜的pH和草酸含量降低而总酸、乳酸和乙酸含量显著增加,J厂的盐度低于W厂,总酸和乳酸含量高于W厂。考虑到盐度对豇豆泡菜中乳杆菌属(Lactobacillus)的生长代谢有一定影响,进而影响乳酸等主要泡菜风味物质的形成,并且长期食用高盐食品容易引发健康问题,所以工厂可根据自身情况适当调整发酵用盐量。本研究探究了工业豇豆泡菜在不同发酵过程中细菌群落变化和理化指标变化规律,以期有助于优化工业泡菜发酵工艺。
[1]徐柯,成林林,袁美,等.泡豇豆发酵过程中有机酸变化及对亚硝酸盐降解的影响[J].食品与发酵工业,2019,45(17):60-65.
[2]唐小曼,唐垚,张其圣,等.四川工业泡豇豆主要生物胺的形成及降解分析[J].食品与发酵工业,2019,45(21):86-92.
[3]杨云露,杨建涛,王猛,等.四川泡菜盐卤中微生物总基因组DNA 提取方法的比较[J].中国酿造,2015,34(4):90-92.
[4]李恒,陈功,伍亚龙,等.高通量测序方法研究传统四川泡菜母水中微生物群落的动态变化[J].食品科学,2018,39(24):131-138.
[5]LIU Z,PENG Z,HUANG T,et al.Comparison of bacterial diversity in traditionally homemade paocai and Chinese spicy cabbage[J].Food Microbiol,2019,83:141-149.
[6]田伟,张琦,邓珍珍,等.利用16S rRNA 分析传统四川发酵泡菜中的细菌多样性[J].食品科学,2013,34(17):215-218.
[7]王勇,周森,魏金旺.基于高通量测序技术分析牛栏山大曲微生物多样性[J].中国酿造,2019,38(2):58-61.
[8]尚雪娇,王玉荣,杨江,等.应用Illumina MiSeq 高通量测序技术解析梅干菜中细菌多样性[J].中国酿造,2019,38(2):140-144.
[9]国家市场监督管理总局,中国国家标准化管理委员会.GB/T 12456—2008 食品总酸的测[S].北京:中国标准出版社,2008.
[10] EDGAR R.UPARSE:Highly accurate OTU sequences from microbial amplicon reads[J].Nat Method,2013,10(10):996-998.
[11] WANG Q,GARRITY G,TIEDIE J,et al.Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol,2007,73(16):5261-5267.
[12] PRUESSE E,QUAST C,KNITTEL K,et al.SILVA:a comprehensive online resource for quality checked and aligned ribosomal RNA sequence data compatible with ARB[J].Nucl Acid Res,2007,35(21):7188-7196.
[13] CAPORASO J,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nat Method,2010,7(5):335-336.
[14]赵楠.四川泡菜的主要特性及其成因分析[D].无锡:江南大学,2017.
[15]XIONG T,LI J,LIANG F,et al.Effects of salt concentration on Chinese sauerkraut fermentation[J].LWT-Food Sci Technol,2016,69:169-174.
[16]魏本良,刘长根,肖阳生,等.基于Illumina HiSeq 技术分析浆水中细菌多样性及理化性质[J].食品科学,2019,40(6):62-68.
[17]LIANG H,CHEN H,ZHANG W,et al.Investigation on microbial diversity of industrial Zhacai paocai during fermentation using high-throughput sequencing and their functional characterization[J].LWT-Food Sci Technol,2018,91:460-466.
[18]XIAO Y,XIONG T,PENG Z,et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J].Food Res Int,2018,114:123-132.
[19]李巧玉,方芳,堵国成,等.魏斯氏菌在发酵食品中的应用[J].食品与发酵工业,2017,43(10):241-247.
[20]李巧玉.魏斯氏菌在酱油发酵过程的含量变化及特性研究[D].无锡:江南大学,2017.