白酒酿造工艺在中国已经有一千多年的历史,其独树一帜的特点便是利用自然发酵[1]。酱香型白酒酿造过程中的高温堆积工艺作为大曲酒生产工艺中较为独特的一环能够通过网罗环境中的微生物进行发酵[2-4],同时代谢产生如醇类[5]、有机酸类、酯类、醛类和吡嗪类[6]等多种酒体香味物质及前体物质,并为入窖发酵创造条件[7]。堆积前期,空气流通,营养物质丰富,酒醅中各种微生物生长代谢旺盛,特别是酵母菌和霉菌[8-9],堆积后期,酒醅温度较高,不同部位氧气浓度存在差异,微生物经自然驯化,为入窖发酵提供微生物基础[10-11]。韩兴林等[12]在对酱香白酒堆积发酵过程中代谢风味生成规律的分析中提出,堆积过程富集的微生物能够产生大量酒体风味物质,与各轮次酱香基酒的品质具有一定的关联性。周恒刚等[13-14]对比研究了堆积发酵和不堆积发酵对酱香型白酒酒质的影响,发现酒醅不堆积直接入窖会导致不产酒或产酒质量差等情况,表明堆积发酵是酱香型白酒生产中不可忽视的一个环节。
在酱香型白酒冬季生产过程中,堆积酒醅内部或表层处会出现酒醅表面呈白色或微黄色,在湿度大、发酵温度高的环境条件下易成团状,或带“霉味”,且酒醅干燥,下窖时酒精味较浓。这种现象在酱香型白酒生产上被称为“腰线”[15]。
江鹏等[15]提出腰线的形成主要原因是由于排与排之间酒醅温差过大、过度糊化以及水分作用造成的发酵现象,但是对于不同种类的腰线并未进行深入研究。因此,本研究分析了不同腰线酒醅中的风味物质、真菌组成与代谢特征,以及二者的关系,有助于认识腰线酒醅在酱香型白酒生产过程中的作用。
1 材料与方法
1.1 材料与试剂
腰线酒醅样品:取自某酱香型白酒生产车间,为一轮次堆积酒醅,具体信息如表1。
表1 不同类型腰线酒醅样品信息
Table 1 Information of different types of fermented grains

氯化钠(分析纯):国药集团化学试剂有限公司;酵母浸出粉胨葡萄糖琼脂(yeast extract peptone,YPD)培养基:青岛高科园海博生物技术有限公司;固态模拟发酵培养基:将高粱粉碎,利用超纯水调节水分至60%,于121 ℃灭菌20 min。
1.2 仪器与设备
MPSⅡ自动顶空固相微萃取装置(solid-phase microextraction,SPME):德国Gerstel公司;安捷伦7890A气相色谱-5975C质谱联用(gas chromatography-mass spectrometry,GCMS)仪:安捷伦科技(中国)有限公司;ME4002E电子天平:瑞士梅特勒-托利多集团;ALP高温灭菌锅:昆明倍捷科技有限公司;AFZ-2002-U型超纯水系统:美国艾科浦国际有限公司;ESCO超净工作台:新加坡艺思高科技有限公司;SPX-250B-2型恒温培养箱:上海福玛实验设备有限公司;LRH-250型生化培养箱:上海飞越实验仪器有限公司。
1.3 方法
1.3.1 酒醅微生物分离纯化与计数方法
采用稀释涂布法对不同腰线酒醅样品的酵母与霉菌进行分离,培养基稀释度分别为10-4、10-5、10-6,于30 ℃恒温培养箱静置培养。3 d后按GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》中平板计数法对酵母菌计数,并对不同形态菌株进行分离与纯化。7 d后,按同样方法对霉菌菌落计数与分离。
1.3.2 单菌株固态模拟发酵
将腰线样品中分离得到的不同形态特征的菌株利用固态发酵培养基,于30 ℃恒温培养箱,静置培养7 d进行固态模拟发酵,发酵结束后,进行代谢产物分析。
1.3.3 固态样品风味物质检测方法
于20 mL顶空样品瓶中加入3 g酒醅样品,通过顶空固相微萃取技术(head-spacesolidphasemicroextraction,HS-SPME)进行萃取,再利用气相色谱质谱联用(GC-MS)仪进样分析。气相色谱分离条件:柱温初始温度为60 ℃,以6 ℃/min的升温速率升至230 ℃,保持15 min;柱流量1.6 mL/min,采用恒压模式;进样口温度230 ℃。质谱条件:电子能量为70 eV;四极杆温度150 ℃;离子源温度230 ℃;采用全扫描方式(scan),使用35~550 amu的质量范围,溶剂延迟5 min。将未知物质图谱与美国国家标准与技术研究院(national institute of standards and technology,NIST)08a.L Database中标准图谱进行比对,进行定性分析。采用面积归一化法确定相对含量。
1.3.4 数量处理分析
将得到的挥发性风味物质峰面积进行归一化处理后,利用R语言3.6.1版本,pheatmap和VennDiagram包对腰线酒醅样品的风味物质进行热图(heatmap)和韦恩图(venn)分析;利用igraph包对菌株代谢产物进行关系网络图分析。
2 结果与分析
2.1 不同腰线酒醅风味组成分析
对不同腰线酒醅风味检测发现,共获得45种风味物质,其中醇类10种,酸类8种,酯类6种。利用R语言对四种酒醅风味物质检测数据进行分析,结果如图1所示。
由图1可知,得出不同类型腰线酒醅风味总量依次为D3>D2>D4>D1;堆积5 d内部白色样品D3的风味物质种类最多,达40种,其次是堆积11 d的外部白色样品D2与堆积8 d的内部白色样品D4,均为32种,外部黄色样品D1的种类最少,为21种。其中(2R,3R)-丁二醇、β-乙基苯乙醇、苯甲醇、苯乙醇、异戊醇、苯乙醛、苯乙酸乙酯、棕榈酸乙酯、三甲基吡嗪、四甲基吡嗪、2-戊基呋喃、愈创木酚、乙偶姻等17种风味物质是四个样品共有的。这可能是由腰线酒醅的位置、温度、堆积时间、微生物种类等特点共同影响的[16]。
D3样品堆积5 d,此时微生物代谢旺盛,且处于酒醅内部,堆积温度为37 ℃,不利于风味物质的挥发,所以风味物质含量最高;而D1堆积时间较长,微生物生长代谢较稳定,且位于表层,堆积温度达45 ℃,疏松度较高,易于风味物质的挥发和前体物质的转化,因此风味物质含量较低。
对比不同种类风味物质含量,乙酸含量最高,其次为苯乙醇,再次为乳酸乙酯。酒醅中的乙酸主要由醋酸菌在堆积过程产生,苯乙醇主要由酵母菌代谢产生[17],4种酒醅均检出苯乙醇,推测4种酒醅均含有一定数量的酵母菌,其中D2的苯乙醇含量明显高于D1,可能是D1还含有大量霉菌,影响了酵母菌的生长代谢[18]。
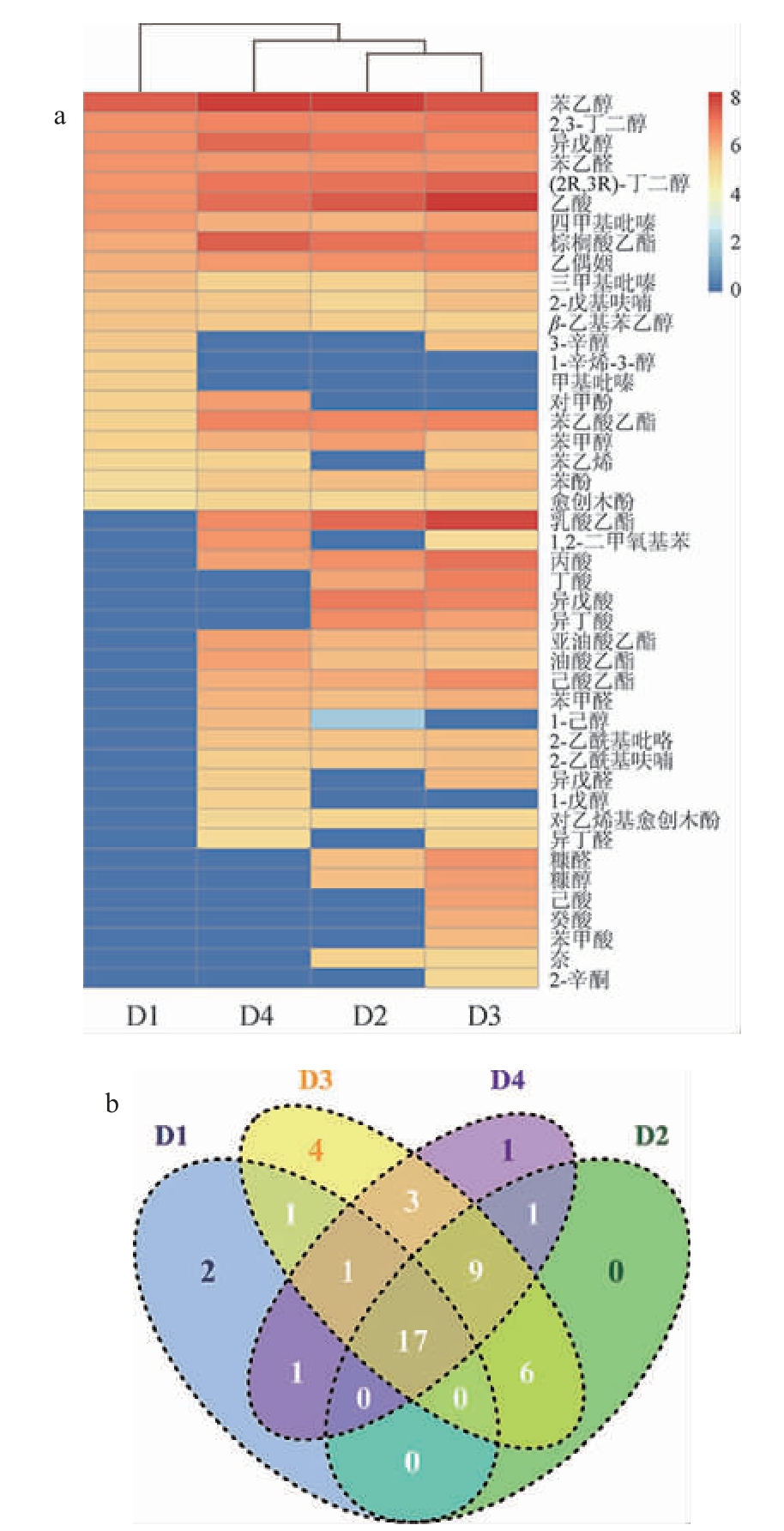
图1 不同堆积发酵酒醅风味物质含量热图(a)及种类Venn图(b)
Fig.1 Heat map of flavor contents (a) and Venn diagram (b) of flavor substances categories in different accumulated fermented grains
2.2 不同腰线酒醅的真菌数量
通过两种不同培养基的微生物计数结果可知,堆积发酵酒醅中酵母菌数在106~108 CFU/g之间,霉菌数在104~107 CFU/g之间,表明堆积发酵过程中的真菌数量丰富,无论是好氧微生物,还是兼性厌氧微生物都能在这一过程中大量生长,而这与堆积发酵酒醅兼具有氧环境和无氧环境相关,因此在不同位置酒醅样品的微生物种类组成也会有较大的差异性,从而造成酒醅风味成分和含量的区别。对4个样品中的霉菌和酵母菌分离纯化,并根据计数结果分析酒醅样品的真菌结构。

图2 4个酒醅样品的真菌结构
Fig.2 Fungal structure of 4 fermented grains samples
由图2可知,D1的霉菌数量最多,尤其是拟青霉,可以达到5.6×107 CFU/g,使酒醅的颜色呈微黄色。而D2则有最多的酵母菌计数结果,尤其是库氏毕赤酵母,可以达到2.29×108 CFU/g,因此酒醅的颜色呈白色。D4无论是霉菌数量,还是酵母菌数量都低于D1和D2,而这可能与发酵时长和所处位置相关。虽然D1和D2所含的主要菌种分别为拟青霉和库氏毕赤酵母,但是在D1中也检出较为丰富的酵母菌,为1.76×108 CFU/g;D2中也同样含有少量的拟青霉,为2×106 CFU/g。说明腰线酒醅堆积发酵是多种微生物共同生长代谢所产生的结果,其中影响较大的主要是拟青霉和非产酒酵母菌。
D3和D4分别是5 d和8 d位于内部腰线酒醅,都为白色。与D1和D2相比,D3和D4的菌群结构更为多样,且发酵8 d的酒醅样品的霉菌和酵母菌菌落数量也比发酵5 d的酒醅样品更多,但相较于D1和D2中的部分微生物仍要小几个数量级,说明在堆积发酵阶段前期主要是各种微生物的积累阶段,此时由于环境适宜,尚不存在某种或某几种突出的优势菌种能够对其他菌种造成抑制,如D1的拟青霉和D2的库氏毕赤酵母,因此酒醅的性状是存在较小的白点。同时,由于霉菌属于好氧菌,但在D3和D4中也能检测出大量霉菌的存在,意味着酒醅内部也存在微氧环境,而这与茅台酒生产工艺中对于酒醅的疏松度要求相关。
2.3 代谢产物分析
将分离出的3株霉菌和3株酵母菌进行单菌株固态模拟发酵,待发酵完全后对培养基中的风味物质做检测分析,分离出来的微生物与培养基中风味物质的种类之间的关系如图3所示。
由图3可知,酒醅空白样品为堆积发酵酒醅发酵代谢产生的风味物质,共有19种,其中醇类2种,酸类5种,酯类5种。霉菌YM5能够特异性地代谢乳酸乙酯,因此含YM5较多的D3样品中的乳酸乙酯含量最高。酵母菌能够特异性地代谢11种风味物质,主要为酸类化合物、酯类化合物和醇类化合物,因此酵母丰度较高的D2、D3和D4中的风味物质种类明显较拟青霉丰度是绝对优势菌种的D1多,与MENG X等[19]的研究结果一致。由此可知,堆积过程中产生的风味物质占总的风味物质的大部分,但是腰线中的微生物代谢却能够充分补充酒醅中风味物质的种类和含量,尤其是各种酵母菌的代谢产物。WU Q等[20-22]提出白酒发酵中风味物质的多样性来源于内源微生物和外源微生物之间的代谢竞争,而腰线层内部会受到原生微生物的影响,外部直接与空气接触,因此有多种霉菌和酵母菌等好氧或兼性厌氧微生物的大量生长繁殖,从而造就了腰线层酒醅的特殊性。
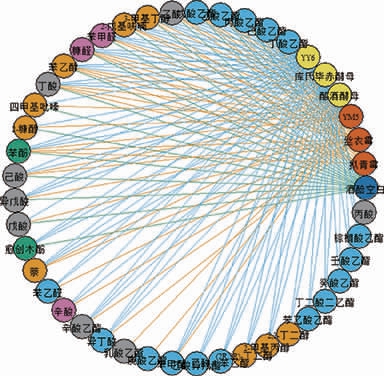
图3 微生物与风味代谢物质关系网络图
Fig.3 Network of the relationship between microorganisms and flavor metabolites
3 结论
通过对不同腰线酒醅风味物质进行对比,得出酒醅风味物质总量依次为:D3>D2>D4>D1,可能是由于不同腰线酒醅的位置、温度、堆积时间等因素的差异影响了微生物的代谢结果;堆积5 d内部白色样品D3的风味物质种类最多,达40种,其次是堆积11 d的外侧白色样品D2与堆积8 d的内部白色样品D4,均为32种,外部黄色腰线酒醅D1的种类最少,为20种,共有17种风味物质在4个样品中均有检出;不同种类风味物质中,乙酸含量最高,其次为苯乙醇,再次为乳酸乙酯。
对比不同酒醅微生物计数结果可知,堆积发酵酒醅中酵母菌在106~108 CFU/g,霉菌在104~107 CFU/g之间,表明堆积发酵过程中的真菌数量丰富,这与堆积发酵酒醅兼具有氧环境和微氧环境相关;其中D1样品中拟青霉数量最多,导致样品呈微黄色,D1、D2、D4样品含有大量酵母菌,因此呈白色。进一步分离纯化样品中的霉菌和酵母菌,进行代谢产物分析,发现腰线酒醅中的微生物代谢过程能够增加酒醅中风味物质的种类和含量。
上述腰线酒醅风味物质的差异主要是由于微生物菌群结构不同,从而使得微生物代谢产物不同。为了更好地分析四种酒醅菌群结构与风味物质的关系,还需对酒醅微生物进行分离、纯化,进一步研究不同真菌利用高粱发酵生产代谢产物的差异。
[1]XU Y,SUN B,FAN G,et al.The brewing process and microbial diversity of strong flavour Chinese spirits:A review[J].J I Brewing,2017,123(1):5-12.
[2]沈怡方.白酒生产技术大全[M].北京:中国轻工业出版社,1998:37-45.
[3]李小东,高大禹,田庆贞,等.芝麻香型白酒堆积发酵对入窖发酵过程及原酒品质的影响[J].食品与发酵工业,2018(5):63-69.
[4]袁再顺.“破堆移位”对酱香型白酒冬季堆积发酵的影响研究[D].贵阳:贵州大学,2019.
[5] ZHOU W,CHEN Z,BAO H,et al.Systematic analysis of the pharmacological effects of alcoholic components in Maotai[J].J Food Sci,2019,84(7):1949-1956.
[6] NIU Y,CHEN X,XIAO Z,et al.Characterization of aroma-active compounds in three Chinese Moutai liquors by gas chromatography-olfactometry,gas chromatography-mass spectrometry and sensory evaluation[J].Nat Prod Res,2017,31(8):938-944.
[7]张守财.堆积发酵对酱香型白酒风味形成的作用及其控制[J].福建轻纺,2006(11):17-8.
[8]袁超.芝麻香型白酒生产关键微生物的功能分析[D].济南:山东轻工业学院,2011.
[9]李豆南,邱树毅.酱香大曲微生物菌群结构及微生物功能研究概述[J].中国酿造,2017,36(1):5-10.
[10] FREY-KLETT P,BURLINSON P,DEVEAU A,et al.Bacterial-fungal interactions:Hyphens between agricultural,clinical,environmental,and food microbiologists[J].Microbiol Mol Biol R,2011,75(4):583-609.
[11]HARUTA S,UENO S,EGAWA I,et al.Succession of bacterial and fungal communities during a traditional pot fermentation of rice vinegar assessed by PCR-mediated denaturing gradient gel electrophoresis[J].Int J Food Microbiol,2006,109(1-2):79-87.
[12]韩兴林,尚柯,王德良,等.酱香白酒堆积发酵过程中代谢风味生成规律的分析[J].酿酒,2018(4):43-50.
[13]周恒刚.酱香型白酒生产工艺的堆积[J].酿酒科技,1999(1):5-7.
[14]杨漫江.堆积发酵对酱香型白酒风味物质形成的影响[J].酿酒科技,2011(7):72-3.
[15]江鹏,蒋红军,王和玉,等.酱香型白酒堆积发酵过程中“腰线”的形成机理[J].酿酒科技,2004(6):43-4.
[16]WU Q,CHEN L,XU Y.Yeast community associated with the solid state fermentation of traditional Chinese Maotai-flavor liquor[J].Int J Food Microbiol,2013,166(2):323-330.
[17]路晓伟.中国酱香型白酒酿造酿酒酵母的独特生理代谢特征[J].微生物学通报,2015,42(11):2098-2107.
[18]吴群,陈笔,李勇,等.芝麻香型白酒酿造功能霉菌及其与酵母的相互作用[J].酿酒科技,2015(1):7-11.
[19]MENG X,WU Q,WANG L,et al.Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J].J Ind Microbiol Biot,2015,42(12):1601-1608.
[20]WU Q,KONG Y,XU Y.Flavor profile of Chinese liquor is altered by interactions of intrinsic and extrinsic microbes[J].Appl Environ Microbiol,2015,82(2):422-430.
[21]WU Q,XU Y,CHEN L Q.Diversity of yeast species during fermentative process contributing to Chinese Maotai-flavour liquor making[J].Lett Appl Microbiol,2012,55(4):301-307.
[22] CHEN B,WU Q,XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotaiflavor liquor[J].Int J Food Microbiol,2014,179(6):80-84.