乳酸菌是一类可发酵糖类物质,以乳酸为主要代谢产物的细菌,通常被认为是安全的益生菌[1-2]。在系统分类学上,乳酸菌分别隶属于厚壁菌门(Firmicutes)和放线菌门(Actinobacteria),包含51个属,至少包括741个种[3]。近几年,乳酸菌对一些腐败菌和食源致病菌的抑制作用引起了极大的关注。已报道的抑菌活性乳酸菌有发酵乳杆菌(Lactobacillus fermentum)、植物乳杆菌(Lactobacillusplantarum)、乳酸乳球菌(Lactococcal lactis)、屎肠球菌(Enterococcus faecium)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、干酪乳杆菌(Lactobacillus casei)、副干酪乳杆菌(Lactobacillus paracasei)等[4-7],部分乳酸菌的抑菌机制也陆续得到阐明[8-10]。
扬州酱菜是江苏扬州地区的传统食品,历史悠久,风味独特,深受消费者喜爱。稀甜酱是生产扬州酱菜的主要原料之一,其酿制过程是酱菜生产中的一个重要环节[11],乳酸菌的发酵作用是其风味形成的关键因素之一[12]。在稀甜酱的中温发酵过程中,乳酸菌大量增殖,将部分糖分转化成适量的有机酸,从而赋予了产品特有的风味。
传统发酵食品中含有丰富的微生物资源,而扬州稀甜酱中乳酸菌的多样性及活性的研究尚无报道。本研究旨在从扬州稀甜酱中分离、纯化乳酸菌,采用形态观察、生理生化试验和分子生物学方法对其进行鉴定,阐述其多样性,并对发酵滤液的抑菌活性进行研究,为进一步开发利用提供良好的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
稀甜酱:扬州三和四美酱菜有限公司。
1.1.2 培养基
MRS琼脂培养基、营养琼脂培养基、MRS肉汤培养基、脑心浸液肉汤培养基:广东环凯微生物科技有限公司。
1.1.3 试剂
KOD FX脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(1.0 U/μL):日本TOYOBO公司;聚合酶链式反应(polymerase chain reaction,PCR)纯化试剂盒:德国Qiagen公司;DNA凝胶回收试剂盒:美国Axygen公司;瓷珠菌种保存管:青岛高科技工业园海博生物技术有限公司;过氧化氢酶(2 000~5 000 U/mg):美国Sigma-Aldrich公司;碳酸钙、氢氧化钠、甘油、双氧水(均为分析纯):国药集团化学试剂有限公司。
1.1.4 指示菌株
金黄色葡萄球菌(Staphylococcus aureus)(ATCC 6538)、单核细胞增生李斯特氏菌(Listeria monocytogenes)(ATCC 19115)、大肠埃希氏菌(Escherichia coli)(ATCC 25922)、枯草芽胞杆菌(Bacillus subtilis)(ATCC 6633):广东省食品微生物安全工程研究开发中心。
1.2 仪器与设备
SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;SQ510C灭菌锅:日本YAMATO公司;SPX-250B-Z生化培养箱:上海博讯实业有限公司;Bugbox M厌氧工作站:英国Ruskinn公司;AL104电子分析天平、FE22 pH计:梅特勒-托利多仪器(上海)有限公司;ECLIPSE生物显微镜:日本尼康公司;3-30k冷冻台式高速离心机:德国Sigma公司;U-3010紫外分光光度计:日本Hitachi公司;9700聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国ABI公司;DYY-8C电泳仪、WD-9413B凝胶成像分析仪:北京六一生物科技有限公司;FC-08拍打式均质器:杭州赛普科学仪器有限公司;Micro Stainer全自动革兰氏染色仪:上海皓信生物科技有限公司。
1.3 方法
1.3.1 乳酸菌的分离
称取10 g稀甜酱样品于无菌均质袋中,加入90 mL无菌生理盐水,拍击均质1 min,制成10-1样品均液。吸取1 mL10-1样品均液于9 mL无菌生理盐水中,振荡均匀,得到10-2样品均液。重复以上操作制成逐级稀释后的样品均液。吸取稀释度为10-5的样品均液1 mL于无菌平皿内,将冷却至适宜温度的含有0.2 g/L碳酸钙的MRS固体培养基倾注平皿,混合均匀后置于36 ℃培养箱中培养48 h。挑取有溶钙圈的单菌落,纯化后进行革兰氏染色和接触酶试验,革兰氏阳性且接触酶阴性[13-14]的菌株列为疑似乳酸菌,由瓷珠吸附后置于含50%甘油的MRS肉汤培养基中,-70 ℃超低温环境中进行保存。
1.3.2 菌种鉴定
(1)形态观察和生理生化鉴定
将疑似乳酸菌活化2代后接种于MRS琼脂培养基,36 ℃培养24 h后观察其菌落形态。参照《乳酸细菌分类鉴定及实验方法》[13]和《常见细菌系统鉴定手册》[14]对乳酸菌进行生理生化鉴定,碳源利用试验采用生化鉴定管进行。
(2)分子生物学鉴定
按照文献[15]方法提取菌株的基因组,以通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')、1492r(5'-TACGGYTACCTTGTTACGACTT-3')对分离菌株的16S rDNA序列进行PCR扩增[15],PCR扩增产物纯化后进行测序。引物合成及测序结果均委托南京金斯瑞生物科技有限公司完成。
将测序结果与美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行BLAST比对搜索,选择序列同源性较高的菌株的16S rRNA序列,用Clustal X进行多重比对,采用MEGA 7.0.26软件中的邻接(neighbor-joining,NJ)法构建系统发育树,分析分离菌株与已知菌株的同源性。
1.3.3 发酵滤液抑菌试验
按照文献[15]的方法准备乳酸菌菌液,使菌液OD600nm值在0.6~0.8范围内。将菌液以10%(V/V)的接种量添加到50 mL MRS肉汤培养基中,36 ℃静置培养24 h。培养液经10 000 r/min离心10 min,取上清液,用0.22 μm无菌滤膜过滤后于4 ℃条件下保存。
滤液的抑菌活性试验采用牛津杯平板扩散法[16]进行,指示菌分别为金黄色葡萄球菌(S.aureus)、单核细胞增生李斯特氏菌(L.monocytogenes)、大肠埃希氏菌(E.coli)和枯草芽胞杆菌(B.subtilis),每项试验设置3组平行和1组空白对照(MRS肉汤培养基)。用2代指示菌的新鲜脑心浸液肉汤培养液倾注营养琼脂平板制备试验平板,试验平板中菌体浓度控制在1×105~1×106 CFU/mL。将滤液和空白对照用1 mol/L的氢氧化钠溶液调至pH 7.0,以中和有机酸的干扰,再加入终质量浓度为5.0 mg/mL的过氧化氢酶,于37 ℃水浴2 h,以排除过氧化氢的干扰[17]。在牛津杯(内径6 mm,外径8 mm)内加入0.2 mL处理后的滤液和空白对照,36 ℃培养24 h,观察其是否有抑菌圈。用十字测量法测定其抑菌圈直径,直径>10 mm时判定为有抑菌作用[18],空白对照应无抑菌圈产生,否则实验结果无效。
2 结果与分析
2.1 乳酸菌的分离
从稀甜酱样品中共分离得到64株有明显溶钙圈的菌株,其中33株革兰氏染色阳性且接触酶试验阴性,初步确定为乳酸菌[13-14],将其编号为TJ01~TJ33。筛选到的菌株在MRS固体培养基上均呈现为圆形、中央凸起、表面光滑湿润、边缘整齐的乳白色菌落。在显微镜油镜下,菌株TJ10和TJ25细胞呈现为单个或呈链状排列的无芽孢革兰氏阳性杆菌,其他菌株细胞均为单个、成对、四联、成链或成片出现的革兰氏阳性球菌。部分代表菌株的革兰氏染色镜检结果见图1。
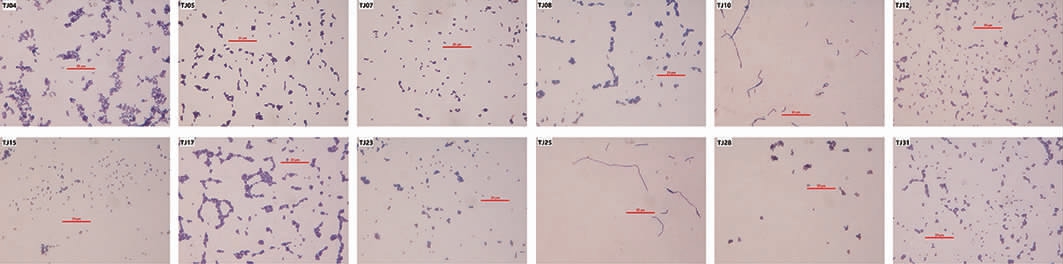
图1 12株代表菌株的革兰氏染色结果
Fig.1 Gram staining results of 12 representative strains
2.2 乳酸菌的生理生化鉴定
将33株乳酸菌接种于MRS琼脂培养基,于36 ℃厌氧培养24 h。乳酸菌在厌氧培养条件下均能正常生长,说明分离得到的菌株均为兼性厌氧菌。部分代表菌株的生理生化特征和碳源利用试验结果分别见表1和表2。
表1 12株代表菌株的生理生化特征
Table 1 Biochemical and physiological characteristics of 12 representative strains
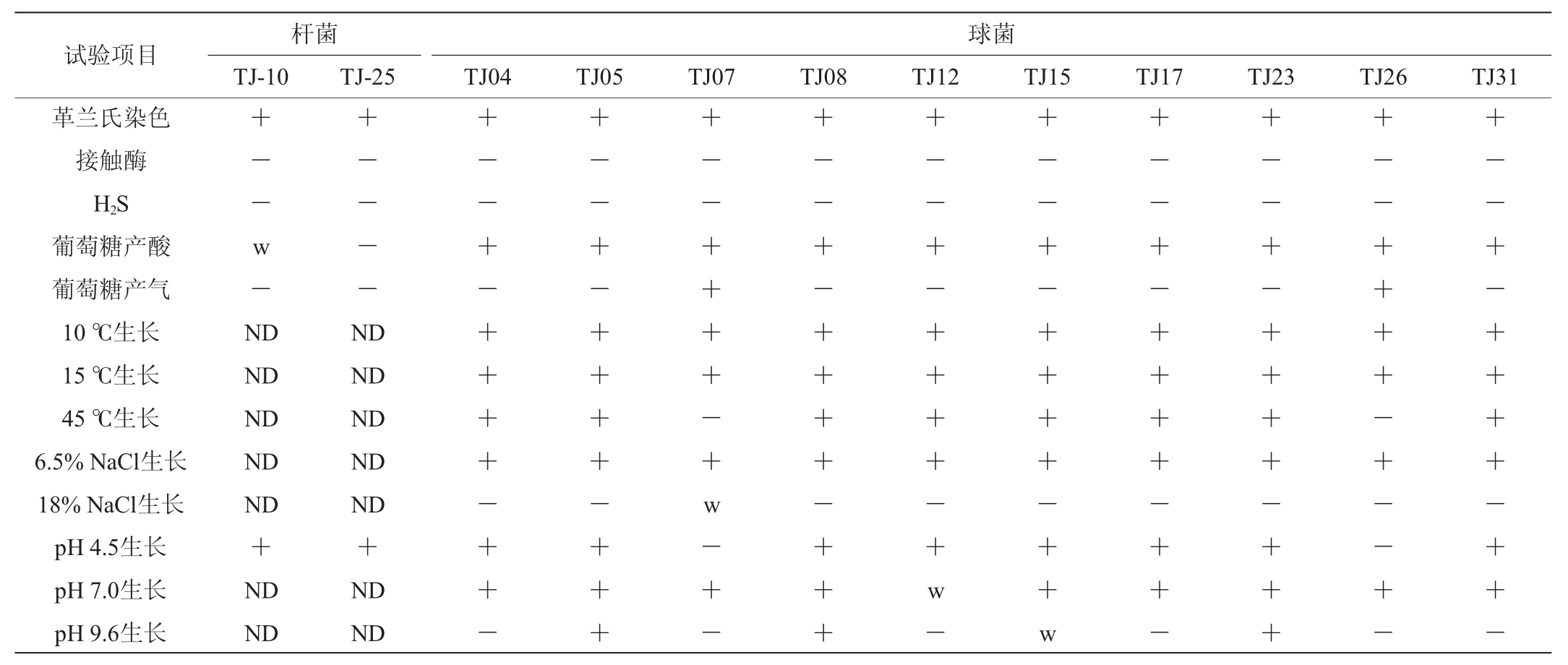
注:“+”表示结果呈阳性,“-”表示结果呈阴性,“w”表示结果呈弱阳性,“ND”表示未测定。下同。
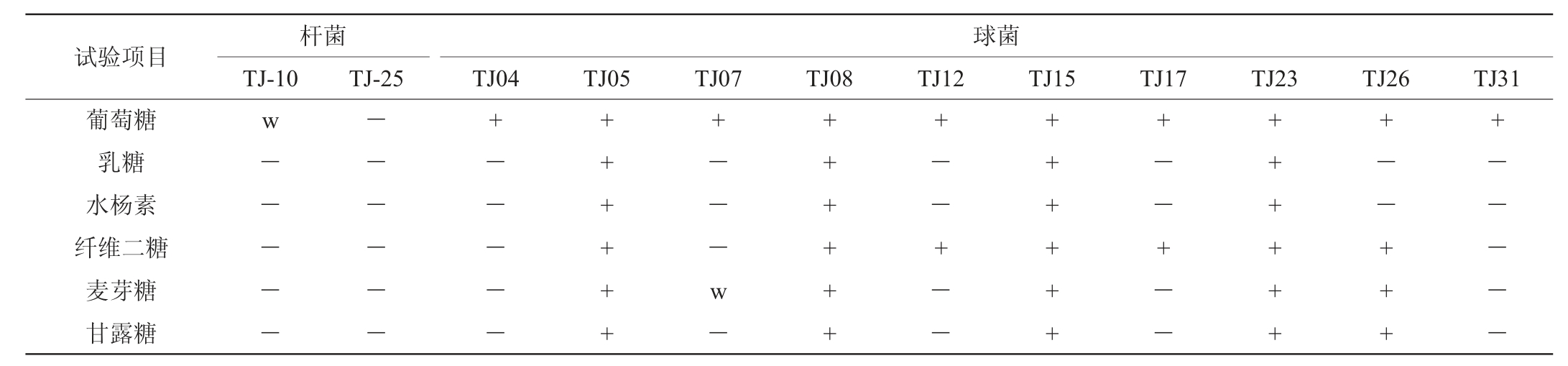
表2 12株代表菌株的碳源利用试验结果
Table 2 Results of carbon sources utilization tests of 12 representative strains
续表
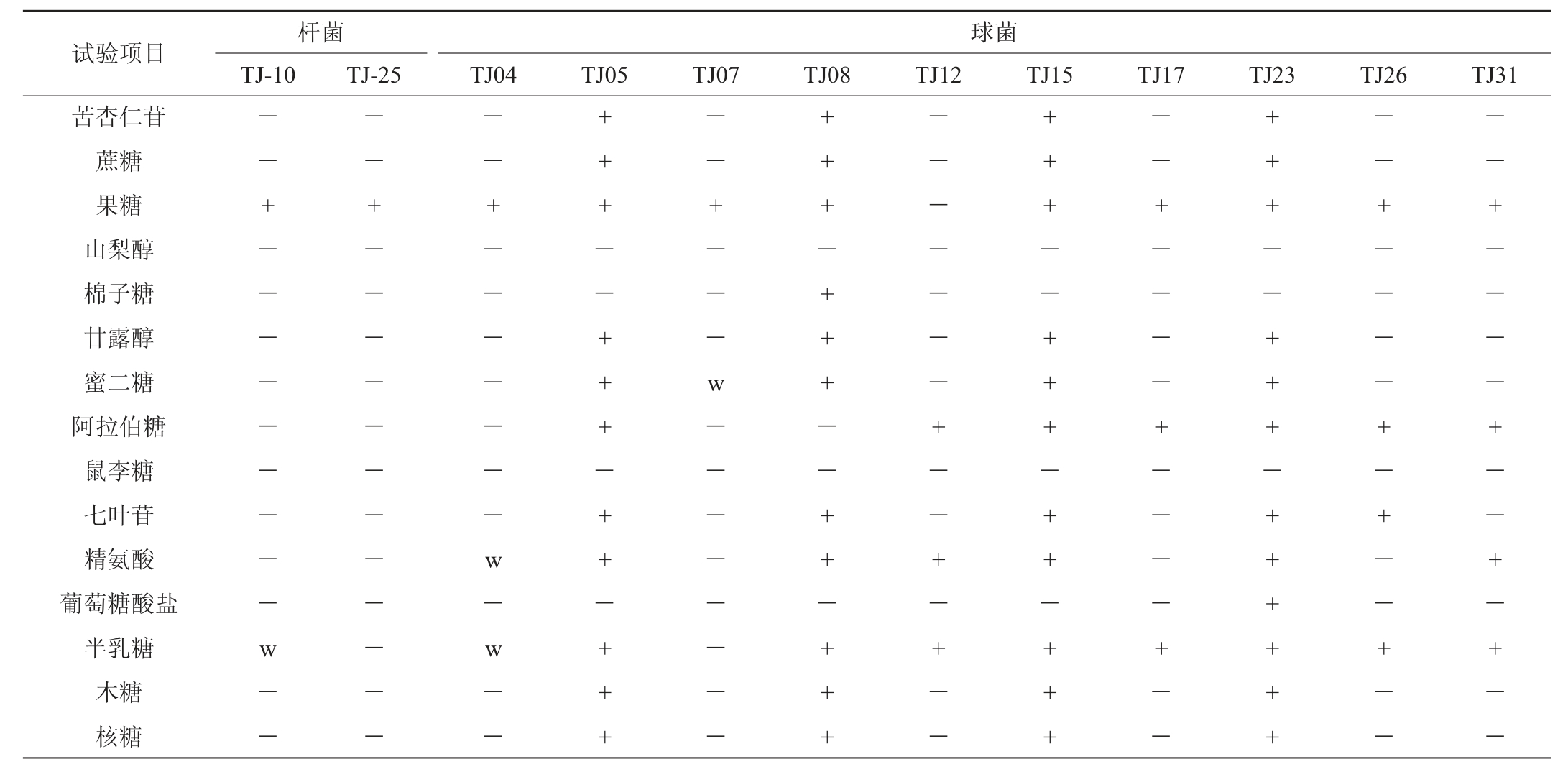
由表1及表2可知,菌株TJ10和TJ25均为接触酶阴性、不产生H2S、pH 4.5条件下能够生长的兼性厌氧杆菌,初步鉴定为乳杆菌属(Lactobacillus)。菌株TJ07和TJ26代谢葡萄糖产酸产气、15 ℃生长、45 ℃不生长,初步鉴定为魏斯氏菌属(Weissella)。菌株TJ05、TJ08、TJ15和TJ23代谢葡萄糖产酸不产气,在15 ℃、45 ℃、6.5%NaCl和pH 9.6条件下均可以生长,初步鉴定为肠球菌属(Enterococcus);菌株TJ04、TJ12、TJ17和TJ31代谢葡萄糖产酸不产气,在18%NaCl中不能生长,初步鉴定为片球菌属(Pediococcus)。碳源利用试验结果和生理生化鉴定结果有一定的匹配性,大多初步鉴定为同属的代表菌株表现出相同或相似的碳源利用能力。结合生理生化特征和碳源利用试验情况,其他21株菌株的初步鉴定结果见表3。
表3 基于生理生化试验21株菌株的初步鉴定结果
Table 3 Preliminary identification results of 21 strains based on biochemical and physiological tests

2.3 乳酸菌的分子生物学鉴定
将分离得到的33株乳酸菌的16S rRNA序列结果在NCBI上进行Blast相似性分析,选择同源性较高的菌株的16S rRNA序列,以邻接法构建系统发育树,结果见图2。
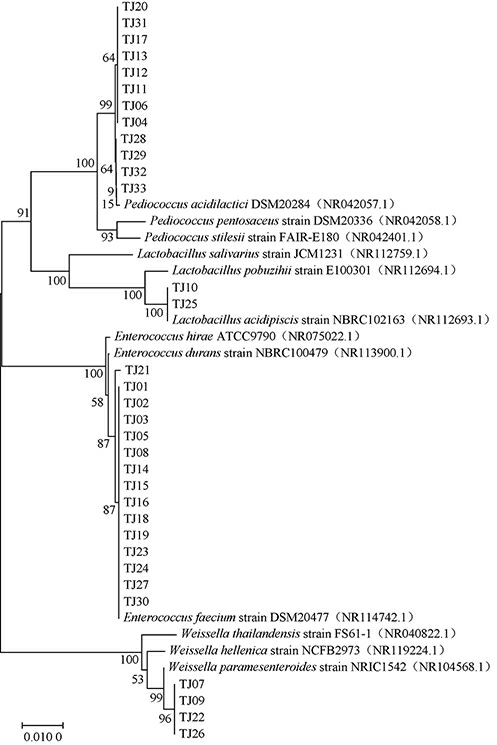
图2 基于16S rRNA序列33株乳酸菌株的系统发育树
Fig.2 Phylogenetic tree of 33 strains of lactic acid bacteria based on 16S rRNA sequences
由图2可知,菌株TJ01、TJ02等15株菌株与屎肠球菌(Enterococcus faecium)聚于同一分支,相似度均为99%,可鉴定为屎肠球菌;菌株TJ04、TJ06等12株菌株与乳酸片球菌(Pediococcus acidilactici)聚于同一分支,相似度均为99%,可鉴定为乳酸片球菌;菌株TJ07、TJ09等4株菌株与类肠膜魏斯氏菌(Weissella paramesenteroides)聚于同一分支,相似度均为99%,可鉴定为类肠膜魏斯氏菌;菌株TJ10和TJ25与酸鱼乳杆菌(Lactobacillus acidipiscis)处于同一分支,相似度均为100%,鉴定为酸鱼乳杆菌。由此得出,稀甜酱中分离得到的屎肠球菌和乳酸片球菌数量最多,分别占总分离乳酸菌数的45.5%和36.4%,为优势乳酸菌。
2.4 乳酸菌发酵滤液的抑菌活性
乳酸菌的发酵滤液中往往含有较多的乙酸、乳酸、过氧化氢等有抑菌效果的代谢产物[19-20],本试验通过调节pH和加入过氧化氢酶排除以上干扰因素[17],测定33株乳酸菌发酵液的抑菌活性,结果显示,空白对照未产生抑菌圈,33株乳酸菌仅有菌株TJ17和TJ31具有抑菌活性,其抑菌圈直径见表4。
表4 乳酸菌TJ31和TJ17发酵滤液对指示菌的抑制作用
Table 4 Antibacterial activity of fermented filtrate of lactic acid bacteria strains TJ31 and TJ17

注:“-”表示无抑菌圈,不同小写字母表示差异显著(P<0.05)。
由表4可知,乳酸菌TJ17和TJ31发酵液对金黄色葡萄球菌、单核细胞增生李斯特氏菌以及大肠埃希氏菌均有一定的抑制作用,且乳酸菌TJ31的抑菌效果强于菌株TJ17,但都对枯草芽孢杆菌无抑制作用。
菌株TJ17和TJ31经鉴定为乳酸片球菌。近年来,乳酸片球菌的益生活性[21]引起广泛关注,而抑菌能力是乳酸片球菌的重点研究内容之一。有研究表明,来源于片球菌属的细菌素(bacteriocins)类物质对单核细胞增生李斯特氏菌、金黄色葡萄球菌等致病菌有着强烈的抑制作用[22],本实验中的乳酸片球菌发酵产物对上述两种致病菌的抑制作用也较为明显,因此,值得对其有效抑菌成分开展进一步研究。
3 结论
利用经典乳酸菌筛选法从扬州稀甜酱中共分离得到33株乳酸菌,经形态学、生理生化和16S rRNA序列分析,鉴定15株为屎肠球菌(E.faecium)、12株为乳酸片球菌(P.acidilactici)、4株为类肠膜魏斯氏菌(W.paramesenteroides)、2株为酸鱼乳杆菌(L.acidipiscis),其中屎肠球菌和乳酸片球菌分别占总分离乳酸菌数的45.5%和36.4%,为稀甜酱中的优势乳酸菌。乳酸片球菌TJ17和TJ31发酵滤液对金黄色葡萄球菌、单核细胞增生李斯特氏菌和大肠埃希氏菌均有明显的抑制作用,且乳酸片球菌TJ31抑菌效果较好。
[1] WIDYASTUT I Y,ROHMATUSSOLIHAT,FEBRISIANTOSA A.The role of lactic acid bacteria in milk fermentation[J].Food Nutr Sci,2014,5(4):435-442.
[2]杜仁佳,张瑶.益生菌调节肠上皮细胞免疫反应的研究进展[J].微生物学免疫学进展,2018,46(1):80-84.
[3]王阶平,刘波,刘欣,等.乳酸菌的系统分类概况[J].生物资源,2019,41(6):471-485.
[4]吴燕,伏二伟,桑学财,等.传统浆水中乳酸菌的筛选及抑菌性能分析[J].食品研究与开发,2019,40(22):42-48.
[5]吴诗敏,雷文平,周辉,等.南山牧场牛乳中具有抑菌活性乳酸菌的筛选及鉴定[J].中国酿造,2019,38(5):108-112.
[6]刘静,杨富民,白斌芳,等.产细菌素乳酸菌菌株的来源及所产细菌素的分类研究进展[J].中国酿造,2018,37(6):20-24.
[7]张可可,王雅棋,张莉,等.红薯淀粉废水中乳酸菌的筛选及其对食源性致病菌的抑制作用[J].中国酿造,2017,36(10):32-35.
[8] DIGAITIENEA I,HANSEN A S,JUODEIKIENE G.Lactic acid bacteria isolated from rye sourdoughs produce bacteriocin-like inhibitory substances active against Bacillus subtilis and fungi[J].J Appl Microbiol,2012,112(4):732-742.
[9]路则宝,王靓贤,姬志林,等.具抑菌活性乳酸菌筛选及抑菌活性物质分析[J].江苏农业科学,2019,47(6):170-173.
[10]孙梦莹,焦煕栋,李新玲,等.海洋源乳杆菌抑菌物质的研究[J].食品研究与开发,2019,40(8):14-20.
[11]张国才,万兆龙.扬州酱菜稀甜酱生产方法的选择与改进[J].中国调味品,2002(4):25-26,28.
[12]汤先祥.扬州酱菜的历史、现状、工艺、技改和方向[J].中国调味品,2006(1):64-69.
[13]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-127.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-370.
[15]丁娟芳,杨嘉,朱淑云,等.扬州酱菜中降解亚硝酸盐乳酸菌的筛选[J].中国酿造,2019,37(12):87-91.
[16]谭才邓,朱美娟,杜淑霞,等.抑菌试验中抑菌圈法的比较研究[J].食品工业,2016,37(11):122-125.
[17]于微,高学军,马春丽,等.干酪乳杆菌产细菌素的生物学特性分析[J].安徽农业科学,2014,42(32):11542-11543.
[18]卫生部卫生法制与监督司.消毒技术规范第一分册[M].北京:中华人民共和国卫生部,2002.
[19] DE KEERSMAECKER S C J,VERHOEVEN T L A,DESAIR J,et al.Strong antimicrobial activity of Lactobacillus rhamnosus GG against Salmonella typhimurium is due to accumulation of lactic acid[J].FEMS Microbiol Lett,2006,259:89-96.
[20]王玉文,刘英华.乳酸菌的生物拮抗作用[J].中国乳品工业,2008,36(2):55-57.
[21]王建设,赵海燕,王凡,等.乳酸片球菌的分离鉴定与益生功能的初步研究[J].中国农学通报,2012,28(24):201-206.
[22]王祺,张军,乔晓妮,等.片球菌素的来源、生物合成、抑菌机理及其构效关系的研究进展[J].食品与发酵工业,2020,46(9):278-284.