随着《国民营养计划(2017-2030年)》的实施,“健康中国”已成为国家战略。天然、健康、功能已经成为消费者选择食品的最大关注,越来越多的消费者出于健康目的而重视植物基化学成分的摄入[1]。酱油中不仅含有大豆原料中的不饱和脂肪酸、多糖、大豆异黄酮、大豆多肽、大豆皂苷等物质,还包括经微生物代谢产生的多肽、类黑精、呋喃酮类物质等[2-7]。已有研究表明,酱油具有抗氧化、降血压、降血脂、降低胆固醇、抗癌、抗过敏等功能活性[8-10]。由此可知,酱油不仅仅是调味品,同时也是消费者摄取植物化学成分的重要载体,消费者可以通过日常生活实现植物化学成分的摄入。因此,通过改变传统发酵酱油用原料、发酵工艺等方式来提升酱油品质,强化营养与安全是酱油产品的创新点之一。
黑豆含有的不饱和脂肪酸、食物纤维、微量元素、黄酮、类黄酮化合物及独特的生物活性物质,具有抗氧化、降血压、降血脂、延缓衰老、增强免疫力、改善睡眠等保健作用[11-13]。此外,有研究表明黑豆蛋白质[14]、维生素、总酚及种皮含有的花青素和花色苷类物质含量高于黄豆[15],故而赋予了黑豆更高的抗氧化活性。王猛[16]研究表明,黑豆酱油中花色苷含量为0.217 g/100 mL;王鹏等[17]研究表明,采用黑豆为原料发酵的酱油原花青素含量为24.2 mg/100 g;张欢欢等[18]比较了黑豆酱油与黄豆酱油的基本成分、抗氧化活性及风味物质,结果显示黑豆酱油体外抗氧化活性显著高于黄豆酱油。然而由于体外抗氧化分析结果往往与体内真实抗氧化作用没有直接联系,且基于体内抗氧化试验比较不同原料酿造酱油尚未见报道。
本研究以市售的黑豆、黄豆和黄豆粕原料发酵的酱油为研究对象,通过斑马鱼体内抗氧化试验,分析比较3种酱油的抗氧化活性;采用电子鼻(electronic nose,E-nose)、气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)结合主成分分析(principal component analysis,PCA)等分析比较不同原料酱油挥发性风味特征,为酱油的配方、发酵工艺优化与市场推广提供科学依据。
1 材料与方法
1.1 材料与试剂
黑豆酱油(1#,配料表:水、非转基因黑大豆、食用盐、小麦)、黄豆酱油(2#,配料表:水、非转基因黄豆、小麦、食用盐)、黄豆粕酱油(3#,配料表:水、非转基因脱脂大豆、小麦、食用盐、白砂糖):市售;谷胱甘肽(glutathione,GSH)、活性氧族物质(reactive oxygen species,ROS)特异性荧光染料:美国Sigma公司;AB品系斑马鱼、CM工作液、E3工作液:杭州环特生物科技股份有限公司。
1.2 仪器与设备
BSA224S型万分之一电子天平:北京赛多利斯仪器系统有限公司;96孔酶标板:赛默飞世尔科技(中国)有限公司;Mithras LB940多功能酶标仪:德国Berthold Technologies(伯托)公司;PEN 3.5系统便携式电子鼻:德国Airsense公司;Agilent Intuvo 9000气相色谱仪、Agilent 5977B气相色谱-质谱联用仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 不同原料酱油体内抗氧化作用测定[19-21]
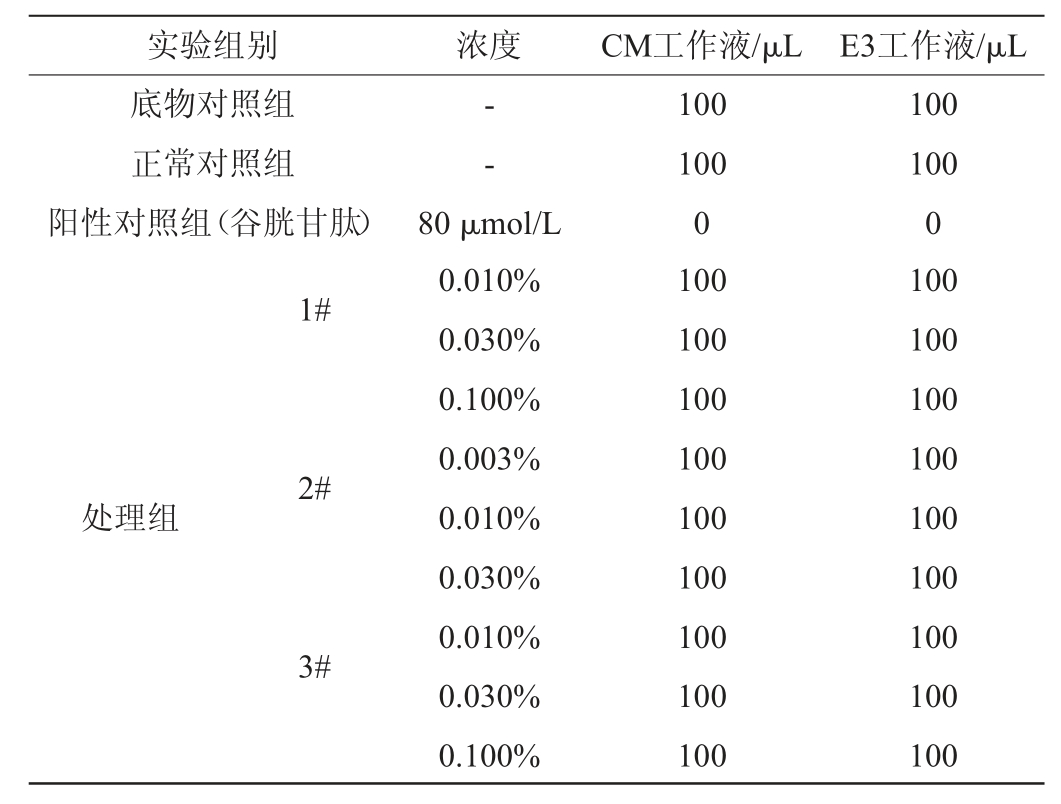
酱油抗氧化作用浓度的确定:在显微镜下挑选发育一致3dpf的AB系斑马鱼10尾于微孔板中,水溶给样,每组进行3次平行试验。正常对照组用标准稀释水处理正常斑马鱼;处理组设置酱油样品1#、2#、3#的检测浓度均为0.001%、0.003%、0.010%、0.030%、0.100%、0.300%,培养24 h后,观察斑马鱼的死亡情况,确定3个酱油样品抗氧化作用的试验浓度。
酱油体内抗氧化作用:在显微镜下挑选发育一致3dpf的AB系斑马鱼10尾于微孔板中,水溶给样。试验设计见表1。
计算抗氧化活性,其计算公式如下:
式中:F正常组表示正常对照组的荧光值,F底物表示底物对照组的荧光值,F实验组表示各处理组的荧光值。
表1 酱油体内抗氧化试验设计
Table 1 Experimental design of antioxidant effect of soy sauce in vivo
1.3.2 不同原料酱油电子鼻分析[22]
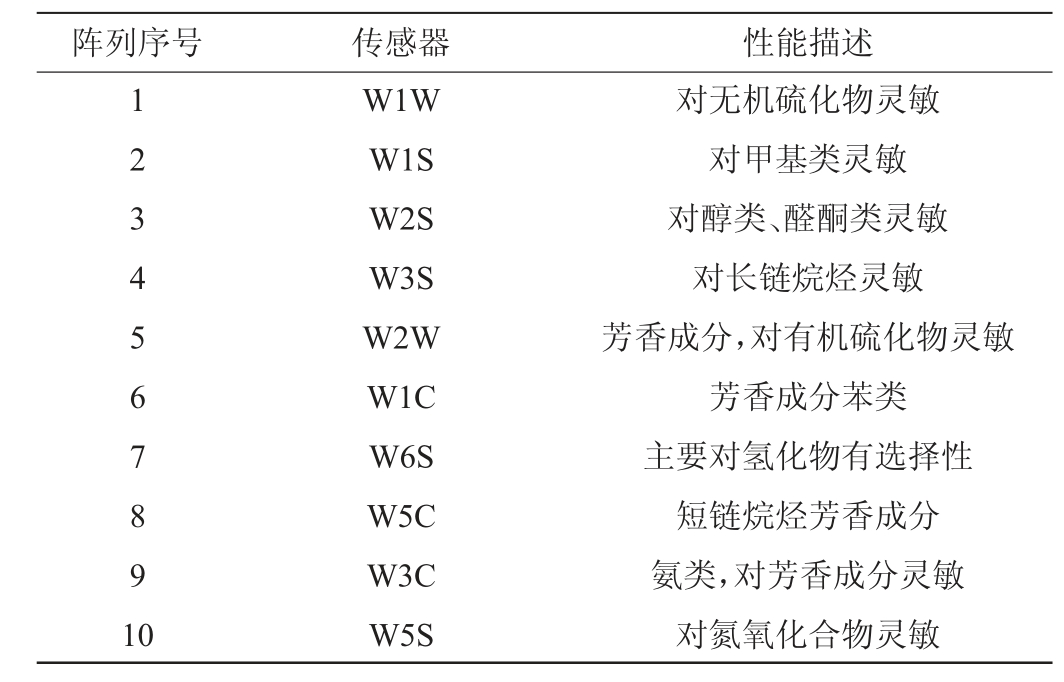
分别准确吸取5 g不同酱油样品于40 mL样品瓶中,室温下静置30min后,采用顶空抽样的方法用电子鼻进行检测。电子鼻参数设置:样品准备时间5 s,自动调零时间为5 s,样品测定时间120 s,清洗时间150 s,内部空气流速300 mL/min,进样流量300 mL/min。电子鼻不同传感器对应物质种类见表2。选取120~122 s检测数据进行主成分分析。
表2 电子鼻不同传感器对应物质种类
Table 2 Corresponding aroma types of different sensors of electronic nose
1.3.3 不同原料酱油挥发性风味物质GC-MS分析[18]
顶空固相微萃取:分别取5 g不同酱油样品于20 mL顶空固相微萃取瓶中,40 ℃平衡20 min,采用50 μm CAR/DVB/PDMS萃取头萃取30 min。
GC条件:DB-5MS UI色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(He),载气流速为1 mL/min,进样口温度250 ℃,不分流进样,解吸时间5 min。升温程序:40 ℃保持3 min,以10 ℃/min速率上升至180 ℃,以4 ℃/min升温至220 ℃保持5 min,以4 ℃/min速率升温至240 ℃保持3 min,最后以10 ℃/min速率升温至250 ℃保持5 min。
MS条件:接口温度280 ℃,电子轰击离子源(electron impact ion source,EI),电离能量70 eV,离子源温度230 ℃,质量扫描范围质核比(m/z)35~500 u。采用美国国家标准与技术研究院(national institute of standards and technology,NIST)2017谱库检索进行定性分析,采用面积归一化法计算各成分相对百分含量。
1.3.4 数据处理
每个样品做3个平行,结果取平均值。描述性统计值以“平均值±标准差”表示,电子鼻测定结果采用自带软件对传感器采集数据进行PCA;GC-MS数据采用Origin 2019 Pro软件进行PCA。
2 结果与分析
2.1 不同原料酱油抗氧化作用比较
2.1.1 不同原料酱油抗氧化作用实验浓度的选择
分别经不同浓度的3种酱油处理斑马鱼后,斑马鱼的死亡率见表3。
表3 不同浓度的3种酱油样品处理后斑马鱼的死亡率
Table 3 Death rate of zebrafish treated by different concentration of three soy sauce samples
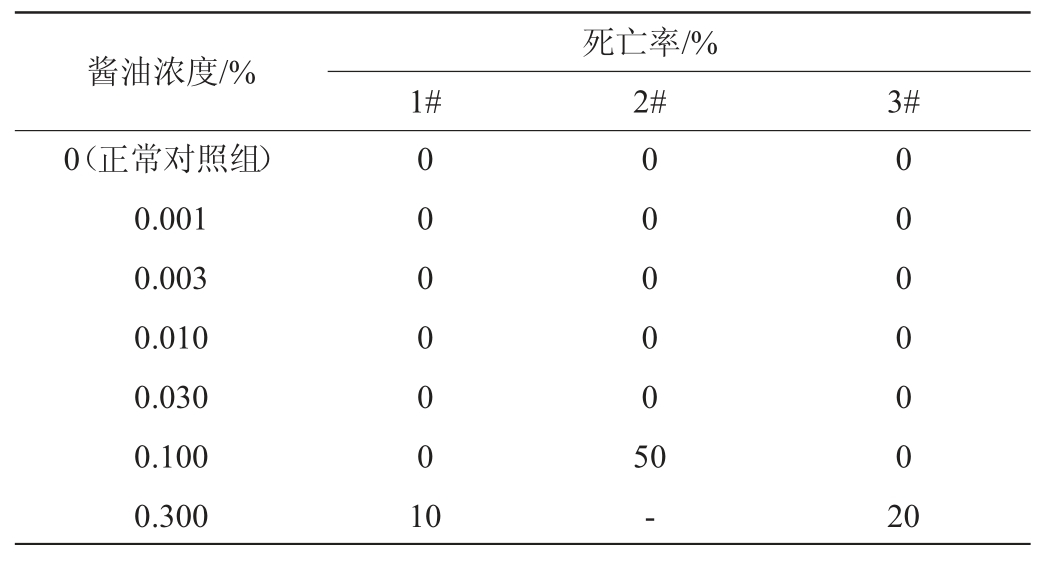
注:“-”表示在此浓度下未做检测。
由表3可知,正常对照组斑马鱼的死亡率为0,1#、2#、3#酱油样品分别在0.30%、0.10%、0.30%浓度条件下导致斑马鱼死亡,致死率分别为10%、50%和20%。因此,本研究选择酱油抗氧化实验浓度分别为:1#和3#酱油样品为0.010%、0.030%和0.100%;2#酱油样品为0.003%、0.010%和0.030%。
2.1.2 不同原料酱油体内抗氧化活性对比分析
通过斑马鱼实验比较了黑豆酱油、黄豆酱油、黄豆粕酱油的体内抗氧化活性,结果见图1,3种酱油浓度为0.030%时对斑马鱼抗氧化作用的荧光图结果见图2。
由图1和图2可知,1#酱油样品抗氧化活性最强,在0.010%和0.030%浓度条件下抗氧化活性与80 μmol/L谷胱甘肽阳性对照组之间无显著性差异(P>0.05)。在相同浓度条件下,1#酱油样品与2#、3#相比较均存在显著差异性(P<0.05),而2#、3#酱油样品在相同浓度(0.010%、0.030%)条件下抗氧化活性无显著差异(P>0.05)。以上研究结果表明,黑豆酱油的抗氧化效果优于黄豆酱油和豆粕酱油。
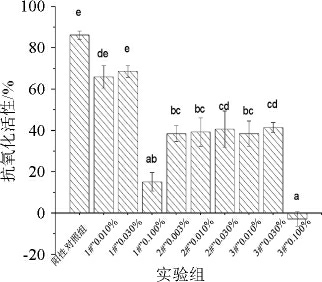
图1 3种酱油样品的体内抗氧化活性
Fig.1 Antioxidant activity in vivo of three soy sauce samples
不同字母表示差异显著(P<0.05)。

图2 浓度为0.03%的3种酱油样品对斑马鱼抗氧化活性荧光图
Fig.2 Fluorescent diagram of the antioxidant activity of three soy sauce samples with concentration 0.03% on Zebrafish
此外,通过比较同一样品不同浓度抗氧化活性可知,1#、3#酱油样品在0.010%和0.030%浓度条件下,2#酱油样品在0.003%、0.010%和0.030%浓度条件下均表现出抗氧化活性,而高浓度0.100%条件下的抗氧化作用低于低浓度的抗氧化作用,可能是由于所选浓度在斑马鱼抗氧化模型上已达到最大能效浓度。结合2.1.1部分结果可知,0.100%浓度接近致死剂量,可能是高浓度条件下对斑马鱼的生存造成了胁迫,促使斑马鱼机体出现毒性反应,产生大量ROS,使得ROS水平较高,检测的抗氧化活性反而更低。该结果也从一定程度上反映了0.010%和0.030%为最大能效浓度。
2.2 不同原料酱油风味电子鼻分析
选择电子鼻120~122s的检测数据进行PCA,结果见图3。
由图3可知,PC1和PC2贡献率分别为99.49%和0.46%,合计贡献率为99.95%。所以这两个成分能够较好代表样品风味的主要信息特征。3种酱油样品95%置信区彼此分开,说明3种酱油风味特征有显著差异。其中,黄豆酱油与豆粕酱油、黑豆酱油相比较,沿PC1正半轴移动较大,沿PC2轴移动较小,且在PC2轴上黄豆酱油与豆粕酱油、黑豆酱油均有重叠。黑豆酱油与豆粕酱油相比,在PC1轴无差异,而在PC2正轴移动较大,且存在显著差异。黄豆酱油与豆粕酱油、黑豆酱油的区分度分别为0.955和0.954,黑豆酱油与豆粕酱油的区分度为0.114,说明3种酱油风味特征有显著差异,且黄豆酱油与豆粕酱油、黑豆酱油之间的区分度更高。
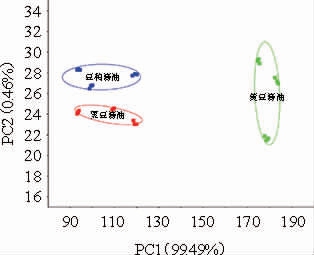
图3 基于电子鼻分析结果酱油风味主成分分析
Fig.3 Principal component analysis of electronic nose of soy sauce flavor
3种酱油样品不同传感器载荷分析见图4。由图4可知,对主成分1贡献率较大的为W5S(氮氧化合物),结合图2可知,黄豆酱油与黑豆酱油、豆粕酱油风味特征差异主要体现在含有较高含量的氮氧化合物,而黑豆酱油和豆粕酱油在W5S传感器上无显著差异。对主成分2贡献率较大的是W1W(无机硫化物)、W2S(醇类)、W1S(甲基类),且特征值均为正。因此,与黑豆酱油相比较,豆粕酱油无机硫化物、醇类和甲基类物质的含量可能相对较高。
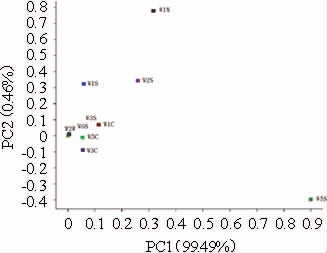
图4 3种酱油样品不同传感器载荷分析图
Fig.4 Sensors loading analysis of three soy sauce samples
2.3 不同原料酱油中挥发性风味物质分析
2.3.1 不同原料酱油中挥发性风味物质GC-MS分析
电子鼻能在一定程度上对风味进行定性分析,能将风味差异定位到某类挥发性组分。为进一步了解3种酱油挥发性成分的变化,采用GC-MS对酱油中挥发性物质的种类进行检测,并采用面积归一化法计算各组分相对百分含量,结果见表4。
表4 3种酱油样品挥发性风味物质组成
Table 4 Volatile flavor components of three soy sauce samples

由表4可知,从3种酱油样品中共鉴定出33种挥发性风味成分,包括醇、醛、酸、酯、酚、酮及杂环类化合物,相对含量由高到低依次为醇(84.18%~88.67%)、杂环类化合物(5.52%~6.87%)、醛(3.30%~4.69%)、酚(0~2.97%)、酸(0~2.58%)、酯(0.42%~0.77%)、酮(0.09%~0.48%),受发酵工艺和检测方法的影响,该研究结果与其他研究结果有一定差异性[18,22]。根据本研究结果,豆粕酱油、黑豆酱油、黄豆酱油中分别鉴定出20种、24种和23种挥发性风味成分,3种酱油样品中共有成分为12种。其中豆粕酱油中乙醇和苯乙醇含量相对较高,相对含量分别为82.07%、4.88%,均为酵母发酵产物,为酱油的主体成分。黄豆酱油中苯乙醇和4-乙基愈创木酚相对含量较豆粕酱油和黑豆酱油高,这两种物质主要由酵母产生且对酱油风味有较大贡献,对酱油特征风味的形成有较大影响[23-24]。黑豆酱油中呋喃甲醇和2-乙酰基吡咯含量较豆粕酱油和黄豆酱油高,其中2-乙酰基吡咯呈香豆素香气,还有茶味香味、甜味[24],也对酱油特征风味的形成有较大影响。
2.3.2 不同原料酱油中挥发性物质PCA分析
对3种酱油样品中的33种成分进行主成分分析,结果见图5和表5。
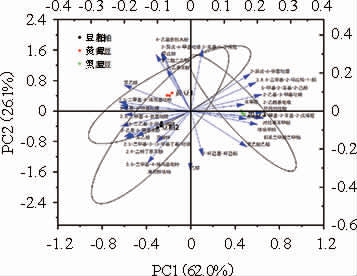
图5 3种酱油样品挥发性物质主成分分析
Fig.5 Principal component analysis of volatile substances in three soy sauce samples
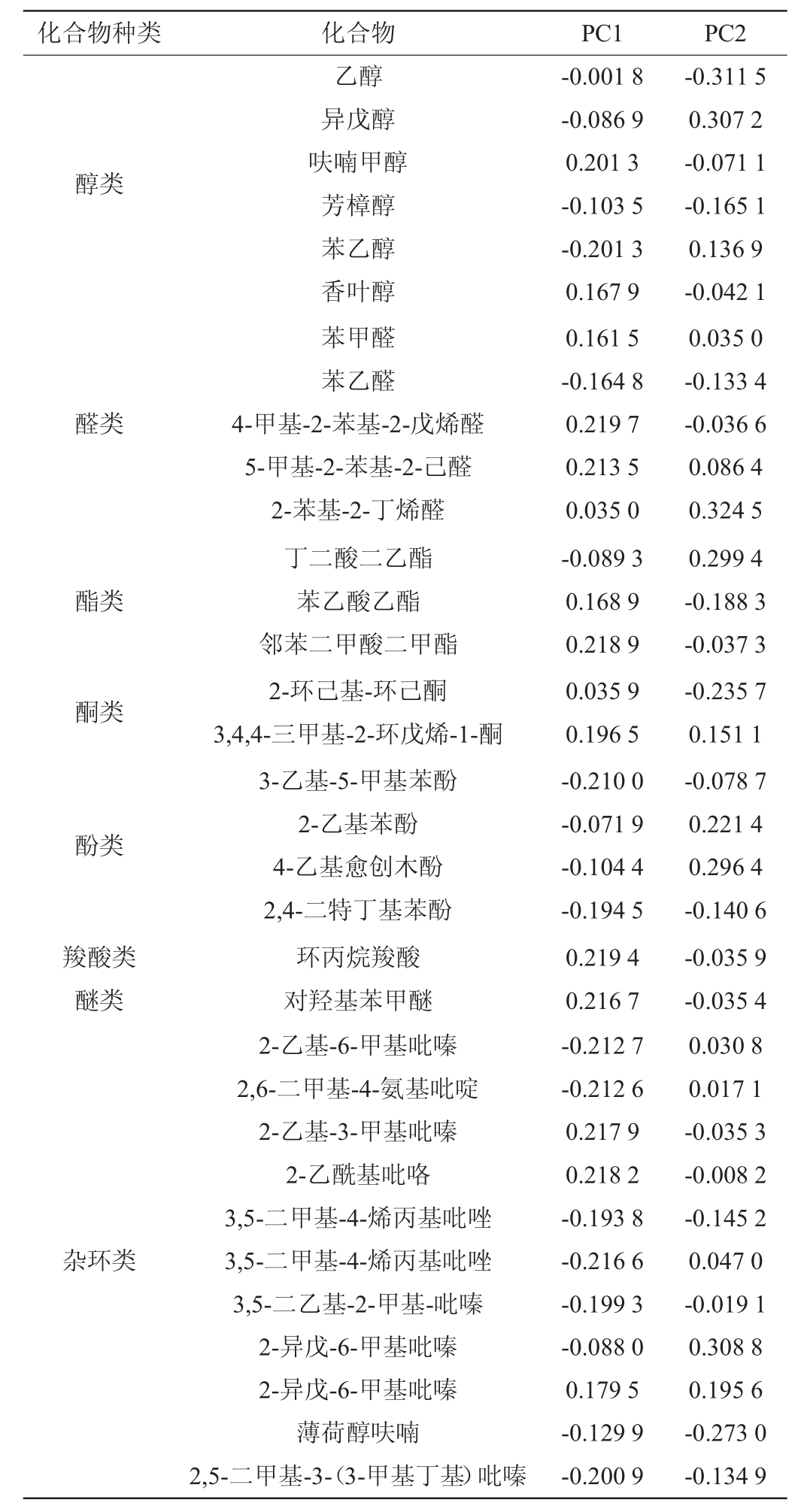
由图5可知,PC1和PC2贡献率分别为62.0%和26.1%,累积贡献率为88.1%,说明这两个主成分能代表33种物质的主要信息。由图5亦可知,3种酱油分布置信区域均有一定重叠,说明3者之间风味物质没有显著差异性。3者之间黑豆酱油与黄豆酱油、豆粕酱油之间的差异较大,黄豆酱油与豆粕酱油之间差异较小。黑豆酱油与黄豆酱油、豆粕酱油分布在PC1轴上移动较大,说明黑豆酱油与黄豆、豆粕风味物质在PC1方向有较大差异。结合表5可知,PC1主成分特征值向量较大的有环丙烷羧酸、苯乙醇及11种杂环化合物,其中正向量包括环丙烷羧酸、2-乙基-3甲基吡嗪、2-乙酰基吡咯、对羟苯甲醚、3,4,4-三甲基-2-环戊烯-1-酮、4-甲基-2-苯基-2-戊烯醛、邻苯二甲酸二甲酯、5-甲基-2-苯基-2-己醛,负向量有2-乙基-6-甲基吡嗪、2,6-二甲基-4-氨基吡啶、3,5-二甲基-4-烯丙基吡唑、苯乙醇、2,5-二甲基3-(3-甲基丁基)吡嗪等。由此可知,以上13种化合物是造成黑豆酱油与黄豆酱油、豆粕酱油差异的主要物质,且黑豆酱油特征风味物质主要为杂环类化合物(正值),而黄豆与豆粕酱油特征风味物质有苯乙醇及杂环类化合物(负值)。通过比较PC2对3种酱油差异的影响可知,3者存在一定差异性。结合表4可知,3者之间差异的物质还包括乙醇、异戊醇、丁二酸二乙酯、2-异戊-6-甲基吡嗪、2-苯基-2-丁烯醛、4-乙基愈创木酚、2-环己基-环己酮等。
表5 主成分PC1、PC2各因子载荷表
Table 5 Factor loading table of main components PC1 and PC2
综合电子鼻及GC-MS分析结果可知,黑豆酱油与黄豆酱油、豆粕酱油在物质组成和风味特征上均有较大差异,豆粕酱油醇类物质含量最为丰富,黄豆酱油中芳香族化合物含量较为丰富(苯乙醇和4-乙基愈创木酚含量相对较高),而黑豆酱油中呋喃类、吡咯类物质含量相对较高。由此可知,发酵过程中的酵母对豆粕酱油和黄豆酱油风味物质的产生有较大贡献,使得黄豆酱油和豆粕酱油的风味更加丰富、协调。而黑豆酱油中的风味物质更多是在加热过程中产生,醇香味突出,但酱香味较为寡淡。黄豆酱油和豆粕酱油虽然在呈味特征上有显著差异,但物质组成上差异较小。两种分析结果差异性主要是源于电子鼻分析结果主要体现的是呈味特征的结果,而挥发性物质PCA体现的是物质组成。产品的风味特征是由物质组成和呈味特性共同决定的,由挥发性物质PCA分析可知,PC1和PC2特征值较大的向量主要为杂环类化合物,这些物质具有呈味阈值低,对酱油风味影响大的特点[18],因此这些物质可能是造成两者风味差异较大的原因。
3 结论
本研究分析比较了以黄豆粕、黑豆、黄豆为原料的三种市售酱油的抗氧化活性、风味特征及风味物质组成。结果表明,黑豆酱油的体内抗氧化活性显著高于黄豆酱油和豆粕酱油(P<0.05),在0.01%和0.03%浓度下,黑豆酱油的抗氧化作用分别为66.0%和68.5%;黄豆酱油的抗氧化作用分别为38.5%和39.3%;黄豆粕酱油的抗氧化作用分别为38.4%和41.5%。黑豆酱油的挥发性物质组成和特征香气与黄豆酱油、豆粕酱油存在较大差异,风味特征差异主要表现为:三者相比氮氧化合物是黄豆酱油特征风味,无机硫化物、W2S醇类、W1S甲基类是豆粕酱油的特征风味,而黑豆酱油特征风味物质主要为杂环类化合物。挥发性风味物质组成差异表现为:黑豆酱油中2-乙酰基吡咯含量较高,豆粕酱油中乙醇和苯乙醛含量相对较高,而黄豆酱油中苯乙醇、4-乙基愈创木酚等重要风味物质相对含量较高,以上具有明显差异的香气成分几乎都为酿造过程中微生物发酵代谢产生,由此推断可能是由于酱油发酵工艺的差异而带来了风味物质成分在组成和含量上的不同。
[1]丁钢强.国民营养计划(2017-2030 年)[C].北京:中国营养学会第十次特殊营养学术会议论文集,2017.
[2]周文斯.低温胁迫米曲霉自溶制备鲜味酱油及呈味肽的分离鉴定[D].无锡:江南大学,2019.
[3]张丽.高盐稀态酱油发酵过程中添加酵母的研究[D].贵阳:贵州大学,2019.
[4]胡贝.酱油生产过程中羧甲基赖氨酸和5-羧甲基糠醛的同步检测及其抑制研究[D].广州:华南理工大学,2019.
[5]李沛,李库,任达洪,等.酵母抽提物协助酱油减盐后对其风味物质的影响研究[J].中国酿造,2019,38(12):92-96.
[6]白佳伟,陈亮,周尚庭,等.特级高盐稀态酿造酱油中关键香气物质的分析[J].中国酿造,2019,38(11):179-185.
[7]葛金鑫,李永凯,曾斌.酱油的风味物质[J].中国酿造,2019,38(10):16-20.
[8]袁园,鲁绯,黄持都,等.酱油功能性研究最新进展[J].中国酿造,2010,29(1):1-4.
[9]吕东津,宋小焱,梁姚顺.酱油中生理活性物质及其营养保健作用[J].中国酿造,2004(11):31-33.
[10]李会品.酱油降尿酸活性评价、XOD 抑制活性成分的分离鉴定及作用机制研究[D].广州:华南理工大学,2019.
[11]徐飞,葛阳阳,刘新春,等.黑豆营养成分及生物活性的研究进展[J].中国食物与营养,2019,25(9):55-61.
[12]曹柏营,张雅婷,孙睿彤,等.黑豆花青素提取及抗氧化活性研究[J].食品研究与开发,2019,40(6):94-99.
[13]张星,童欣,刘振春,等.大孔树脂纯化黑豆异黄酮的工艺优化[J].西北农林科技大学学报,2018,46(1):136-145.
[14]罗诗茹,蔡玉莲,朱冠琳,等.黑豆、黄豆、红豆、绿豆中的蛋白质含量比较[J].科技视界,2014(20):69.
[15]XU B,CHANG S K C.Antioxidant capacity of seed coat,dehulled bean,and whole black soybeans in relation to their distributions of total phenolics,phenolic acids,anthocyanins,and isoflavones[J].J Agr Food Chem,2008,56(18):8365-8673.
[16]王猛.黑豆酱油的初步研发[D].天津:天津科技大学,2012.
[17]王鹏,王文平,续丹丹,等.黑豆酱油的开发及其品质分析[J].中国酿造,2018,37(10):25-30.
[18]张欢欢,耿予欢,李国基.黄豆酱油与黑豆酱油抗氧化活性及风味物质的比较[J].现代食品科技,2018,34(6):97-106.
[19] HERMANN A C,MILLARD P J,BLAKE S L,et al.Development of a respiratory burst assay using zebrafish kidneys and embryos[J].J Immunol Meth,2004,292(1):119-129.
[20] XU H,SHAO X,ZHANG Z,et al.Oxidative stress and immune related gene expression following exposure to di-n-butyl phthalate and diethyl phthalate in zebrafish embryos[J].Ecotoxicol Environ Safe,2013,93:39-44.
[21]南京新环检测科技有限公司.一种斑马鱼体内ROS 检测模型的建立方法及其应用:CN201310398791.3[P].2019-04-16.
[22]范霞,陈荣顺.五种市售酿造酱油风味物质及氨基酸含量分析[J].中国调味品,2019,44(10):144-148.
[23]朱莉,许长华.酱油关键风味物质及其功能与发酵工艺研究进展[J].食品与发酵工业,2018,44(6):287-292.
[24]冯云子.高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D].广州:华南理工大学,2015.