杏为蔷薇科(Rosaceae)杏属(Armeniaca Mill)[1],其广义上认为主要分为普通杏(Prunus armeniaca L.)、西伯利亚杏(Prunus sibirica L.)、东北杏(Prunus mandshurica)和梅(Prunus mume)的变种、变型和杂交种质[2-4],原产于我国,有着丰富的物种资源和广泛的地理分布[5-6]。我国是杏的起源地,种类繁多[7],分布广泛,其中华北温热带杏区是我国杏树资源的主产区[8]。杏营养价值极为丰富[9],其中糖类物质约5%~17%,含氮物质约9%,矿物质约0.37%~0.83%[10-11],是一种实用性价值比较高的水果。杏属于呼吸跃变型果实[12],且采收期较为集中,多为高温季节,因而不耐贮藏[13],采收后易发生软化腐败、失水、褐变等品质劣变[14],故杏的货架期较短,限制了杏的市场供应时间。
白兰地是一种蒸馏酒,以水果为原料,经过发酵、蒸馏、陈酿及调配制成的酒[15],根据国标GB/T 11856—2008《白兰地》,白兰地的酒精度不低于36.0%vol。传统的水果白兰地通常选用葡萄、苹果、红枣、梨等水果[16-18]作为原料,决定白兰地品质的因素有原料的品质、酿造工艺以及陈酿的时间等[19-20]。
目前对杏的加工主要集中在杏干、杏脯、杏酱、杏汁、杏酒等产品[21],对杏白兰地研究报道很少。李宝坤等[22]采用单因素试验和正交试验,确定了杏白兰地的发酵工艺为发酵温度23 ℃,起始糖度26%,接种量3%。何伟等[23]研究了杏皮渣浆液的制备方式、酵母筛选、接种量等影响因素对杏皮渣白兰地发酵的影响。本研究以河北串枝红杏为原料,研究杏浆的酶解工艺及杏白兰地的酿造工艺,通过单因素试验、正交试验和响应面试验优化果胶酶酶解和发酵工艺,以期能酿造出口感醇厚、典型性强的杏白兰地,提高杏的深加工能力,为实现杏白兰地的工业化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
河北串枝红杏,白砂糖:市售;高效活性干酵母:安琪酵母有限公司;果胶酶(酶活2.25×104 U/g):法国SAS SOFRALAB OENOFRANCE公司;偏重亚硫酸钾(分析纯):天津天利化学试剂有限公司;抗坏血酸(色谱纯):美国蓝白Labscience公司。
1.2 仪器与设备
15R高速冷冻离心机:力康生物医疗科技控股有限公司;SPX型生化培养箱:上海东器实业有限公司;ZNCL-BS磁力搅拌器:上海卓越仪器设备有限公司;PAL-α糖度计:日本爱拓公司。
1.3 方法
1.3.1 杏白兰地工艺流程
1.3.2 操作要点
原料处理[24-25]:选择无腐烂、无病虫害的八分熟杏果为原料,贮存于-18 ℃。处理时用清水淋洗两遍,注意不要破坏杏果表面组织,去核去果柄。
酶解[26]:将杏果肉与0.2%的抗坏血酸水溶液按照质量比1∶1混合,果胶酶添加量0.10%,酶解温度45 ℃,酶解时间3 h对混合液进行酶解处理。
成分调整[27]:以80 mg/L的比例添加偏重亚硫酸钾,并调整果浆pH到适合酵母菌生长的范围,加入白砂糖调整可溶性固形物含量。
发酵:在无菌条件下,向果汁中加入活化酵母菌,24 ℃条件下恒温发酵,发酵期间每日搅拌2次,每天测定残糖、总酸、酒精度,当残糖量连续3 d不变时,发酵结束。
蒸馏:将果浆发酵后的原酒液和果渣进行一次蒸馏和二次蒸馏,得到馏出液,馏出液经过陈酿即为杏白兰地。
1.3.3 杏果浆酶解工艺优化正交试验
表1 杏果浆酶解工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for enzymatic hydrolysis process optimization of apricot pulp
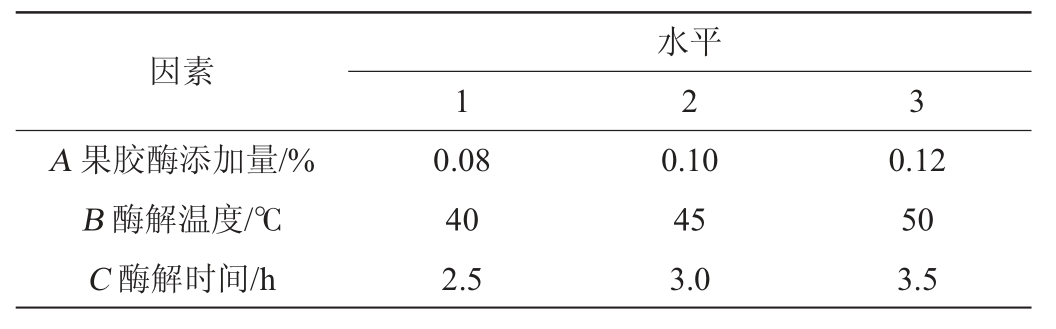
因素A 果胶酶添加量/%B 酶解温度/℃C 酶解时间/h 1水平2 3 0.08 40 2.5 0.10 45 3.0 0.12 50 3.5
采用果胶酶酶解杏果浆,研究果胶酶添加量、酶解时间、酶解温度对酶解后杏浆的可溶性固形物和出汁率的影响。在单因素试验结果基础上,选取果胶酶添加量(A)、酶解温度(B)、酶解时间(C)为自变量,以透光率、出汁率、可溶性固形物含量为评价指标,采用Max-Min归一化处理,以3个指标处理结果的平均值作为综合评价的指标,设计L9(33)进行3因素3水平的正交试验,其因素与水平见表1。
1.3.4 杏白兰地发酵工艺优化
发酵工艺优化单因素试验:分别考察发酵温度(18 ℃、20 ℃、22 ℃、24 ℃、26 ℃、28 ℃)、酵母接种量(0.02%、0.04%、0.06%、0.08%、0.10%)和初始糖浓度(20%、22%、24%、26%、28%)对杏白兰地发酵结束后的酒液感官评分及酒精度的影响。
在单因素试验的基础上,设计发酵温度(A)、酵母接种量(B)和初始糖度(C)3个因素作为影响杏白兰地发酵的因子,依照Box-Behnken设计原理,以发酵结束后的白兰地酒精度(Y1)和感官评分(Y2)为响应值,优化杏白兰地发酵工艺参数,Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken tests design
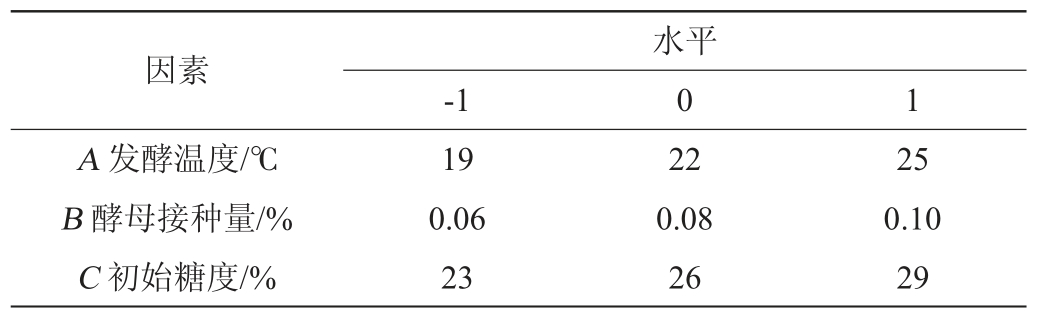
因素A 发酵温度/℃B 酵母接种量/%C 初始糖度/%-1水平0 1 19 0.06 23 22 0.08 26 25 0.10 29
1.3.5 杏白兰地发酵结束后一次蒸馏的酒液感官评分方法
选择经过感官品评知识培训的10名研究生(5男,5女)进行,评定参照国标GB/T 11856—2008《白兰地》,杏白兰地发酵结束后的酒液感官评分标准见表3,满分100分,结果取平均值。
表3 杏白兰地发酵结束后的酒液感官评分标准
Table 3 Sensory evaluation standards of liquor after apricot brandy fermentation
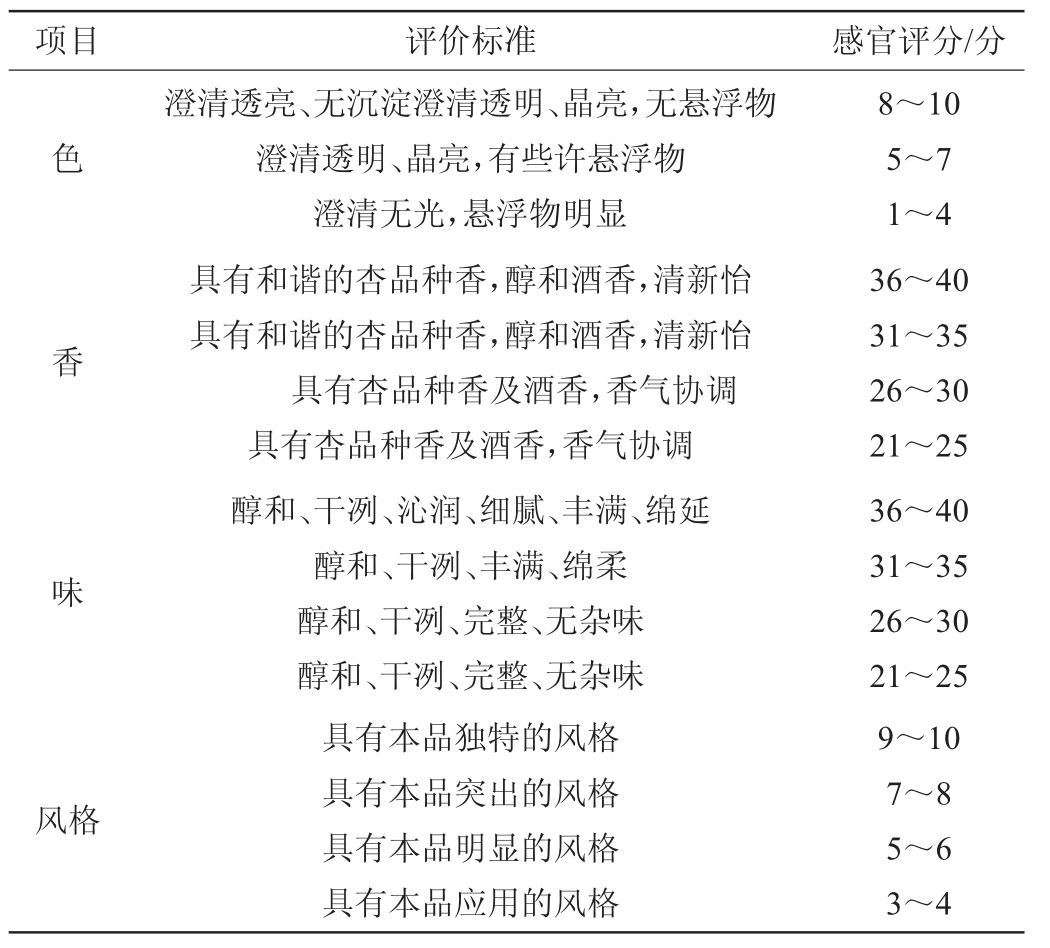
项目 评价标准 感官评分/分色香澄清透亮、无沉淀澄清透明、晶亮,无悬浮物澄清透明、晶亮,有些许悬浮物澄清无光,悬浮物明显具有和谐的杏品种香,醇和酒香,清新怡具有和谐的杏品种香,醇和酒香,清新怡具有杏品种香及酒香,香气协调具有杏品种香及酒香,香气协调8~10 5~7 1~4 36~40 31~35 26~30 21~25味风格醇和、干冽、沁润、细腻、丰满、绵延醇和、干冽、丰满、绵柔醇和、干冽、完整、无杂味醇和、干冽、完整、无杂味具有本品独特的风格具有本品突出的风格具有本品明显的风格具有本品应用的风格36~40 31~35 26~30 21~25 9~10 7~8 5~6 3~4
1.3.6 理化指标检测方法
可溶性固形物:使用PAL-α型手持精度计进行测定;总酸:参考GB/T 12456—2008《食品中总酸的测定》中的方法进行测定;酒精度、总酯、挥发性物质含量参照GB/T 11856—2008《白兰地》中的方法进行测定。
2 结果与分析
2.1 酶解工艺条件优化
采用果胶酶酶解杏果浆,研究果胶酶添加量、酶解时间、酶解温度对酶解后杏浆的可溶性固形物和出汁率的影响。果胶酶酶解杏果浆正交试验结果见表4,方差分析见表5。
表4 杏果浆酶解工艺优化正交试验结果与分析
Table 4 Results and analysis of orthogonal tests for enzymatic hydrolysis process optimization of apricot pulp
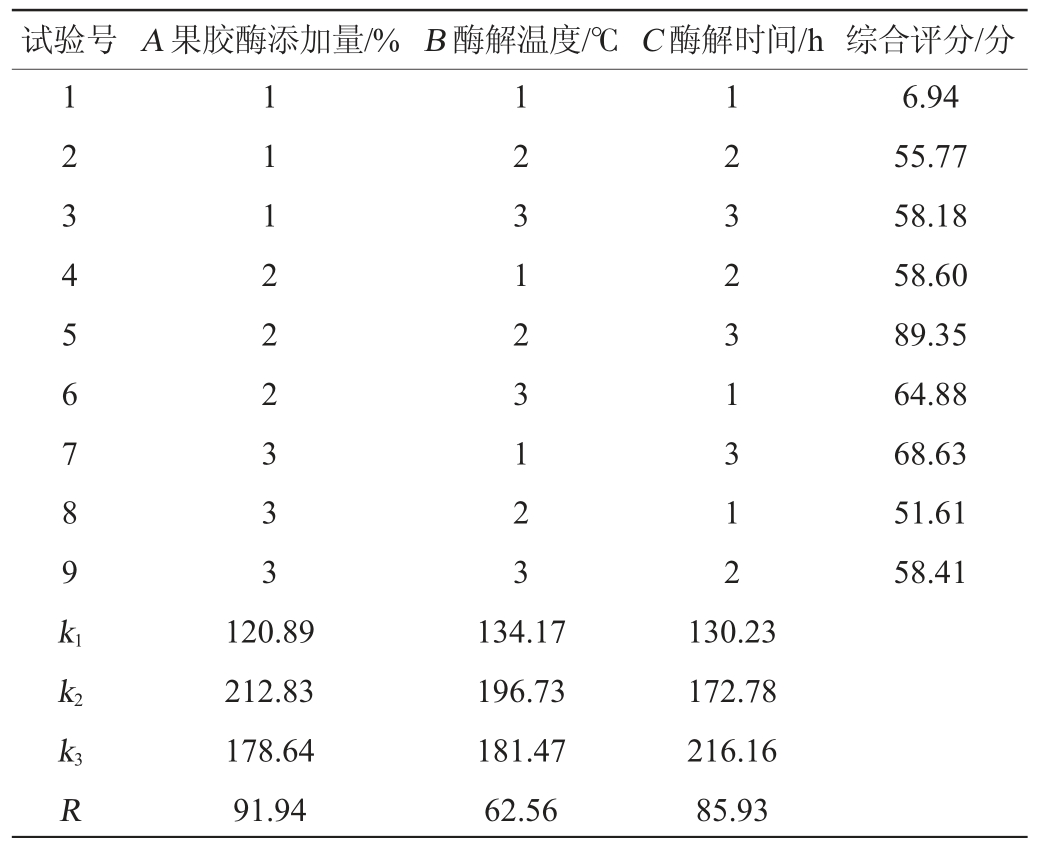
试验号 A 果胶酶添加量/% B 酶解温度/℃ C 酶解时间/h 综合评分/分1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 6.94 55.77 58.18 58.60 89.35 64.88 68.63 51.61 58.41 k2 k3 R 120.89 212.83 178.64 91.94 134.17 196.73 181.47 62.56 130.23 172.78 216.16 85.93
表5 正交试验结果方差分析
Table 5 Variance analysis of orthogonal tests results
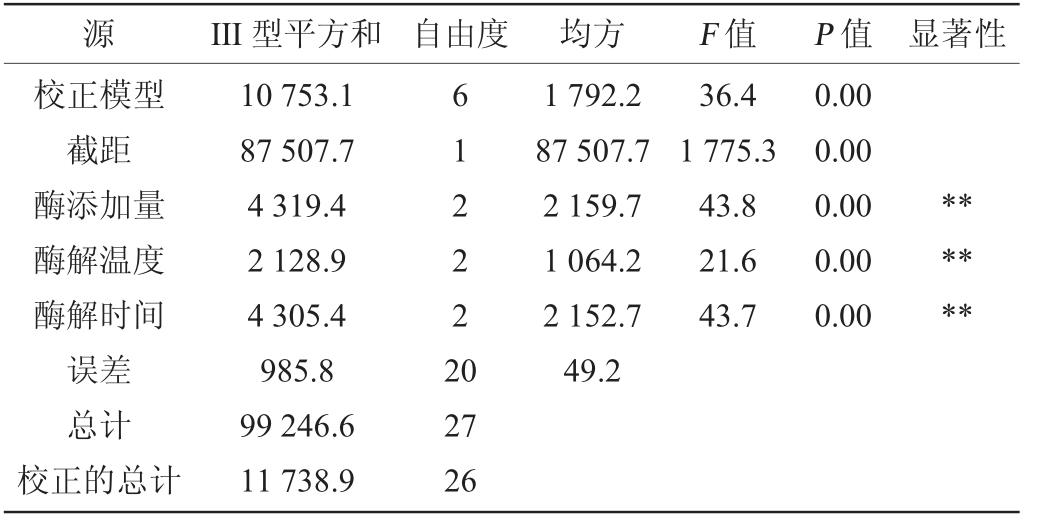
注:“**”表示对结果影响极显著(P<0.01)。
源 III 型平方和 自由度 均方 F 值 P 值 显著性校正模型截距酶添加量酶解温度酶解时间误差总计校正的总计10 753.1 87 507.7 4 319.4 2 128.9 4 305.4 985.8 99 246.6 11 738.9 6 1 2 2 2 2 0 1 792.2 87 507.7 2 159.7 1 064.2 2 152.7 49.2 36.4 1 775.3 43.8 21.6 43.7 0.00 0.00 0.00 0.00 0.00******27 26
由表4可知,果胶酶添加量对综合评价的影响最大,其次是酶解时间,酶解温度的影响最小,综合评分最高的组合为A2B2C3,即果胶酶添加量0.10%,酶解温度45 ℃,酶解时间3.5 h。在此优化酶解条件下,综合评价最高,为89.35分。由表5可知,果胶酶添加量、酶解时间与酶解温度对综合评分的影响均极显著(P<0.01)。
2.2 发酵工艺优化
2.2.1 不同发酵温度对杏白兰地发酵的影响
在酵母接种量为0.08%,初始糖量为26%条件下,考察发酵温度18 ℃、20 ℃、22 ℃、24 ℃、26 ℃、28 ℃对杏果浆发酵后酒液酒精度、感官评分、总糖的影响,结果见图1。
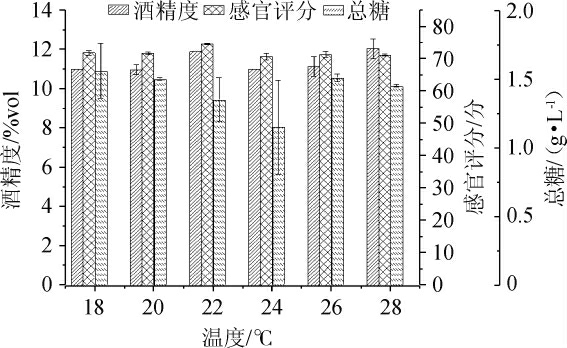
图1 发酵温度对杏果浆发酵后酒液的影响
Fig. 1 Effect of fermentation temperature on liquor after apricot pulp fermentation
由图1可知,随着发酵温度的升高,杏果浆发酵后酒液感官评分呈现先升高后下降的趋势,酒精度随着发酵温度的升高,变化不明显,总糖随着发酵温度的升高,呈现先增加后降低的趋势。当发酵温度达到22 ℃时,感官评分达到峰值74.60分,酒精度达到11.9%vol,随着发酵温度的升高,起酵速度加快,发酵周期变短,但同时加快了酵母的衰老,导致乙醇体积分数下降,温度升高会使整个发酵醪的体系中腐败微生物增多,酒香中包含着杏果实过熟气味,且果香会随着发酵产生的CO2气体溢出,香气损失较大,风味、口感等感官特性变差,使得感官评分下降。因此,确定适宜发酵温度为22 ℃。
2.2.2 不同酵母接种量对杏白兰地发酵的影响
在发酵温度22 ℃,初试糖量为26%条件下,考察酵母菌接种量0.02%、0.04%、0.06%、0.08%、0.10%对杏果浆发酵后酒液感官评分、酒精度和总糖的影响,结果见图2。
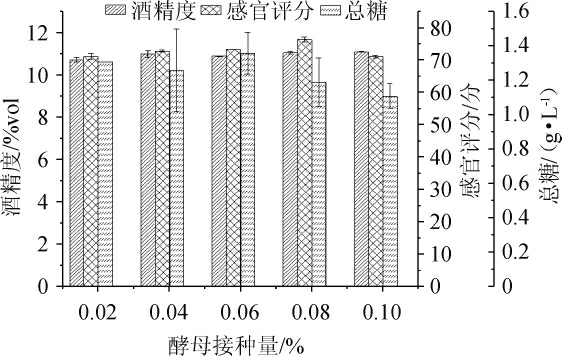
图2 不同酵母接种量对杏果浆发酵后酒液的影响
Fig. 2 Effect of different yeast inoculum on liquor after apricot pulp fermentation
由图2可知,当酵母接种量为0.08%时,杏果浆发酵后酒液感官评分达到最大值,酵母接种量低于0.08%时,酒精度和感官评分随着酵母菌接种量的增加而逐渐升高,当接种量达到0.10%时,酒精转化量不显著,感官评分却显著性下降(P<0.05),当酵母接种量为0.08%时,总糖为1.19 g/L。这可能是因为酵母接种量过少,酵母不能将糖全部转化为酒精;而酵母接种量过大会导致酵母菌在短时间内利用糖进行自身繁殖,因此大量的糖类被消耗而酒精度并不会显著上升,与此同时由于初始糖度是一定的,过多酵母菌的加入会导致其与糖类物质相比是过量的,因此所得的酒酵母味比较重,与杏香和酒香并不能协调,感官评分降低。因此,确定酵母接种量为0.08%。
2.2.3 不同初始糖度对杏白兰地发酵影响
在发酵温度为22 ℃,酵母接种量为0.08%条件下,考察初始糖度20%、22%、24%、26%、28%对杏果浆发酵后酒液感官评分、酒精度和总糖的影响,结果见图3。
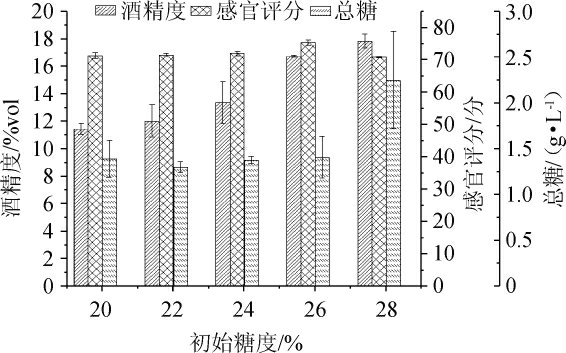
图3 不同初始糖度对杏果浆发酵后酒液的影响
Fig. 3 Effect of different initial sugar contents on liquor after apricot pulp fermentation
由图3可知,随着糖添加量的增加,杏白兰地发酵后酒液的感官评分和酒精度逐渐增加,当糖添加量为26%时,感官评分达到最大值75.4分,继续增大糖度含量,感官评分降低,原因可能是因为当初始糖度较低时,酵母菌可利用的糖较少,发酵周期相应较短,同时酯类物质和香气物质积累的也少;当糖浓度过高时会使发酵液渗透压过大,酵母菌的代谢被抑制,过多的糖已经不能再被转化为酒精,发酵延滞对杏白兰地品质有较大影响。因此,选择初始糖度含量为26%。
2.2.4 响应面法优化发酵工艺
在单因素试验的基础上,采用Design-Expert 8.0.6软件设计3因素3水平响应面优化试验,设计发酵温度(A)、酵母接种量(B)和初始糖度(C)作为影响因子,依照Box-Behnken设计原理,以发酵结束后的酒液酒精度(Y1)和感官评分(Y2)为响应值,优化杏白兰地发酵工艺参数,Box-Behnken试验设计结果见表6。
表6 Box-Behnken试验设计结果
Table 6 Design and results of Box-Behnken tests
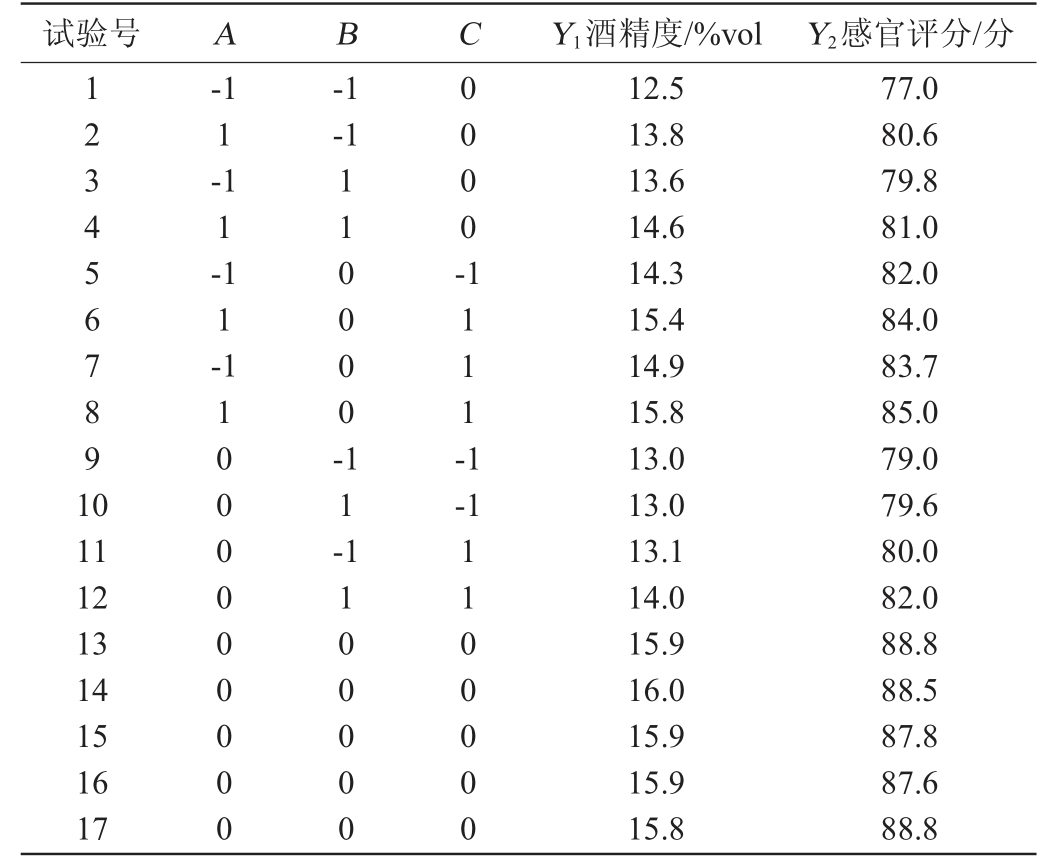
试验号 A B C Y1酒精度/%vol Y2感官评分/分1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 1 1 0 0 0 0-0 0 0 0-1 1 1 1-1-1 11 12 13 14 15 16 17 1 0 0 0 0 0 0 0 0 0 1 1-1 1 0 0 0 0 0 1 1 0 0 0 0 0 12.5 13.8 13.6 14.6 14.3 15.4 14.9 15.8 13.0 13.0 13.1 14.0 15.9 16.0 15.9 15.9 15.8 77.0 80.6 79.8 81.0 82.0 84.0 83.7 85.0 79.0 79.6 80.0 82.0 88.8 88.5 87.8 87.6 88.8
2.2.5 回归模型的建立及方差分析
应用Design-Expert 8.0.6软件对试验数据进行回归分析,得到酒精度(Y1)和感官评分(Y2)的回归方程:

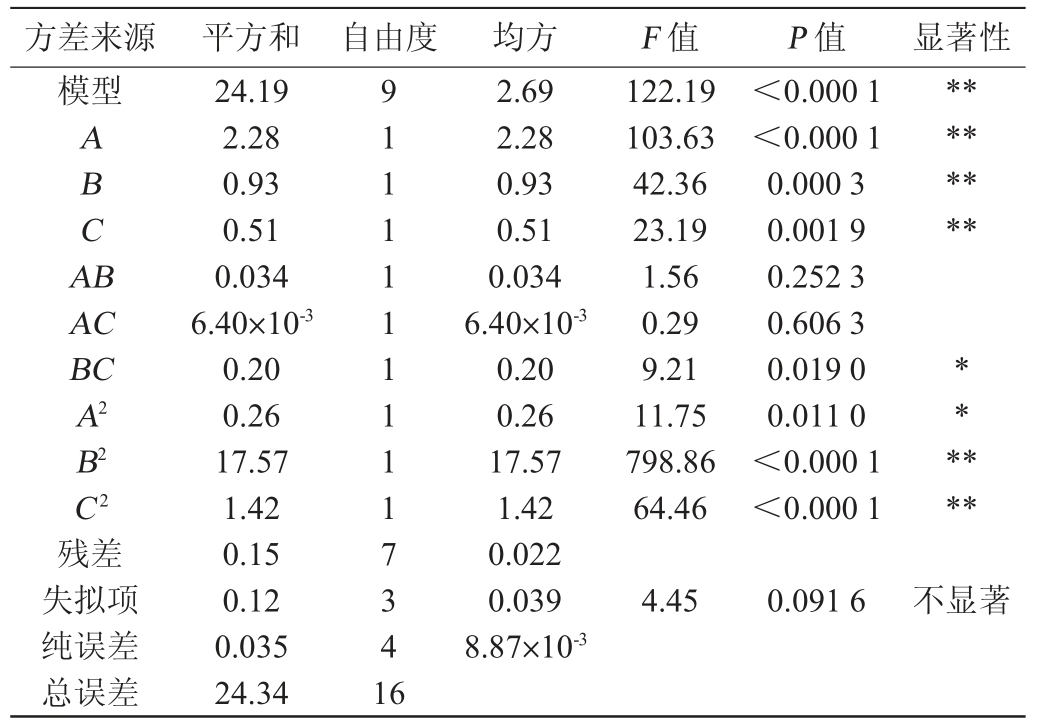
以酒精度为响应值回归模型的方差分析结果见表7。从表7可知,响应面回归模型P<0.000 1,说明回归模型极显著;失拟项的P=0.091 6>0.05,说明模型失拟项不显著。决定系数R21=0.993 7,调整决定系数R21adj=0.985 5,说明该模型拟合度高,试验误差小,能够用于分析发酵温度(A)、酵母接种量(B)、初始糖度(C)交互作用对酒精度影响的预测。根据回归系数的显著性表明,交互项AB、AC及二次项A2对酒精度影响没有达到显著性水平(P>0.05),而一次项A、B、C和二次项B2、C2对酒精度的影响都达到了极显著水平(P<0.01);交互项BC对酒精度的影响也达到了显著水平(P<0.05);这说明发酵温度、酵母接种量、初始糖度是杏白兰地酿造过程中影响酒精度的重要因素,也是酿造过程中的关键控制因素。由表7可知,各个因素对酒精度影响显著程度由大到小依次为发酵温度(A)>酵母接种量(B)>初始糖度(C)。
以感官评分为响应值的回归模型方差分析结果见表8。由表8可知,模型P<0.000 1,说明回归模型极显著;失拟项P=0.752 4>0.05,说明模型失拟项不显著。决定系数R22=0.993 2,调整决定系数R2adj2=0.984 6,说明该模型拟合度高,试验误差小,能够用于分析发酵温度(A)、酵母接种量(B)、初始糖度(C)交互作用对感官评分影响的预测。
表7 以酒精度为评价指标的回归模型方差分析
Table 7 Variance analysis of regression model using alcohol content as evaluation index
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。下同。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型A B C A B********AC BC A2 B2 C2残差失拟项纯误差总误差24.19 2.28 0.93 0.51 0.034 6.40×10-3 0.20 0.26 17.57 1.42 0.15 0.12 0.035 24.34 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 2.69 2.28 0.93 0.51 0.034 6.40×10-3 0.20 0.26 17.57 1.42 0.022 0.039 8.87×10-3 122.19 103.63 42.36 23.19 1.56 0.29 9.21 11.75 798.86 64.46<0.000 1<0.000 1 0.000 3 0.001 9 0.252 3 0.606 3 0.019 0 0.011 0<0.000 1<0.000 1******4.45 0.091 6不显著
根据回归系数的显著性表明,交互项AC、BC没有达到显著性水平(P>0.05),对感官评分没有显著影响,而在一次项A、B、C和二次项A2、B2、C2对感官评分的影响都达到了极显著水平(P<0.01);交互项AB对感官评分的影响也达到了显著水平(P<0.05);这说明发酵温度、酵母接种量、初始糖度是杏白兰地酿造过程中影响感官评分的重要因素。通过比较F值的大小,可以推断出试验范围内各因素对酒精度和感官评分的影响大小,F值越大,对结果的影响越大。由表8可知,各个因素对感官评分的影响程度由大到小依次为发酵温度(A)>初始糖度(C)>酵母接种量(B)。
表8 以感官评分为评价指标的回归模型方差分析
Table 8 Variance analysis of regression model using sensory score as evaluation index
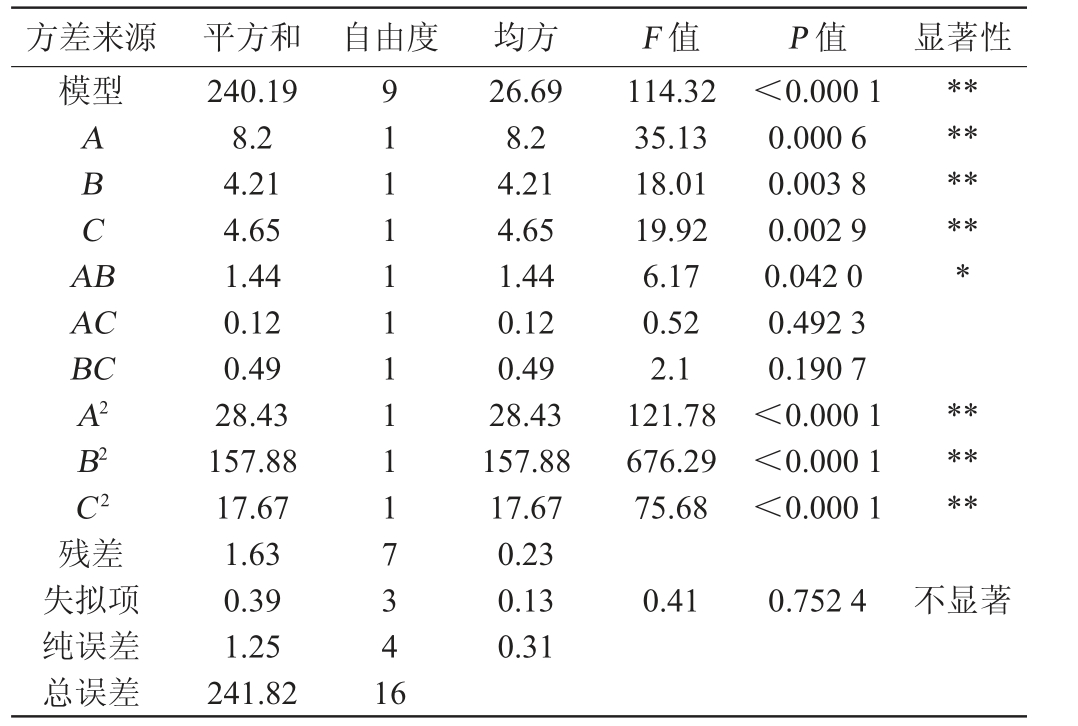
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型A B C A B*********AC BC A2 B2 C2残差失拟项纯误差总误差240.19 8.2 4.21 4.65 1.44 0.12 0.49 28.43 157.88 17.67 1.63 0.39 1.25 241.82 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 26.69 8.2 4.21 4.65 1.44 0.12 0.49 28.43 157.88 17.67 0.23 0.13 0.31 114.32 35.13 18.01 19.92 6.17 0.52 2.1 121.78 676.29 75.68<0.000 1 0.000 6 0.003 8 0.002 9 0.042 0 0.492 3 0.190 7<0.000 1<0.000 1<0.000 1******0.41 0.752 4不显著
2.2.6 响应面分析及优化

图4 发酵温度、酵母接种量及初始糖度对杏果浆发酵后酒液酒精度影响的响应面及等高线
Fig. 4 Response surface plots and contour lines of effects of interaction between fermentation temperature, yeast inoculum and initial sugar content on alcohol content of liquor after apricot pulp fermentation
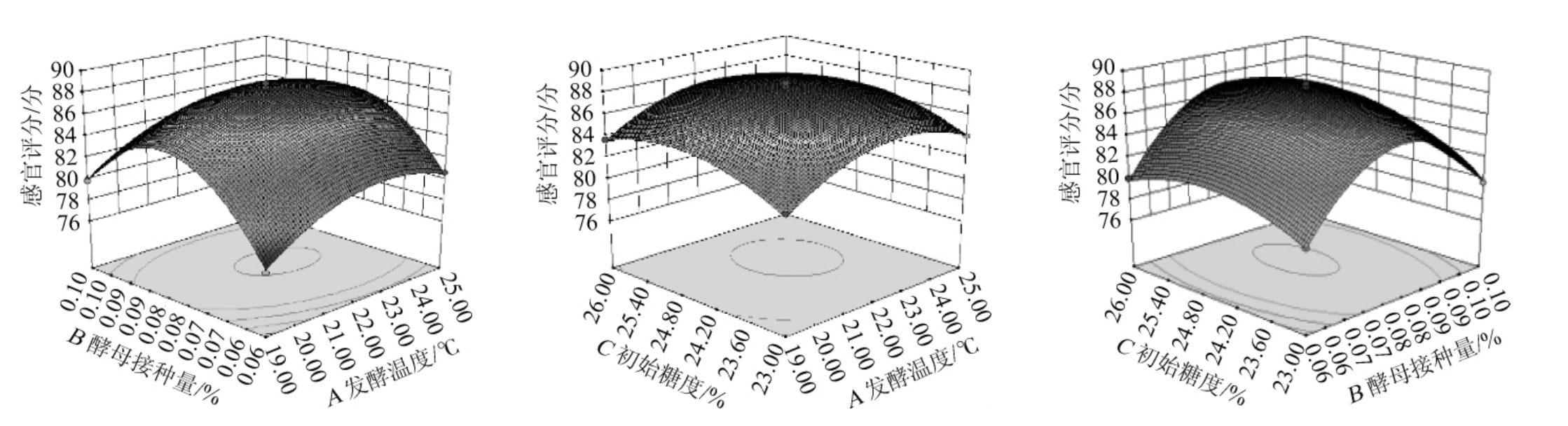
图5 发酵温度、初始糖度及酵母接种量对杏果浆发酵后酒液感官评分影响的响应面及等高线
Fig. 5 Response surface plots and contour lines of effects of interaction between fermentation temperature, initial sugar content and yeast inoculum on sensory score of liquor after apricot pulp fermentation
利用Design-Expert 8.0.6软件对回归模型进行响应面优化,得到发酵温度、酵母接种量、初始糖度三个因素交互影响对杏果浆发酵后酒液酒精度和感官评分的响应曲面及等高线分别见图4和图5。由图4和图5可知,酵母接种量(B)和初始糖度(C)、发酵温度(A)和酵母接种量(B)的响应面曲面较陡峭,而且等高线为椭圆形,说明BC交互作用对酒精度影响显著,AB交互作用对感官评分影响显著。这与方差分析结果一致。
2.2.7 响应面验证试验
通过Design-Expert 8.0.6软件,预测最佳发酵工艺参数为:发酵温度24.27 ℃、酵母接种量0.08%、初始糖度24.80%,在此优化工艺条件下,酒精度预测值为16.20%vol,感官评分预测值为87.64分,考虑到实际生产的操作性,将发酵工艺参数修正为发酵温度24 ℃、酵母接种量0.08%、初始糖度24.8%,为验证该模型的预测是否正确,在修正后的参数下进行3次试验,得到的酒精度实际值为16.0%vol,感官评分实际值为88.22分,与预测值接近,表明该模型有效。因此,采用响应面分析方法优化杏白兰地发酵工艺参数比较准确,有实际的应用价值。
2.3 杏白兰地理化指标分析
杏白兰地理化指标测定:总酸含量81.12 mg/L,酒精度为38.0%vol,总酯(乙酸乙酯计)140.8 mg/L,高级醇356.24 mg/L,甲醇1.34 g/L,成品理化指标符合相关国标要求。
3 结论
结果表明,最佳酶解工艺为果胶酶添加量0.10%,酶解温度45 ℃,酶解时间3.5 h,在此条件下,综合评价可以达到89.35分。杏白兰地最佳发酵工艺为发酵温度24 ℃、酵母接种量0.08%、初始糖度24.8%。在此优化发酵工艺条件下,得到的一次蒸馏液酒精度为16.0%vol,感官评分为88.22分。将一次蒸馏液二次蒸馏后,酒精度为38.0%vol,成品杏白兰地色泽透亮,果香浓郁,入口干冽,具有杏果特有的香气。
[1]张加延,张钊.中国果树志·杏卷[J].园艺学报,2004,31(1):119.
[2]ZHEBENTYAYEVA T N,REIGHARD G L,GORINA V M,et al.Simple sequence repeat(SSR)analysis for assessment of genetic variability in apricot germplasm[J].Theor Appl Genet,2003,106(3):435-440.
[3]LI M,ZHAO Z,MIAO X,et al.Genetic diversity and population structure of Siberian apricot (Prunus sibirica L.) in China[J]. Int J Mol Sci, 2014,15(1):377-400.
[4]张加延,吕亩南,王志明.杏属二新种[J].植物分类学报,1999,3(1):106-107.
[5]何天明.中国普通杏(Prunus Armeniaca)种质资源遗传多样性及紫杏(P.dasycarpa)起源研究[D].泰安:山东农业大学,2006.
[6]杨沫,孙玉霞,赵新节,等.玉杏发酵酒及蒸馏酒挥发性物质分析[J].食品工业,2018,39(1):154-158.
[7]马倩,徐佳,左勇,等.杏子果酒加工技术及品质分析研究进展[J].食品与发酵工业:1-6[2020-07-14].https://doi.org/10.13995/j.cnki.11-1802/ts.023877.
[8]苑兆和.杏属植物(Armeniaca Mill.)种质资源分子系统学研究[D].泰安:山东农业大学,2007.
[9]刘昌蒙.杏果深加工及其综合利用[D].西安:陕西科技大学,2013.
[10]张加延.杏的营养成分与医疗保健作用[C].中国园艺学会、河北农业大学.中国园艺学会干果分会成立大会暨第二届全国干果生产与科研进展学术研讨会论文集.中国园艺学会、河北农业大学:中国园艺学会,2001:139-143.
[11]FRATIANNI F,OMBRA MN,DACIERNO A,et al.Apricots:biochemistry and functional properties[J].Curr Opin Food Sci,2018,19(2):3-9.
[12]李亚玲,崔宽波,石玲,等.冰温贮藏对杏果实冷害及活性氧代谢的影响[J].食品科学,2019,9(3):1-11.
[13]杨婷婷,朱璇,向玉洁,等.采收成熟度对杏果实贮藏品质的影响[J].现代食品科技,2015,31(7):277-282.
[14]刘帮廸,范新光,舒畅,等.近冰点贮藏对杏果实长时间低温贮藏后货架品质的影响[J].食品科学,2019,1(2):1-10.
[15]谢爱华,熊含鸿,孙文佳.白兰地成分检测方法的研究进展[J].食品安全质量检测学报,2018,9(12):2894-2900.
[16]王卉青,张军翔.白兰地品质及其影响因素研究进展[J].中国酿造,2019,38(10):21-25.
[17]SZYMCZYCHA-MADEJA A,WELNA M,JAMROZ P,et al.Advances in assessing the elemental composition of distilled spirits using atomic spectrometry[J].Trac-Trend Anal Chem,2015,64(1):27-35.
[18] LÓPEZ F, RODRÍGUEZ-BENCOMO J J, ORRIOLSI. Chapter 10-Fruit Brandies[J].Sci Technol Fruit Wine Prod,2017,5(3):531-556.
[19]姜忠军.白兰地酿造工艺及质量评价指标研究[D].无锡:江南大学,2006.
[20]杨丽萍,黄新泉,单春会,等.红提葡萄生产白兰地发酵工艺研究[J].食品工业,2019,40(1):64-68.
[21]张慧卿.杏产品加工利用探索[J].农产品加工,2016,1(8):62-63.
[22]李宝坤,郑晓吉,戚晓红,等.杏白兰地酿造工艺初探[J].酿酒,2010,37(1):86-88.
[23]何伟,张富县,艾乃吐拉,等.杏皮渣白兰地酒精发酵最佳工艺条件的研究[J].酿酒科技,2011,7(11):21-5.
[24]张新.壳聚糖+纳他霉素复合处理对梅杏贮藏品质及生理的影响[D].石河子:石河子大学,2016.
[25]黄蓓蓓.仰韶杏酒发酵工艺研究[J].中国酿造,2012,31(12):147-151.
[26]谢晓霞,王陈强,赵长兰,等.果胶酶处理浓缩杏浆的工艺条件优化[J].价值工程,2011,30(28):315-316.
[27]娄静文.小白杏果酒果醋酿造工艺的研究[D].石河子:石河子大学,2015.