乳酸菌(lactic acid bacteria,LAB)是一种存在于人类体内的益生菌[1-3],能够将碳水化合物发酵成乳酸,具有降低胆固醇、抗氧化等生物活性[4-5]。LAB在生长代谢过程中能够生产两类胞外多糖(expolysaccharides,EPS),一类是由同一种单糖组成的同多糖(homopolysaccharide,HoPS);一类是由含有两个以上不同单糖的重复单元组成的杂多糖(heteropolysaccharide,HePS)[7-9]。LAB产生的EPS无毒、能够调节机体胃肠道正常菌群、保持微生态平衡、降低血清胆固醇、抑制肠道内腐败菌生长繁殖,制造营养物质、刺激组织发育,从而对机体营养状态、生理功能、细胞感染、肿瘤反应和突然的应急反应等产生作用[10-12],常被用作功能性食品成分。此外,还作为天然添加剂如增稠剂、稳定剂、乳化剂、起泡剂和凝胶剂等应用于食品、化工和医药领域[6]。
近几十年来,由于微生物胞外多糖在产品结构、性能及生产方面所具有的特别优势而得到大力研究开发[13-14]。同时,乳酸菌又是食品级工业生产菌,与其他菌相比安全性高,所以近年来对乳酸菌胞外多糖的研究逐渐增多。但是除了肠膜明串珠菌(Leuconostoc mesenteroides)所产的右旋糖酐现已工业化以外,产量低,菌株稳定性差仍是制约乳酸菌胞外多糖广泛应用的首要因素,因此需要不断摸索各种方法来提高乳酸菌胞外多糖产量[15-17]。
本研究以副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp.paracasei)M5L为研究对象,采用单因素试验及响应面试验对其产胞外多糖的发酵条件进行优化,并对胞外多糖的抗肿瘤活性进行初步研究,对乳酸菌胞外多糖更加广泛的应用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与细胞
副干酪乳杆菌副干酪亚种(Lactobacillusparacasei subsp.paracasei)M5L:由哈尔滨工业大学化工学院食品科学与工程系从新疆马奶酒中分离鉴定[11];Caco-2细胞:中国科学院。
1.1.2 培养基
MRS培养基:北京毕特博生物技术有限责任公司;杜氏改良Eagle(Dulbecco's modified Eagle,DEME)培养基:上海玉博生物科技有限公司。
1.1.3 主要试剂
胎牛血清:赛业生物科技有限公司;无水乙醇、三氯乙酸、硫酸、苯酚、正丁醇、二甲基亚砜、磷酸缓冲盐溶液(phosphate buffer saline,PBS)、浓硫酸、葡萄糖等均为国产分析纯。
1.2 仪器与设备
S-1-150S高速离心机:德国Sigma公司;VS-502FD冻干机:河南海克尔仪器仪表有限公司;BPN-50CHUV细胞培养箱:济南来宝医疗器械有限公司;CKX53倒置显微镜:南京衡桥仪器有限公司;CT115C灭菌锅:姜堰市新康医疗器有限公司;GH86超净工作台:苏州博立斯净化科技有限公司;InfiniteM200酶标仪:瑞士TECAN公司。
1.3 试验方法
1.3.1 乳酸菌胞外多糖的生产
将冻存的乳酸菌M5L干粉接种于MRS液体培养基中,42 ℃条件下培养10 h,活化两代使其恢复活力,得到发酵种子液(109 CFU/mL)。按照2%(V/V)的接种量将种子液接种于MRS液体培养基中,装液量为100 mL/250 mL,37 ℃条件下发酵8 h。
1.3.2 乳酸菌胞外多糖的提取及检测
发酵液经100 ℃串气灭酶活,10 000 r/min离心20 min,去除菌体,加入10%的三氯乙酸,4 ℃静置隔夜,12 000 r/min离心30 min,除去蛋白,再加入3倍体积分数为95%的乙醇,4 ℃静置隔夜,12 000 r/min离心20 min,得到多糖沉淀,双蒸水(ddH2O)溶解多糖后,采用苯酚-硫酸法对多糖含量进行测定,最后将糖液冷冻干燥备用[18-19]。
1.3.3 乳酸菌M5L产胞外多糖发酵条件优化的单因素试验
初始pH值的优化:按2%(V/V)的接种量将乳酸菌M5L种子液接种于初始pH值分别为4.5、5.5、6.5、7.5和8.5的MRS液体培养基中,装液量为100 mL/250 mL,在37 ℃条件下分别发酵8 h,提取胞外多糖并对胞外多糖含量进行测定。
菌体浓度的优化:按2%(V/V)的接种量将菌体浓度分别为105 CFU/mL、106 CFU/mL、107 CFU/mL、108 CFU/mL、109 CFU/mL的乳酸菌M5L菌液接种于MRS液体培养基中,初始pH值为7.5,装液量为100 mL/250 mL,在37 ℃条件下分别发酵8 h,提取胞外多糖并对胞外多糖含量进行测定。
发酵温度的优化:按2%(V/V)的接种量将乳酸菌M5L种子液接种于MRS液体培养基中,初始pH值为7.5,装液量为100 mL/250 mL,分别在25 ℃、30 ℃、37 ℃、42 ℃条件下发酵8 h,提取胞外多糖并对胞外多糖含量进行测定。
发酵时间的优化:按2%(V/V)的接种量将乳酸菌M5L种子液接种于MRS液体培养基中,初始pH为7.5,装液量为100 mL/250 mL,在37 ℃条件下分别发酵8 h、12 h、24 h、36 h和48 h,提取胞外多糖并对胞外多糖含量进行测定。
1.3.4 乳酸菌M5L产胞外多糖发酵条件优化响应面试验
在单因素试验的基础上,选取发酵温度(A)、发酵时间(B)、菌体浓度(C)、初始pH值(D)为考察因素,以胞外多糖产量(Y)为响应值,采用中心组合设计(central composite design,CCD)法进行4因素3水平响应面试验,对乳酸菌M5L产胞外多糖浓度发酵条件进行优化,试验因素与水平见表1。
表1 乳酸菌M5L产胞外多糖发酵条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for fermentation conditions optimization of exopolysaccharides by lactic acid bacteria

因素A 发酵温度/℃B 发酵时间/h C 菌体浓度/(CFU·mL-1)D 初始pH值-1水平0 1 32 9 107 6.5 37 12 108 7.5 42 15 109 8.5
1.3.5 乳酸菌胞外多糖抗肿瘤活性的测定
噻唑蓝(methyl thiazolyl tetrazolium,MTT)法[11]:调整Caco-2的细胞浓度为106个/mL到96孔板中,分别加入质量浓度为0 μg/mL、250 μg/mL、500 μg/mL和750 μg/mL的乳酸菌胞外多糖。每个质量浓度5个平行。在5%CO2、37 ℃条件下培养24 h、48 h、72 h后吸出培养液,每孔加入150 μL PBS清洗两次,然后每孔中加入0.5 mg/mL的MTT 100 μL,37 ℃继续培养4 h,吸出MTT后每孔中加入150 μL二甲基亚砜,置于摇床振荡10 min,最后用酶标仪在波长490 nm处测定吸光度值,计算肿瘤细胞抑制率,其计算公式如下:
实时荧光定量聚合酶链式反应(real time-fluorescent quantitative polymerase chain reaction,RT-FQPCR)[20]:采用乳酸菌胞外多糖孵育Caco-2细胞72 h后,采用Trizol法提取Caco-2细胞的总核糖核酸(ribonucleic acid,RNA),参照逆转录试剂盒说明逆转录为互补脱氧核糖核酸(complementaryDNA,cDNA)。再以cDNA为模板,进行RT-FQPCR扩增,检测Caco-2细胞中抑凋亡基因Bcl-2、促凋亡基因Bax和Caspase-3信使核糖核酸(messenger ribonucleic acid,mRNA)的表达水平。
1.3.6 数据分析
每组试验重复3次,采用Origin 8.0、Design Expert 8.0.6软件对数据进行作图和统计分析。试验结果以“平均值±标准偏差”表示。
2 结果与分析
2.1 乳酸菌M5L产胞外多糖发酵条件优化单因素试验结果
2.1.1 初始pH值对乳酸菌胞外多糖得率产量的影响
菌体生长需要适宜的pH值,初始pH值可以通过影响菌体生长进而影响多糖产量。不同初始pH值对乳酸菌M5L产胞外多糖的影响见图1。由图1可知,随着初始pH值的增加,乳酸菌胞外多糖产量呈现先升高后下降的趋势,当初始初始pH值为7.5时,胞外多糖产量最高,为127.7 mg/mL,说明过酸过碱均可影响菌体胞外多糖的产量。因此,确定最佳初始pH值为7.5。
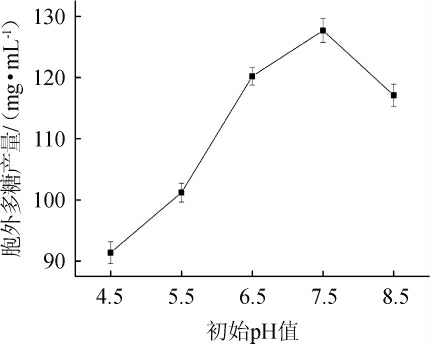
图1 初始pH值对胞外多糖产量的影响
Fig. 1 Effect of initial pH on exopolysaccharides yield
2.1.2 菌体浓度对乳酸菌胞外多糖产量的影响
接种量可以直接影响单位发酵液中的菌体数量,从而影响最终胞外多糖的产量。不同菌体浓度对乳酸菌M5L产胞外多糖的影响见图2。
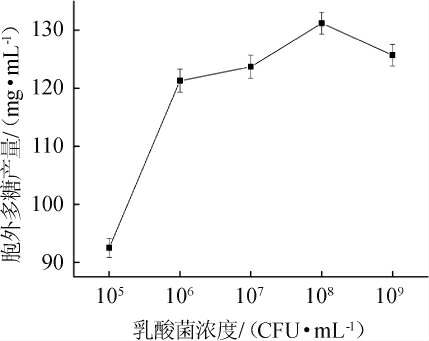
图2 菌体浓度对胞外多糖产量的影响
Fig. 2 Effect of cell concentration on exopolysaccharides yield
由图2可知,随着菌体浓度不断增加,胞外多糖产量呈先增加后减少的趋势。当菌体浓度为108 CFU/mL时,胞外多糖产量达到最高,为131.2 mg/mL。因此,选择最佳菌体浓度为108 CFU/mL。
2.1.3 发酵温度对乳酸菌胞外多糖产量的影响
温度是影响胞外多糖发酵产量的重要因素,不同发酵温度对乳酸菌M5L产胞外多糖的影响见图3。由图3可知,当发酵温度为37 ℃时,乳酸菌胞外多糖产量达到最高,为132.7 mg/mL。因此,确定最佳发酵温度为37 ℃。
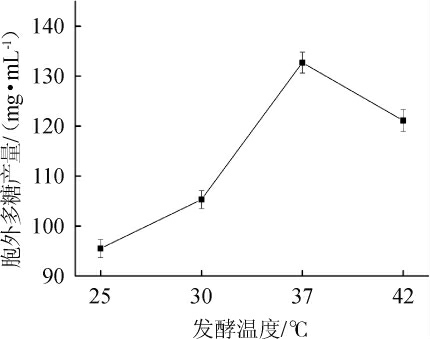
图3 发酵温度对胞外多糖产量的影响
Fig. 3 Effect of fermentation temperature on exopolysaccharides yield
2.1.4 发酵时间对胞外多糖产量的影响
发酵时间对乳酸菌M5L产胞外多糖的影响见图4。由图4可知,发酵时间对乳酸菌M5L产胞外多糖影响较大,当发酵时间为12 h时,乳酸菌胞外多糖产量达到最高,为147.1 mg/mL。随后产量降低,这可能是由于培养基碳源的含量减少,导致菌体消耗自身产的多糖所致。因此,确定最佳发酵时间为12 h。

图4 发酵时间对胞外多糖产量的影响
Fig. 4 Effect of fermentation time on exopolysaccharides yield
2.2 乳酸菌M5L产胞外多糖发酵条件优化响应面试验结果
2.2.1 响应面试验设计及结果
根据单因素试验结果,以发酵温度(A)、发酵时间(B)、菌体浓度(C)及初始pH值(D)为考察因素,胞外多糖产量(Y)为响应值,进行4因素3平响应面分析,试验设计及结果见表2,方差分析见表3。
表2 乳酸菌M5L产胞外多糖发酵条件优化响应面试验设计及结果
Table 2 Design and results of response surface tests for fermentation conditions optimization of exopolysaccharides by lactic acid bacteria M5L
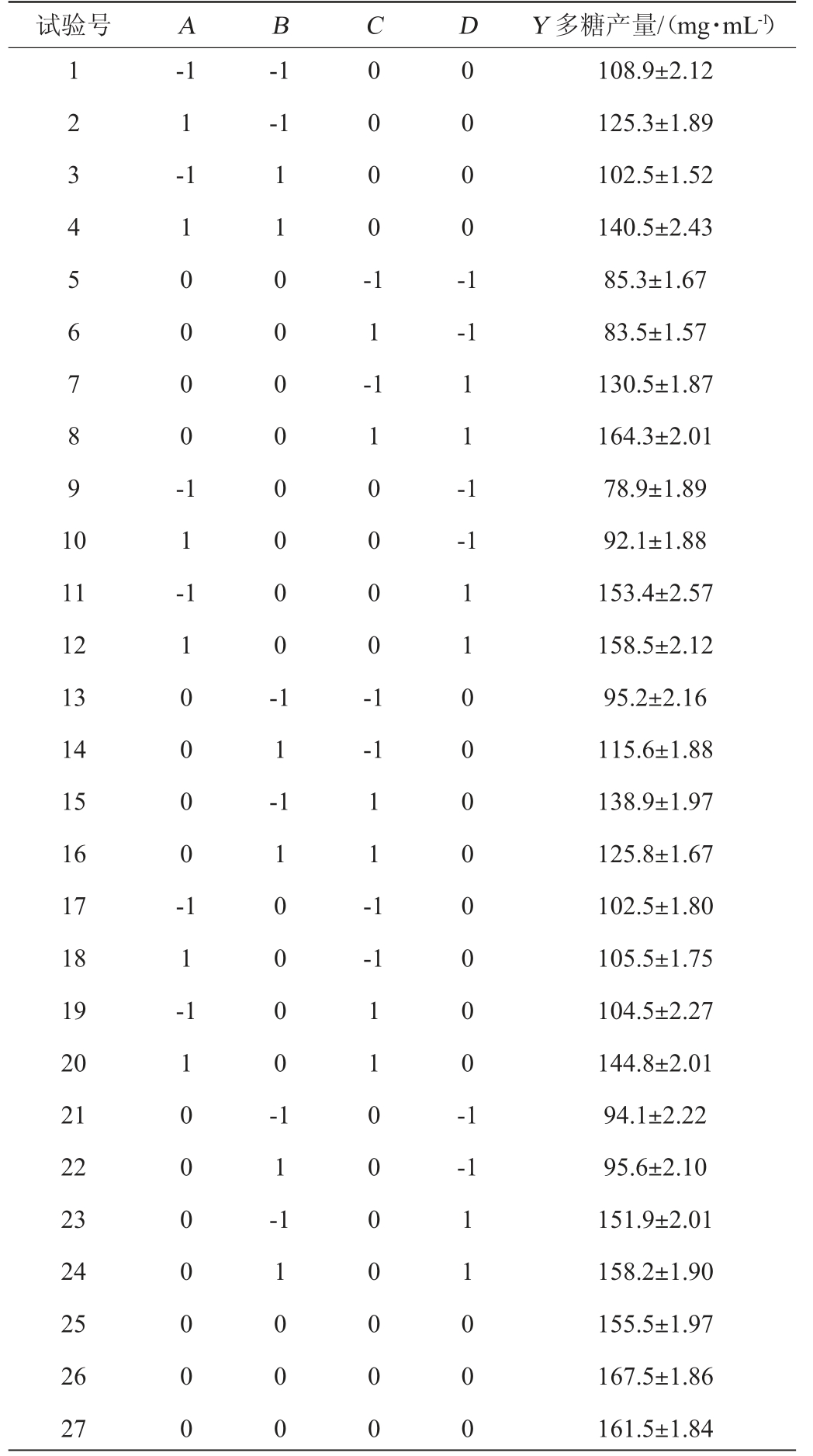
试验号 A B C D Y 多糖产量/(mg·mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1-1-1 1 0 0 0 0 -0 0 0 0 -1 1 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 1 1 -1 1 0 0 0 0 -1 1 0 0 0 0 0 0 0 0 -1 1 -1 1 0 0 0 0 -1-1 1 1 -1 1 -1-1 1 1 0 0 0 0 0 0 0 1 1 0 0 0 0 -1 1 -1 1 0 0 0 0 0 0 0 0 -1-1 1 1 0 0 0 1 1 0 0 0 0 0 0 0 1 1 0 0 0 108.9±2.12 125.3±1.89 102.5±1.52 140.5±2.43 85.3±1.67 83.5±1.57 130.5±1.87 164.3±2.01 78.9±1.89 92.1±1.88 153.4±2.57 158.5±2.12 95.2±2.16 115.6±1.88 138.9±1.97 125.8±1.67 102.5±1.80 105.5±1.75 104.5±2.27 144.8±2.01 94.1±2.22 95.6±2.10 151.9±2.01 158.2±1.90 155.5±1.97 167.5±1.86 161.5±1.84
根据表2所得试验数据,采用Desigh-Expert 8.0.6进行多元回归拟合,得到乳酸菌胞外多糖产量对试验因素的二次多项回归方程:Y=161.50+9.67A+1.99B+10.60C+32.28D+5.40AB+9.33AC-2.02AD-8.38BC+1.20BD+8.90CD-22.59A2-18.20B2-25.21C2-18.98D2。
方程中各项系数绝对值的大小可以直接反映各因素对响应值的影响程度,系数的正负号则反映了影响的方向。由二次项系数均为负数可知方程所代表的抛物线开口向下,因此方程有极大值,可以用来优化分析。由方程的一次项系数可以得出,影响乳酸菌M5L产胞外多糖的因素依次为初始pH值>菌体浓度>发酵温度>发酵时间。
表3 回归模型的方差分析
Table 3 Variance analysis of regression model

注:“*”表示对结果影响显著(P<0.05),“**”表示对结果极显著(P<0.01)。
项目 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 C2 D2 47.28 35.06 1.49 42.15 390.80 3.65 10.87 0.51 8.77 0.18 9.91 85.07 55.23 105.99 60.03<0.000 1<0.000 1 0.245 9<0.000 1<0.000 1 0.080 4 0.006 4 0.487 6 0.011 9 0.678 8 0.008 4<0.000 1<0.000 1<0.000 1<0.000 1** * * ********残差失拟项纯误差总离差R2变异系数21 170.97 1 121.33 47.60 1 348.32 12 500.11 116.64 347.82 16.40 280.56 5.76 316.84 2 721.04 1 766.61 3 390.24 1 920.27 383.83 311.83 72.00 21 554.80 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 2 10 2 26 1 512.21 1 121.33 47.60 1 348.32 12 500.11 116.64 347.82 16.40 280.56 5.76 316.84 2 721.04 1 766.61 3 390.24 1 920.27 31.99 31.18 36.00 0.87 0.646 1 0.982 2 4.57%
由表3可知,方程的模型的P值<0.000 1,极显著,说明模型有意义;失拟项P值=0.646 1>0.05,不显著;即模型与试验值之间的误差较小;决定系数R2=0.982 2,说明此模型可以解释98.22%的数据;变异系数(variable coefficient,CV)=4.57%,CV值较小,说明试验误差较小。此外,一次项A、C、D及二次项A2、B2、C2、D2对结果影响极显著(P<0.01),交互项AC、AD、BC及CD对结果影响显著(P<0.05),而其他项对结果影响不显著(P>0.05)。通过F值可知,影响乳酸菌M5L产胞外多糖的因素的主次顺序为初始pH值>菌体浓度>发酵温度>发酵时间,与模型中回归线性方程的分析相吻合。
2.2.2 响应面分析图
各因素交互作用对乳酸菌M5L产胞外多糖的影响的响应面及等高线见图5。
由图5可知,所有响应面开口均朝下,存在极大值。胞外多糖含量均随发酵时间、发酵温度、初始pH值及菌体浓度的变化呈先增大后减小的趋势,且各因素极大值分别为发酵时间12 h、发酵温度37 ℃、初始pH值7.5、菌体浓度108 CFU/mL。
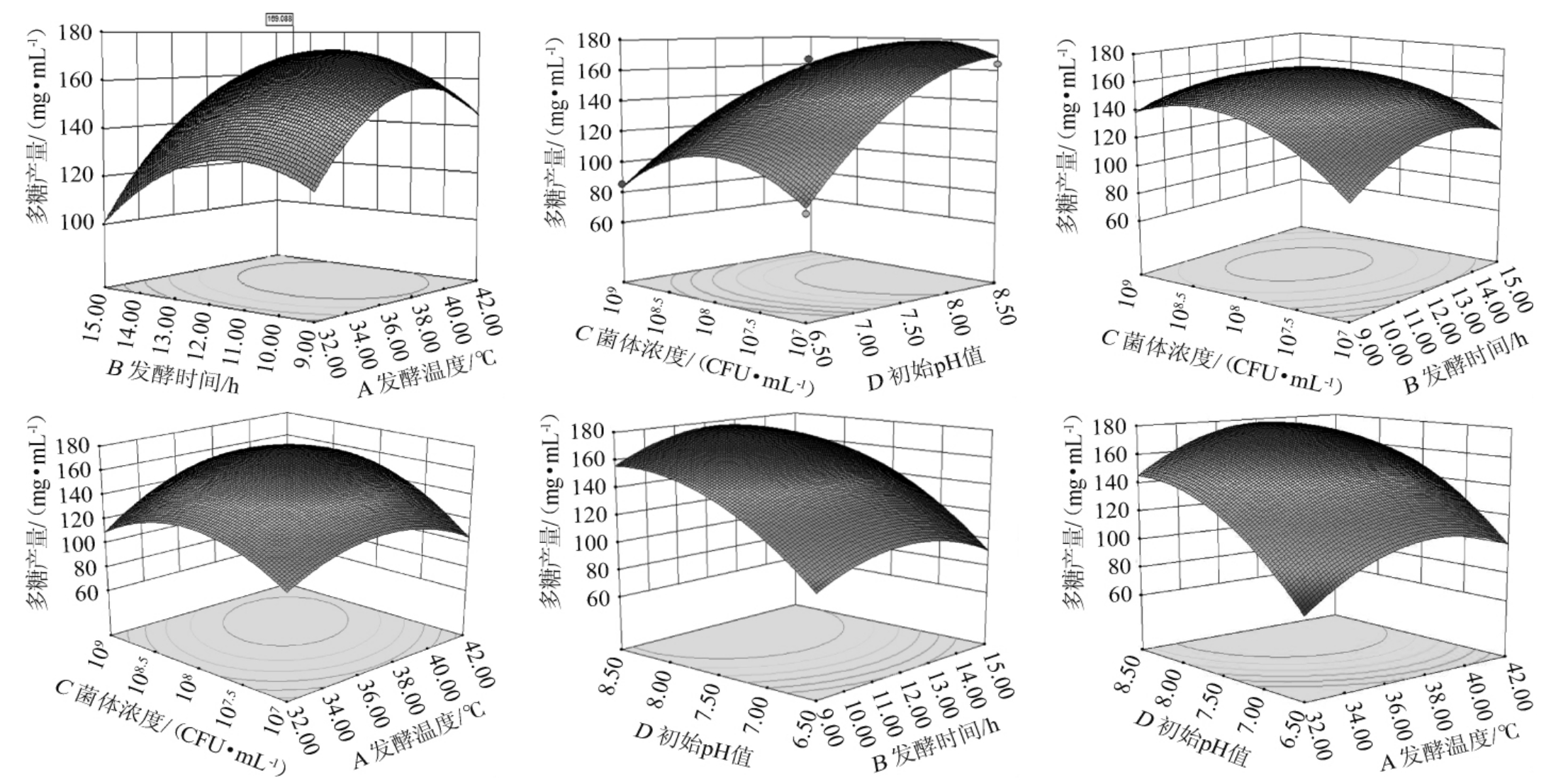
图5 各因素间交互作用对胞外多糖产量影响的响应面及等高线
Fig. 5 Response surface plots and contour lines of effects of interaction between each factor on exopolysaccharides yield
2.2.3 验证试验
通过响应面试验优化分析,确定乳酸菌M5L产胞外多糖的最佳发酵工艺条件为发酵温度37.19 ℃,初始pH值7.72,菌体浓度108.31 CFU/mL,发酵时间12.79 h。胞外多糖产量的最大预测值为167.5 mg/mL。根据实际情况,将最优条件修订为发酵温度37 ℃,发酵时间12.8 h,初始pH值7.7,菌体浓度108 CFU/mL,在此最优发酵条件下,进行三组验证性试验,胞外多糖平均产量实际值为167.2 mg/mL,与预测值之间拟合较好,误差在允许范围内,说明利用响应面法优化结果分析是可行的、有效的。
2.3 乳酸菌胞外多糖抗肿瘤活性的测定
2.3.1 MTT试验结果
采用MTT法测定乳酸菌胞外多糖的抗肿瘤活性,结果见图6。

图6 噻唑蓝法乳酸菌胞外多糖抗肿瘤活性测定结果
Fig. 6 Determination results of antitumor activity of exopolysaccharides of lactic acid bacteria by methyl thiazolyl tetrazolium method
由图6可知,乳酸菌胞外多糖对肿瘤细胞的抑制率呈现出时间和质量浓度依赖性,即时间越长,质量浓度越大,对Caco-2细胞的抑制效果越好。胞外多糖作用于Caco-2细胞72 h后,其肿瘤细胞抑制率显著高于作用24 h和48 h,且当胞外多糖质量浓度为500 μg/mL和750 μg/mL处理72 h后,肿瘤抑制率相差不大。因此,选择质量浓度为500 μg/mL的胞外多糖作用72 h用于后续的研究。
2.3.2 RT-FQPCR结果
以未经胞外多糖处理的Caco-2细胞为对照,采用RTFQPCR测定经质量浓度为500 μg/mL的胞外多糖作用72 h后的Caco-2细胞中的促凋亡基因Bax、抑凋亡基因Bcl-2及促凋亡基因Caspase-3的表达量,结果见图7。
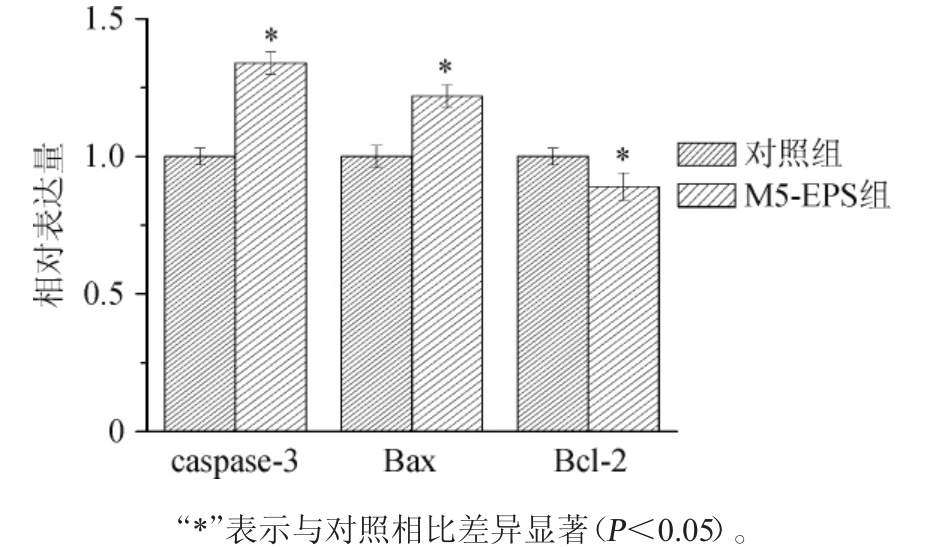
图7 Caco-2细胞中凋亡相关基因的表达量
Fig. 7 Expression quantity of apoptosis-related gene in Caco-2 cells
Bcl-2家族蛋白是细胞凋亡过程中重要的凋亡蛋白之一,其蛋白家族中的Bax蛋白具有促进凋亡的作用,Bcl-2蛋白可以抑制细胞的凋亡[11]。Caspase是一类天冬氨酸特异性的半胱氨酸蛋白酶,在人类细胞中Caspase-3的超量表达和激活均会引起细胞凋亡,因此,又称死亡蛋白酶[11]。由图7可知,与未经乳酸菌胞外多糖处理的对照组相比,乳酸菌胞外多糖处理组可以显著提高Caco-2细胞中促凋亡基因Bax的表达量(P<0.05),显著降低抑凋亡基因Bcl-2的表达量(P<0.05),因此Bax/Bcl-2比值变大,且Caco-2细胞中Caspase-3的表达量显著升高(P<0.05),说明乳酸菌M5L所产胞外多糖可通过影响凋亡相关蛋白的表达来促进Caco-2细胞凋亡。
3 结论
采用单因素及响应面试验优化得出副干酪乳杆菌副干酪亚种(Lactobacillus paracasei subsp.paracasei)M5L产胞外多糖的最优发酵条件为发酵温度37 ℃,发酵时间12.8 h,初始pH值7.7,菌体浓度为108 CFU/mL。在此最优发酵条件下,胞外多糖产量为167.2 mg/mL,是优化前(128.3 mg/mL)的1.3倍。该胞外多糖可通过影响凋亡相关蛋白的表达来促进Caco-2细胞凋亡,当质量浓度为500 μg/mL的胞外多糖作用于Caco-2细胞72 h时,肿瘤抑制率达到19.5%。
[1]胡盼盼,宋微,单毓娟,等.影响乳酸菌胞外多糖产量的因素[J].食品科技,2014,39(9):31-37.
[2]胡盼盼,宋微,张兰威,等.乳酸菌胞外多糖的研究进展[J].粮油食品科技,2014,22(5):87-92.
[3] CAMPANA R, HEMERT S V, BAFFONE W. Strain-specific probiotic properties of lactic acid bacteria and their interference with human intestinal pathogens invasion[J].Gut Pathog,2017,9(1):1-4.
[4] JABBARI V, KHIABANI M S, MOKARRAM R R, et al. Lactobacillus plantarum as a probiotic potential from Kouzeh cheese(traditional Iranian cheese)and its antimicrobial activity[J].Prob Antimicrob Proteins,2017,9:189-193.
[5] YI Y J, LIM J M, GU S, et al. Potential use of lactic acid bacteria Leuconostoc mesenteroides as a probiotic for the removal of Pb(II)toxicity[J].J Microbiol,2017,55(4):296-303.
[6]刘先,康小红,岭南.乳酸菌发酵产生胞外多糖的研究进展[J].中国乳业,2012(2):46-48.
[7]段希宇,叶陵,刘成国,等.乳酸菌的抗氧化作用机制[J].微生物学杂志,2017,37(3):111-115.
[8]艾连中,张灏,陈卫,等.干酪乳杆菌LC2W 胞外多糖的分离纯化及性质研究[J].食品与机械,2007,23(7):9-12.
[9] WANG Y P, LI C, LIU P, et al. Physical characterization of exopolysaccharide produced by Lactobacillus plantarum KF5 isolated from Tibet Kefir[J].Carbohyd Polym,2010,82(3):895-903.
[10]SPANÒ A,LAGANÀ P,VISALLI G,et al.In vitro antibiofilm activity of an exopolysaccharide from the marine thermophilic Bacillus licheniformis T14[J].Curr Microbiol,2016,DOI:10.1007/s00284-015-0981-9.
[11]HU P,SONG W,SHAN Y J,et al.Lactobacillus paracasei subsp.paracasei M5L induces cell cycle arrest and calreticulin translocation via the generation of reactive oxygen species in HT-29 cell apoptosis[J].Food Funct,2015,6:2257-2265.
[12] OUYA F J,WANG G B, GUO W, et al. AKT signalling and mitochondrial pathways are involved in mushroom polysaccharide-induced apoptosis and Gi or S phase arrest in human hepatoma cells[J]. Food Chem,2013,138(4):2130-2139.
[13]WANG J,ZHAO X,TIAN Z,et al.Characterization of an exopolysaccharide produced by Lactobacillus plantarum YW11 isolated from Tibet kefir[J].Carbohyd Polym,2015,125:16-25.
[14]KANMANI P,KUMAR R S,YUVARAJ N,et al.Production and purification of a novel exopolysaccharide from lactic acid bacterium Streptococcus phocae PI80 and its functional characteristics activity in vitro[J].Bioresource Technol,2011,102(7):4827-4833.
[15] LANEUVILLE S I, TURGEON S, SYLVIE L, et al. Microstructure and stability of skim milk acid gels containing an anionic bacterial exopolysaccharide and commercial polysaccharides[J]. Int Dairy J, 2014, 37(1):5-15.
[16] GHOMSHE S M T, AMINZADEH R, ABARZANI M. Use of response surface methodology to study the combined effect of various parameters on hexavalent chromium adsorption[J].Chem Eng Commun,2014,201(2):191-208.
[17]RAZA W,YANG W,JUN Y,et al.Optimization and characterization of a polysaccharide produced by Pseudomonas fluorescens WR-1 and its antioxidant activity[J].Carbohyd Polym,2012,90(2):921-929.
[18]POLAK-BERECKA M,CHOMA A.Physicochemical characterization of exopolysaccharides produced by Lactobacillus rhamnosus on various carbon sources[J].Carbohyd Polym,2015,117:501-509.
[19]司天昭,柳陈坚,秦晓萌,等.植物乳杆菌YM-2 菌株胞外多糖生物合成工艺优化[J].食品科学,2017,38(10):24-30.
[20]刘晶,杨森,陈杨扬,等.副干酪乳杆菌VL8 产胞外多糖条件优化及其抗氧化性质[J].中国食品学报,2017,17(5):82-89.