葛根(Puerariae lobatae Radix)是多年生豆科植物野葛的干燥块根,是国家卫生部批准的药食两用植物[1-2]。中药葛根历史悠久,最早记载于《神农本草经》,后据《中国药典》及《中华本草》等资料记载,葛根具有解酒的功效[3-4],是古代文献记载和现代研究证实解酒功效比较明确的中药。葛根除富含淀粉、膳食纤维、17种氨基酸和大量矿质元素外,主要活性成分为总黄酮中的异黄酮,研究证实葛根中含30多种异黄酮物质,另含多糖、生物碱、三萜皂甙等功能活性成分,具有抑制脂质过氧化,清除体内自由基,抗氧化,预防心脑血管疾病,提高免疫力,降血糖,调节血脂,改善骨质疏松,调节雌激素水平,调节血压,益智和美容等药理保健功能[5-9]。
大量研究证实,酒精进入人体后的代谢是一系列氧化还原过程,乙醇代谢相关酶的作用至关重要,如超氧化物歧化酶(superoxide dismutase,SOD)、乙醇脱氢酶(alcohol dehydrogenase,ADH)、乙醛脱氢酶(acetaldehyde dehydrogenase,ALDH)及其亚型等,还原酶等增多可加快乙醇的氧化代谢速率,加速其还原成乙酸进而排出体外[10-12]。
我国早在1 000多年前就已将微生物发酵的方法应用于中药炮制当中,成为最早利用微生物转化天然药物的国家[13],利用微生物发酵得到的中药成分更易于吸收,而且能达到减毒增效的作用[14]。微生物发酵中药能提高有效成分的含量,产生新化合物及减少不良反应,促进有效成分吸收和利用,是现代生物技术与中医药相结合的理想途径[15-16]。CHOI Y等[17]研究发现,短双歧杆菌发酵后的葛根在改善葡萄糖和脂代谢相关途径方面更有效,发酵过程提高了乳酸含量,并促进了某些微生物群落的富集,从而有助于抗肥胖和抗炎活动。
该研究用植物乳杆菌(Lactobacillus plantarum)和副干酪乳杆菌(Lactobacillus paracasei)混合发酵技术,考察发酵对葛根抗氧化成分及解酒功效的影响,为葛根成为更高效解酒食品提供理论依据。
1 材料与方法
1.1 材料与试剂
葛根饮片、56°牛栏山二锅头、力克保健液:市售;氢氧化钠、硝酸铝、亚硝酸钠(均为分析纯);植物乳杆菌(Lactobacillus plantarum):CGMCC 1.568、副干酪乳杆菌(Lactobacillus paracasei)CGMCC 1.2468:中国普通微生物菌种保藏管理中心。MRS肉汤培养基:北京索莱宝科技有限公司。天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)试剂盒:南京建成生物工程研究所;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒:上海碧云天生物技术有限公司。
清洁级美国癌症研究所(institule of cancer researcch,ICR)小鼠:雄性,体质量(20±2)g,购自长春亿斯实验动物技术有限公司。饲养环境温度为(23±2)℃,相对湿度为40%~60%,明暗交替周期为12 h。
1.2 仪器与设备
SX-700蒸汽灭菌器:日本Tomy Digital Biology公司;SW-CJ-2D型双人净化工作台:苏州净化设备有限公司;innova 40摇床:德国Eppendorf公司;UV-2550型紫外可见光度计:日本岛津公司;KQ-600E型超声清洗器:昆山超声仪器有限公司。
1.3 试验方法
1.3.1 葛根提取液的制备
精密称定葛根饮片,以1∶10(g∶mL)料液比加蒸馏水→沸腾后转小火,1.5 h/次,煎煮两次→3 500 r/min离心10 min后过绢布→浓缩至生药质量浓度为0.1 g/mL→分装,高温高压灭菌锅121 ℃灭菌60 min→晾凉至室温,取一份4 ℃冷藏保存,设为葛根水提液对照组,其余备发酵。
1.3.2 乳酸菌发酵方法
采用两步培养法培养,取甘油冻藏的植物乳杆菌和副干酪乳杆菌,4 ℃解冻,置紫外消毒30 min后的超净台中,取40 μL解冻菌液置于4 mL灭菌后的MRS培养基中,37 ℃,180 r/min培养24 h后得一级活化液,再取1 mL一级活化液置100 mL灭菌后的MRS培养基中,37 ℃、180 r/min培养24 h活化完成。按单因素试验及正交试验所需不同接种量,接种至灭菌后的葛根提取液中,摇床37 ℃,180 r/min条件下发酵试验所对应不同时间[14]。
1.3.3 单因素试验
以初始pH值为6.0、接种量为3%、发酵时间为48 h、接种比例(植物乳杆菌∶副干酪乳杆菌=1∶1)为基础条件,在固定其他因素条件下逐一进行单因素试验,考察不同初始pH值(2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0),接种量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%),发酵时间(6 h、12 h、18 h、24 h、30 h、36 h、42 h、48 h、54 h),植物乳杆菌与副干酪乳杆菌接种比例(1∶5、1∶2、1∶1、2∶1、5∶1)对SOD酶活性的影响。
1.3.4 正交试验设计
在单因素试验的基础上,以初始pH值(A)、接种量(B)、发酵时间(C)、植物乳杆菌∶副干酪乳杆菌接种比例(D)为试验因素,以SOD活性(R)为评价指标,采用L9(34)正交设计试验,因素与水平见表1。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation conditions optimization
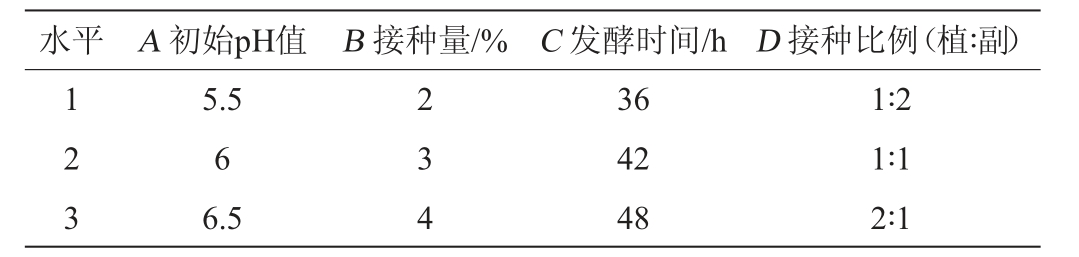
水平 A 初始pH值 B 接种量/% C 发酵时间/h D 接种比例(植∶副)1 2 3 5.5 6 6.5 2 3 4 36 42 48 1∶2 1∶1 2∶1
1.3.5 解酒防醉实验
取健康ICR雄性小鼠28只,适应性饲养3 d后,随机分为模型组、力克阳性对照组、葛根发酵液组、葛根水提液组,禁食不禁水12h后,各给药组给予相应药物灌胃(0.15mL/10g),模型组给予生理盐水0.15 mL/10 g。30 min后,各组小鼠灌胃给予56°牛栏山二锅头(0.15 mg/10 g),观察小鼠醉酒潜伏期(灌酒到翻正反射消失时间)、醒酒时间(翻正反射消失到翻正反射恢复时间)[16]。
1.3.6 生物指标检测
(1)预处理
取健康ICR雄性小鼠35只,适应性饲养3 d后,随机分为阴性对照组、模型组、力克阳性对照组、葛根发酵液组、葛根水提液组,每天给予阴性对照组和模型组生理盐水0.15 mL/10 g灌胃,其他组给予0.15 mL/10 g相应药物,30 min后,除阴性对照组灌胃生理盐水外,其他组给予56°牛栏山二锅头0.08 mL/10 g,连续8 d。末次给药30 min后,除阴性组外给予56°牛栏山二锅头0.1 mL/10 g。给酒后半小时摘眼球取血,脱椎处死,解剖取肝脏,用预冷生理盐水漂洗后,用滤纸吸干水分,液氮冷冻备用[17-18]。
(2)血清AST、ALT检测
摘眼球取血于离心试管中,3 000 r/min离心10 min,取上清,参照试剂盒方法测定血清中天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)含量。
(3)肝脏中SOD活力检测
采用超氧化物歧化酶(SOD)试剂盒(WST-8)法,参照试剂盒说明书,准确称取组织质量,按照质量(g)∶体积(mL)=1∶9的比例加入9倍体积生理盐水,剪碎组织,冰水浴制备匀浆,3 000 r/min,离心10 min,取上清即10%匀浆上清待测。通过预实验将10%组织匀浆上清用生理盐水稀释成适当浓度后参照操作表操作后,37 ℃孵育20 min,于450 nm处测定各复孔吸光度值。

2 结果与分析
2.1 单因素试验
2.1.1 初始pH对SOD活力的影响
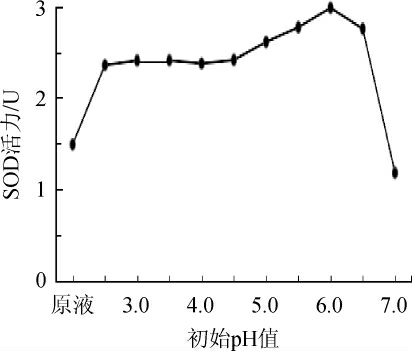
图1 初始pH值对SOD活力的影响
Fig. 1 Effect of initial pH value on SOD activity
由图1可知,SOD活力随初始pH的升高呈先升高再降低的趋势,在pH为6.0时达到峰值。推测原因为可能是,弱酸性条件下乳酸菌的生长繁殖及次级代谢产物的产生较快,强酸以及偏碱性环境均不利于乳酸菌的生长繁殖及代谢。因此,试验最佳初始pH值为6.0。
2.1.2 乳酸菌总接种量对SOD活力的影响
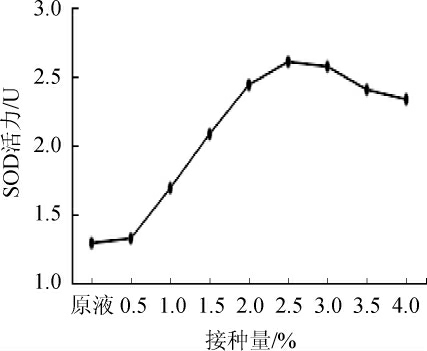
图2 接种量对SOD活力的影响
Fig. 2 Effect of inoculum on SOD activity
由图2可知,SOD活力在总接种量在2.5%之前逐渐上升,在2.5%达到峰值,随后呈下降趋势,推测在空间物质充裕的情况下,乳酸菌代谢活动与菌密度呈正比,但当乳酸菌密度过高时,乳酸菌的代谢活动因空间、营养物质等因素减缓。因此,试验最佳接种量为2.5%。
2.1.3 发酵时间对SOD活力的影响
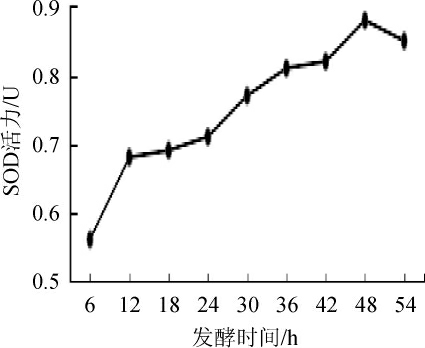
图3 发酵时间对SOD活力的影响
Fig 3 Effect of fermentation time on SOD activity
由图3可知,SOD活力在48 h内随发酵时间基本呈上升趋势,48 h达到峰值,推测在48 h内乳酸菌处于生长代谢旺盛期,48 h以后随着乳酸菌的密度增高和衰老转而消耗营养产物,使得次级代谢产物减少,SOD活力降低。因此,试验最佳发酵时间为48 h。
2.1.4 接种比例对SOD活力的影响
接种比例对SOD活力的影响如图4所示,结果表明,植物乳杆菌与副干酪乳杆菌比例过高或者过低时,SOD活力都比较低,植物乳杆菌∶副干酪乳杆菌=1∶1时,SOD活力最高,因此选用植物乳杆菌∶副干酪乳杆菌=1∶1为最佳接种比例。
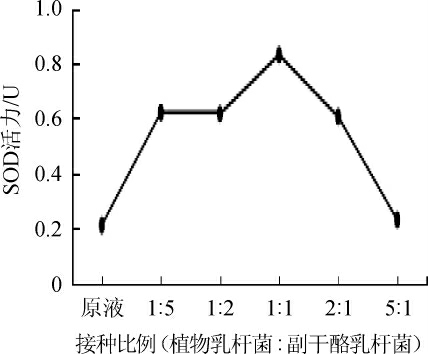
图4 接种比例对SOD活力的影响
Fig. 4 Effect of inoculation ratio on SOD activity
2.2 正交试验设计
在单因素试验的基础上,以初始pH值、接种量、发酵时间、植物乳杆菌与副干酪乳杆菌接种比例为评价因素,以SOD活力为评价指标进行正交试验,试验结果与分析见表2,正交试验结果方差分析见表3。
表2 发酵条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation conditions optimization
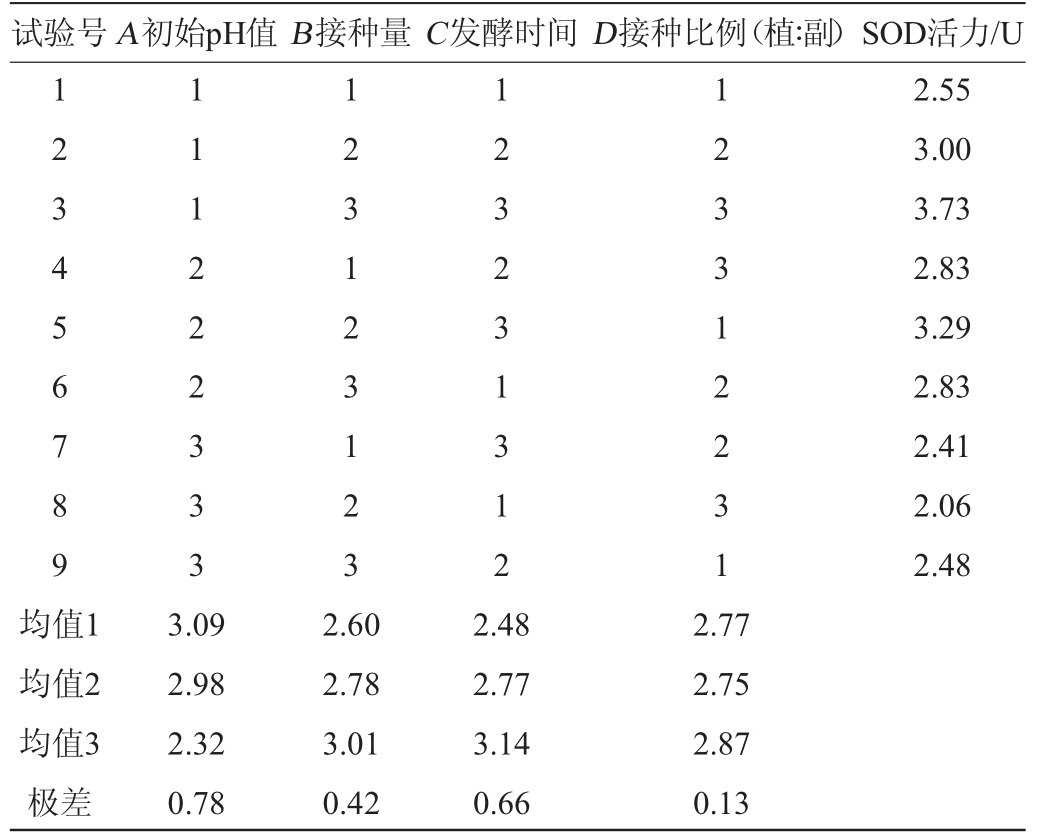
试验号A初始pH值B接种量C发酵时间D接种比例(植∶副)SOD活力/U 1 2 3 4 5 6 7 8 9 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 2.55 3.00 3.73 2.83 3.29 2.83 2.41 2.06 2.48均值1均值2均值3极差3.09 2.98 2.32 0.78 2.60 2.78 3.01 0.42 2.48 2.77 3.14 0.66 2.77 2.75 2.87 0.13
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
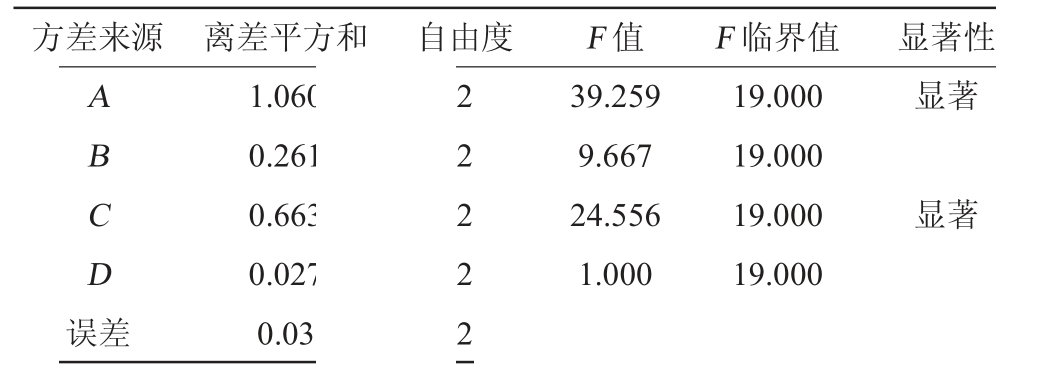
方差来源 离差平方和 自由度 F 值 F 临界值 显著性ABCD误差1.060 0.261 0.663 0.027 0.03 2 2 2 2 2 39.259 9.667 24.556 1.000 19.000 19.000 19.000 19.000显著显著
由表2正交试验结果极差分析可知,各因素对SOD活力影响次序为A>C>B>D。由表2可知,最佳发酵工艺为A1B3C3D3。遂发酵工艺条件为A1B3C3D3不变,即初始pH5.5,接种量4%,接种比例(植∶副)2∶1,发酵48 h。由表3方差分析结果可知,A、C因素对结果均有显著性影响(P<0.05),B、D因素对结果无显著性影响(P>0.05)。
2.3 验证试验
在上述最佳条件下,进行平行试验5次,SOD活力值依次为:4.06 U、4.09 U、4.05 U、4.11 U、4.08 U,平均值为4.08 U,相对标准偏差为0.585%。由此可得此试验设计合理。
2.4 解酒防醉实验
表4 小鼠解酒防醉实验结果
Table 4 Results of hangover and anti-drunk experiment of mice

注:与模型组相比较,“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。下同。
组别 醉酒潜伏期/min 醒酒时间/min模型组力克阳性对照组葛根发酵液组葛根水提液组169.2±0.7114 127.67±1.4487**138.53±0.7820**144.56±1.3003*3.93±0.2418 7.87±0.2354**6.6±0.2475**6±0.2711*
由表4可知,与模型组相比,葛根水提液组醉酒潜伏期显著延长、醉酒时间显著缩短(P<0.05),葛根发酵液组与阳性组醉酒潜伏期极显著延长(P<0.01),醉酒时间极显著缩短(P<0.01),且葛根发酵液组防醉解酒效果强于水提液组(P<0.05)。
2.5 血清AST、ALT活力检测
小鼠血清AST、ALT活力检测结果如图5所示。给药8 d后,与阴性组相比,模型组血清ALT和AST活力极显著升高(P<0.01),与模型组相比,阳性组、葛根水提液组、葛根发酵液组小鼠血清AST、ALT活力显著或极显著降低(P<0.05或P<0.01)。并且葛根发酵液组作用优于水提液组(P<0.05)。
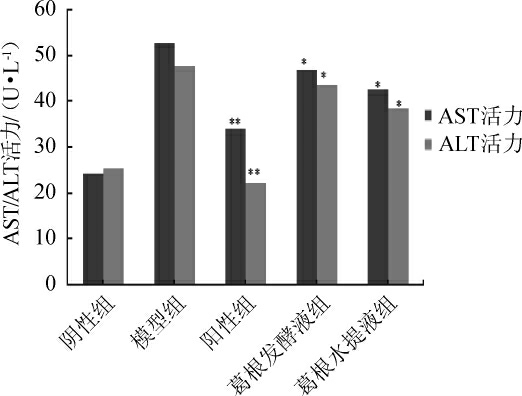
图5 小鼠血清AST、ALT含量检测结果
Table 5 Determination results of AST and ALT contents in mice serum
2.6 肝脏SOD活力检测
肝脏SOD活力检测结果如图6所示,与阴性组相比,模型组小鼠肝脏SOD活力极显著下降(P<0.01),与模型组相比,阳性组、葛根发酵液及水提液组小鼠肝脏SOD活力极显著上升(P<0.01)。且葛根发酵组优于水提液组(P<0.05)。
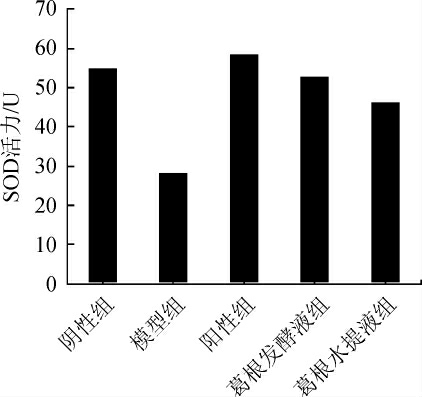
图6 小鼠肝脏SOD活力检测结果
Fig. 6 Determination results of SOD activity in mice liver
3 结论
本试验通过植物乳杆菌和副干酪乳杆菌混合发酵,研究了葛根水提液乳杆菌发酵前后抗氧化活性、对小鼠解酒防醉效果以及酒精性肝损伤的保护作用的变化。通过正交试验,得到葛根水提液的最佳发酵工艺为初始pH5.5,接种量4%,接种比例(植∶副)2∶1,发酵时间48 h,较对照组及发酵前抗氧化成分SOD活性均升高,一定程度上延长小鼠醉酒潜伏期并缩短醉酒时间(P<0.05或P<0.01),缓解了肝损伤引起的小鼠血清中AST、ALT活力升高,并提高小鼠肝脏SOD活力。综上所述,植物乳杆菌和副干酪乳杆菌双菌发酵可提高葛根的抗氧化能力及对小鼠急性醉酒的解酒防醉能力,增强小鼠肝脏的抗氧化能力,并且可一定程度上对小鼠酒精性肝损伤起保护作用。
[1]刘杏荣.葛根异黄酮的检测方法与提取纯化工艺研究[D].镇江:江苏大学,2007.
[2]张晓瑢,王明奎,彭树林,等.葛根的化学成分研究(英文)[J].中草药,2002,35(1):11-14.
[3]曹毅.中药葛根的相关药理药效研究综述[J].中国处方药,2018,16(2):27-28.
[4]国家药典委员会.中华人民共和国药典[M].2015 版.北京:中国医药科技出版社,2015.
[5]王文亮,杜方岭,祝清俊.葛根素提纯方法研究新进展[J].中国食物与营养,2009(8):40-42.
[6]李臻,赖富饶,吴晖.葛根的营养成分分析[J].现代食品科技,2011,27(8):1010-1011,1019.
[7]陈荔,陈树和,刘焱文.葛根资源、化学成分和药理作用研究概况[J].时珍国医国药,2006,17(11):2305-2306.
[8]CHEN X,HE Z,WU X,et al.Comprehensive study of the interaction between Puerariae radix flavonoids and DNA:From theoretical simulation to structural analysis to functional analysis[J].Spectrochimica Acta A,2020,231:118109.
[9] DONG Z, ZHANG M, LI H, et al. Structural characterization and immunomodulatory activity of a novel polysaccharide from Pueraria lobata(Willd.)Ohwi root[J].Int J Biol Macromol,2020,154:1556-1564.
[10]高慧.快速解酒厌氧微生物的筛选鉴定及其解酒能力研究[D].杭州:浙江大学,2016.
[11]薛成荣.酒精代谢酶基因多态性与酒精性肝病关系研究探讨[J].中国卫生产业,2012,9(2):148.
[12]ZHANG Y,REN J.ALDH2 in alcoholic heart diseases:Molecular mechanism and clinical implications[J].Pharmacol Therapeut,2011,132(1):86-95.
[13]钦传光,李世杰,丁焰,等.发酵工程在医药研究和生产中的应用[J].湖北工业大学学报,2000,15(1):67-70.
[14]卢传功,季秀敏.微生物发酵中药功效浅析[J].生物技术世界,2015,12(2):52.
[15]王延年,董雪,乔延江,等.中药发酵研究进展[J].世界科学技术:中医药现代化,2010(3):437-441.
[16]CHA J,JEONG J,YANG H,et al.Effect of fermented sea tangle on the alcohol dehydrogenase and acetaldehyde dehydrogenase in Saccharomyces cerevisiae[J].J Microbiol Biotechnol,2011,21(8):791-795.
[17] CHOI Y, BOSE S, SHIN N, et al. Lactate-fortified Puerariae radix fermented by Bifidobacterium breve improved diet-induced metabolic dysregulation via alteration of gut microbial communities[J].Nutrients,2020,12(2):276.
[18]杜晨晖,闫艳,冯前进,等.葛根芩连汤发酵前后总黄酮和总生物碱含量变化研究[J].中华中医药杂志,2016,31(11):4850-4853.
[19]廖瑟静,翁竞玉,石榆锋,等.桧木纯露解酒护肝作用的实验研究[J].食品研究与开发,2019,40(8):184-187.
[20]何会,陈爱丽,陈伊锴.葛根、枳椇子对于解酒功效的协同作用功能评价[J].临床医药文献电子杂志,2019,6(37):10-11,13.
[21]杨静.栀子醒酒饮品醒酒、护肝及对记忆影响研究[D].泸州:西南医科大学,2019.