红曲菌(Monascus spp.)又称为红曲霉,是我国重要的药食同源微生物。其发酵产品——红曲在我国有近两千年的应用历史[1]。在分类地位上,将红曲菌归属于散囊菌目(Eurotiales)、曲霉科(Aspergillaceae)、红曲霉属(Monascus)[2]。目前,关于红曲菌种的分类,一直存在着争议,文献报道的红曲菌有30余种:1983年,HAWSKWORTH D L等[3]将红曲菌归分为3类;1987年,BARNARD E L等[4]研究发现,弗罗里达红曲菌(Monascus floridanus)新种;1995年,CANNON P F等[5]发现2个新种:依据有性世代形态将其命名为苍白红曲菌(Monascus pallens)和血红红曲菌(Monascus sanguineus);2007年,李钟庆等[6]利用形态学方法对红曲菌属进行分类后重新确认为8个种;2017年,BARBOSA R N等[7]将红曲菌种分为两组共9种,第一组为弗罗里达(Floridani)组,包括黄色红曲菌(Monascus flavipigmentosum)、蜂蜜红曲菌(Monascus mellicola)、累西腓红曲菌(Monascus recifensis)、弗罗里达红曲菌(Monascusfloridanus)、苍白红曲菌(Monascus pallens)、新月红曲菌(Monascus lunisporas)和阿根廷红曲菌(Monascus argentinensis)7个种;第二组为红色(Rubri)组,包括红色红曲菌(Monascus ruber)和紫色红曲菌(Monascus purpureus)2个种,并认为丛毛红曲菌(Monascus pilosus)与红色红曲菌(Monascus ruber)为同一物种,血红红曲菌(Monascus sanguineus)与紫色红曲菌(Monascus purpureus)为同一物种;2018年,何亚涛[8]将红曲菌分为两个组共10种,第一组为弗罗里达(Floridani)组,与BARBOSA R N等[7]报道一致;第二组为红色(Rubri)组包括红色红曲菌(Monascus ruber)、紫色红曲菌(Monascus purpureus)和血红红曲菌(Monascussanguineus)3个种,其中认为血红红曲菌(Monascus sanguineus)为一个独立的种。表明红曲菌物种具有丰富的多样性,有必要借助有效的分类方法进行区分。
目前,红曲菌的分类鉴定方法主要包括传统的形态学方法和现代的分子生物学方法[9]。依据形态特征进行分类的方法是红曲菌分类鉴定的主要手段[10],但由于受环境、人的主观判断的影响较大,往往不能有效区分形态相近的种。而物种的脱氧核糖核酸(deoxyribonucleic acid,DNA)序列信息通常不受外界环境的影响,因此,基于DNA序列信息的分子标记技术常被用来辅助形态学分类[11]。分子生物学方法共同的特点是以DNA为材料,通过聚合酶链式反应(polymerase chain reaction,PCR)扩增,依据琼脂糖凝胶电泳检测结果或DNA测序结果进行聚类分析,但由于各种分子生物学技术的原理不同,并且PCR扩增结果受扩增体系内组分、扩增条件等因素的影响较大,不同分子生物学分类方法可能会出现聚类结果不一致的情况。通过比较分析不同的分子标记技术,内部简单重复序列(inter simple sequence repeats,ISSR)技术被筛选出来作为辅助红曲菌形态学分类的有效方法[12-13]。
ISSR标记技术是利用真核生物基因组中广泛存在的简单重复序列(simple sequence repea,SSR),设计出能与其结合的各种PCR引物,对两个相距较近且方向相反的SSR序列之间的DNA区段进行扩增,并检测其多态性[14]。ISSR技术所用的PCR引物长度在20个核苷酸左右,可以采用与常规PCR相同的反应条件,具有操作简单、可重复性高、模板DNA用量少等优点[15-16],且ISSR指纹分析可以作为区分具有相似形态或ITS序列的丝状真菌[17],以及分析检测种的复杂度和验证新种的有效工具。因此,本研究利用形态学分类鉴定法结合ISSR分子生物学分类鉴定法鉴别25种不同来源的红曲菌,以期为不确定归属种的红曲菌株分类鉴定提供一种辅助鉴定手段。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
25株实验用菌株为MY1、MY2、MY3、ZH1、ZH2、ZH3、ZH4、ZH5、JC1、JC2、MG1、MG2、MG3、MF2、MF3、MS1、MS3、GW1、GW2、GW3、GW4、GW5、GW6、GW7、MS2,其中,前17株菌株分离自不同类型的红曲产品,菌株MS1前期已被鉴定为丛毛红曲菌(Monascus pilosus)保藏于中国典型培养物保藏中心,对应的编号为CCTCC M 2013295,其余16株保藏于华中农业大学食品科学与工程学院食品安全与技术实验室;菌株GW1~GW7购自荷兰菌种保藏中心,对应的编号分别为红色红曲菌(Monascus ruber)CBS 554.76、高梁红曲菌(Monascus kaoliang)CBS 302.78、紫色红曲菌(Monascus purpureus)CBS 736.83、血红红曲菌(Monascus sanguineus)CBS 123568、红色红曲菌(Monascus ruber)CBS 254.65、丛毛红曲菌(Monascus pilosus)CBS 290.34和红色红曲菌(Monascus ruber)CBS 291.34);菌株MS2购自中国科学院微生物研究所菌种保藏中心,对应的编号为紫色红曲菌(Monascus purpureus)AS 3.5838。
1.1.2 试剂
Easy Taq DNA聚合酶、Trans 2K plus Marker、Trans 15K Marker:北京全式金生物有限公司;RNase A:宝生物技术(北京)有限公司;麦芽汁浸粉、琼脂(均为生化试剂):安琪酵母股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基[18]
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:200 g土豆去皮后切成小块,加水煮沸20 min,过滤后,加入20 g葡萄糖,15 g琼脂粉,以蒸馏水定容至1 000 mL,pH值自然。
麦芽提取物琼脂(malt extract agar,MEA)培养基:麦芽提取粉20 g,蛋白胨1 g,葡萄糖20 g,琼脂15 g,加蒸馏水定容至1 000 mL。
麦芽汁琼脂(wort agar,WA)培养基:麦芽汁(15°Bx)1 000 mL,琼脂15 g。
察氏酵母提取粉琼脂(Czapek yeast extract agar,CYA)培养基:NaNO3 3.0 g,K2HPO4 1.0 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,酵母提取物5.0 g,蔗糖20 g,琼脂15 g,加蒸馏水定容至1 000 mL,pH值自然。
25%甘油硝酸盐琼脂(25%glycerol nitrate agar,G25N)培养基:在CYA培养基中加入25%甘油。
PDA培养基在115 ℃灭菌20 min。MEA、WA、CYA、G25N培养基在121 ℃灭菌20 min。
1.2 仪器与设备
T960型PCR仪:上海Heal Force公司;DYY-8C凝胶成像系统:北京六一电泳仪器厂;Neofuge 18R高速冷冻离心机:上海Heal Force公司;SCB-1360无菌操作台:北京东联哈尔仪器制造有限公司;HH-8水浴锅:国华电器有限公司。
1.3 实验方法
1.3.1 红曲菌的形态学观察
菌落形态和显微形态观察:将在PDA上活化7 d后的25株菌株分别接种到MEA、WA、CYA、G25N培养基上,将平板倒置在25 ℃恒温箱中培养,观察第7天的菌落形态特征,主要记录其菌落形态、生长速度、气生菌丝疏密和产色素等情况;同时,取无菌盖玻片,以倾斜约45°方式插入WA培养基中,每皿插入4~6片,25 ℃恒温箱中倒置培养7 d,取盖玻片在显微镜下观察包括菌丝颜色及形态、分生孢子形态、闭囊壳和子囊孢子形态在内的显微形态特征,记录并拍照。
1.3.2 红曲菌ISSR的聚类分析
红曲菌基因组提取:具体提取步骤参照SHAO Y C等[19]的方法。
ISSR聚类分析:以25株供试红曲菌的DNA为模板,采用前期筛选的包括808#、810#、811#、834#、835#、841#、842#在内的7条引物进行ISSR实验,引物序列见表1[20],根据扩增片段的多态性对供试菌株进行聚类分析。
表1 ISSR分析所用引物序列
Table 1 Sequences of primers used in ISSR analysis

编号 引物 序列(5'→3')1 2 3 4 5 6 7 808#810#811#834#835#841#842#AGA GAG AGA GAG AGA GC GAG AGA GAG AGA GAG AT GAG AGA GAG AGA GAG AC AGA GAG AGA GAG AGA GYT AGA GAG AGA GAG AGA GYT GAG AGA GAG AGA GAG AYC GAG AGA GAG AGA GAG AYG
ISSR PCR扩增体系:模板1 μL,引物1 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)2 μL,10×buffer 2.5 μL,Taq DNA聚合酶0.3 μL,Mg2+(50 mmol/L)0.5 μL,双蒸水(ddH2O)17.7 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸90 s,共40个循环;72 ℃再延伸7 min。PCR扩增结束后采用1%琼脂糖凝胶电泳进行检测。
DNA多样性聚类分析:对照25株菌株PCR扩增产物的凝胶电泳图,根据同一位点DNA条带的有无编成1、0矩阵输入计算机,用NTSYSpc软件中的SIMQUAI程序计算菌株间的相似系数,最后采用UPGMA法进行聚类分析,构建相似聚类树状图。相似系数的数值范围为0~1,当数值接近于0时,表示两菌株间遗传相似性程度较低;当数值接近于1时,表示两菌株间遗传相似性程度较高。
2 结果与分析
2.1 供试红曲菌形态学分类鉴定
2.1.1 供试红曲菌的菌落形态观察结果
参照《红曲菌的形态与分类学》[18],根据菌落形态分类描述,可将本研究的25株供试菌株分为6类,具体菌落形态描述见表2,其中6种典型红曲菌的菌落形态见图1。
表2 25株供试红曲菌的菌落形态观察结果
Table 2 Results of colony morphology of 25 tested strains
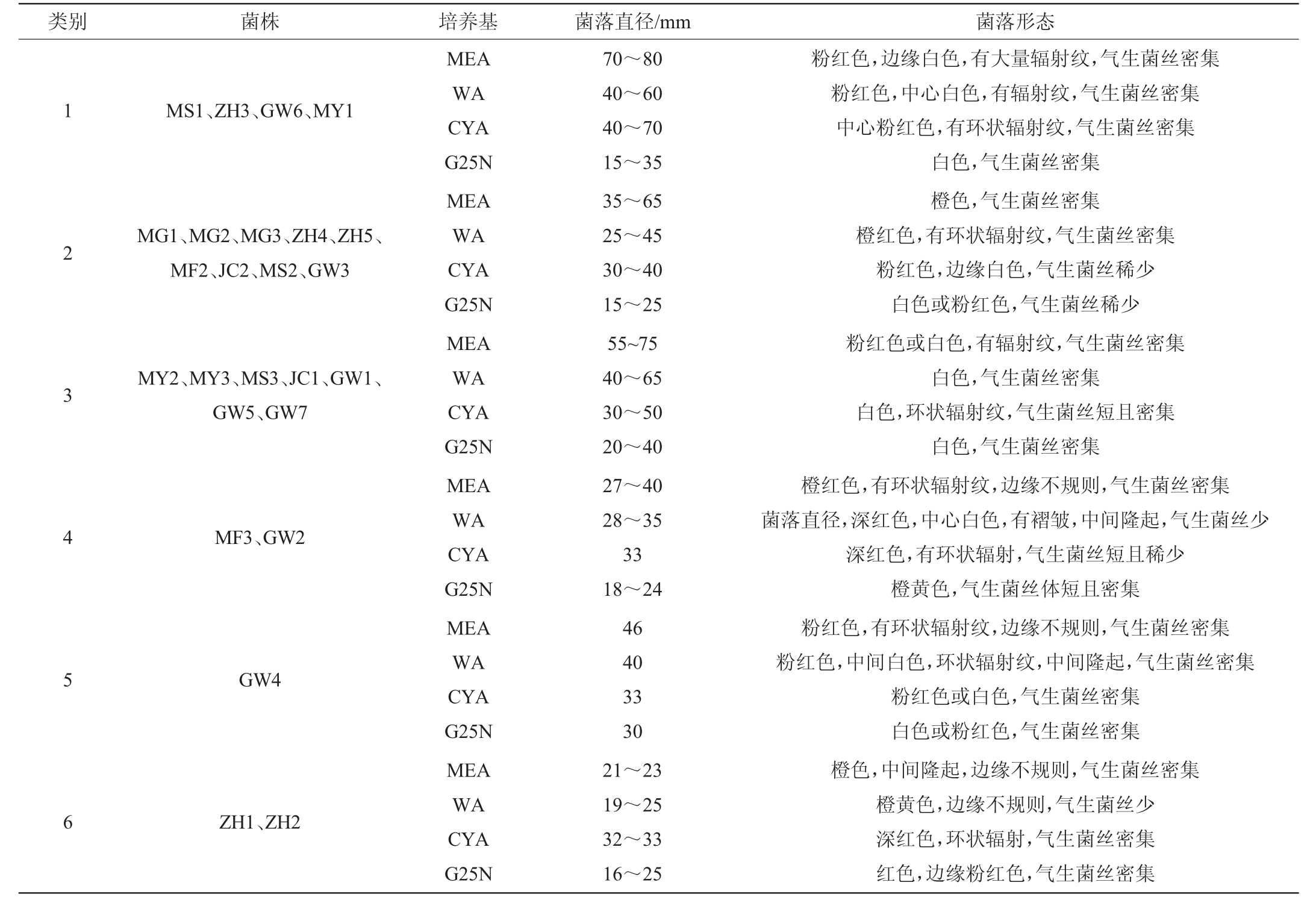
类别 菌株 培养基 菌落直径/mm 菌落形态1 2 3 4 5 6 MS1、ZH3、GW6、MY1 MG1、MG2、MG3、ZH4、ZH5、MF2、JC2、MS2、GW3 MY2、MY3、MS3、JC1、GW1、GW5、GW7 MF3、GW2 GW4 ZH1、ZH2 MEA WA CYA G25N MEA WA CYA G25N MEA WA CYA G25N MEA WA CYA G25N MEA WA CYA G25N MEA WA CYA G25N 70~80 40~60 40~70 15~35 35~65 25~45 30~40 15~25 55~75 40~65 30~50 20~40 27~40 28~35 33 18~24 46 40 33 30 21~23 19~25 32~33 16~25粉红色,边缘白色,有大量辐射纹,气生菌丝密集粉红色,中心白色,有辐射纹,气生菌丝密集中心粉红色,有环状辐射纹,气生菌丝密集白色,气生菌丝密集橙色,气生菌丝密集橙红色,有环状辐射纹,气生菌丝密集粉红色,边缘白色,气生菌丝稀少白色或粉红色,气生菌丝稀少粉红色或白色,有辐射纹,气生菌丝密集白色,气生菌丝密集白色,环状辐射纹,气生菌丝短且密集白色,气生菌丝密集橙红色,有环状辐射纹,边缘不规则,气生菌丝密集菌落直径,深红色,中心白色,有褶皱,中间隆起,气生菌丝少深红色,有环状辐射,气生菌丝短且稀少橙黄色,气生菌丝体短且密集粉红色,有环状辐射纹,边缘不规则,气生菌丝密集粉红色,中间白色,环状辐射纹,中间隆起,气生菌丝密集粉红色或白色,气生菌丝密集白色或粉红色,气生菌丝密集橙色,中间隆起,边缘不规则,气生菌丝密集橙黄色,边缘不规则,气生菌丝少深红色,环状辐射,气生菌丝密集红色,边缘粉红色,气生菌丝密集

图1 6种典型菌株的菌落形态
Fig. 1 Colony morphology of 6 typical strains
由表2及图1可知,第一类为与丛毛红曲菌(Monascus pilosus)MS1的菌落形态较为相似的菌株,包括菌株MS1、ZH3、GW6、MY1;第二类为与紫色红曲菌(Monascus purpureus)GW3的菌落形态较为相似的菌株,包括菌株MG1、MG2、MG3、ZH4、ZH5、MF2、JC2、MS2、GW3;第三类为与红色红曲菌(Monascus ruber)GW1的菌落形态较为相似的菌株,包括菌株MY2、MY3、MS3、JC1、GW1、GW5、GW7;第四类为与高梁红曲菌(Monascus kaoliang)GW2的菌落形态较为相似的菌株,包括菌株MF3和GW2;第五类为血红红曲菌(Monascus sanguineus)菌株GW4;菌株ZH1和ZH2菌落形态相近,但与其他菌株菌落形态均不相同,为第六类,需进一步分析鉴定。
2.1.2 红曲菌显微形态观察结果
参照《红曲菌的形态与分类学》[18],根据WA培养基上显微形态观察结果,将25株供试菌株归为7类,具体显微形态观察结果描述见表3,其中5种典型菌株的显微形态见图2。
由表3及图2可知,第一类为与丛毛红曲菌(Monascus pilosus)MS1的显微形态较为相似的菌株,该类的分类结果与菌落形态分类结果相同;第二类为与紫色红曲菌(Monascus purpureus)GW3的显微形态较为相似的菌株,该类的分类结果与菌落形态分类结果减少了菌株MS2,同时增加了菌株ZH1和ZH2;第三类为与红色红曲菌(Monascusruber)GW1的菌落形态较为相似的菌株,该类的分类结果与菌落形态分类结果减少了菌株GW7;第四类为与高梁红曲菌(Monascus kaoliang)GW2的菌落形态较为相似的菌株,该类的分类结果与菌落形态分类结果相同;第五类为血红红曲菌(Monascus sanguineus)菌株GW4,该类的分类结果与菌落形态分类结果相同;而菌株GW7和MS2的显微形态中,分生孢子和菌丝形态不同,但均未观察到其闭囊壳,可能由于这两株菌株在WA培养基下很少产生或不产生闭囊壳,或其闭囊壳形成时间发生改变而未被观察到。菌株GW7和MS2分别分类为第六类和第七类。
表3 25株供试红曲菌显微形态观察结果
Table 3 Results of microscopic morphology of 25 tested strains

类别 菌株 分生孢子 闭囊壳 菌丝1 2 3 4 5 6 7 MS1、ZH3、GW6、MY1 MG1、MG2、MG3、ZH4、ZH5、MF2、JC2、GW3、ZH1、ZH2 MY2、MY3、MS3、JC1、GW1、GW5 MF3、GW2 GW4 GW7 MS2球形或倒梨形,单生或2~4个成链球形或倒梨形,单生或2~8个成链球形或倒梨形,单生或2~10个成链球形或倒梨形,单生或2~3个成链球形或倒梨形,单生或2~3个成链球形或倒梨形,单生或2~8个成链球形或倒梨形,单生或2~6个成串球形,表面被菌丝包裹,无色球形,表面被菌丝包裹,橙色至褐色球形,生于菌丝顶端,无色球形,橙色至褐色球形,橙色至褐色无无不规则分枝,分隔,无色透明不规则分枝,分隔,无色透明或至褐色不规则分枝,分隔,无色透明不规则分枝,分隔,橙色至褐色不规则分枝,分隔,无色透明不规则分枝,分隔,无色透明不规则分枝,分隔,橙色至褐色

图2 5种典型菌株的显微形态
Fig. 2 Microscopic morphology of 5 typical strains
2.1.3 供试菌株的形态学鉴定结果
综合形态观察结果,根据《红曲菌的形态与分类学》[18],对25种供试菌株进行初步分类鉴定,结果见表4。
表4 25株供试菌株的形态学分类结果
Table 4 Results of morphological classification of 25 tested strains
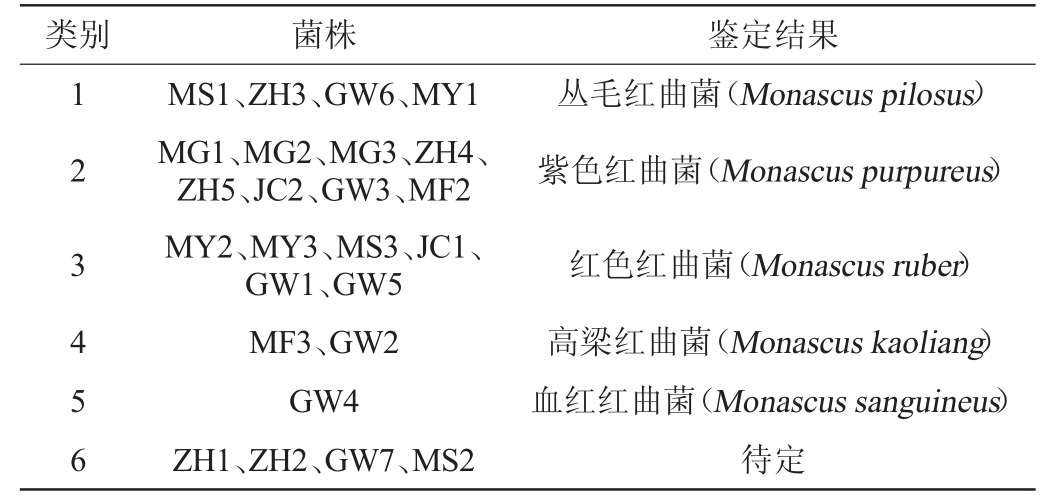
类别 菌株 鉴定结果1 2 3 4 5 6 MS1、ZH3、GW6、MY1 MG1、MG2、MG3、ZH4、ZH5、JC2、GW3、MF2 MY2、MY3、MS3、JC1、GW1、GW5 MF3、GW2 GW4 ZH1、ZH2、GW7、MS2丛毛红曲菌(Monascus pilosus)紫色红曲菌(Monascus purpureus)红色红曲菌(Monascus ruber)高梁红曲菌(Monascus kaoliang)血红红曲菌(Monascus sanguineus)待定
由表4可知,25株供试菌株归为6类,分别为丛毛红曲菌(Monascus pilosus)、紫色红曲菌(Monascus purpureus)、红色红曲菌(Monascus ruber)、高梁红曲菌(Monascus kaoliang)、血红红曲菌(Monascus sanguineus)和待定。其中菌株ZH1和ZH2菌落形态相近,而与其他菌种菌落形态显著不同,仅见显微形态与紫色红曲菌的显微形态相近,仍需进一步分析鉴定。菌株GW7和MS2的菌落形态分别与红色红曲菌和紫色红曲菌相近,但显微形态中未观察到闭囊壳,有必要进一步分析鉴定。
2.2 供试红曲菌ISSR分类结果
2.2.1 ISSR PCR扩增结果
25株供试红曲菌的ISSR PCR扩增产物的琼脂糖凝胶电泳结果见图3,PCR扩增产物的总条带数和多态性条数统计结果见表5。
由图3及表5可知,每条引物可以扩增出7~16条DNA条带,7条引物共扩增出88条DNA条带,其中90.1%呈多态性,除血红红曲菌(Monascus sanguineus)GW4的ISSR扩增图谱与其他菌株的图谱差异较大,其余菌株均扩增出l~2条大小相同的条带,这一方面表明了红曲菌属内种群之间遗传背景的多样性,另一方面也反映出它们同属间的共性。
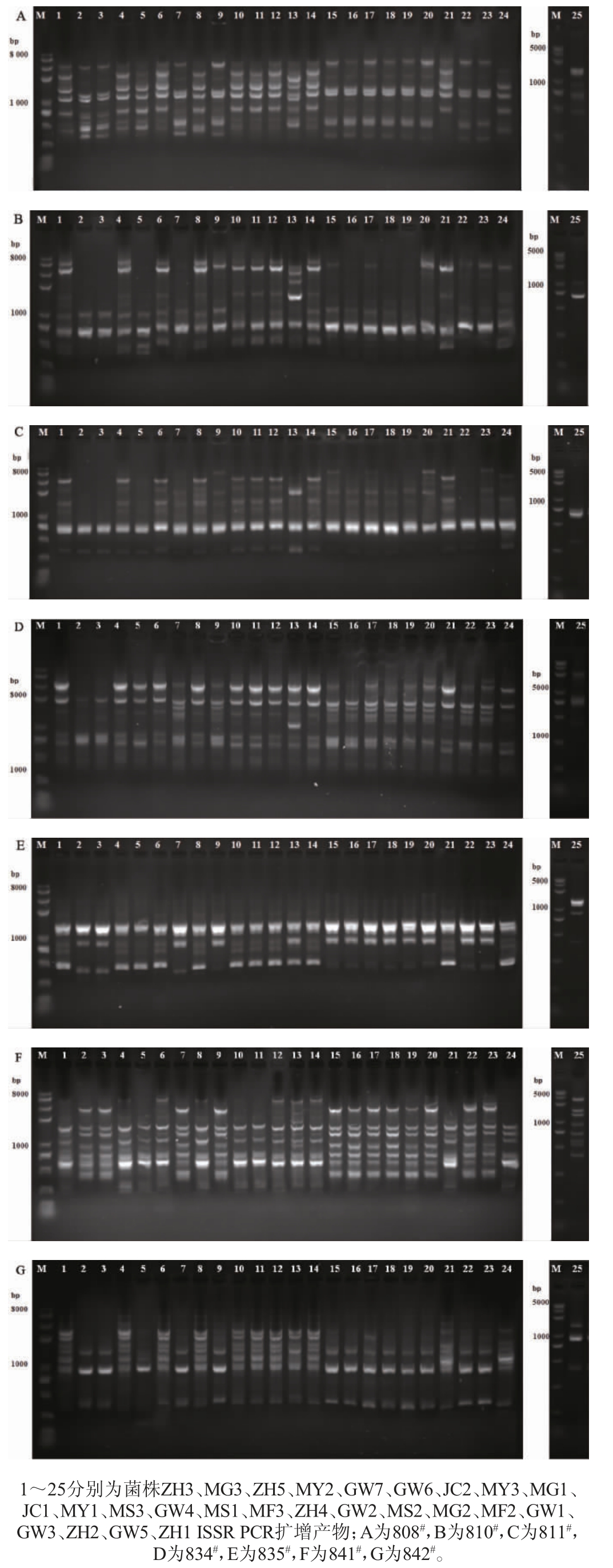
图3 ISSR PCR扩增产物琼脂糖凝胶电泳结果
Fig. 3 Electrophoretogram results of ISSR PCR amplified products
表5 ISSR PCR扩增产物的总条带数和多态性条数
Table 5 Total stripes and polymorphic stripes of PCR amplified products of ISSR
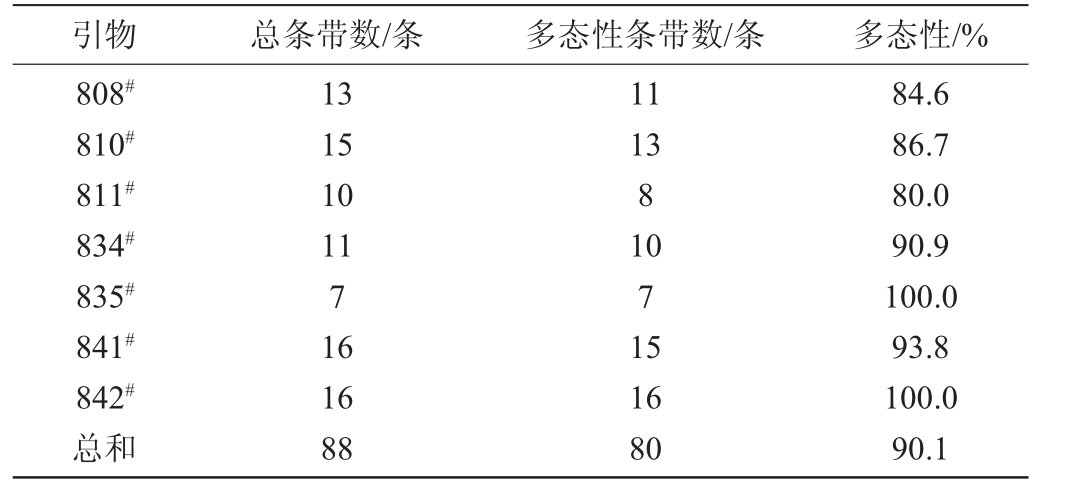
引物 总条带数/条 多态性条带数/条 多态性/%808#810#811#834#835#841#842#总和13 15 10 11 7 16 16 88 11 13 8 10 7 15 16 80 84.6 86.7 80.0 90.9 100.0 93.8 100.0 90.1
2.2.2 ISSR PCR扩增结果聚类分析
将每株红曲菌用7条引物PCR扩增得到的所有条带进行统计,结果见图4。
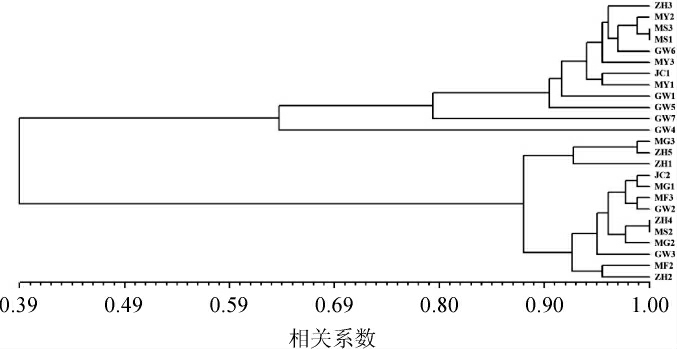
图4 基于ISSR 25株供试菌株聚类分析结果
Fig. 4 Results of clustering analysis of 25 tested strains based on ISSR fingerprints
由图4可知,供试红曲菌菌株间的遗传相似系数范围为0.39~1.00,表现出一定的多态性。在相似性水平为0.9时,25株菌株可分为5类,第一类包括菌株ZH3、MY2、MS3、MS1、GW6、MY3、JC1、MY1、GW1、GW5在内的共10株菌株,这些菌株的遗传相似系数>0.91;第二类只有菌株GW7;第三类只有菌株GW4;第四类包括菌株MG3、ZH5、ZH1在内的共3株菌株,这些菌株的遗传相似系数>0.93;第五类包括菌株JC2、MG1、MF3、GW2、ZH4、MS2、MG2、GW3、MF2、ZH2在内的共10株菌株,这些菌株的遗传相似系数>0.93。
2.3 形态学分类结果与ISSR聚类结果比较分析
根据菌落形态,菌株GW7与红色红曲菌(Monascus ruber)相似,菌株MS2与紫色红曲菌(Monascus purpureus)相似,但根据显微形态,菌株GW7与MS2中均未观察到闭囊壳。根据菌落形态,菌株ZH1、ZH2与其他菌株均不相同,而根据显微形态,菌株ZH1、ZH2与紫色红曲菌(Monascus purpureus)相似。为进一步分析这些菌株的分类关系,采用ISSR进行辅助分类分析。ISSR聚类分析结果显示,菌株GW7与红色红曲菌(Monascus ruber)遗传相似系数达到0.80,故将其鉴定为红色红曲菌(Monascus ruber);菌株MS2与紫色红曲菌(Monascus purpureus)遗传相似系数达到1.00,则将其鉴定为紫色红曲菌(Monascus purpureus);菌株ZH1和ZH2与紫色红曲菌(Monascus purpureus)遗传相似系数分别为0.88和0.96,则将其均鉴定为紫色红曲菌(Monascus purpureus)。
根据形态学分类方法,菌株MG3、ZH5的菌落形态和显微形态,均与紫色红曲菌(Monascus purpureus)相近,且根据聚类分析结果,菌株MG3、ZH5与紫色红曲菌(Monascus purpureus)的遗传相似系数>0.88,所以将其均鉴定为紫色红曲菌(Monascus purpureus)。
根据形态学分类方法,将菌株MF3、GW2归为高梁红曲菌(Monascus kaoliang);而ISSR分子生物学分类结果显示,菌株MF3、GW2与紫色红曲菌(Monascus purpureus)的遗传相似系数>0.98,故将菌株MF3、GW2鉴定为紫色红曲菌(Monascus purpureus)。此结果与李钟庆等[6]报道的高梁红曲菌(Monascus kaoliang)是紫色红曲菌(Monascus purpureus)的同种异名结果一致。
根据形态学分类方法,将菌株ZH3、GW6、MY1、MS1鉴定为丛毛红曲菌(Monascus pilosus);菌株MY2、GW7、MY3、JC1、MS3、GW1、GW5鉴定为红色红曲菌(Monascus ruber),而丛毛红曲菌(Monascuspilosus)MS1和红色红曲菌(Monascus ruber)GW1两株标准菌株在MEA和WA培养基上菌落形态无明显差异,且ISSR分子生物学分类结果显示,菌株ZH3、MY3、MY2、丛毛红曲菌(Monascus pilosus)GW6、MS3、丛毛红曲菌(Monascus pilosus)MS1、MY1、JC1、GW5、红色红曲菌(Monascus ruber)GW1的遗传相似系数>0.91,故将菌 株ZH3、GW6、MY1、MS1、MY2、GW7、MY3、JC1、MS3、GW1、GW5综合鉴定为红色红曲菌(Monascus ruber)。这与BARBOSA R N等[7]认为丛毛红曲菌(Monascus pilosus)与红色红曲菌(Monascus ruber)为同一类的报道相符。
综合形态学分类方法与ISSR分子鉴定的方法可知,目前市售红曲产品的生产菌种主要为红色红曲菌(Monascus ruber)、紫色红曲菌(Monascus purpureus),与文献[21]报道的一致。但由于生产条件或菌株自身的遗传差异,导致一些菌株分类鉴定存在不确定性。本研究表明,以形态学分类方法为基础,以ISSR分子鉴定的方法为辅助,可以分析检测红曲菌种的复杂度以及相似性关系。研究结果也为了解市售红曲相关发酵产品生产菌株的特征和应用情况,进一步发掘和保护红曲菌株资源提供参考。
3 结论
本研究以市场购买的红曲产品分离得到的17株红曲菌和8株标准菌株为主要材料,根据其在MEA、WA、CYA、G25N四种培养基上的菌落形态和WA培养基上的显微形态特征,将25株红曲菌分为6大类,ISSR分子生物学分类鉴定法将25株红曲菌分为5大类。综合形态学与ISSR分子标记鉴定结果,25株红曲菌株可以聚为3大类,将菌株ZH3、MY2、MS3、MS1、GW6、MY3、JC1、MY1、GW1、GW5、GW7鉴定为红色红曲菌(Monascus ruber);将菌株MG3、ZH5、ZH1、JC2、MG1、MF3、GW2、ZH4、MS2、MG2、GW3、MF2、ZH2鉴定为紫色红曲菌(Monascus purpureus);菌株MG4鉴定为血红红曲菌(Monascus sanguineus)。
[1] CHEN W P, HE Y, ZHOU Y X, et al. Edible filamentous fungi from the species Monascus:Early traditional fermentations modern molecular biology and future genomics[J]. Compr Rev Food Sci Food Safe, 2015, 14(5):555-567.
[2] PETTERSSON O V, LEONG S L L, LANTZ L, et al. Phylogeny and intraspecific variation of the extreme xerophile,xeromycesbisporus[J].Fungal Biol,2011,115(11):1100-1111.
[3] HAWKSWORTH D L, PITT J I. A new taxonomy for Monascus species based on cultural and microscopial characters[J].Aust J Botany,1983,31(1):51-61.
[4] BARNARD E L, CANNON P F. A new species of Monascus from pine tissues in Florida[J].Taylor Francis,2018,79(3):479-484.
[5] CANNON P F, ABDULLAH S K, ABBAS B A. Two new species of Monascus from Iraq,with a key to known species of the genus [J].Mycol Res,1995,99(6):659-662.
[6]李钟庆,郭芳.红曲菌属的种之进一步研究(英文)[J].菌物学报,2004(1):1-6,169.
[7]BARBOSA R N,LEONG S L,VINNERE P O,et al.Phylogenetic analysis of Monascus and new species from honey, pollen and nests of stingless bees[J].Stud Mycol,2017,1(86):29-51.
[8]何亚涛.基于多基因分析对我国红曲霉属Monascus 真菌的系统发育研究[J].菌物学报,2018,37(9):1154-1169.
[9]高慧民.红曲菌的分类鉴定及其固态发酵产孢条件的优化[D].天津:天津科技大学,2015.
[10]刘欢欢,杨帆,李贞景,等.高产酯化酶红曲菌的筛选、鉴定及酶学性质研究[J].中国酿造,2019,38(5):49-53.
[11]黄颖颖,杨成龙.分子标记技术在红曲霉分类鉴定中的研究进展[J].福建轻纺,2013(9):28-34.
[12]YANG C L, WU X P, CHEN B, et al. Comparative analysis of genetic polymorphisms among Monascus strains by ISSR and RAPD markers[J].J Sci Food Agr,2017,97(2):636-640.
[13]徐定洪,赵玖,嘉晓勤.红曲菌ISSR 分子标记体系的构建和聚类分析[J].中国酿造,2014,33(9):38-41.
[14]ZHOU S,SMITH D R,STANOSZ G R.Differentiation of botryosphaeria species and related anamorphic fungi using inter simple or short sequence repeat(ISSR)fingerprinting[J]. Mycol Res,2001,105(8):919-926.
[15]孙玥,苏京平,王胜军,等.ISSR 分子标记技术在作物遗传育种中的应用[J].种子科技,2019,37(12):26-30.
[16]MINI M L,SATHYA M,ESSA M M,et al.Identification of salt-tolerant cowpea genotypes using ISSR markers and proteome analysis[J]. Front Biosci,2019,11(1):130-149.
[17]杨成龙,陈章娥,吴小平,等.基因组ITS 序列分析鉴定红曲霉菌株[J].核农学报,2015,29(2):252-259.
[18]李钟庆,郭芳.红曲菌的形态与分类学[M].北京:中国轻工业出版社,2003:45-61.
[19] SHAO Y C, XU L, CHEN F S. Genetic diversity analysis of Monascus strains using SRAP and ISSR markers[J]. Mycoscience, 2011, 52(4):224-233.
[20]许璐.分子标记技术在红曲菌菌种鉴别中的应用[D].武汉:华中农业大学,2007.
[21]李志强,刘颖,林风,等.福建古田红曲生产用红曲霉菌主要种类的鉴别[J].食品与发酵工业,2017,43(5):64-69.