萨兹酒花具有持久优雅、略带草药的清香,经常作为香花随锅熬煮[1],在啤酒酿造中赋予啤酒特殊的清香和爽口的苦味,大大提高了啤酒的可饮性,啤酒区别于其他饮料的关键也正是添加了酒花。酒花香气成分复杂,萜类化合物和醇类化合物对酒花的香气贡献显著,但因其香气物质的阈值和存在条件差别很大,其贡献程度也存在显著差异[2]。目前酒花的应用主要是在啤酒[3]、面包[4]、饮料[5]和口香糖[6]等方面,对于其在葡萄酒中的研究尚未见报道。
电子鼻和气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术可在较短时间内完成多组分混合物的定性和定量分析,结果受主观因素影响小,在葡萄酒[7]、茶叶[8]和肉类[9]等食品挥发性风味物质研究中有着广泛的应用。如陈明等[10]使用顶空-固相微萃取(headspacesolid phase microextraction,HS-SPME)对样品香气化合物进行萃取,然后用GC-MS对比分析了蛇龙珠葡萄酒在发酵前后的香气化合物变化。刘琨毅等[11]采用顶空固相微萃取-气质联用技术对川南地区的不同品种葡萄的柑橘-葡萄酒香气化合物进行了检测,通过比较分析筛选出了夏黑葡萄最适于柑橘-葡萄酒的酿造。但GC-MS不能分析这些物质作为一个整体时对样品风味的贡献,而电子鼻是模拟人的嗅觉系统,将化学信号转换为电信号,形成传感器阵列对气味的响应谱,能够对整体风味物质进行区分[12],同时弥补感官评价中人为因素影响和识别精度低的缺点[13]。
本研究将萨兹酒花与葡萄酒酿造相结合,将酒花特有香味融入葡萄酒中,应用电子鼻和气相色谱-质谱联用技术探究萨兹酒花对葡萄酒香气成分的影响,并通过主成分分析(principal component analysis,PCA)法对结果进行分析,建立萨兹酒花葡萄酒香气品质的评价模型,筛选出萨兹酒花添加的适宜浓度,以丰富葡萄酒香气,同时为研究新型葡萄酒、扩大酒花的应用提供新思路,以及为新型酒花葡萄酒整体品质评价提供一定参考依据。
1 材料与方法
1.1 材料与试剂
酒花(萨兹):河南省帕洛丁贸易有限公司;玫瑰香葡萄:成都金满堂农业开发有限公司;壳聚糖(粒度120目):深圳天扬生物科技有限公司;葡萄酒-果酒专用酵母RW:安琪酵母股份有限公司。
1.2 仪器与设备
FOX 4000型电子鼻:法国Alpha MOS公司;SQ680气相色谱质谱联用仪:美国Perkin Elmer公司;PC-420D专用磁力加热搅拌装置;FALLC4N电子天平:常州市衡正电子仪器有限公司;WK2102电磁炉:美的集团有限公司;MY-50粉碎机:广州市扬鹰医疗器械有限公司;HHS-8S电子恒温不锈钢水浴锅:上海广地仪器设备有限公司。
1.3 试验方法
1.3.1 萨兹酒花葡萄酒酿造工艺及操作要点
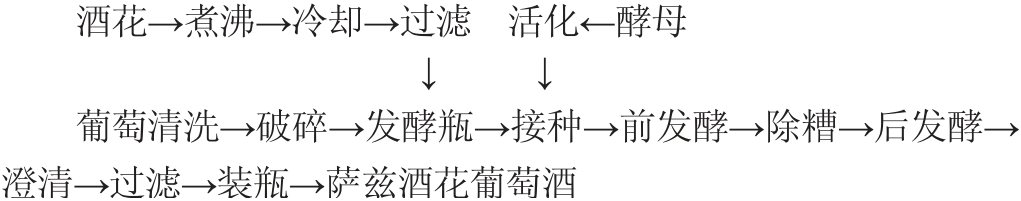
操作要点:选取新鲜、无腐烂、无病虫害且成熟度好的玫瑰香葡萄样品,清洗干净,去皮取果肉,酒花采取4个添加量,分别为0、0.5 g/L、0.8 g/L、1.0 g/L,分别编号为C00、E01、E02、E03,按工艺流程进行萨兹酒花葡萄酒酿造[14]。将果肉和果肉质量20%的酒花溶液一起放入发酵瓶中,接入1.0%活化后的酵母溶液,置于20~25 ℃发酵,当皮渣下沉、整罐酒体浑浊和酒液基本没有甜味时发酵结束。添加糖以调整酒样总糖度至22°Bx。主发酵结束后,过滤除杂,再在15 ℃条件下进行二次发酵(120 h)。待后发酵结束后,(2±2)℃低温保藏168 h左右。在温度为15 ℃的条件下,向酒样中加入0.05%的壳聚糖进行澄清(10 h)。将澄清过滤后的酒液移入新的发酵容器在5 ℃条件下进行陈酿,后置于阴凉通风环境下进行保藏,即得萨兹酒花葡萄酒。
1.3.2 电子鼻测试条件
取样品5 mL置于10 mL顶空瓶中,静置10 min以保证样品香气足够挥发并达到平衡状态。用注射器吸取1 000 μL注入电子鼻检测器。电子鼻手动进样,进样速度0.7 L/min,数据采集时间120 s,数据采集延迟240 s,每个样品平行测试3次,取传感器在第120 秒时获得的稳定信号进行分析。
1.3.3 GC-MS分析
萃取条件:准确吸取4 mL不同酒花含量葡萄酒的酒样,置于15 mL固相微萃取样品瓶中,加入0.5 g NaCl以促进香气成分挥发,加盖密封,于40 ℃水浴中平衡10 min,将已活化的萃取头插入样品瓶上,萃取吸附40 min后拔出。当样品萃取平衡后,缩回纤维头,吸附后的萃取针头迅速插入气相色谱进样口,推出纤维头于230 ℃解吸5 min,GC-MS分析。
GC条件:进样口温度230℃;色谱柱为DB-Wax(30 mm×0.25 mm×0.25 μm);升温程序为初始温度40 ℃,保持5 min,以6 ℃/min升至230 ℃,保持6 min;载气(高纯氦气),流速0.97 mL/min,不分流。
MS条件:电子电离(electronic ionization,EI)源,电子能量为70 eV,灯丝流量为0.20 mA,离子源温度为230 ℃,接口温度为250 ℃,质量扫描范围30.00~500.00 m/z。
定性定量分析:将未知化合物经过计算机与美国国家标准技术研究所(national institute of standards and technology,NIST)质谱库和Wiley质谱库检索定性,结合解析谱库,确定香气物质,数据平行测定3次,按峰面积归一化法[15-16]计算各组分的相对含量。
1.3.4 数据处理
数据用Microsoft Excel 2010统计处理并绘图,利用SPSS 19.0软件进行主成分分析。
2 结果与分析
2.1 电子鼻对萨兹酒花葡萄酒挥发性成分的检测
2.1.1 主成分分析
不同浓度萨兹酒花葡萄酒对电子鼻响应值的PCA 结果见图1。由图1可知,将3种浓度的萨兹酒花葡萄酒对18个传感器的电子鼻响应值进行降维处理后,得到两个主成分,其中,第1主成分(PC1)的方差贡献率为72.00%,第2主成分(PC2)的方差贡献率为27.18%,二者累计方差贡献率达到99.18%,足以代表样品的绝大部分信息[17-19]。由图1可知,空白组(C00)分布在坐标轴的第四象限,且和实验组(E01、E02、E03)样品对电子鼻传感器感应值距离最大,说明添加了萨兹酒花的葡萄酒与未添加的在风味上有很大差异。E01、E02、E03三种酒样分布在图1中不同位置,说明不同浓度的萨兹酒花葡萄酒在香气上存在差异,这种差异由18个传感器共同决定。E02、E03酒样有交叉,说明这两个浓度下的萨兹酒花葡萄酒风味存在相似性。
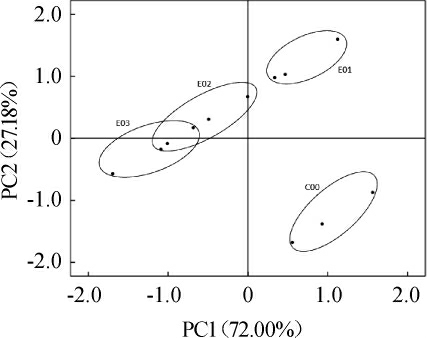
图1 不同浓度萨兹酒花葡萄酒电子鼻主成分分析结果
Fig. 1 Principal component analysis results of wines with different concentration of Saaz-hops based on electronic nose
2.2.2 载荷分析
载荷值是各成分与各个变量(传感器)的相关系数[20],电子鼻不同传感器响应值载荷分析结果见图2。
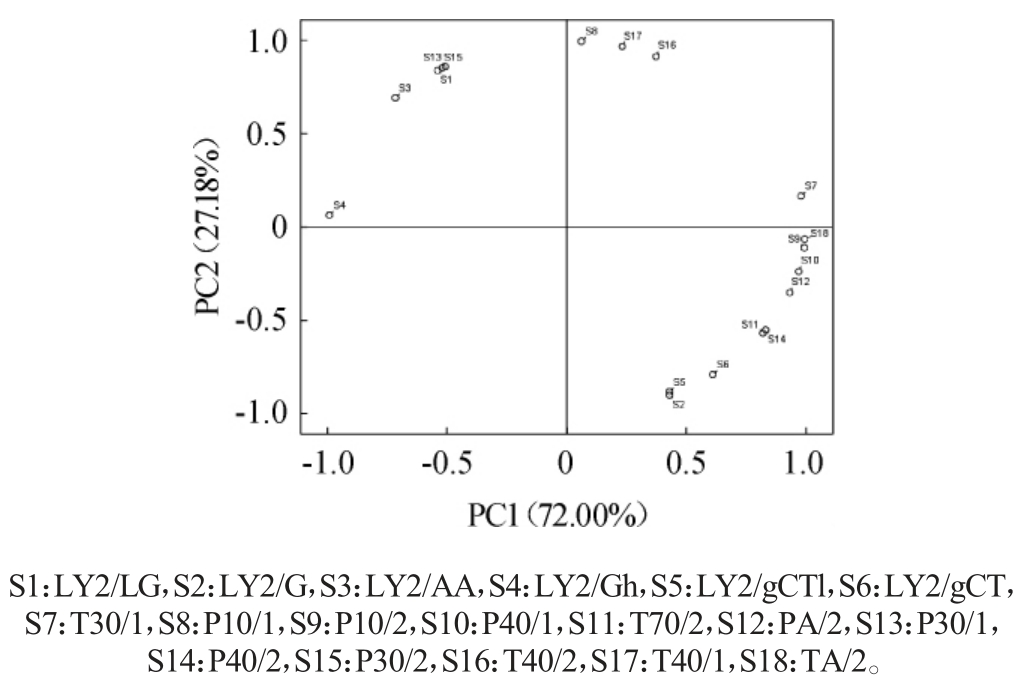
图2 电子鼻不同传感器响应值载荷分析
Fig. 2 Loading analysis of response value of different electronic nose sensors
由图2可知,TA/2传感器在第一主成分上有较大的载荷值(>0.99),其他传感器在第一主成分上的载荷值相对较小,说明TA/2传感器对第一主成分的贡献率较大,且呈正相关。在图1中,沿第一主成分轴,样品C00到E03的位置随着萨兹酒花浓度的增加自右向左排列,TA/2传感器(对乙醇等有机化合物敏感)的响应值可能也随之降低。第二主成分上P10/1传感器的载荷值较大(>0.99),与第二主成分呈正相关。
2.2 GC-MS对萨兹酒花葡萄酒挥发性成分分析
通过GC-MS对不同酒花质量浓度葡萄酒酒样挥发性成分进行数据采集和分析,得到总离子流色谱图见图3。经NIST数据库检索和保留指数计算挥发性成分相对含量结果见表1。
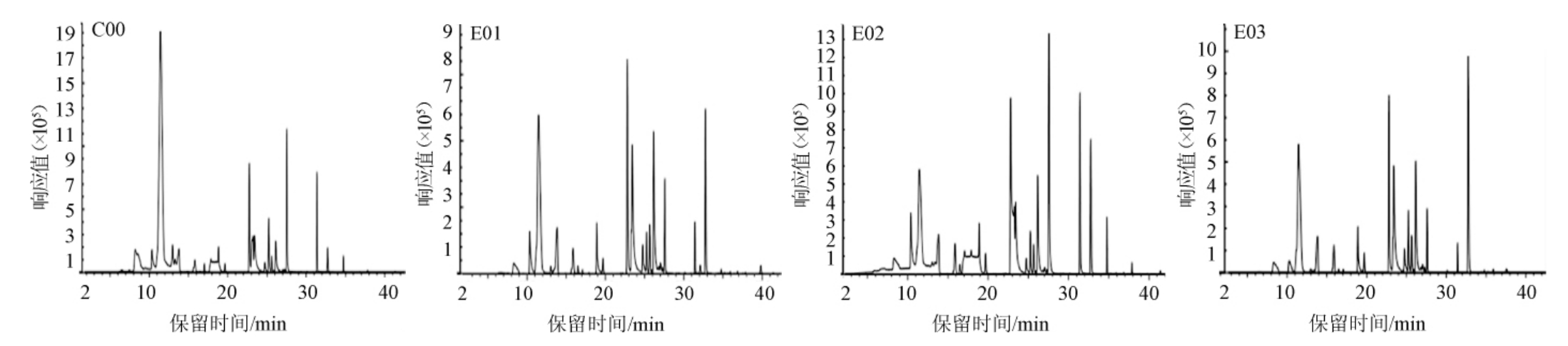
图3 各酒样挥发性风味物质GC-MS总离子流色谱图
Fig. 3 Total ion chromatogram of volatile flavor substances in wines analyzed by GC-MS
表1 不同浓度萨兹酒花葡萄酒挥发性成分GC-MS分析结果
Table 1 Analysis results of volatile components in wines with different concentration of Saaz-hops by GC-MS
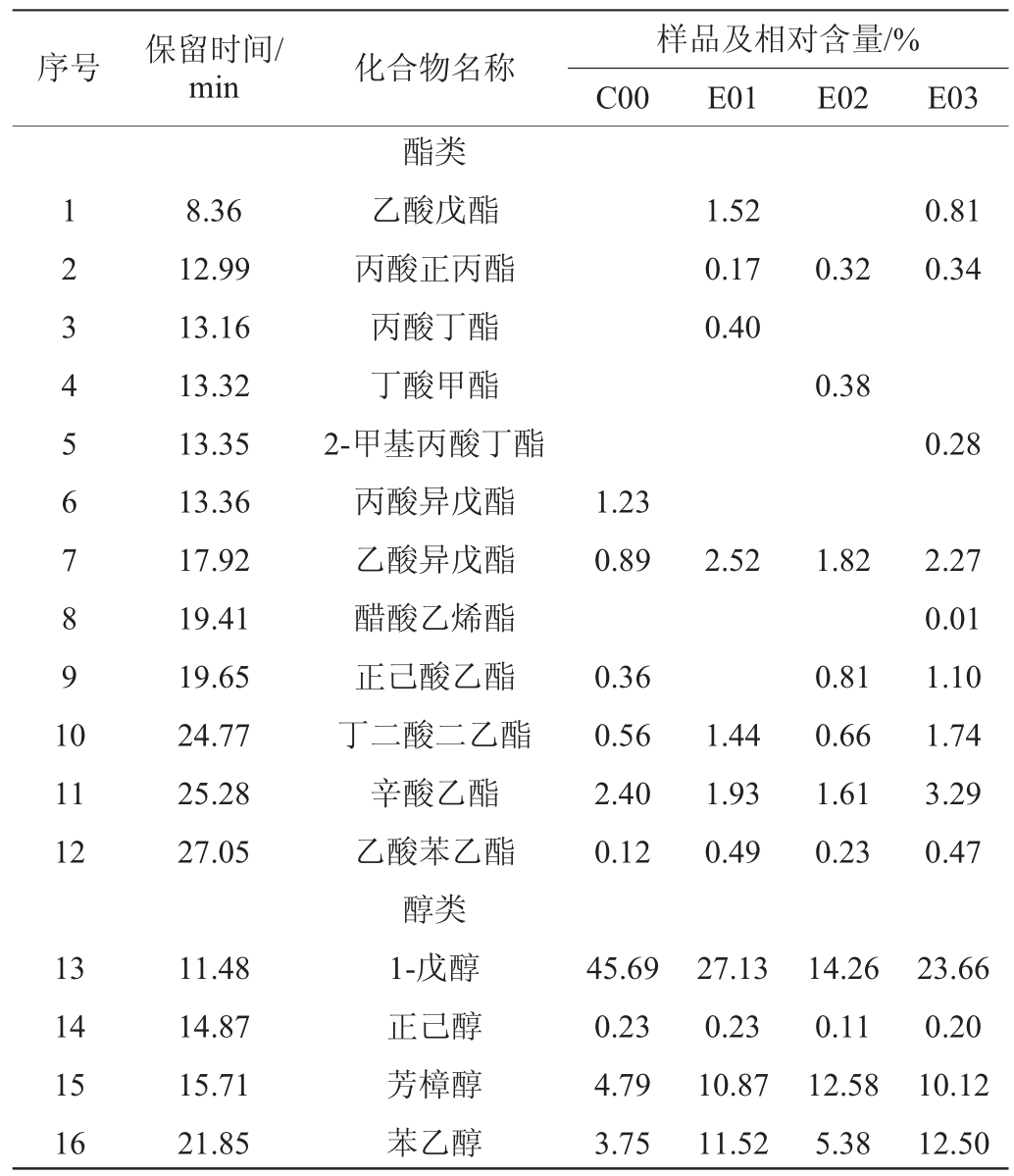
序号 保留时间/min 化合物名称样品及相对含量/%C00 E01 E02 E03 1 2 3 4 5 6 7 8 9 1 0 1.52 0.17 0.40 8.36 12.99 13.16 13.32 13.35 13.36 17.92 19.41 19.65 24.77 25.28 27.05酯类乙酸戊酯丙酸正丙酯丙酸丁酯丁酸甲酯2-甲基丙酸丁酯丙酸异戊酯乙酸异戊酯醋酸乙烯酯正己酸乙酯丁二酸二乙酯辛酸乙酯乙酸苯乙酯醇类1-戊醇正己醇芳樟醇苯乙醇0.32 0.81 0.34 0.38 0.28 1.23 0.89 2.52 1.822.27 0.01 1.10 1.74 3.29 0.47 11 12 0.36 0.56 2.40 0.12 1.44 1.93 0.49 0.81 0.66 1.61 0.23 13 14 15 16 11.48 14.87 15.71 21.85 45.69 0.23 4.79 3.75 27.13 0.23 10.87 11.52 14.26 0.11 12.58 5.38 23.66 0.20 10.12 12.50
续表
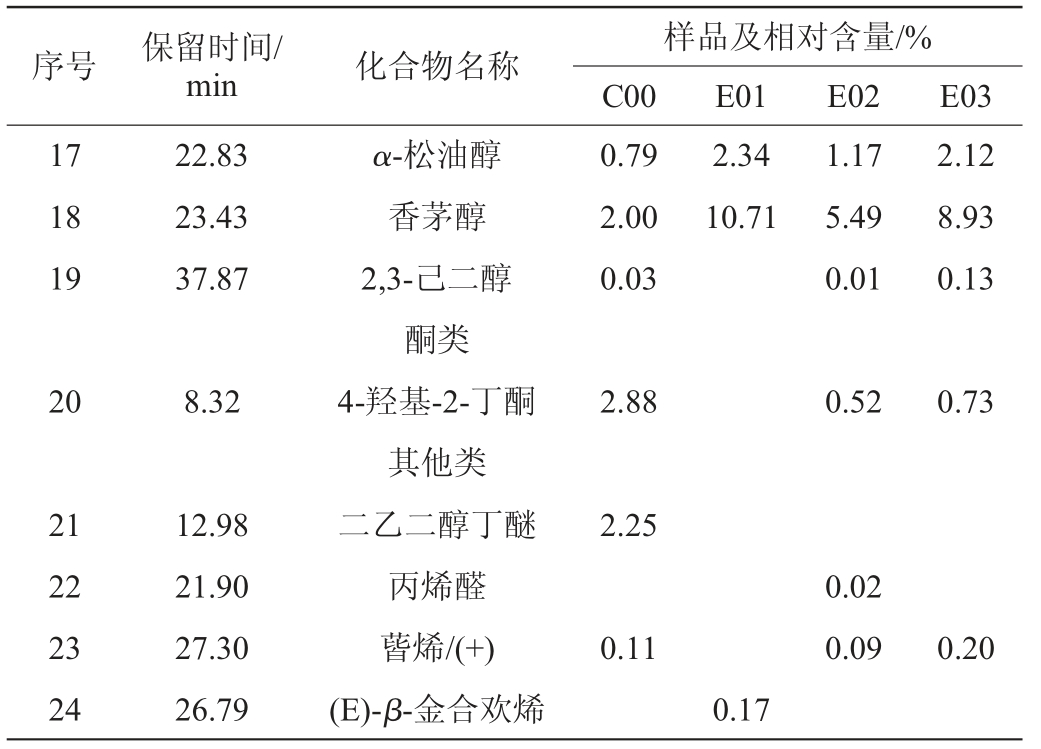
样品及相对含量/%C00 E01 E02 E03序号 保留时间/min 化合物名称17 18 19 22.83 23.43 37.87 0.79 2.00 0.03 2.34 10.71 1.17 5.49 0.01 2.12 8.93 0.13 20 8.32 2.88 0.52 0.73 2.25 21 22 23 24 12.98 21.90 27.30 26.79 α-松油醇香茅醇2,3-己二醇酮类4-羟基-2-丁酮其他类二乙二醇丁醚丙烯醛蒈烯/(+)(E)-β-金合欢烯0.11 0.02 0.09 0.20 0.17
由图3可知,添加了酒花的萨兹酒花葡萄酒酒样与空白酒样可以明显区分。由表1可知,4种不同浓度的萨兹酒花葡萄酒的挥发性成分物质共鉴定出24种,其中酯类12种、醇类7种、酮类1种、其他类4种。在酒样C00中共检测出16种挥发性物质,包括6种酯(5.56%)、7种醇(57.28%)、1种酮(2.88%)、2种其他类(2.36%);酒样E01共检测出14种挥发性物质,包括7种酯(8.47%)、6种醇(62.80%)、1种其他类(0.17%);酒样E02共检测出17种挥发性物质,包括7种酯(5.83%)、7种醇(39.00%)、1种酮(0.52%)、2种其他类(0.11%);E03共检测出18种挥发性物质,包括9种酯(10.31%)、7种醇(57.66%)、1种酮(0.73%)、1种其他类(0.20%)。对比空白组,萨兹酒花的加入提高了葡萄酒中醇类和酯类的百分含量。萨兹酒花葡萄酒的挥发性成分物质以醇类为主,其次是酯类和酮类等。与空白组相比,添加了萨兹酒花的葡萄酒中特有挥发性物质有乙酸戊酯、丙酸正丙酯、丙酸丁酯、丁酸甲酯、2-甲基丙酸丁酯、醋酸乙烯酯、丙烯醛、(E)-β-金合欢烯。
不同浓度的萨兹酒花葡萄酒的挥发性香气成分在种类和含量上有一定的差异,但也存在相似的香气物质,包括乙酸异戊酯、丁二酸二乙酯、辛酸乙酯、乙酸苯乙酯、1-戊醇、正己醇、芳樟醇、苯乙醇、α-松油醇、香茅醇等,其中有具有香蕉气味的乙酸异戊酯、水果香的丁二酸二乙酯、舒适花香的乙酸苯乙酯、花果香的芳樟醇、玫瑰和花粉香的苯乙醇、樟脑味和辛辣味的α-松油醇、玫瑰香气的香茅醇,由此可知,萨兹酒花葡萄酒香气以花果香为主。由于芳樟醇、α-松油醇、香茅醇是酒花特征香味化合物中的萜醇类物质及其衍生物,能赋予啤酒非常浓郁的酒花香气,且芳樟醇数年来一直被认为是酒花香气中的“标志性化合物”[21]。在添加了酒花的样品中这三种化合物含量有明显提升,说明酒花特有香味在葡萄酒中得到了保留,以E01酒样最为明显,此浓度下酒花香味能更好的融入到葡萄酒中。
2.3 萨兹酒花葡萄酒挥发性成分相对含量对比
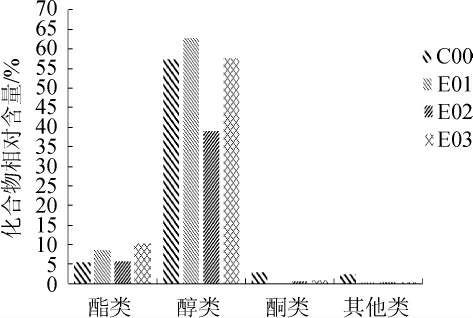
图4 不同浓度萨兹酒花葡萄酒各类挥发性物质相对含量比较
Fig. 4 Comparison of relative content of volatile substances in wines with different concentration of Saaz-hops
由图4可知,萨兹酒花葡萄酒香气成分中1-戊醇、芳樟醇等醇类物质含量接近55%,说明醇类物质是萨兹酒花葡萄酒主要香气成分,其主要源于发酵、氨基酸的转化及亚麻酸降解物的氧化[22-23];而酯类物质含量虽小,但阈值低,同样属于萨兹酒花葡萄酒中的特征香气,主要是在葡萄酒酿造过程中酯化反应生成[24],其中含量较高的酯类主要有:辛酸乙酯、乙酸异戊酯、丁二酸二乙酯等,4种酒样的酯类物质种类和含量存在着一定的差异,空白组C00中酯类物质含量较低,添加酒花的酒样的总酯类含量相对较高,可能是萨兹酒花的添加对葡萄酒中酯类物质的产生过程有促进作用。
2.4 香气成分建模验证分析
参照沈静等[25]的主成分建模方法对萨兹酒花葡萄酒香气品质进行进一步验证分析。将所有检测到的气体分为醇类(X1)、醚类(X2)、酯类(X3)、醛类(X4)、酮类(X5)、萜烯类(X6)6种香气类型。对这6种挥发性成分进行主成分分析,各酒样中的6类挥发性成分的特征值及方差贡献率见表2,主成分因子载荷矩阵见表3,标准化后主成分综合得分见表4。
表2 主成分的特征值及贡献率
Table 2 Eigenvalues and contribution rates of principal components
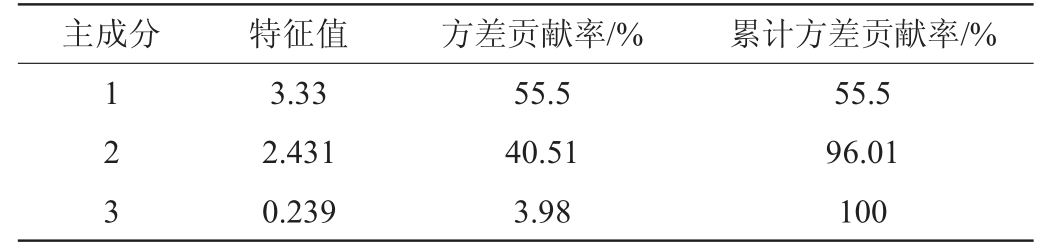
主成分 特征值 方差贡献率/% 累计方差贡献率/%1 2 3 3.33 2.431 0.239 55.5 40.51 3.98 55.5 96.01 100
由表2可知,前三个主成分的累计方差贡献率达100%,可以有效解释所有变量的原有信息,故选用这3个主成分作为香气数据分析的有效成分。第一主成分的方差贡献率为55.5%,主要反应酯类、萜烯类和醇类的变异信息;第二主成分的方差贡献率占总变异信息的40.51%,主要反应醚类和酮类的变异信息。
表3 主成分因子荷载矩阵
Table 3 Load matrix of principal components factors
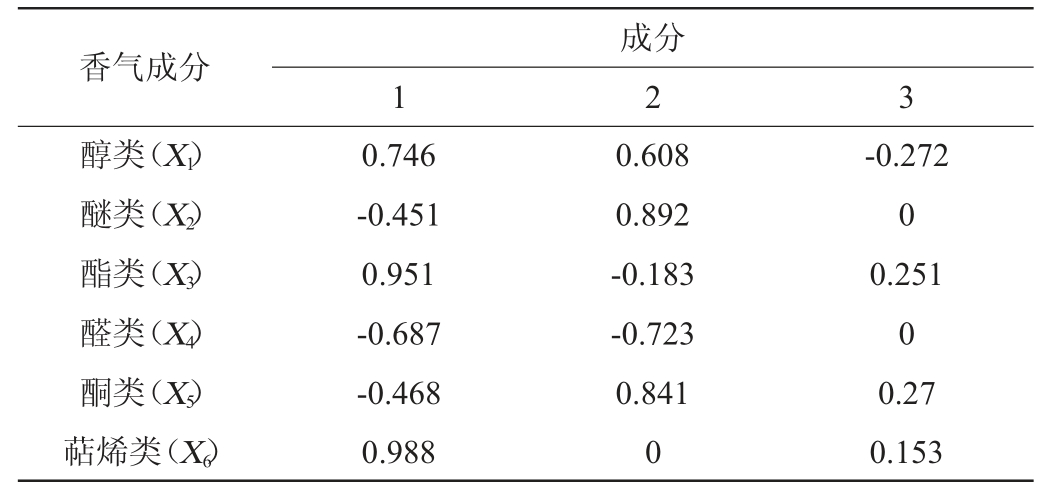
香气成分醇类(X1)醚类(X2)酯类(X3)醛类(X4)酮类(X5)萜烯类(X6)1成分2 3 0.746-0.451 0.951-0.687-0.468 0.988 0.608 0.892-0.183-0.723 0.841 0-0.272 0 0.251 0 0.27 0.153
由表3可知,前3个主成分可以解释不同酒样香气中100%的变异信息,根据3个主成分的特征向量,可以用F1、F2、F3这三个新的综合指标代替原来6种香气成分,进行香气品质综合评价,得到香气化合物的线性关系式:
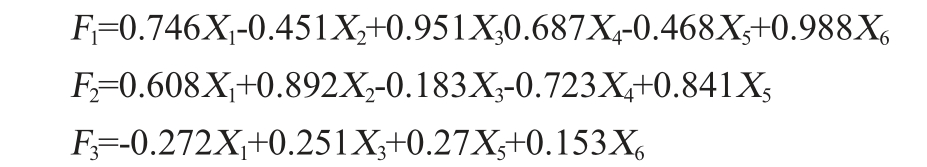
式中:F1、F2、F3分别代表综合主成分值
用F1、F2、F3的方差贡献率作为权重数计算主成分因子的权重,计算公式如下:
计算得到主成分因子1、2、3的权重为0.555、0.405、0.040。得到综合评价函数F的表达式为:F=0.555F1+0.405F2+0.040F3。
表4 标准化后主成分综合得分
Table 4 Synthetic scores of principal components after standardization
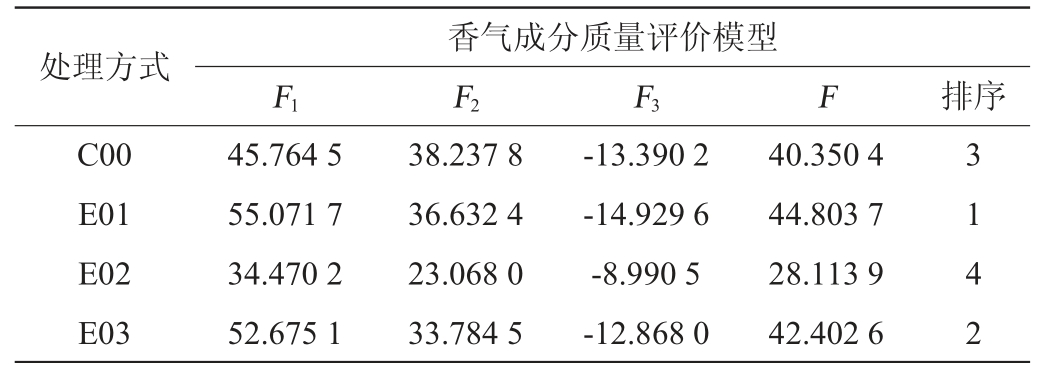
处理方式C00 E01 E02 E03香气成分质量评价模型F1 F2 F3 F 排序45.764 5 55.071 7 34.470 2 52.675 1 38.237 8 36.632 4 23.068 0 33.784 5-13.390 2-14.929 6-8.990 5-12.868 0 40.350 4 44.803 7 28.113 9 42.402 6 3 1 4 2
由表4可知,第一主成分得分最高的是E01处理的葡萄酒,其次是E03处理的葡萄酒,第二主成分得分最高的为C00空白样品,第三主成分得分最高的是E02处理的葡萄酒。综合评价得分中E01的酒花葡萄酒得分最高,其次为E03、C00、E02。结果表明,一定浓度的酒花能使葡萄酒产生更好的香气品质,但酒花浓度大小的影响并不呈现出规律性。
3 结论
通过对不同酒样进行电子鼻检测,结果表明电子鼻对不同浓度酒花葡萄酒的样品香气差异可以进行有效区分和识别,添加了萨兹酒花的酒样在电子鼻PCA分析上明显与空白样品分布不同,说明添加了酒花的葡萄酒产生了不同于空白样品的风味。此外,酒样间的差异可能是由于TA/2和P10/1传感器的响应值不同引起。GC-MS的定量分析结果表明,4个酒样中检测出24种香气成分,萨兹酒花的加入整体提高了葡萄酒中酯类和醇类的百分含量,促进了酯类物质的合成,新增加酯类物质有乙酸戊酯、丙酸正丙酯、丙酸丁酯、丁酸甲酯、2-甲基丙酸丁酯、醋酸乙烯酯。萜醇类物质是啤酒酒花香气最重要提供者,添加了酒花的酒样中萜醇类物质的百分含量增加明显,说明酒花原有香气特点在葡萄酒中得以保留,不同浓度的酒花葡萄酒酒样保留程度存在差异。通过主成分及建模验证分析,E01处理(添加0.5 g/L萨兹酒花)样品的香气成分质量评价最高,进一步验证在E01处理萨兹酒花对葡萄酒的风味起到了一定的积极作用。该结果为后期进一步剖析酒花葡萄酒的骨架香气体系奠定了基础,同时也为酿造优质酒花葡萄酒的浓度选择提供了一些参考依据。
[1]关雪芹.酒花香味物质在啤酒酿造和储存过程中风味演变的研究[D].济南:齐鲁工业大学,2019.
[2]全巧玲,江伟,王德良,等.酒花香气成分的检测及富含典型酒花香气啤酒的试验研究[J].啤酒科技,2013(2):28-36.
[3]黄琳,许忠平,闫菲,等.蜂蜜艾尔精酿啤酒酿造工艺研究[J].中国酿造,2019,38(3):134-138.
[4]褚洋洋.俄式面包——大列巴制作工艺的探讨[J].食品安全导刊,2015,9(8):66-67.
[5]敬思群,潘杨.乳酸菌发酵红枣酒花饮料的研究[J].食品科技,2007,33(1):156-160.
[6]李莉,易醒,肖小年,等.啤酒花口香糖的研制[J].江西食品工业,2010,23(1):43-45.
[7]CAPONE S,TUFARIELLO M,FRANCIOSO L,et al.Aroma analysis by GC/MS and electronic nose dedicated to Negroamaro and Primitivo typical Italian Apulian wines[J].Sensor Actuat B-Chem,2013,179:259-269.
[8] LIN J, ZHANG P, PAN Z, et al. Discrimination of oolong tea (Camellia sinensis) varieties based on feature extraction and selection from aromatic profiles analysed by HS-SPME/GC-MS[J].Food Chem,2013,141(1):259-265.
[9]刘丹,何鑫,李涛,等.不同品种脂臀羊尾脂品质的比较分析[J].现代食品科技,2019,35(4):244-249,300.
[10]陈明,高珊,王瑞琦,等.HS-SPME-GC-MS 分析蛇龙珠葡萄酒发酵过程中香气成分变化[J].食品工业,2018,39(9):164-166.
[11]刘琨毅,王琪,郑佳,等.基于HS-SPME-GC-MS 剖析三种柑橘-葡萄酒的香气成分[J].中国食品添加剂,2017(12):72-78.
[12]吴燕燕,王悦齐,李来好,等.基于电子鼻与HS-SPME-GC-MS 技术分析不同处理方式腌干带鱼挥发性风味成分[J].水产学报,2016,40(12):1931-1940.
[13]张谦益,包李林,熊巍林,等.电子鼻在两种类型浓香菜籽油识别中的应用[J].中国油脂,2018,43(10):151-153.
[14]段丽丽,武晓影,汤思忆,等.不同酒花对葡萄酒感官品质的影响[J].中国酿造,2019,38(1):94-98.
[15]CHENG H,QIN Z H,GUO X F,et al.Geographical origin identification of propolis using GC-MS and electronic nose combined with principal component analysis[J].Food Res Int,2013,51(2):813-822.
[16]张薇薇,张秀玲.基于主成分分析和聚类分析的苹果香气成分比较及品种分类研究[J].食品工业科技,2018,39(17):217-224.
[17]陈辰,鲁晓翔,张鹏,等.电子鼻结合GC-MS 检测玫瑰香葡萄贮后货架期内挥发性物质的变化[J].现代食品科技,2015,31(10):313-320.
[18]李俊星,钟玉娟,罗剑宁,等.基于电子鼻与HS-SPME/GC-MS 技术的香芋南瓜果实香气物质解析[J].现代食品科技,2018,34(9):250-256,303.
[19] HADDI Z, HALAMI H, BARI N E, et al. Electronic nose and tongue combination for improved classification of Moroccan virgin olive oil profiles[J].Food Res Int,2013,54(2):1488-1498.
[20]董画,何雨,薛桂新.电子鼻技术对哈达山白酒中掺兑酒精的鉴别[J].中国酿造,2018,37(9):43-47.
[21]阿敏,陆健,张志军.里那醇在啤酒酒花风味建模中的作用[J].啤酒科技,2011(5):71-73.
[22]HERNÁNDEZ-ORTE P,CERSOSIMO M,LOSCOS N,et al.The development of varietal aroma from non-floral grapes by yeasts of different genera[J].Food Chem,2008,107(3):1064-1077.
[23]刘晶,李华,陶永胜,等.不同酿造工艺对两性花毛葡萄NW196 葡萄酒挥发性物质的影响[J].食品科学,2013,34(10):117-121.
[24]LEE J W,KANG S A,CHEONG C.Quality characteristics of distilled alcohols prepared with different fermenting agents[J].J Kor Soc Appl Biol Chem,2015,58(2):275-283.
[25]沈静,杜若曦,魏婷,等.干制方式对鲜食枣脆片香气品质的影响[J].食品科学,2017,38(18):131-137.