刺葡萄(Vitis davidii var.davidii)是葡萄属东亚群下的一个种,为我国南方主要野生普通品种之一[1],是我国特有的珍贵野生葡萄品种[2]。由于刺葡萄的枝条上密布皮刺,故称刺葡萄[3]。刺葡萄对于生长环境的适应性非常强,具有较好的高温、高湿耐受性,抗病能力强,栽培上施用农药较少,深得消费者喜爱[4]。“紫秋”是从我国南方野生刺葡萄资源中选育出来的栽培品种[5-6],与其他葡萄相比,刺葡萄果粒小、果皮厚,酸度高,其适合于加工成其他产品,而目前刺葡萄大多数主要用于鲜食[7-8],存在附加值低、产品单一的问题。目前酿酒技术中,多数以引入酵母酿造,但引入酵母由于外界条件的变化,在刺葡萄酒酿造过程中并不一定能完全表现出其优良性状,或不能完全体现产地刺葡萄酒的品质和特色[9-10]。王瑞琛等[11]从自然发酵刺葡萄酒中筛选得到1株发酵性能良好的酵母菌株,而由于地域的差异,刺葡萄营养成分的差异,筛选的刺葡萄酒酵母并不适用于刺葡萄酒的生产。
基于此,本试验拟从铜仁区域刺葡萄种植基地的土壤中采集试验样品,从中分离纯化获取酵母菌株,筛选出适合铜仁区域刺葡萄酒酿造的酿酒酵母(Saccharomyces cerevisiae),对改善刺葡萄酒品质有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
刺葡萄园土壤样品:贵州省铜仁市川硐镇坞泥刺葡萄园。
1.1.2 试剂
乙醇(分析纯):山西艳阳升华有限公司;无水葡萄糖、柠檬酸(均为分析纯):天津市大茂化学试剂厂;偏重亚硫酸钾(分析纯):山东西亚化学工业有限公司;氯化钠(分析纯):成都金山化学试剂有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液(固)体培养基、WL营养琼脂培养基:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
SPX-150恒温培养箱:金坛市三和仪器有限公司;HZQQA恒温振荡培养箱:苏州威尔实验用品有限公司;SHA-B数显水浴恒温振荡器:北京科伟永兴仪器有限公司;DHG-9070A电热鼓风干燥箱:常州普天仪器制造有限公司;YXQLS-100G高压蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;JH-1超净工作台:安徽杰克欧德实验室设备有限公司。
1.3 实验方法
1.3.1 酵母菌株的分离
称取10 g土样于无菌三角瓶中,加入200 mL无菌水,28 ℃、200 r/min条件下培养20 min,制成菌落悬液。在无菌操作下,使用10倍稀释法[12-14]进行梯度稀释,选取稀释度为10-3、10-4、10-5的稀释液涂布于YPD固体培养基,28 ℃恒温培养48 h。以其菌落颜色、直径大小、透明度、厚薄程度等[15]选择典型酵母菌落,多次划线纯化,得到单菌落。将分离纯化的酵母菌分别接种到YPD斜面培养基上,28 ℃条件下培养48 h,转至冰箱4 ℃保存。
1.3.2 酿酒酵母的筛选
在无菌条件下,将筛选出的酵母菌株接种于YPD液体培养基中,28 ℃、200 r/min条件下培养24 h[16]。取0.2 mL菌液接种到WL营养琼脂培养基中,28 ℃条件下培养5 d,观察记录菌落的颜色、形态特征,并对筛选得到的菌株进行分类,分类依据见表1[17-19]。
表1 WL营养琼脂培养基上酵母菌的分类依据
Table 1 Basis of classification for yeasts on WL nutrient agar media

菌种 菌落颜色 菌落形态酿酒酵母(Saccharomyces cerevisiae)戴尔有孢圆酵母(Torulaspor delbruekii)葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)路氏类酵母(Saccharomycodes ludwigii)粟酒裂殖酵母(Schizosaccharomyces pombe)红酵母(Rhodutorula species)全美梅氏酵母(Metschnikowia pilcheirma)膜璞毕赤酵母(Pichiamem branefaciens)克鲁维毕赤酵母(Pichia kluyveri)异常汉逊酵母(Hansenula anomala)中间型酒香酵母(Brettanomyces intermedius)拜耳结合酵母(Zygosaccharomyces bailli)假丝酵母(Candida sp.)奶油色带绿色奶油色深绿色鲜绿色深绿色红色奶油色,稍带红色,底部红色至棕色绿色,稍带蓝色白色带绿色奶油色至灰蓝色奶油色奶油色中央奶油色,边缘绿色球形突起,表面光滑,不透明、奶油状球形突起,表面光滑,不透明、奶油状平坦,表面光滑,不透明、黄油状球形突起,表面光滑,不透明、奶油状菌落很小,表面光滑,不透明、黄油状球形突起,表面光滑,粘稠、黄油状菌落小,突起,面粉状较高的突面,表明褶皱,面粉状扁平,表面褶皱,粗糙,中间火山状平坦,表面光滑,奶油状菌落很小,较高的圆呈顶状突起,表面光滑,奶油状菌落很小,较高的圆呈顶状,表面光滑,奶油状扁平、表面光滑,不透明
1.3.3 酿酒酵母耐受性研究[20-21]
将筛选得到的酿酒酵母菌株接种于乙醇体积分数分别为10%、12%、14%、16%、18%;葡萄糖质量浓度分别为200 g/L、300 g/L、400 g/L、500 g/L、600 g/L;柠檬酸质量浓度分别为10 g/L、15 g/L、20 g/L、25 g/L、30 g/L;温度分别为5 ℃、10 ℃、15 ℃、35 ℃、45 ℃、55 ℃;SO2质量浓度分别为100 mg/L、150 mg/L、200 mg/L、250 mg/L、300 mg/L的YPD液体培基,28 ℃条件下静置培养7 d。分别取0.2 mL菌液接种于YPD固体培养基,28 ℃条件下恒温培养3 d,观察并记录平板上菌落的生长情况,分别考察菌株的乙醇、糖、酸、温度及SO2耐受性。
2 结果与分析
2.1 酵母菌株的分离鉴定
经过YPD平板涂布以及多次划线培养后,根据其菌落颜色、直径大小、透明度、厚薄程度,从刺葡萄园土壤中初步分离筛选得到10株酵母菌,并命名为TR-1、TR-2、TR-3、TR-4、TR-5、TR-6、TR-7、TR-8、TR-9、TR-10,其菌落形态见图1A。将10株酵母菌分别接种于WL营养琼脂培养基中,28 ℃条件下培养5 d后对其菌落颜色、形态特征进行观察,结果见图1B。
由图1A可知,菌株TR-2、TR-3、TR-4、TR-5、TR-6、TR-7、TR-8、TR-9、TR-10这9株菌株的菌落形态均为表面光滑、湿润、粘稠,易挑取,菌落质地均匀,正反面和边缘、中央部位的颜色均一、呈乳白色,其中菌株TR-2、TR-6、TR-10有酒精味散发。菌株TR-1的菌落形态表面光滑、湿润、易挑取、菌落质地均匀、中央部位的颜色均一、呈淡红色。
由图1B可知,菌株TR-2、TR-3、TR-6、TR-7、TR-10的菌落颜色为奶油色带绿色,菌落形态为球形突起,表面光滑,不透明、奶油状;菌株TR-4、TR-9的菌落颜色为深绿色,菌落很小,表面光滑,不透明、黄油状;菌株TR-1、TR-5、TR-8的菌落颜色为白色带绿色,菌落形态为扁平、表面褶皱、粗糙、中间火山状褶皱。参照表1,对其进行分类,结果见表2。
由表2可知,将分离得到的10株酵母菌株分为3种酵母,其中,菌株TR-2、TR-3、TR-6、TR-7、TR-10均为酿酒酵母(Saccharomyces cerevisiae),菌株TR-4、TR-9均为粟酒裂殖酵母(Schizosaccharomycespombe),菌株TR-1、TR-5、TR-8均为克鲁维毕赤酵母(Pichia kluyver)。
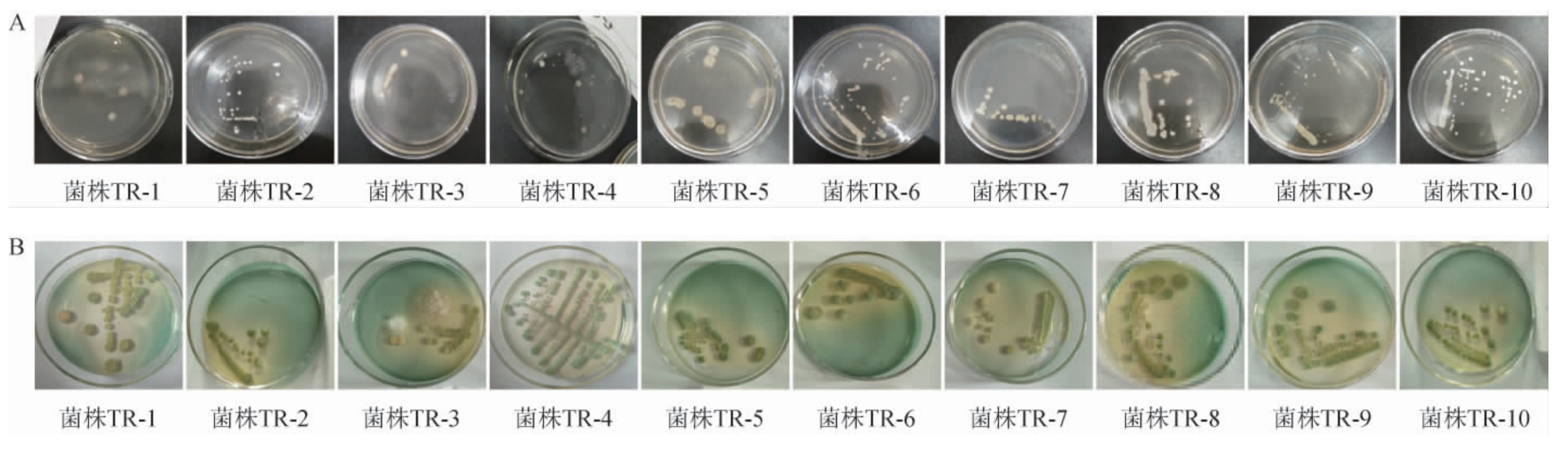
图1 10株酵母菌菌株在PDA(A)及WL营养琼脂(B)培养基上的菌落特征
Fig. 1 Colony characteristics of 10 yeast strains on the PDA(A) and WL nutritional agar (B) media
表2 WL营养琼脂培养基筛选酵母分类结果
Table 2 Classification results of yeasts screened by WL nutrient agar media
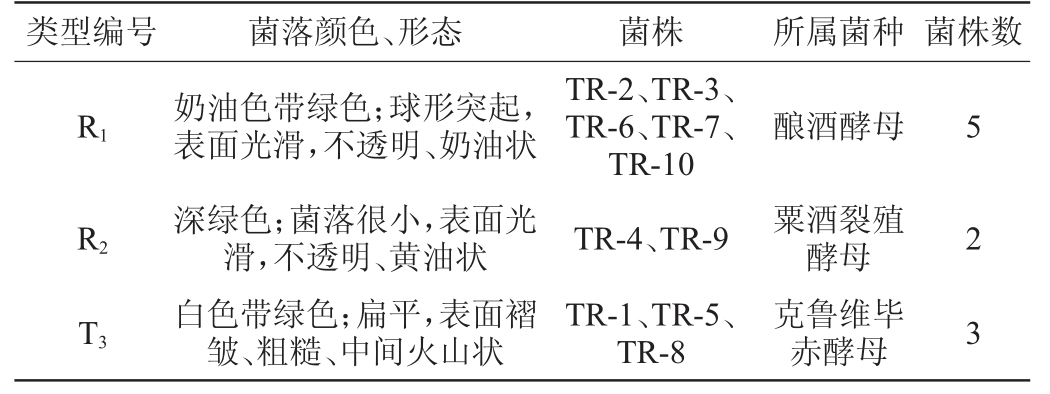
类型编号 菌落颜色、形态 菌株 所属菌种 菌株数R1酿酒酵母R2 T3奶油色带绿色;球形突起,表面光滑,不透明、奶油状深绿色;菌落很小,表面光滑,不透明、黄油状白色带绿色;扁平,表面褶皱、粗糙、中间火山状TR-2、TR-3、TR-6、TR-7、TR-10 TR-4、TR-9 TR-1、TR-5、TR-8粟酒裂殖酵母克鲁维毕赤酵母5 2 3
2.2 酿酒酵母的耐受性研究
2.2.1 乙醇耐受性实验
酿酒酵母对高浓度酒精胁迫的耐性是葡萄酒酿造过程中的重要特性,耐酒精能力强可以使酿造过程发酵完全,提高葡萄酒的酒精度[22]。酒精对细胞的抑制作用很复杂,主要表现在抑制酵母的增殖速度、存活性和发酵力3个方面[22]。5株酿酒酵母菌株的乙醇耐受性实验结果见表3。
表3 5株酵母菌株的乙醇耐受性
Table 3 Alcohol tolerance of 5 yeast strains
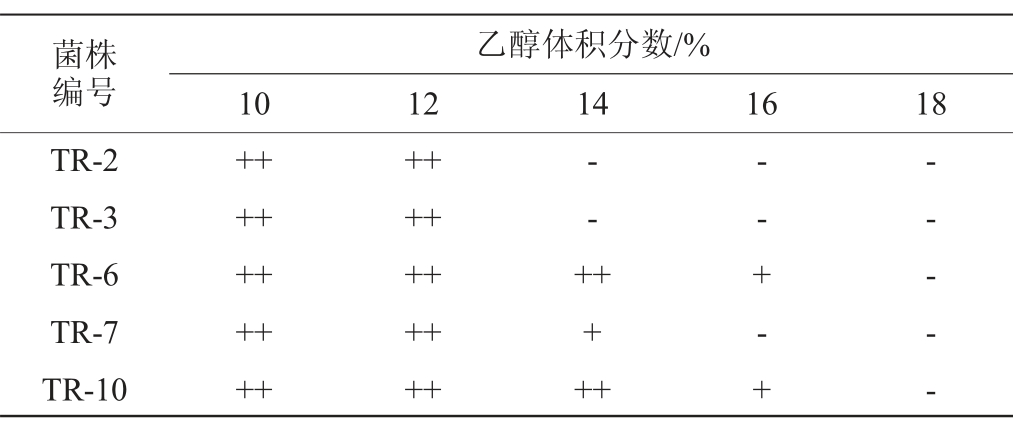
注:“++”表示菌株生长良好(菌落数量直径大,且菌落数量多);“+”表示菌株生长一般(菌落直径大,但菌落数量少);“-”表示不生长。下同。
菌株编号TR-2 TR-3 TR-6 TR-7 TR-10乙醇体积分数/%10 12 14 16 18++++++++++++++++++++-- +++++-- + - +-- - - -
由表3可知,5株酵母菌株均能在乙醇体积分数为10%、12%的培养基中生长,并且生长良好。随着乙醇体积分数的增加,5株酵母菌株对不同体积分数乙醇的耐受性有明显的差异,其中菌株TR-7可在乙醇体积分数为14%的培养基中生长,菌株TR-6、TR-10可在乙醇体积分数高达16%的培养基中生长。由此可知,菌株TR-6、TR-10的乙醇耐受性最好。
2.2.2 糖耐受性实验
葡萄酒酿造过程中,糖是酒精发酵的基质,也是酵母赖以生存的能源物质,但是高浓度糖会对酵母有抑制作用[8]。5株酵母菌株的糖耐受糖性实验结果见表4。由表4可知,在葡萄糖质量浓度为200~300 g/L时,5株酵母菌株生长良好,但随着葡萄糖质量浓度的增加各菌株的生长表现出一定的差异性,当葡萄糖质量浓度为500 g/L时,只有菌株TR-6、TR-10可以生长,当葡萄糖质量浓度为600 g/L时,只有菌株TR-10生长。由此可知,菌株TR-6、TR-10的糖耐受性较好。
表4 5种酵母菌株的糖耐受性
Table 4 Glucose tolerance of 5 yeast strains

菌株编号TR-2 TR-3 TR-6 TR-7 TR-10葡萄糖质量浓度/(g·L-1)200 300 400 500 600+++++++++++++++++++++++++++-- + - +-- - - +
2.2.3 酸耐受性实验
5株酵母菌株的耐酸性实验结果见表5。
表5 5株酵母菌株的酸耐受性
Table 5 Acid tolerance of 5 yeast strains

菌株编号TR-2 TR-3 TR-6 TR-7 TR-10柠檬酸质量浓度/(g·L-1)10 15 20 25 30+++++++++++++++++++++++++++++-+ ++- ++-- + - ++
由表5可知,当柠檬酸质量浓度为10~20 g/L时,5株酵母菌株均能生长,且菌株TR-3、TR-6、TR-7、TR-10生长良好;当柠檬酸质量浓度为25 g/L时,仅有菌株TR-3、TR-6、TR-10能生长,且菌株TR-6、TR-10生长良好;当柠檬酸质量浓度为30 g/L时,仅有菌株TR-6和TR-10能生长,且菌株TR-10生长良好。由此可知,菌株TR-3、TR-6、TR-10的酸耐受性较好。
2.2.4 温度耐受性实验
5株酵母菌株的温度耐受性实验结果见表6。由表6可知,当培养温度为5 ℃时,菌株TR-6、TR-7、TR-10可以生长,但生长一般;当培养温度为10~35 ℃时,5株酵母菌株均能生长,但随着培养温度的升高,这5株酵母菌株对高温耐受性表现出一定差异,当温度为45 ℃时,仅有菌株TR-3、TR-6、TR-10可以生长,且菌株TR-6生长良好;当培养温度为55 ℃时,所有菌株均不能生长。由此可知,菌株TR-6和TR-10既可在低温为5 ℃条件下生长,又可耐受45 ℃,温度耐受性较好。
表6 5株酵母菌株的温度耐受性
Table 6 Temperature tolerance of 5 yeast strains
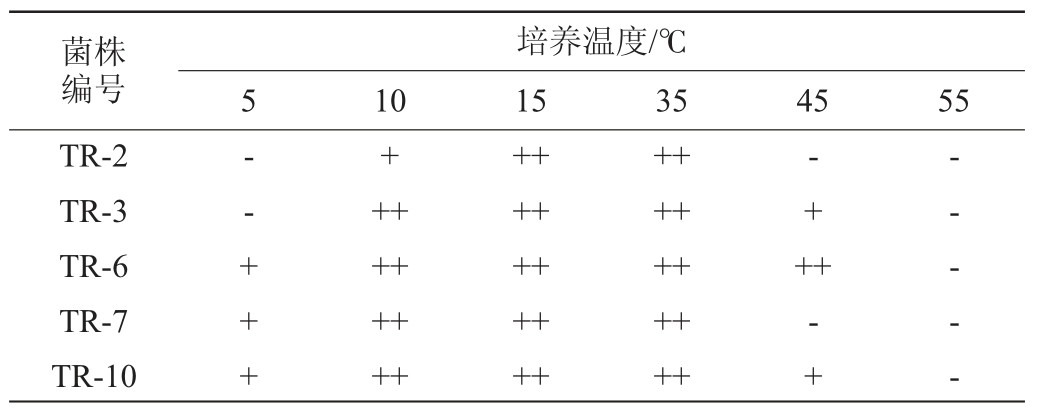
菌株编号TR-2 TR-3 TR-6 TR-7 TR-10培养温度/℃5 10 15 35 45 55--++++++++++++++++++++++++++++++++-+++-+-- - - -
2.2.5 SO2耐受性实验
在葡萄酒酿过程中,添加适量SO2的目的是抑制有害微生物的生长、阻止葡萄汁的氧化作用、加速胶体的凝集以及有利于葡萄汁澄清,在酿造过程中被广泛使用[9]。5株酵母菌株的SO2耐受性实验结果见表7。由表7可知,当SO2质量浓度为100~200 mg/L时,5株菌株均生长良好;当SO2质量浓度为250 mg/L时,菌株TR-3不能生长;当SO2质量浓度为300 mg/L时,只有菌株TR-10可以生长。由此可知,菌株TR-2、TR-6、TR-7、TR-10这四株的SO2耐受性较强。
表7 5株酵母菌株的SO2耐受性
Table 7 SO2 tolerance of 5 yeast strains

菌株编号TR-2 TR-3 TR-6 TR-7 TR-10 SO2质量浓度/(g·L-1)100 150 200 250 300+++++++++++++++++++++++++++++++-++++-- - - +
综上,菌株TR-6和TR-10的耐受性较好,均分别能在乙醇体积分数为16%、葡萄糖质量浓度为500 g/L、柠檬酸质量浓度为30 g/L、SO2质量浓度为250 mg/L的YPD液体培养基和高温45 ℃、低温5 ℃条件下生长繁殖。
3 结论
从铜仁市川硐镇坞泥刺葡萄园土壤中共分离、筛选得到5株酿酒酵母(Saccharomyces cerevisiae),其中菌株TR-6和TR-10的耐受性较好,均分别能在乙醇体积分数为16%、葡萄糖质量浓度为500 g/L、柠檬酸质量浓度为30 g/L、SO2质量浓度为250 mg/L的YPD液体培养基和高温45 ℃、低温5 ℃条件下生长繁殖,为后续选育出适合酿造刺葡萄酒的酵母菌奠定基础,对今后酿造具有独特风格的刺葡萄酒及促进铜仁地区的刺葡萄资开发利用和产业化生产有非常重要的意义。
[1]刘婷,王燕,李韵,等.响应面法优化超临界CO2 萃取刺葡萄酒渣中白藜芦醇工艺[J].食品工业科技,2015,36(4):193-198
[2]祝音洁,郭思江,李斯屿,等.刺葡萄酒发酵过程中几类多酚成分的含量变化分析[J].中国酿造,2016,35(3):45-51.
[3]王美军,黄乐,刘昆玉,等.刺葡萄的物候期观察及扦插生根特性[J].湖南农业大学学报(自然科学版),2016,42(4):370-373.
[4]林尧忠,包日在,齐陈红.刺葡萄营养学特性及种植要点[J].中国果菜,2018,38(1):59-61.
[5]李桂永,李枝清,吴瑞章,等.南方刺葡萄新品种“紫秋”的选育[J].中国南方果树,2007,36(1):59-60.
[6]周恒,万召娣,罗静.紫秋刺葡萄离体繁殖研究初报[J].贵州农业科学,2010,38(9):22-25.
[7]周恒,龙香菊,胡世珍,等.紫秋刺葡萄引种贵州铜仁的表现及主要栽培技术[J].中国南方果树,2010,39(3):82-83
[8]秦丹,熊兴耀,石雪晖,等.刺葡萄品质分析及加工性能研究[J].食品科技,2006,31(6):52-54.
[9]朱力,SIECZKOWSKI N,BELANCIC A,等.更完美的展现葡萄品种的个性——“品种酵母”的筛选和应用[J].中外葡萄与葡萄酒,2007(1):58-61.
[10]陈金丽,王异静,郭阳,等.葡萄酒酵母选育技术研究进展[J].中国酿造,2011,30(11):13-16.
[11]王瑞琛,伍婧,刘静,等.刺葡萄酿酒酵母菌株的分离与筛选[J].保鲜与加工,2013,13(3):47-50.
[12]郭薇丹,刘薇丛,胡作民,等.抗鱼肉脂肪氧化的耐冷冻酵母筛选及鉴定[J].食品科学,2019,40(10):166-170.
[13]姚晓瑞宁,高飞飞,王斌,等.库尔勒香梨表皮酵母菌的筛选及耐受性的分析[J].中国酿造,2017,36(6):67-71.
[14]张莉,张兰,张玉,等.酿酒酵母菌株的筛选与发酵特性分析[J].河南农业科学,2018,47(6):144-148.
[15]巴尼特,佩恩,亚罗,等.酵母菌的特征与鉴定手册[M].青岛:海洋大学出版社,1991:68-171.
[16]蒋成,魏妙宏,刘路,等.猕猴桃果酒专用酵母的筛选与鉴定[J].食品与机械,2018,34(6):202-207.
[17]葛含静,杨苗苗.户太八号葡萄酒优势酿酒酵母的选育研究[J].食品研究与开发,2016,37(15):197-201.
[18]程雷,李梓,王军.葡萄自然发酵过程中酵母菌的研究[J].中国食品学报,2010,10(2):131-137.
[19]伍强,彭娟娟,余有贵,等.大湘西野生猕猴桃果肉中酵母菌的分离鉴定及其耐受性研究[J].中国酿造,2018,37(9):89-93.
[20]李豪,章霞,张静,等.草莓果酒酵母菌的筛选、鉴定及耐受性研究[J].中国酿造,2017,36(2):85-88.
[21]刘瑞,陈福生,张秀艳.橘园分离的非酿酒酵母的耐受性分析[J].中国酿造,2015,34(3):20-23.
[22]薛波,韩娜,侯敏,等.7 株葡萄野生酵母菌的特性研究[J].中国酿造,2009,28(10):24-26.