我国是农业大国[1],化肥年使用量占世界近40%,居世界第一位,超过了美国、印度的总和[2]。由于过量使用化肥,极大危及农产品质量安全和人体健康[3],因此传统的化肥已不能适应农业发展的需要,为实现农产品可持续发展,发展高效环保的生物有机肥势在必行[4]。
生物有机肥是特定功能微生物与动植物残体、农作物秸秆等为来源并经无害化处理、腐熟的有机物料复合而成的一类兼具微生物肥料和有机肥效应的肥料[5]。生物有机肥和饲料的原料主要来源于秸秆、豆粕、棉粕、菜籽饼、酒糟、醋糟、木薯渣、糖渣、糠醛渣、锯末、餐厨垃圾、菜市场尾菜等,由于纤维素不易被降解利用,因此现阶段国内施用生物有机肥的积极性不高,使用率相对较低[6-7]。
在生物有机肥的生产过程中,加入高酶活的菌种,能缩短有机肥的发酵周期,提高产品质量[8]。目前,自然分离的菌种产纤维素酶能力较低[9],其酶活很难满足大规模工业生产应用的需求[10]。诱变育种就是利用诱变剂加以处理,提高诱变对象的突变频率,最后通过相应的筛选方式来提高菌种能力,诱变育种主要分为物理诱变和化学诱变。其中物理诱变中以紫外线辐射的使用最为普遍,其他诱变因子则受到现阶段设备条件的限制,还未能大量普及。紫外线作为物理诱变用于工业微生物菌种的诱变处理具有悠久的历史,近几年紫外诱变依旧作为首选[11],化学诱变剂常用于处理迟变突变,对某特定的基因或核酸有选择性作用[12-13]。因此本研究从基因突变的角度出发,利用紫外和亚硝酸钠(NaNO2)设计单因素和正交试验获得复合诱变的最佳条件,选育得到遗传性状稳定的高产纤维素酶突变株,为高产纤维素酶菌种在绿色、环保农业中的开发尊定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
贝莱斯芽孢杆菌(Bacillus velezensis):本实验室从酒醅中筛选得到。
1.1.2 化学试剂
羧甲基纤维素钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、硫酸铵、氯化钠、磷酸二氢钠(均为分析纯)、琼脂粉(生化试剂):成都市科龙化工试剂厂;葡萄糖(生化试剂)、磷酸二氢胺、硫酸镁(均为分析纯):重庆川东化工集团有限公司;纤维素粉(生化试剂)、纤维素酶(10 000 U/mL):宁夏和氏璧生物技术有限公司。
1.1.3 培养基[14-15]
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)液体培养基:马铃薯200 g,葡萄糖20 g,定容至1 000 mL,121 ℃灭菌20min。
PDA固体培养基:PDA培养基中加入15~20 g琼脂粉。
羧甲基纤维素钠(sodium carboxymethylcellulose,CMCNa)培养基:KH2PO4 1g,(NH4)2SO4 1g,MgSO4·7H2O 0.15 g,CMC-Na 15 g,酵母粉1 g,琼脂20 g,pH 7.2,121 ℃灭菌20 min。
刚果红培养基:KH2PO4 0.5 g/L、(NH4)2SO4 2 g/L、琼脂18 g、MgSO4·7H2O 0.25 g/L、纤维素粉1.88 g/L、刚果红0.2 g/L,自然pH值,121 ℃灭菌20 min。
液体发酵培养基:CMC-Na 10 g,(NH4)2SO4 4 g,NaCl 1.25 g,KH2PO4 1 g,MgSO4 0.5 g,琼脂粉20 g,121 ℃灭菌20 min。
1.2 仪器与设备
STARTER2C pH计:奥豪斯仪器(上海)有限公司;T6紫外分光光度计:北京普析通用仪器有限责任公司;YXQLS-75S11压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;ME104E/02电子天平:托利多仪器(上海)有限公司;HWS-12电热恒温水浴锅:上海乔欣科学仪器有限公司;GZ-250-HS11恒温恒湿培养箱:韶关市广智科技设备有限公司;THZ-98A 恒温振荡器:上海一恒科学仪器有限公司。
1.3 方法
1.3.1 菌种的活化
将贝莱斯芽孢杆菌(Bacillus velezensis)接种到PDA培养基平板上,28 ℃条件下静置恒温培养2~3 d。
1.3.2 菌悬液的制备
将活化的贝莱斯芽孢杆菌(Bacillus velezensis)接种到PDA液体培养基中,28 ℃、150 r/min条件下振荡培养24 h。
1.3.3 生长曲线和酶活力曲线的绘制
将菌液接种至50 mL/250 mL液体发酵培养基中,采用光电比浊法测定原始菌株的生长曲线[9];菌株在28 ℃、150 r/min条件下发酵培养24 h,吸取2 mL菌液,12 000 r/min离心5 min,取上清液,即为粗酶液,每4 h在波长600 nm条件下测定吸光度值(OD600 nm值),并用DNS法测定CMC酶活[16],绘制贝莱斯芽孢杆菌(Bacillus velezensis)生长曲线和酶活力曲线。
纤维素酶活的测定[17]:取0.5 mL粗酶液,加入1.5 mL 1%CMC缓冲液,50 ℃水浴30 min,加入3 mL DNS溶液,沸水浴10 min,迅速冷却后定容至10 mL。对照组加0.5 mL灭活的粗酶液代替粗酶液,其他条件不变,于540 nm波长条件下测定OD540nm值。
纤维素酶活定义[18]:将每分钟由羧甲基纤维素钠水解成1.0 μg葡萄糖所需的酶量定义为一个酶活力单位(U/mL)。
1.3.4 复合诱变
(1)紫外诱变
用无菌水将培养好的菌液梯度稀释,取10-6梯度5 mL菌悬液于培养皿中;在暗室中先将紫外预热20 min,再将培养皿置于紫外灯20 cm处分别照射30 s、60 s、90 s、120 s、150 s、180 s、210 s、240 s后4 ℃冷藏2 h。避光条件下取60 μL菌液涂布于PDA固体培养基上,避光、28 ℃条件下静置培养2~3 d,计算不同紫外诱变时间对原始菌株的致死率,其计算公式如下:
(2)亚硝酸钠(NaNO2)诱变
将紫外诱变选出的菌种制成菌液进行NaNO2诱变,将诱变后的菌液稀释涂布于羧甲基纤维素钠平板上,与空白组对照计算致死率。
1.3.5 复合诱变条件优化
(1)单因素试验
NaNO2诱变时间:将1mL菌液加入1mL0.2mol/LNaNO2中,再加入1 mL pH 4.4醋酸缓冲液,28 ℃水浴,反应5 min、10 min、15 min、20 min、25 min、30 min后加入2 mL pH 8.6 Na2HPO4缓冲液,考察诱变时间对纤维素酶酶活的影响。
在此基础上依次考察NaNO2诱变温度(20℃、25℃、30℃、35 ℃、40 ℃)、NaNO2浓度(0.1 mol/L、0.2 mol/L、0.3 mol/L、0.4 mol/L、0.5 mol/L)对纤维素酶酶活的影响。
(2)正交试验
由于复合诱变是多因素相互作用对诱变效果影响较大,因此以单因素试验结果为依据,采用L9(33)正交设计试验,对影响致死率的几个因素进行设计,即以诱变温度(A)、诱变时间(B)和NaNO2浓度(C)为试验影响因素,以致死率为评价指标,正交试验因素与水平见表1。
表1 复合诱变条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for complex mutagenesis conditions optimization

水平 A 诱变温度/℃ B 诱变时间/min C NaNO2浓度/(mol·L-1)123 23 25 27 23 25 27 0.15 0.20 0.25
1.3.6 高产纤维素酶菌株的筛选
初筛:将复合诱变后的菌株接种到羧甲基纤维素钠培养基上,28 ℃、150 r/min条件下培养48 h。选取在培养基上长势好的菌株进行复筛。
复筛:选取在羧甲基纤维素钠培养基上长势较好的单菌落点接到PDA培养基培养,选取水解圈直径(D)/菌落直径(d)值大的菌株测定其纤维素酶酶活。
1.3.7 遗传稳定性试验
将复合诱变后纤维素酶活最高的突变株转接到羧甲基纤维素钠培养基上,28 ℃恒温培养24 h,连续传代培养10代。用DNS法测定隔代之间的酶活变化,考察诱变后菌株的稳定性。
1.3.8 数据处理与分析
采用SPSS19.0数据处理系统对正交试验数据进行一般线性模型分析,采用Origin 7.5进行图表的绘制。试验数据表示为“平均值±标准误差”(n=3)。
2 结果与分析
2.1 生物量和酶活力曲线
贝莱斯芽孢杆菌(Bacillus velezensis)生长曲线和酶活力曲线,结果见图1。
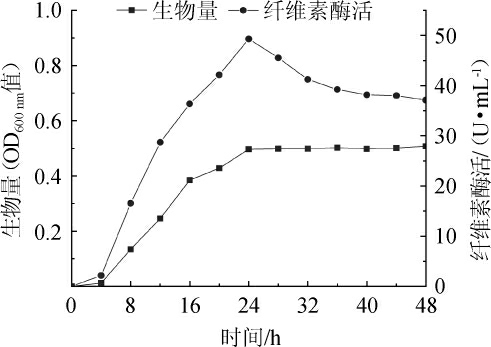
图1 贝莱斯芽孢杆菌生长曲线和酶活力曲线
Fig. 1 Growth curve and enzyme activity curve of Bacillus velezensis
由图1可知,贝莱斯芽孢杆菌在经过短暂迟缓期后,在前16 h处于对数期,菌体浓度增加速率快,16 h后进入稳定期,菌体浓度增长缓慢,24 h后菌种进入衰亡期,生长缓慢菌体浓度几乎保持不变。菌株在培养24 h之前,纤维素酶活随培养时间而增大;在培养24 h时纤维素酶活达到最高,达到49.31 U/mL;培养24 h后由于发酵液中底物消耗较多和产物的反馈抑制,酶活缓慢下降一段后达到平衡。因此,选择培养24 h的菌株作为出发菌进行紫外诱变。
2.2 紫外诱变
通过紫外对原始菌株进行诱变处理,根据不同紫外诱变时间的致死率,优化紫外处理时间,试验结果见图2。
由图2可知,对贝莱斯芽孢杆菌出发菌进行紫外诱变时,随着诱变时间的增加,菌株的致死率也随之增加。当紫外照射时间为150 s时,菌株的致死率达到85.4%,满足菌株正突变率最高的致死率范围(80%~90%)[20],此时诱变效果最佳。所以选择紫外诱变时间为150 s。
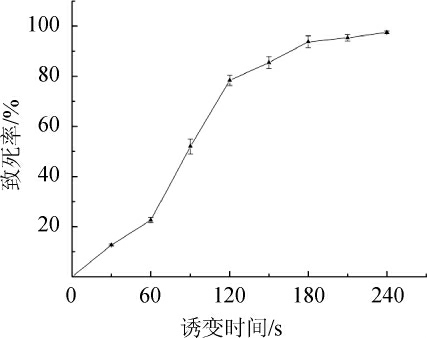
图2 贝莱斯芽孢杆菌紫外诱变致死率
Fig. 2 Lethality rate of Bacillus velezensis by ultraviolet mutagenesis
2.3 复合诱变条件优化单因素试验
2.3.1 不同NaNO2诱变时间对致死率的影响
用NaNO2对菌株进行诱变时,处理时间不同菌株基因发生突变的概率有差异,本研究在室温条件下用浓度为0.2 mol/L的NaNO2,根据不同诱变时间对菌种的致死率,选择最优范围进行正交试验,结果见图3。
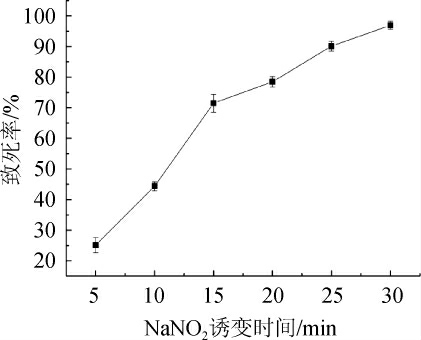
图3 不同NaNO2诱变时间对菌株致死率的影响
Fig. 3 Effect of different NaNO2 mutagenesis time on lethality rate of strains
由图3可知,随着NaNO2处理时间的增长,菌种的致死率增加,说明NaNO2处理对菌种有明显的致死性,菌株对NaNO2较敏感。当NaNO2诱变时间为25 min时,菌种的致死率达到90.1%。因此,选择NaNO2最佳诱变时间为25 min。
2.3.2 不同NaNO2诱变温度对致死率影响
对菌株进行诱变时,温度对诱变剂的诱变效果有一定影响,本研究通过用0.2 mol/L的NaNO2在不同温度下诱变处理菌种25 min,根据致死率优化NaNO2诱变温度,结果见图4。
由图4可知,在20~45 ℃范围内NaNO2对菌种进行诱变时,致死率随温度增加而增加。当温度在25~35 ℃时,温度处于细菌生长的最适温度范围,此时菌株对NaNO2较敏感,因此致死率增加最快。当诱变温度为25 ℃时,菌种致死率达到85.0%。当温度超过40℃,菌种受到高温和诱变剂的影响,致死率>97%。因此,选择NaNO2最佳诱变温度为25 ℃。
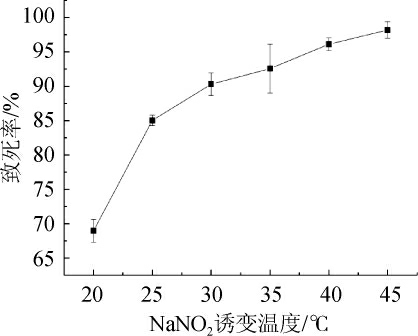
图4 不同NaNO2诱变温度对菌株致死率的影响
Fig. 4 Effect of different NaNO2 mutagenesis temperature on lethality rate of strains
2.3.3 不同NaNO2浓度对致死率的影响
用NaNO2对菌株进行诱变,在25 ℃条件下用不同浓度NaNO2诱变处理25 min,根据致死率优化NaNO2诱变浓度,结果见图5。
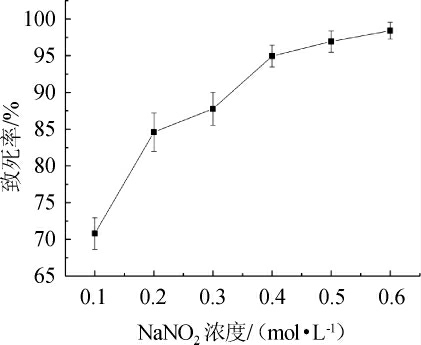
图5 不同NaNO2浓度对菌株致死率的影响
Fig. 5 Effect of different NaNO2 concentration on lethality rate of strains
由图5可知,菌种对NaNO2诱变敏感,在NaNO2浓度为0.1 mol/L时致死率达到70.8%。随NaNO2的浓度上升,菌种致死率持续升高,当NaNO2浓度为0.2 mol/L时,致死率达到87.8%。NaNO2浓度>0.4 mol/L后,受高浓度NaNO2的作用菌种几乎全部失活。因此,选择NaNO2最佳诱变浓度为0.2 mol/L。
2.3.4 复合诱变条件优化正交试验
在单因素试验基础上,采用L9(33)正交试验设计,选择诱变温度(A)、诱变时间(B)和NaNO2浓度(C)为试验影响因素,以致死率为评价指标进行正交试验,正交试验结果与分析见表2。
表2 复合诱变条件优化正交试验结果与分析
Table 1 Results and analysis of orthogonal tests for complex mutagenesis conditions optimization
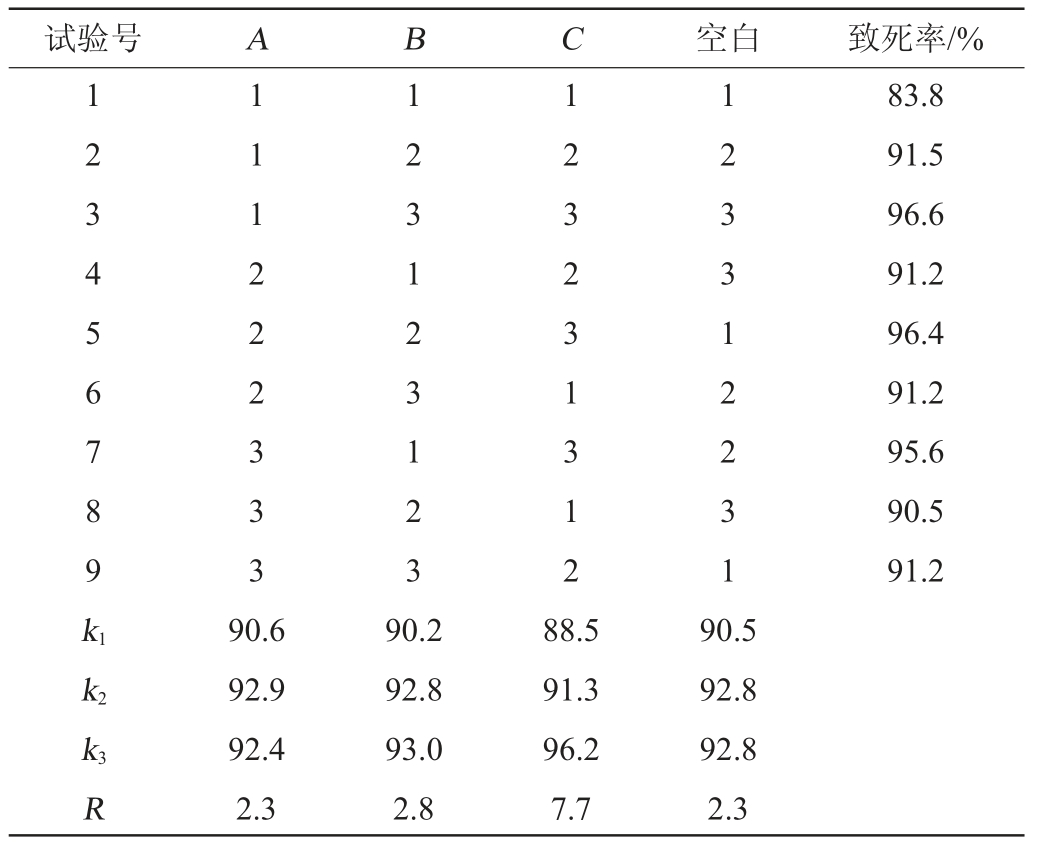
试验号 A B C 空白 致死率/%1 2 3 4 5 6 7 8 9 k1 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 1 2 3 3 1 2 2 3 1 83.8 91.5 96.6 91.2 96.4 91.2 95.6 90.5 91.2 k2 k3R 90.6 92.9 92.4 2.3 90.2 92.8 93.0 2.8 88.5 91.3 96.2 7.7 90.5 92.8 92.8 2.3
由表2可知,由极差R得到诱变温度、时间和NaNO2浓度对致死率影响顺序为C>B>A,说明NaNO2浓度对致死率影响最大,对致死率影响最小的因素是诱变温度,由正交试验结果分析得到最佳NaNO2诱变条件组合为A1B1C1,即诱变温度23 ℃、诱变时间23 min、NaNO2浓度0.25 mol/L。在此优化复合诱变条件下,进行3次平行验证试验,致死率达到83.8%,与正交分析结果相符合,说明NaNO2最佳诱变条件组合为A1B1C1。
2.4 高产纤维素酶突变株筛选
按最优复合诱变条件对原始菌株进行诱变后,用DNS法测定突变菌株纤维素酶活并与原始菌株酶活比较,结果见表3。诱变菌株在28 ℃条件下培养24 h,用刚果红溶液对长势较好的菌落进行染色,根据水解圈大小和菌圈大小比值(D/d值)选择比值大的菌株,突变菌株的D/d值见图6。
由表3可知,经复合诱变筛选出的菌株均有纤维素酶活,其中突变株UN-2酶活提高最少,仅提高到原始酶活的126.3%,突变株UN-5纤维素酶活提高最明显,比原始菌株酶活提高了205.8%。
表3 突变菌株酶活与原始菌株酶活比较
Table 3 Enzyme activity ratio of mutant strain and original strain

项目 菌株UN-1 菌株UN-2 菌株UN-3 菌株UN-4 菌株UN-5 菌株UN-6 菌株UN-7 菌株UN-8纤维素酶活/(U·mL-1)酶活提高百分比/%62.21 126.2 60.25 122.2 70.84 143.7 96.42 195.5 101.48 205.8 72.54 147.1 75.18 152.5 65.48 132.8
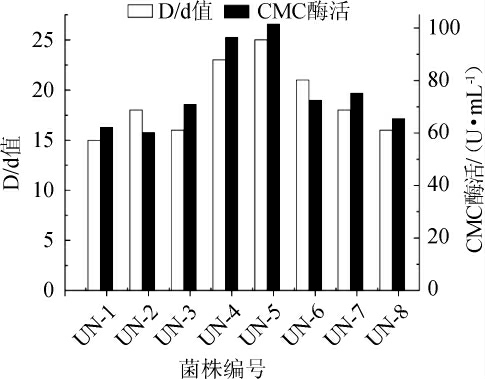
图6 复合突变菌株D/d值和酶活测定结果
Fig. 6 Determination results of D/d values and enzyme activities of complex mutagenesis strains
由图6可知,刚果红染色中水解圈和菌落比大的酶活也相对较高,其中菌株UN-5的纤维素酶酶活最高,达到101.48 U/mL,比原始菌株酶活提高了205.8%,说明经UVNaNO2复合诱变,原始菌株贝莱斯芽孢杆菌的突变菌株产纤维素酶能力增强。
2.5 遗传稳定性
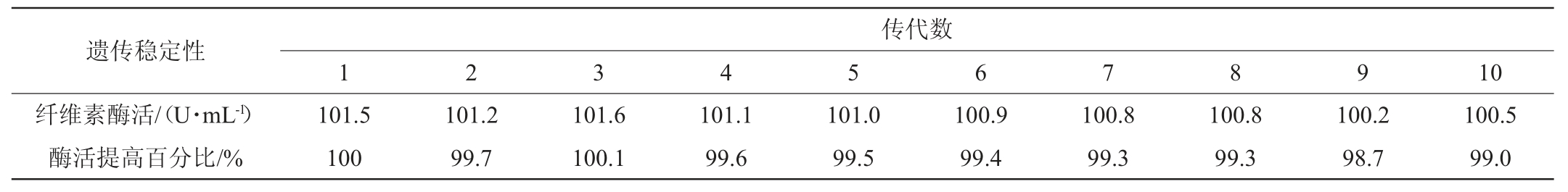
将复合诱变后筛选出的突变株UN-5接种至CMC-Na培养基进行传代培养,连续传代10代,用DNS法测定每代的纤维素酶酶活,结果见表4。
由表4可知,突变株UN-5连续传代10代后纤维素酶活仍然达到100.5 U/mL。与第一代相比,纤维素酶活稍有降低,酶活降低1 U/mL,变化率为1%,变化幅度不显著,连续传代对突变株UN-5酶活虽然有一定影响,但变化很小,传代10代后酶活仍有99.0%。说明该突变株遗传性状稳定,可进一步应用到实际生产中。
表4 突变菌株UN-5遗传稳定性
Table 4 Genetic stability of mutant strain UN-5
遗传稳定性纤维素酶活/(U·mL-1)酶活提高百分比/%1 101.5 100 2 101.2 99.7传代数3 4 5 6 101.6 100.1 101.1 99.6 101.0 99.5 100.9 99.4 7 100.8 99.3 8 100.8 99.3 9 100.2 98.7 10 100.5 99.0
3 结论
本研究以贝莱斯芽孢杆菌为出发菌,确定菌种在培养12 h时到达对数期,菌株原始酶活为49.31 U/mL;用紫外对菌株诱变150 s时,菌株致死率达到85.4%。经单因素和正交试验优化诱变条件,得到NaNO2诱变的最佳条件:23 ℃条件下0.25 mol/L的NaNO2诱变处理23 min。按最优诱变条件对原始菌株进行紫外-NaNO2复合诱变处理,突变株UN-5纤维素酶产量最高,其酶活达到101.5 U/mL,比原始菌株的酶活提高了205.8%。突变株UN-5连续传代10代后酶活仍有99.0%,遗传性能稳定,可用于生物有机肥生产。
[1]张华锋.纤维素酶研究进展[J].现代农业科学,2009,16(6):25-26.
[2]王立刚,李维炯,邱建军,等.生物有机肥对作物生长、土壤肥力及产量的效应研究[J].中国土壤与肥料,2004(5):12-16.
[3]陈洪章.纤维素生物技术[M].济南:化学工业出版社,2011:67-89.
[4] CHANG E H, CHUNG R S, TSAI Y H. Effect of different application rates of organic fertilizer on soil enzyme activity and microbial population[J].Soil Sci Plant Nutr,2010,53(2):132-140.
[5]钟发刚,王新华.饲用纤维素酶研究进展[J].中国微生态学杂志,2002,14(5):308-309.
[6]韩梦颖,王雨桐,高丽,等.降解秸秆微生物及秸秆腐熟剂的研究进展[J].南方农业学报,2017,48(6):1024-1030.
[7]杨新,杨双全,陈莉,等.以酒糟为基质的高温型生物有机肥复合发酵菌剂的制备[J].食品与发酵工业,2019,45(9):242-249.
[8]ADSUL M G,BASTAWDE K B,VANMA A J,et al.Strain improvement of Penicillium janthinellum NCIM 1171 for increased cellulase production[J].Bioresource Technol,2012,102(7):S20-S21.
[9]方芳,李相前,赵玉萍,等.紫外-微波复合诱变选育高产纤维素酶的Trichoderma asperelloides 菌株[J].中国饲料,2015,14(2):27-30.
[10] CRIQUET S. Measurement and characterization of cellulase activity in sclerophyllous forest litter[J].J Microbiol Meth,2002,50(2):165-173.
[11]曹友声,刘仲敏.现代工业微生物学[M].长沙:湖南科学出版社,1998:156-170.
[12]于秀莲,何建勇,白秀峰,等.阿维菌素产生菌的诱变育种[J].沈阳药科大学学报,2004,21(3):64-67.
[13]李忠玲,秦涛,岳淑宁,等.绿色木霉产纤维素酶菌种诱变[J].中国酿造,2011,30(12):70-72.
[14]刘春芬,贺稚非.纤维素酶高产菌株的诱变选育[J].中国酿造,2008,27(5):29-33.
[15]程鹏,刘姗姗,王玉,等.1 株高产纤维素酶菌株的筛选鉴定及对稻秆降解的研究[J].华南农业大学学报,2019,40(1):90-97.
[16]武香玉.纤维素酶产生菌的选育、发酵产酶条件及酶学性质的研究[D].北京:北京工商大学,2010.
[17]黄晓梅,赵红晓,范金霞,等.一株高产纤维素酶绿色木霉菌株诱变选育与发酵研究[J].东北农业大学学报,2018,49(6):22-31.
[18] ADSUL M G, BASTAWDE K B, VAMMA A J, et al. Strain improvement of Penicillium janthinellum NCIM 1171 for increased cellulase production[J]. Bioresource Technology,2012,102(7):S20-S21.
[19]罗艳青,张丹,冯海玮,等.DNS 法检测灰略红链霉菌JSD-1 产纤维素酶的CMC 酶活条件的优化[J].食品工业科技,2015,36(3):156-162.
[20]穆春雷.低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J].微生物学通报,2013,40(7):1193-1201.
[21] GUO H, CHANG J, YIN Q, et al. Effect of the combined physical and chemical treatments with microbial fermentation on corn straw degradation[J].Bioresource Technol,2013,14(12):361-365.