化石能源的大量消耗,致使全球环境污染日趋严重,因此迫切需要寻求清洁可再生能源替代化石资源。生物柴油因其燃烧性能好、热值高和污染小[1],备受各国能源生产企业和研究者们的广泛关注。当前,市场上生产生物柴油的主要原料来源于植物油、动物脂肪或餐余废弃油类,但其生产成本较高,成为制约生物柴油发展的关键问题。自然界中存在大量真菌、细菌或者微藻能够利用碳氢化合物或碳水化合物合成油脂[2-4],其中微生物具有生长速度快和易培养等特点,具备商业开发的潜力。
目前,已报道的微生物油脂主要集中于以葡萄糖为碳源,较少微生物可以利用木糖产油脂,这样的模式必然会造成生产成本较高,从而制约微生物油脂产业发展。因此,采用廉价生产原料是生物柴油能否规模化生产的关键因素之一。木质纤维素水解后的主要产物为葡萄糖、木糖和木质素,如果微生物能够同时利用葡萄糖、木糖、木质素及其衍生物为碳源合成油脂,对微生物油脂产业化具有重要的现实意义。
近年来,相关研究表明红球菌属(Rhodococcus sp.)细菌可以利用葡萄糖、木质素及其衍生物产油脂,如不透明红球菌(Rhodococcus opacus)[5]、弗氏红球菌(Rhodococcus wratislaviensis)、红球菌(Rhodococcus jostii)[6]和红球菌YHY01[7]等。此外,有研究发现红球菌属细菌还可以产色素,陈亚淑等[8]对海洋红球菌(Rhodococcus sp.)B7740产类胡萝卜素进行提取,并发现该色素具有体外抗氧化活性和抗增殖活性。于淼等[9]从土壤中分离得到一株可以产红色素的赤红球菌,经过培养条件优化后,其红色素粗产品可达到0.93 g/L。近年来天然微生物色素逐渐受到人们关注,它不仅可以赋予产品丰富单位色彩,而且具有多种生理功能,并与人类健康有着密切关系,被广泛应用于医药、食品和化妆品等行业[10-12]。因此,利用红球菌产油脂和色素具有重要的理论意义和应用前景。
本研究以海洋环境中筛选的能够同时利用葡萄糖、木糖和木质素产油脂和色素的红球菌为研究对象,采用形态学观察、生理生化特征和16S rRNA基因序列分析对其进行鉴定,并初步探讨培养条件对其生物量的影响,以期为红球菌利用木质纤维素(或其他类型生物质)水解液合成油脂和天然色素的产业化应用提供理论基础。
1 材料与方法
1.1 材料与试剂
2017年7月于广西北部湾茅尾海红树林湿地采集不同类型植物根系土壤15份,保存在无菌密封袋中,将样品置于冰盒中带回实验室,用于细菌的筛选分离。
碱木质素:美国Sigma公司;聚合酶链反应(polymerase chain reaction,PCR)扩增试剂、Ezup柱式细菌基因组提取剂盒、琼脂糖、细菌通用引物(27F和1492R):上海生工生物工程有限公司;其他化学试剂均为国产分析纯。
分离培养基:胰蛋白胨5.0 g/L,酵母粉2.5 g/L,NaCl 5.0 g/L,琼脂15.0 g/L。
基础培养基:(NH4)2SO4 1.0 g/L,NaCl 5.0 g/L,MgSO4 0.2 g/L,K2HPO4 1.0 g/L,KH2PO4 1.0 g/L,FeSO4 0.001 g/L,CuSO4 0.001 g/L,琼脂15.0 g/L,碳源(葡萄糖、木糖或碱木质素)2.0 g/L。
发酵培养基:碳源10g/L,胰蛋白胨5.0g/L,酵母粉2.5g/L,NaCl 5.0 g/L,MgSO40.2 g/L,K2HPO4 1.0 g/L,FeSO4 0.001 g/L,CuSO4 0.001 g/L,pH自然。
以上培养基均在115 ℃条件下灭菌20 min。
1.2 仪器与设备
高温蒸汽灭菌锅:日本SANYO公司;730R回转振荡恒温培养箱:美国APlus公司;S1000TM PCR仪:美国Bio-Rad生命医学有限公司;DYY-6D电泳仪:北京六一生物科技有限公司;TU-1901紫外分光光度计:北京普析仪器有限公司;WGD-30S凝胶成像仪:韩国Wisd公司;TE2000-U尼康倒置显微镜:日本尼康株式会社。
1.3 实验方法
1.3.1 菌株筛选及分离纯化
将采集红树林植物根际土壤用无菌水稀释至10-1~10-4,吸取50 μL涂布于分离培养基的培养皿中,置于30 ℃培养箱3~5 d后,观察培养基中菌落形状、颜色、表面光滑度等。挑取有颜色单菌落继续分离纯化。单菌落经3次分离纯化后进行革兰氏染色,将其中的革兰氏阳性菌划线于以葡萄糖、木糖或者木质素为唯一碳源的基础培养基,选取能够在3种碳源上生长的菌落进行后续实验。细菌显微形态观察:取细菌培养液稀释一定倍数后,吸微量液体置于洁净的载玻片上,盖上盖玻片,用高倍显微镜观察细胞形态。同时,分离得到所有纯化的单菌落标记后,用25%甘油保藏于-80 ℃冰箱。
1.3.2 生理生化特征分析
根据菌株的表型特征、革兰氏染色、过氧化氢酶实验,以及碳源(葡萄糖、木糖、果糖等糖类物质和乙酸、琥珀酸等有机酸类物质)利用生长情况,并参照已报道文献中类似属种细菌的生理生化特征,初步确定菌株分类学地位。
1.3.3 分子生物学鉴定
细菌基因组采用Ezup柱式细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)试剂盒进行提取,具体步骤按照说明书进行操作。以基因组为模板,进行16S rRNA基因序列PCR扩增。细菌扩增通用正向引物27F:5'-AGAGTTTGATCCTGGCTCAG-3',反向引物1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR具体操作步骤参考文献[13]。菌株的PCR产物凝胶成像检测合格后,送上海生工进行测序。最终获得序列拼接后,提交美国国家生物技术信息中心(nationalcenterofbiotechnologyinformation,NCBI)网站基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)数据库进行比对,选取多个近似菌株序列利用MEGA 5.05软件构建菌株的系统发育树,以确定其分类学地位。
1.3.4 菌株TH-22培养条件的单因素试验
在100 mL的培养体系中,接种量2%条件下培养120 h,分别测定不同碳源(10 g/L葡萄糖、木糖、果糖、蔗糖、半乳糖和1 g/L碱木质素)、温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、初始pH(6.0、6.5、7.0、7.5、8.0)、转速(100 r/min、120 r/min、150 r/min、180 r/min、200 r/min)和NaCl含量(0.5%、1.0%、2.0%、3.0%)对菌株TH-22生长状况的影响,以生物量(干质量)作为考察指标。其中不同碳源生长情况采用基础培养基进行试验,确定最佳碳源后,采用发酵培养基考察其他因素对细菌生长的影响。细菌适宜培养条件确定后,考察菌株TH-22利用葡萄糖、木糖、果糖、蔗糖和碱木质素等碳源合成色素和油脂的能力。
1.3.5 分析方法
菌体干质量的测定:取50 mL培养液,10 000 r/min离心10 min,弃上清液,收集离心管底部菌体,将其置于真空冷冻干燥机中,24 h后取出干燥菌体并称取菌体干质量。
色素的提取及测定[14]:取50 mL培养液,10 000 r/min离心10 min,弃上清液,收集离心管底部菌体,用去离子水重新悬浮菌体并反复洗涤,菌体沉淀中加入30 mL无水乙醇混匀,将其置于冰浴中进行超声波细胞破碎,超声功率200 W,超声时间30 min,超声时间隔5 s,离心后的色素提取液,在波长300~600 nm范围内进行扫描,确定色素的最大吸收波长及吸光度值,用如下公式计算色素产量:
式中:A为色素在最大波长下的吸光度值;D为稀释倍数;V为溶剂体积,mL;0.16为色素摩尔消光系数;W为色素提取所用的细胞干质量,g;c为发酵液中细胞质量浓度,g/L。
细菌胞内油脂的提取及含量测定[15]:将1 g湿菌体置于10 mL盐酸(4 mol/L)溶液中,重悬菌体混匀后,放置20 min,然后沸水浴10 min,将经过沸水浴的离心管置于-20 ℃冰箱中冰浴30 min,在离心管中分别接入10 mL甲醇和氯仿,振荡30 min,5 000 r/min离心3 min,静置分层后,取下部氯仿层,65 ℃干燥2 h,称取干燥后油脂质量。
2 结果与分析
2.1 菌株筛选及分离纯化
选取分离培养基中一株橙黄色的菌落,对其进一步划线分离纯化,得到菌株TH-22。
2.2 菌株TH-22的形态及生理生化特征
观察菌株TH-22生长颜色、大小及菌落形态并进行显微镜观察,结果见图1。由图1可知,菌株TH-22呈现橙黄色、圆形、表面圆润光滑,边缘整齐;色素只产在胞内,培养基中无色素。革兰氏染色为阳性,过氧化氢酶阳性,显微镜下观察菌体呈现多种形态,如球状和短杆状,与文献报道红球菌属细菌类似[16]。
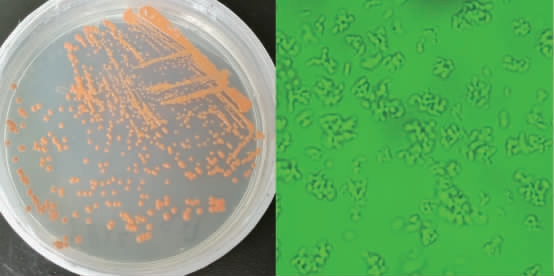
图1 菌株TH-22菌落形态(a)以及显微形态(b)
Fig. 1 Colony morphology (a) and microscopic morphology (b) of strain TH-22
菌株TH-22接种于液体基础培养基,观察以木糖、葡萄糖、碱木质素和有机酸等作为唯一碳源的生长状况。实验结果见表1。由表1可知,该菌可以利用单糖、多糖等多种糖类以及小分子有机酸和芳香族有机酸作为碳源进行生长代谢,与已报道的赤红球菌生理生化特征基本一致[9,17]。
表1 菌株TH-22的生理生化特性检测结果
Table 1 Detection results of physiological and biochemical characteristics of stain TH-22

注:“-”表示阴性结果;“+”表示阳性结果。
检测项目 结果 检测项目葡萄糖木糖蔗糖糊精半乳糖果糖结果 检测项目 结果++++++D-核糖L-鼠李糖甘露醇酮戊二酸乙酸乳酸+++-++琥珀酸原儿茶酸对羟基苯甲酸乳酸甲酯柠檬酸庚二酸+++---
2.3 分子生物学鉴定
以菌株TH-22基因组为模板,27F和1492R为引物进行16S rRNA基因序列PCR扩增,扩增产物通过1%琼脂糖凝胶电泳检测,序列在1 500 bp左右,扩增产物送上海生工进行测序。将双向测序结果进行拼接后,提交至NCBIGenBank数据库,通过BLAST进行同源性比对,选取同源性较高的11株细菌序列,利用MEGA5.05计算细菌序列相似度,同时利用邻接法构建细菌系统发育树,结果见图2。由图2可知,菌株TH-22与赤红球菌(Rhodococcus ruber)在同一个分支上,同源性达到99%。因此,结合菌株TH-22的菌落形态、生理生化特性及16S rRNA基因序列分析,菌株TH-22被鉴定为赤红球菌(Rhodococcus ruber)。

图2 基于16S rRNA基因序列菌株TH-22的系统发育树
Fig. 2 Phylogenetic tree based on 16S rRNA gene sequences of strain TH-22
2.4 紫外/可见吸收光谱分析
采用紫外/可见分光光度计在波长300~600 nm范围内对乙醇提取色素溶液进行扫描,结果见图3。由图3可知,菌株TH-22的色素提取液在波长460 nm处存在最高吸收峰,因此,确定菌株TH-22可以产类胡萝卜素类的物质,色素的最大吸收波长为460 nm。

图3 菌株TH-22胞内色素乙醇提取液的紫外/可见吸收光谱图
Fig. 3 Spectrum of intracellular pigment ethanol extracting solution of strain TH-22
2.5 培养条件对菌株TH-22生长的影响
2.5.1 碳源对细菌生物量的影响
由图4可知,以葡萄糖为碳源时,菌株TH-22的生物量可达8.99 g/L,其次为果糖,生物量为8.86 g/L,其他碳源对生物量的影响依次为蔗糖、半乳糖和木糖;而以碱木质素为碳源时,菌株TH-22的生物量仅达到1.75 g/L,可能是由于木质素结构复杂,其在同化过程中需要先被降解为小分子芳香族化合物,从而造成其生长缓慢。因此,选择葡萄糖作为菌株合成油脂和色素的最佳碳源。

图4 碳源对菌株TH-22生物量的影响
Fig. 4 Effect of carbon sources on the biomass of strain TH-22
2.5.2 温度对细菌生物量的影响
由图5可知,随着温度的升高,菌株TH-22的生物量也逐渐升高,其中在35 ℃时,其生物量达到最高值10.1 g/L;当温度达到40 ℃时,其生物量明显降低,仅为3.62 g/L。故确定该菌的最适宜生长温度为35 ℃。
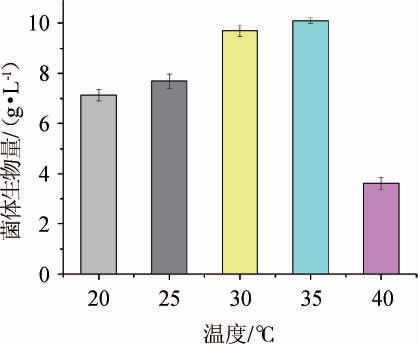
图5 温度对菌株TH-22生物量的影响
Fig. 5 Effect of temperature on the biomass of strain TH-22
2.5.3 初始pH对细菌生物量的影响
由图6可知,培养环境的初始pH对菌株TH-22的生物量影响较大,随着培养基中初始pH的不断升高,其初始pH=6.0时,生物量为6.11 g/L,当初始pH=7.5时,生物量增加至11.76 g/L,而当初始pH=8.0时,其生物量开始减少;由此表明该菌适宜在中性环境中生长,偏酸或者偏碱的培养体系都会影响菌株TH-22的正常代谢,因此确定该菌的适宜生长pH为7.5。
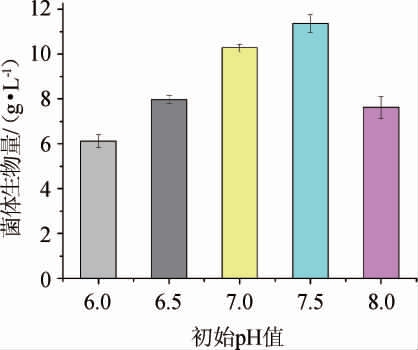
图6 初始pH值对菌株TH-22生物量的影响
Fig. 6 Effect of initial pH value on the biomass of strain TH-22
2.5.4 转速对细菌生物量的影响
由图7可知,随着转速升高,菌株TH-22的生物量逐渐增加,当转速为150 r/min时,达到最大生物量为10.88 g/L,在低转速时,其生物量较低可能是由于培养体系溶氧不足导致的。而在高转速的培养环境中,虽然溶氧充足,但转速太高时,由于剪切力的作用,可能会引起菌体损伤,从而导致菌体生物量减少,故选择转速为150 r/min。

图7 转速对菌株TH-22生物量的影响
Fig. 7 Effect of rotation speed on the biomass of strain TH-22
2.4.5 NaCl含量对细菌生物量的影响
菌株TH-22来源于海洋环境,可能具备不同于陆地微生物等生物遗传特征。培养体系中NaCl维持细菌体内的内外渗透压、细胞内外的电势差和参与物质运输的作用等功能[18]。在NaCl含量为0.5%~3.0%时,考察细菌生物量的变化。

图8 NaCl含量对菌株TH-22生物量的影响
Fig. 8 Effect of NaCl contents on the biomass of strain TH-22
由图8可知,菌株TH-22在NaCl含量为0.5%~3.0%时,均能够生长,但NaCl含量<1.0%时利于细菌生长,其中在NaCl含量为1.0%时,其生物量为11.5 g/L,因此选择培养基中NaCl含量为1.0%。
2.6 菌株TH-22利用不同碳源产油脂和色素初探
本实验对菌株TH-22利用四种糖类物质(葡萄糖、木糖、蔗糖和果糖)合成油脂和色素进行评价。按照接种量为2%分别接种于4种碳源质量浓度10 g/L的发酵培养基中,在发酵温度35 ℃、摇床转速150 r/min、初始pH为7.5和NaCl含量为1%的条件下培养5 d,测定菌株TH-22胞内的油脂和色素产量,结果见表2。
表2 菌株TH-22的胞内油脂和色素产量
Table 2 Yield of intracellular lipid and pigment of stain TH-22

碳源 油脂产量/(g·L-1) 色素产量/(mg·L-1)葡萄糖木糖果糖蔗糖2.87±0.15 2.06±0.23 2.66±0.18 2.35±0.13 3.89±0.28 2.63±0.12 3.42±0.16 3.04±0.18
由表2可知,以葡萄糖为碳源时,其油脂和色素产量最高分别为(2.87±0.15)g/L和(3.88±0.28)mg/L;其次,油脂和色素产量依次分别为果糖、蔗糖和木糖。本试验结果与分离自北极海水的红球菌B7740产色素相似[14],都是以葡萄糖为碳源时,其色素产量最高;而分离自土壤中的红球菌ZA-UR6以蔗糖为碳源时[19-20],其色素产量最高;由此表明细菌生长环境不同,导致了所需营养不同。菌株TH-22可以利用多种糖类物质,因此后续研究需要继续探索廉价的培养基质,如农作物秸秆水解液、甘蔗和菊芋水解液等。
3 结论
本实验从北部湾红树林湿地海泥中筛选到一株能够产油脂和色素的放线菌TH-22,经形态学观察、生理生化特性检测和分子生物学鉴定菌株TH-22为赤红球菌(Rhodococcus ruber)。菌株TH-22可以利用多种糖类物质产油脂和色素,其中葡萄糖为最佳碳源。此外,通过单因素实验确定最佳培养条件:培养温度35 ℃、摇床转速150 r/min、初始pH为7.5和NaCl含量为1%。在此优化条件下,以10 g/L葡萄糖为碳源,菌株TH-22的油脂和色素产量分别为(2.87±0.15)g/L和(3.89±0.28)mg/L。为进一步开发研究红球菌利用生物质资源提供科学依据。
[1]KUMAR D,SINGH B,KORSTAD J.Utilization of lignocellulosic biomass by oleaginous yeast and bacteria for production of biodiesel and renewable diesel[J].Renew Sustain Energy Rev,2017,73:654-671.
[2] SHIELDS-MENARD S A, AMIRSADEGHI M, FRENCH W T, et al. A review on microbial lipids as a potential biofuel[J].Bioresource Technol,2018,259:451-460.
[3] MUBARAK M, SHAIJA A, SUCHITHRA T V. A review on the extraction of lipid from microalgae for biodiesel production[J].Algal Res,2015,7:117-123.
[4]HUANG X,DING Y,LIAO X,et al.Microbial lipid production from enzymatic hydrolysate of corn stover pretreated by combining with biological pretreatment and alkalic salt soaking[J].Ind Crop Prod,2018,124:487-494.
[5]FEI Q,WEWETZER S J,KUROSAWA K,et al.High-cell-density cultivation of an engineered Rhodococcus opacus strain for lipid production via co-fermentation of glucose and xylose[J].Process Biochem,2015,50(4):500-506.
[6]HERRERO O M,VILLALBA M S,LANFRANCONI M P,et al.Rhodococcus bacteria as a promising source of oils from olive mill wastes[J].World J Microbiol Biotechn,2018,34(8):114.
[7] BHATIA S K, KIM J, SONG H S, et al. Microbial biodiesel production from oil palm biomass hydrolysate using marine Rhodococcus sp.YHY01[J].Bioresource Technol,2017,233:99-109.
[8]陈亚淑,汪荣,谢笔钧,等.北极海洋红球菌(Rhodococcus sp.)B7740产类胡萝卜素的提取条件优化及甲基萘醌类类胡萝卜素鉴定[J].食品科学,2016,37(2):25-30.
[9]于淼,侯莉,黄娟,等.产红色素赤红球菌的筛选鉴定和产色素条件的优化[J].食品科技,2017,2:2-8.
[10]陈新颜,杨培周,姜绍通,等.天然红色素灵菌红素的急性经口毒性和遗传毒性[J].食品科学,2017,38(13):224-228.
[11]卢绍闯,胡琳慧,冯艳丽.紫苏叶对红曲菌产色素和莫纳可林K 及抗氧化物的影响[J].中国酿造,2017,36(11):101-104.
[12]丁长河,张梦涵.一株β-胡萝卜素生产菌的鉴定及其发酵工艺优化[J].中国酿造,2019,38(7):116-121.
[13]李锋,梁念,孙建中.一株新型苯胺蓝降解菌MP-13 的代谢特征[J].微生物学通报,2020,47(1):43-53.
[14]张加蓉,杨季芳,陈福生.一株分离自北极海水红球菌(Rhodococcus sp.)B7740 的生长条件及其粗类胡萝卜素提取方法的优化[J].极地研究,2012,24(2):168-177.
[15]张可可,习宇,程方,等.烟草废水中红色酵母菌的分离鉴定及其胞内色素和油脂的初步研究[J].中国酿造,2019,38(9):32-35.
[16]华苟根,郭坚华.红球菌属的分类及应用研究进展[J].微生物学通报,2003,30(4):107-111.
[17]DE LAS HERAS L F,FERNANDEZ E G,LLORENS J M N,et al.Morphological,physiological,and molecular characterization of a newly isolated steroid-degrading actinomycete,identified as Rhodococcus ruber strain Chol-4[J].Curr Microbiol,2009,59(5):548-553.
[18]孔菲,蔡宇杰,许晨,等.海洋细菌Planococcus rifietoensis 发酵产色素培养基的优化[J].食品与生物技术学报,2017,36(2):179-186.
[19]郑晓冬,王友永.用红球菌生产类胡萝卜素的研究[J].浙江大学学报(农业与生命科学版),2000,26(5):55-59.
[20]张加蓉,杨季芳,陈福生,等.一株分离自北极海水红球菌(Rhodococcus sp.)B7740 的生长条件及其粗类胡萝卜素提取方法的优化[J].极地研究,2012,24(2):168-177.