老白干香型白酒以衡水老白干为代表,具有醇香清雅、酒体协调、醇厚甘冽、回味悠长的风格特点。白酒的风格特点取决于特征风味物质的种类和含量,其中呈甜味物质的存在可以使得酒体更加的丰满醇厚、绵甜自然。研究表明,多元醇是白酒醇甜味的重要来源之一[1],大多数多元醇都沸点高且不易挥发,白酒作为世界六大蒸馏酒之一,拥有独特的甑桶蒸馏技术,它的独特之处即通过蒸汽将酒醅中的风味物质先富集再随蒸汽带入酒体中[2],难挥发的多元醇进入酒体中为白酒增加甜味和醇厚感,同时也对白酒起助香的作用。白酒中的多元醇种类繁多,主要包括甘油、阿拉伯糖醇、核糖醇、赤藓糖醇、木糖醇、山梨醇、甘露醇、半乳糖醇、麦芽糖醇等[3],且甜度随羟基数增多而增强[4]。
白酒呈甜味物质的种类和数量不仅取决于生产工艺,而且与功能微生物的存在息息相关。微生物能利用葡萄糖等还原糖代谢产生各种多元醇[5],其中以酵母利用还原糖为主,尤其是耐高渗酵母[1]。目前研究显示,耐高渗的酵母可以发酵糖类产生多元醇类物质,并且酵母的耐高渗能力与多元醇产物的种类有所联系[6-7]。范光先等[8]的研究也证实,耐高渗酵母在高浓度葡萄糖存在的条件下更易产生D-阿拉伯醇或赤藓糖醇,而在高盐条件下产生的多元醇以甘油居多。目前研究可产多元醇的酵母主要有:假丝酵母属(Candida sp.)[9-10]、德巴利酵母属(Debaryomyces sp.)[11]、汉逊酵母属(Hansenula sp.)[12]、毕赤酵母属(Pichia sp.)[13]、克鲁维酵母属(Kluyveromyces sp.)[14]等。但现在从白酒酿造过程中筛选产多元醇酵母的研究较少,因此通过筛选白酒酿造过程中的产多元醇酵母,不仅利于解析白酒甜味物质来源,还能从源头上改善白酒品质。
为筛选出产多元醇酵母,本实验以从衡水老白干生产大曲和发酵酒醅中筛选并保藏的酵母为研究对象,进行耐高糖实验筛选出耐高渗酵母,由葡萄糖标准培养基发酵制得的发酵培养基,通过高效液相色谱-蒸发光散射检测法(high performance liquid chromatography-evaporative lightscattering detector,HPLC-ELSD)定性、定量分析酵母发酵液中多元醇,研究耐高糖酵母产多元醇的能力,通过筛选耐高糖酵母菌,旨在为解析酵母产多元醇提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
30株酵母菌(大曲中8株,发酵酒醅中22株):衡水老白干技术中心从生产用大曲和发酵酒醅中筛选并保藏。其中酿酒酵母6株(Y1、Y2、YX13、YX24、YX25、YX38),库德里阿兹威赤酵母1株(Y3),异常毕赤酵母1株(Y4),伯顿毕赤酵母1株(Y5),异常威克汉姆酵母1株(Y6),扣囊复膜酵母1株(Y7),发酵毕赤酵母1株(Y8),尼泊尔德巴利酵母1株(YX1),埃戚氏许旺酵母1株(YX2),埃切德巴利酵母1株(YX3),蜂生假丝酵母11株(YX27、YX16、YX23、YX26、YX28、YX29、YX33、YX36、YX39、YX40、YX41),鲁氏酵母3株(YX14、YX19、YX21),木兰假丝酵母1株(YX22)。
1.1.2 试剂
葡萄糖、核糖醇、赤藓糖醇、甘油、甘露醇和D-阿拉伯糖醇标准品(均为色谱纯):国家标准物质商城。
1.1.3 培养基
酵母膏胨葡萄糖琼脂(yeast extract peptone dextrose,YEPD)培养基:酵母膏1 g,蛋白胨2 g,葡萄糖2 g,琼脂2 g,蒸馏水100 mL。121 ℃灭菌20 min。
高糖培养基:葡萄糖40 g,酵母粉1 g,蛋白胨2 g,琼脂1.5 g,蒸馏水100 mL。115 ℃灭菌20 min。
种子培养基:葡萄糖2 g,酵母粉1 g,蛋白胨2 g,蒸馏水100 mL。115 ℃灭菌20 min。
发酵培养基:葡萄糖20 g,酵母粉1 g,蛋白胨2 g,蒸馏水100 mL。115 ℃灭菌20 min。
1.2 仪器与设备
TCYQ振荡培养箱:太仓市实验设备厂;TGL-16M台式高速冷冻离心机:湖南湘仪实验室仪器开发有限公司;SPE C18固相萃取小柱(200 mg/3 mL):深圳逗点生物技术有限公司;Agilent 1200 Series &1260 Infinity高效液相色谱仪、Agilent Hi-plexCa柱(300 mm×7.7 mm):安捷伦科技有限公司;ELSD6000蒸发光检测器:美国奥特公司。
1.3 实验方法
1.3.1 耐高糖酵母筛选
酵母活化:将本实验室筛选并保藏的酵母在YEPD平板培养基上划线,30 ℃培养,复苏48 h。之后将活化菌株接种到YEPD液体培养基培养24 h。
高糖培养:将YEPD液体培养酵母接入高糖培养基中,30 ℃培养,48 h,筛选出能在高糖培养基中良好生长的酵母菌株。
1.3.2 高效液相色谱-蒸发光散射检测多元醇
(1)发酵液制备
将筛选的耐高糖酵母在YEPD平板培养基上划线,28 ℃培养,活化48 h;将活化酵母接入种子培养液中28 ℃、160 r/min扩培24 h,制得种子培养液;将酵母种子液按5%的接种比例接种至装液量为100 mL/250 mL发酵培养基中,28 ℃、160 r/min摇瓶培养5 d制得发酵液,每组做三个平行。
(2)发酵液前处理
吸取10 mL发酵液于试管,65 ℃水浴10 min,转移到离心管中6 000 r/min离心10 min,上清液经C18固相萃取小柱净化,收集滤液,用0.22 μm水系滤膜过滤,取1 ml滤液进样分析。
(3)标准品溶液的配制
准确配制葡萄糖、D-阿拉伯糖醇、甘露糖醇、赤藓糖醇、核糖醇及甘油的标准混合储备液,用0.22 μm微孔滤膜过滤。准确配制D-阿拉伯糖醇、甘露糖醇、赤藓糖醇、核糖醇及甘油标准储备液,使用超纯水稀释成梯度标准工作液。
(4)测定条件
HPLC-ELSD法测量条件:AgilentHi-plexCa柱(300mm×7.7 mm),柱温为80 ℃,进样量为4 μL,流速0.5 mL/min,以超纯水为流动相;ELSD6000蒸发光散射检测器,温度45 ℃,空气流速1.5 mL/min。
(5)多元醇定量分析
将标准储备工作液依次稀释,在相同测定条件下进样分析,根据测得的峰面积的对数(Y)与对应的多元醇浓度(X)进行线性回归。
2 结果与分析
2.1 耐高糖酵母的筛选
30株酵母中有12株酵母能在高糖培养基上生长,其中产多元醇的酵母有蜂生假丝酵母5株(YX16、YX26、YX27、YX33、YX36),鲁氏酵母3株(YX14、YX19、YX21),酿酒酵母2株(Y2、YX38),德巴利氏酵母1株(YX1),埃戚氏许旺酵母1株(YX2)。从产多元醇酵母的来源上,1株酵母(Y2)来自于大曲,其余均来自于发酵酒醅中。
2.2 高效液相色谱-蒸发光散射检测多元醇
2.2.1 产物定性分析
在实验条件下对多元醇混合标准溶液及12株酵母发酵液产物进样测定,高效液相色谱图见图1。
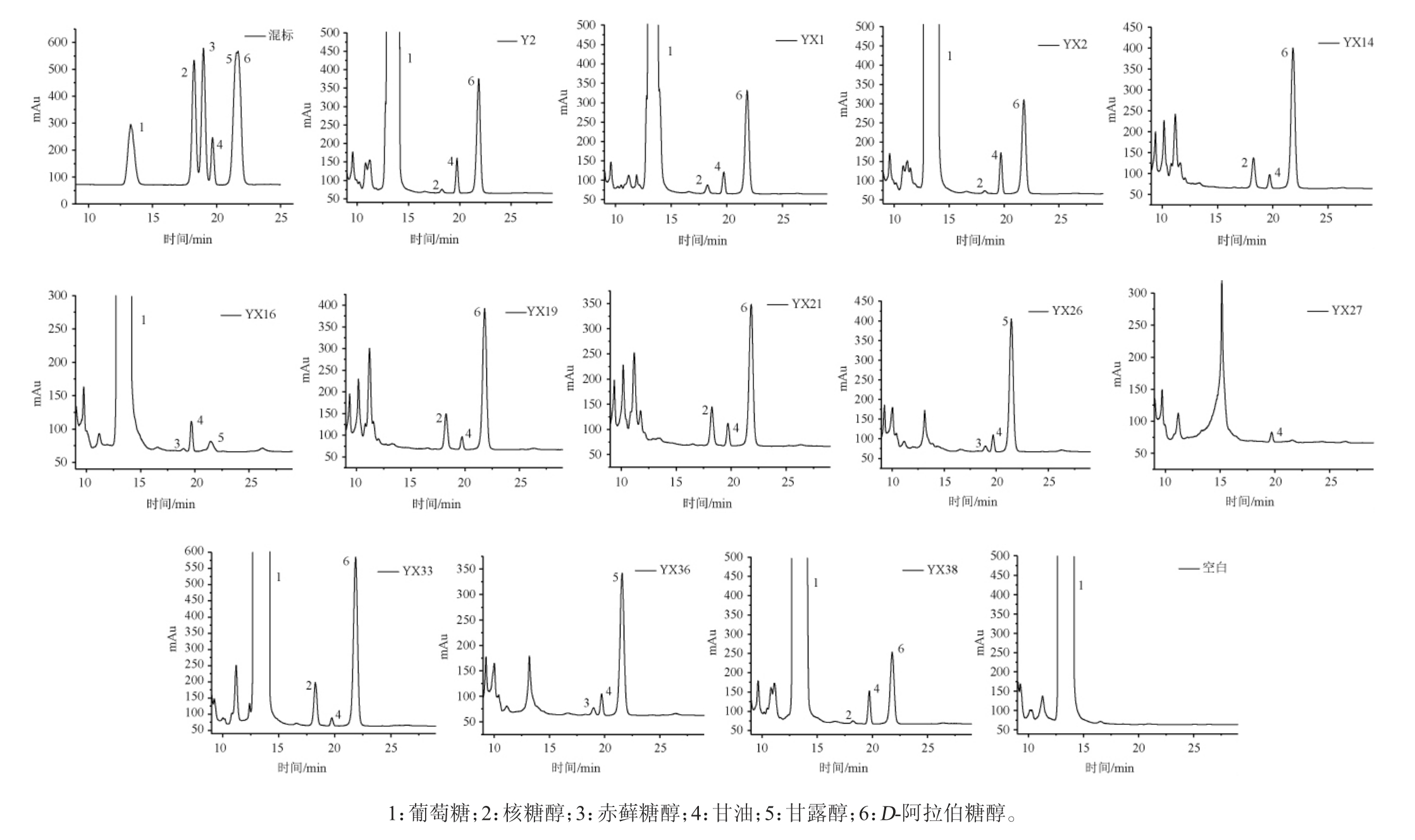
图1 混合标准溶液及12株酵母发酵液产物高效液相色谱图
Fig. 1 HPLC Chromatogram of mixed standard and fermentation broth of 12 yeasts
由图1可知,混合标准溶液中6种多元醇的保留时间为13.304 min(葡萄糖)、18.250 min(核糖醇)、18.976 min(赤藓糖醇)、19.711 min(甘油)、21.458 min(甘露醇)、21.759 min(D-阿拉伯糖醇),有较好的分离度。
12株酵母菌均产甘油,8株酵母菌(Y2、YX1、YX2、YX14、YX19、YX21、YX33、YX38)均产核糖醇、甘油、D-阿拉伯糖醇,3株酵母菌(YX16、YX26、YX36)均产赤藓糖醇、甘油、甘露醇。可见大多耐高糖酵母均能产生多种多元醇,这是由于处于高糖胁迫条件下,多元醇可作为酵母的相容性物质,具有亲水性强、易于跨膜、对于酶类温和等优点[15],从而调节细胞膜内外渗透压平衡,以适应其生长。
当环境渗透压较高时,为了应对细胞失水,一些响应机制会被诱导激活。因此酵母在高渗条件下能够调控关键基因转录水平从而改变碳流在不同代谢途径中的分布,使其利于相容性物质的合成,从而适应环境。对于酵母而言,高渗透性甘油促分裂原活化蛋白激酶(high osmolarity glycerol mitogen-activated protein kinase,HOG-MAPK)途径是高渗诱导的重要信号转导途径,因此可在极短的时间内发生高渗响应,生成甘油以应对外界环境[16]。本实验所测定的酵母发酵液中均能测得甘油且含量较多,这可能是酵母应对高糖环境所做出的应答。
酵母产糖醇的原因可能作为胞内储能物质,或维持胞内氧化还原平衡[17]。酵母利用葡萄糖经过糖酵解途径(embden-meyerhof-parnas pathway,EMP)和磷酸戊糖途径(pen tose phosphate pathway,PPP)产生许多前体物质如D-核糖-5-磷酸、D-赤藓糖-4-磷酸等(见图2),以及足量的还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide reduced,NADPH)利于多元醇的合成。当外界环境渗透压较高时,使得耐高渗酵母更容易积累多元醇,以抵御细胞脱水及保护细胞结构免受破坏。但不同酵母菌株所产多元醇种类及含量有所不同,同时参考KEGG酵母菌的部分多元醇代谢途径,除测得的5种多元醇外还有木糖醇、山梨醇、半乳糖醇等多元醇未检测出,这是由于不同种酵母代谢通路上可能存在该种酵母特定的基因或酶不同,也可能缺少或缺失该基因、酶或激发因子,因此在高渗环境中的代谢应答不同,会出现糖偏转,故产生的多元醇种类亦不同。
在白酒的酿造过程中,随着发酵的进行,发酵产物的积累(如丙酮酸、柠檬酸、乙醇等),会使得发酵体系的渗透压不断增加,使得关键代谢物的代谢途径发生变化,对部分产物的合成及积累产生抑制作用,但对于某些与高渗胁迫响应相关的产物而言,适当的提高发酵体系的渗透压,反而有利于目的产物的积累。最为典型的就是多元醇物质,如甘油、D-阿拉伯糖醇、甘露醇等。因此筛选耐高渗酵母有利于探究白酒酿造过程中甜味物质的来源。
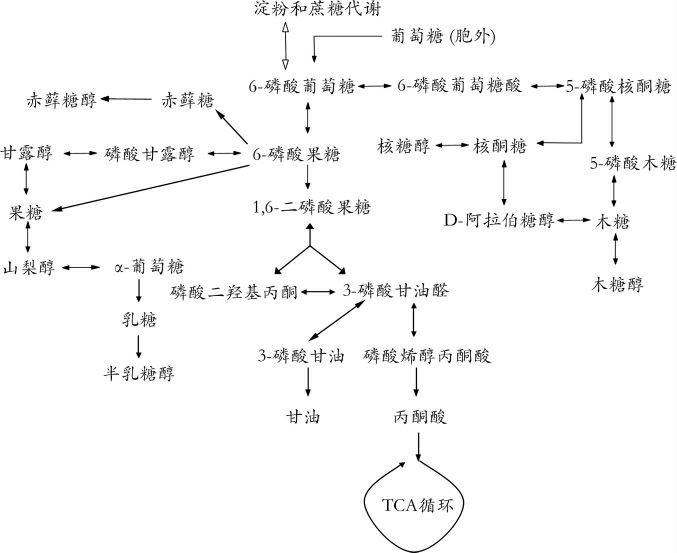
图2 酵母部分多元醇代谢过程
Fig. 2 Partial polyhydric alcohols metabolism process in yeast
2.2.2 产物定量分析
经过线性回归分析可得到5种标准品的标准曲线线性回归方程和相关系数结果见表1。由表1可知,5种多元醇的相关系数R在0.997 5~0.999 8之间,表明在各自线性范围内5种多元醇的质量浓度与峰面积的对数均具有良好的线性关系。
表1 5种多元醇的回归方程和线性范围
Table 1 Regression equations and correlation coefficients of 5 polyhydric alcohols
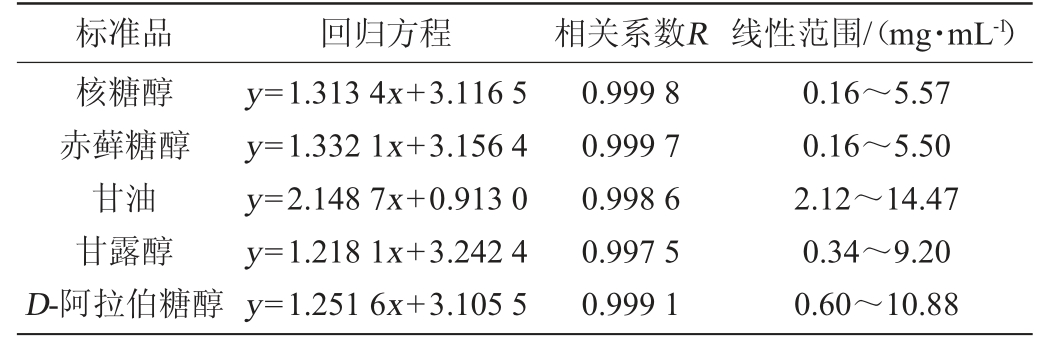
标准品 回归方程 相关系数R 线性范围/(mg·mL-1)核糖醇赤藓糖醇甘油甘露醇D-阿拉伯糖醇y=1.313 4x+3.116 5 y=1.332 1x+3.156 4 y=2.148 7x+0.913 0 y=1.218 1x+3.242 4 y=1.251 6x+3.105 5 0.999 8 0.999 7 0.998 6 0.997 5 0.999 1 0.16~5.57 0.16~5.50 2.12~14.47 0.34~9.20 0.60~10.88
利用HPLC-ELSD法按照实验条件,对12株酵母菌的发酵液中多元醇含量进行分析检测,将峰面积带入回归方程得到各多元醇的产量,结果见表2。
表2 不同酵母发酵液中多元醇含量
Table 2 Polyhydric alcohols contents in fermentation broth of different yeasts
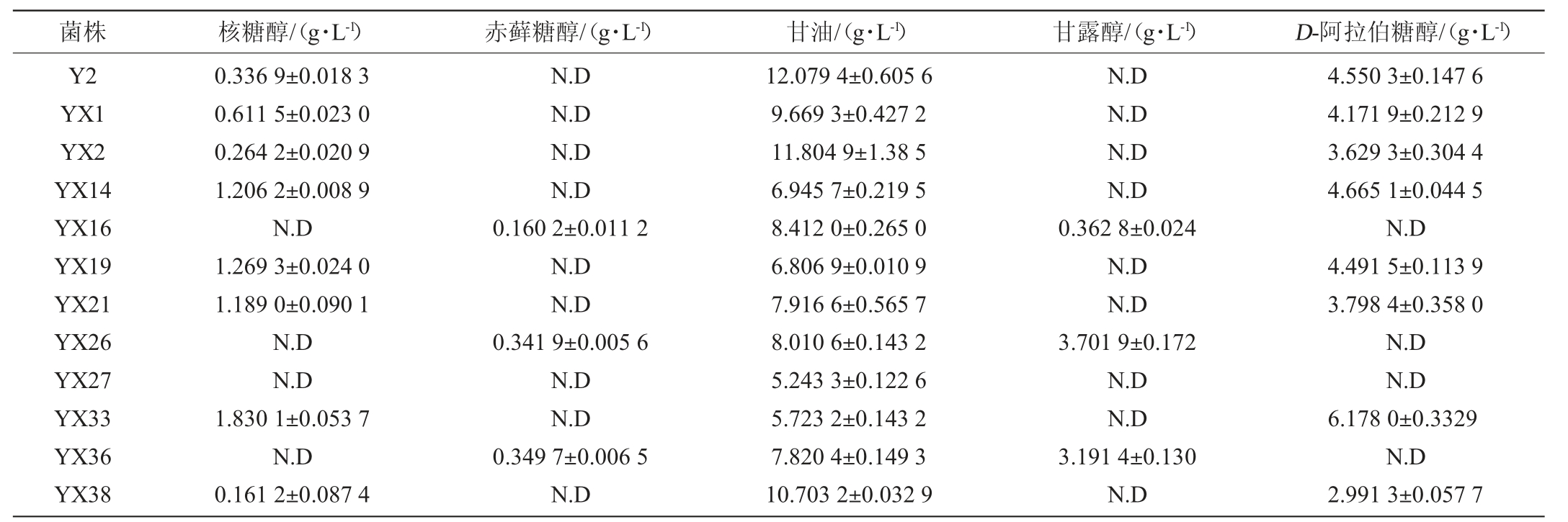
注:“N.D”表示未检出。
菌株 核糖醇/(g·L-1) 赤藓糖醇/(g·L-1) 甘油/(g·L-1) 甘露醇/(g·L-1) D-阿拉伯糖醇/(g·L-1)Y2 YX1 YX2 YX14 YX16 YX19 YX21 YX26 YX27 YX33 YX36 YX38 0.336 9±0.018 3 0.611 5±0.023 0 0.264 2±0.020 9 1.206 2±0.008 9 N.D 1.269 3±0.024 0 1.189 0±0.090 1 N.D N.D 1.830 1±0.053 7 N.D 0.161 2±0.087 4 N.D N.D N.D N.D 0.160 2±0.011 2 N.D N.D 0.341 9±0.005 6 N.D N.D 0.349 7±0.006 5 N.D 12.079 4±0.605 6 9.669 3±0.427 2 11.804 9±1.38 5 6.945 7±0.219 5 8.412 0±0.265 0 6.806 9±0.010 9 7.916 6±0.565 7 8.010 6±0.143 2 5.243 3±0.122 6 5.723 2±0.143 2 7.820 4±0.149 3 10.703 2±0.032 9 N.D N.D N.D N.D 0.362 8±0.024 N.D N.D 3.701 9±0.172 N.D N.D 3.191 4±0.130 N.D 4.550 3±0.147 6 4.171 9±0.212 9 3.629 3±0.304 4 4.665 1±0.044 5 N.D 4.491 5±0.113 9 3.798 4±0.358 0 N.D N.D 6.178 0±0.3329 N.D 2.991 3±0.057 7
从表2可以看出,12株酵母均产甘油,且甘油的产量相对较高。菌株YX33所产D-阿拉伯糖醇最多,达6.178 0 g/L;其次是核糖醇、甘露醇及赤藓糖醇。Y2产多元醇的总量最多,为16.966 6 g/L,包括核糖醇0.336 9 g/L、甘油12.079 4 g/L、D-阿拉伯糖醇4.550 3 g/L;YX27产多元醇总量和数量最少,仅产甘油5.243 3 g/L。对比白小燕等[18]对酱香型白酒酿造酵母产多元醇能力的研究可知,两者产多元醇能力总体相当,两种香型耐高糖酵母均产甘油、D-阿拉伯糖醇、赤藓糖醇,但老白干香型酵母与酱香型酵母不同的是还产核糖醇、甘露醇,同时老白干单株酵母同时产三种多元醇菌株较酱香型酵母更多,对于形成老白干香型白酒风格特点之“醇厚甘冽”有很大作用。
白酒生产过程中,酵母不仅是产酒微生物,也是重要的产香微生物。产酒酵母通过无氧呼吸产生乙醇,产酯酵母能够利用乙醇和其他代谢产物生成香味物质。研究表明,酵母除了具有产酒和产香的作用外,一部分酵母还具有产酶、产多元醇类物质的作用[19]。白酒的主成分是乙醇和水,占总量的98%~99%左右,溶于其中的酸、酯、醇、醛等种类繁多的微量化合物仅为总量的1%~2%,而这些微量成分却是白酒的呈香呈味物质,决定了白酒的风味及品质。从酿造过程中筛选的酵母虽然产多元醇能力不很高,但对于形成白酒风格具有重要作用。本研究筛选的酵母在白酒酿造过程中除了产多元醇,为白酒提供甜味外,也是酒精的主要来源,同时常见的酿酒酵母、假丝酵母[20]、德巴利氏酵母[21]鲁氏酵母[22]等能够产生酯类等风味物质,对白酒的风味和品质起着重要作用。
3 结论
本实验通过耐高糖实验筛选的12株酿造酵母为蜂生假丝酵母5株,鲁氏酵母3株,酿酒酵母2株,德巴利氏酵母1株,埃戚氏许旺酵母1株,12株酿造酵母均具有产多元醇能力,发酵液测得酵母所产多元醇分别为核糖醇、赤藓糖醇、甘油、甘露醇、D-阿拉伯糖醇,所有酵母都产甘油,且其中11株酵母均产3种多元醇,Y2产多元醇的总量最多,为16.966 6 g/L,除甘油外,以D-阿拉伯糖醇最为常见且产量最高。各香型白酒国家标准中均明确要求不添加非白酒发酵产生的呈香呈味物质,因此通过筛选、利用白酒酿造过程中的产多元醇酵母,可从源头上改善白酒的品质,响应新发展理念,为消费者提供更高质量、绿色健康的醇香美酒。
[1]白小燕.酱香白酒酿造过程中产多元醇酵母菌株筛选及应用研究[D].贵阳:贵州大学,2017.
[2]王跃.白酒变压变温蒸馏自动化系统设计[D].天津:天津大学,2012.
[3]宋林林,李净,谭光迅,等.枝江白酒含氮化合物和多元醇的定量分析[J].酿酒,2015(3):42-45.
[4] TAT L,COMUZZO P,STOLFO I,et al.Optimization of wine headspace analysis by solid-phase microextraction capillary gas chromatography with mass spectrometric and flame ionization detection[J]. Food Chem, 2005,93(2):361-369.
[5]沈怡方.白酒技术全书[M].北京:中国轻工业出版社,2008:55-58.
[6]SPENCERJF T,SALLANSH R.Production of polyhydric alcohols by osmophilic yeasts[J].Canad J Microbiol,1956,2(2):72-79.
[7] SÁNCHEZ-FRESNEDA R,GUIRAO-ABAD J P,ARGUELLES A,et al.Specific stressinduced storage of trehalose,glycerol and D-arabitol in response to oxidative and osmotic stress in Candida albicans[J]. Biochem Biophys Res Communicat,2013,430(4):1334-1339.
[8]范光先,诸葛健,徐成勇.高浓度盐对耐高渗酵母产多元醇的影响[J].工业微生物,2001,31(1):1-3.
[9] YOSHIKAWA J, HABE H, MORITA T, et al. Production of D-arabitol from raw glycerol by Candida quercitrusa[J]. Appl Microbiol Biotechn,2014,98(7):2947-2953.
[10] JEON Y J, SHIN H S, ROGERS P L. Xylitol production from a mutant strain of Candida tropicalis[J].Lett Appl Microbiol,2011,53(1):106-113.
[11]尤翠萍.发酵法生产木糖醇中重要中间产物的发酵条件的研究[D].无锡:江南大学,2011.
[12]ESCALANTE J,GLÒRIACAMINALSAPERA S,GALIMANYM F,et al.Production of arabitol from glucose by Hansenula polymorpha[J].J Ferment Bioeng,1990,70(4):228-231.
[13]ZHANG G,LIN Y,HE P,et al.Characterization of the sugar alcohol producing yeast Pichia anomala[J]. J Ind Microbiol Biotechn,2013,41(1):41-48.
[14] KUMAR S, DHEERAN P, SINGH S P, et al. Bioprocessing of bagasse hydrolysate for ethanol and xylitol production using thermotolerant yeast[J].Bioproc Biosyst Eng,2014,38(1):39-47.
[15]王颖群,陶涛.微生物渗透压调节过程中的相容性溶质[J].微生物学通报,1994(5):293-296.
[16]杨利博.Yarrowia lipolytica 高渗发酵生产赤藓糖醇及高渗响应机制研究[D].无锡:江南大学,2015.
[17] BROWN A. Compatible solutes and extreme water stress in eukaryotic micro-organisms[J].Adv Microbial Physiol,1978,17(3):181-242.
[18]白小燕,邱树毅,雷安亮,等.酱香白酒酿造过程中产多元醇功能酵母的筛选[J].中国酿造,2017,36(5):58-62.
[19]胡帮超,刘国英,董琪,等.白酒酿造中功能性酵母菌的研究及应用[J].酿酒,2017,44(2):13-18.
[20]李增胜,任润斌.清香型白酒发酵过程中酒醅中的主要微生物[J].酿酒,2005(5):33-34.
[21]王涛,姚韬,李涛,等.浓香型白酒酿造相关酵母发酵糟醅产己酸乙酯的研究[J].食品与发酵工业,2013,39(1):41-45.
[22]李梦琦,赵一凡,郑飞云,等.耐高糖产香酵母菌的分离鉴定及其应用[J].食品与发酵工业,2019,45(24):45-51.