酯酶是指能够催化酯键水解或合成的酶类,当发生水解时,能催化酯键产生相应的酸和醇;合成时,可以把酸的羧基与醇的羟基缩合并脱水,产物为酯类及其它香味物质。甾醇酯酶(sterol esterase)又称为胆固醇酯酶,它他泛存在于包括人在内的高等动物、微生物等生物体内[1]。甾醇酯酶能够在水相条件下催化甾醇酯水解生成甾醇和脂肪酸,同时在有机溶剂中通过酯化或酯交换进行催化酯合成反应[2]。甾醇酯酶作为一种重要的酶制剂,可帮助机体消化吸收油脂类营养物质,因其与人体脂质代谢及胆固醇吸收有关,甾醇酯酶是检测血液中总胆固醇含量的重要酶制剂之一[3]。同时还可解决机械制浆造纸工艺中树脂障碍问题的潜力[4],由于其广泛的底物特异性和稳定性,在食品、医药、纸浆工业及化工行业等发挥重要作用[5]。
自然界中,微生物生产的甾醇酯酶具有生产成本低、工艺简单、不易污染、不受季节影响及易形成规模化生产等优点,已成为目前研究热点[6-7]。
本研究以莓实假单胞菌(Pseudomonas fragi)Q-06为出发菌株,对其发酵培养基和发酵条件进行单因素、Plackett-Burman(PB)、最陡爬坡试验、Box-Behnken(BB)和响应面试验[9-10]。通过对最优发酵条件的初步探究,提高酶产量和酶活力,以期为此海洋低温甾醇酯酶的规模化生产打下良好的基础,并提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 出发菌株莓实假单胞菌(Pseudomonas fragi)Q-06 筛选自渤海海泥中,保藏于辽宁省海洋微生物工程技术研究中心。
1.1.2 试剂
可溶性淀粉:哈灵生物公司;麦芽糖、葡萄糖、氯化铵:吉林东博生物公司;蔗糖、乳糖、硝酸铵:赛德试剂公司;牛肉膏:福建明福试剂公司;辣根过氧化物酶:生工生物(上海)股份工程有限公司;胆固醇氧化酶(cholesterol oxidase,COD):上海源叶生物科技有限公司;罗丹明B:国药集团化学试剂有限公司;植物甾醇酯:江苏春之谷生物制品有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
保藏培养基:酵母浸粉10 g/L,蛋白胨10 g/L,葡萄糖6 g/L,K2HPO4 2 g/L,琼脂粉20 g/L,单蒸水1.0 L,pH 7.0。
种子培养:胰蛋白胨10 g/L,牛肉膏5 g/L,NaCl 10 g/L,pH 7.0。
发酵培养基:植物甾醇酯0.5%,酵母粉0.3%,KH2PO4 0.1%,MgSO4·7H2O 0.03%,(NH4)2SO4 0.05%,葡萄糖0.5%,pH值为7.0。
1.2 仪器与设备
LFX-30B Thermo酶标仪:北京昊诺斯科技有限公司;HZP-256 全温振荡培养箱:上海智诚分析仪器制造有限公司;BA410E生物显微镜:麦克迪奥实业集团有限公司;NB-1630超净工作台:菲迪康乐(广州)科学仪器有限公司;LDFX-50BI立式压力蒸汽灭菌锅:兰州方盛生物科技有限公司;PHS-3E雷磁pH计:上海仪电科学仪器股份有限公司;UV-H232可见紫外分光光度计:菲迪康乐(广州)科学仪器有限公司。
1.3 方法
1.3.1 菌株活化
将菌株Q-06接种于LB平板上,28 ℃活化培养24 h,重复活化3次,4 ℃保存备用。
1.3.2 种子液制备
将活化后的单菌落接种于种子培养基中,28℃、200r/min振荡培养24 h,连续转接3次。
1.3.3 发酵液制备
将二级种子液以3%~5%接种量,接种到发酵培养基中,28 ℃、200 r/min振荡培养48 h。
1.3.4 菌株生长曲线与发酵产酶酶活曲线测定
无菌条件下,对发酵液每隔4h定时取样。28℃、200r/min振荡培养,利用分光光度计测定波长600 nm处吸光度值(OD600nm值),以确定菌株的生长情况和产甾醇酯酶活力的大小。
1.3.5 菌株粗酶液制备
对振荡培养48h的发酵液,在温度为4℃、转速为8000r/min、时间为20 min条件下离心得到的上清,即为粗酶液[9]。
1.3.6 甾醇酯酶活性测定方法
酶活定义:在测定条件下,每分钟催化1 μmol底物水解所消耗的酶量为一个酶活单位(IU)[9]。
根据甾醇酯酶活性的测定原理进行酶活性测定,具体操作参考曾诚等[3]的报道:分别配制底物溶液(在0.15 mol/L磷酸缓冲液中先后加入胆固醇亚油酸酯0.61 mmol/L,异丙醇8.0%,0.015 TritonX-100 mol/L,调节pH为7.0)与4-乙酰氧基氮杂环丁酮-苯酚工作液(0.15 mol/L磷酸缓冲液中分别加入1.48 mmol/L 4-乙酰氧基氮杂环丁酮,3.0 IU/mL过氧化物酶,0.5 IU/mL COD,0.01 mmol/L苯酚,pH 7.0),将两者按照1∶2的比例混合,再加入适量酶液,充分混合后于37 ℃水浴条件下反应15 min,以灭活酶液作为对照,测量波长500 nm处的紫外吸光度值,平行3次,取平均值。相对酶活(%)即为样品酶活与同组最高酶活之比。
1.3.7 发酵条件优化
在基础培养条件为28 ℃、200 r/min、摇瓶发酵48 h,碳源、氮源添加量为3.0%的基础上,分别改变不同的发酵条件,考察不同碳源种类(可溶性淀粉、葡萄糖、蔗糖、乳糖、麦芽糖、糊精)、最适碳源添加量(1.0%、2.0%、3.0%、4.0%、5.0%)、不同氮源种类(尿素、牛肉膏、NH4Cl、酵母粉、NH4NO3、蛋白胨)、最适氮源添加量(0.50%、0.75%、1.00%、1.25%、1.50%、1.75%)、不同无机盐(1.0%KH2PO4、1.0%MgSO4·7H2O、1.0%(NH4)2SO4),不同的初始pH值(6.0、6.5、7.0、7.5、8.0、8.5)、培养温度(22 ℃、24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)、转速(150 r/min、160 r/min、170 r/min、180 r/min、190 r/min、200 r/min)、装液量(30 mL/250 mL、50 mL/250 mL、70mL/250mL、90mL/250mL、110mL/250mL、130mL/250mL)、二级种子液接种量(2%、3%、4%、5%、6%、7%)对菌株Q-06生长的影响。
1.3.8 发酵条件Plackett-Burman试验设计
在确定了菌株发酵产酶的最优单因素条件后,在此基础上,在发酵产酶条件中选择酵母粉添加量、葡萄糖、转速、磷酸二氢钾、pH、接种量、装液量和温度8个因素作为PB试验的考察对象,进行PB试验设计(N=12),最终确定3个显著影响因素[10-11]。PB试验设计见表1。
表1 发酵条件优化PB试验设计因素与水平
Table 1 Factors and levels of PB tests for fermentation conditions optimization

因素A 酵母粉/%B 葡萄糖/%水平-1 +1 1.00 2.0 1.50 4.0
续表
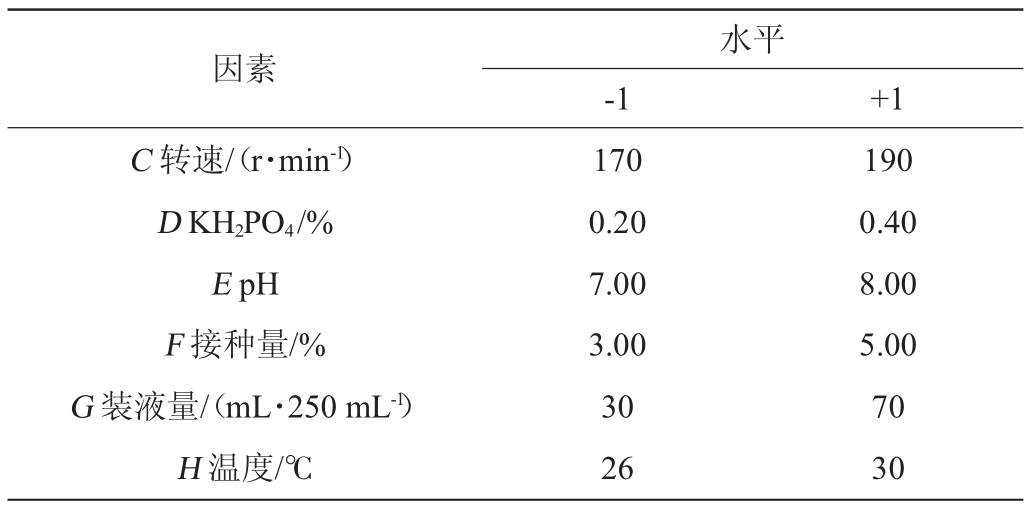
因素水平-1 +1 C 转速/(r·min-1)D KH2PO4/%E pH F 接种量/%G 装液量/(mL·250 mL-1)H 温度/℃170 0.20 7.00 3.00 30 26 190 0.40 8.00 5.00 70 30
1.3.9 最陡爬坡试验设计
通过上述PB试验后,得到影响菌株Q-06发酵产酶的3个显著因素,然后对其进行步长设计,设计2个因素逐渐增大步长,1个因素逐渐减小步长,进行中心组合试验[12]。
1.3.10 响应面试验设计
以菌株Q-06发酵产酶的酶活性最高点为中心点,对上述最显著的3因素进行3水平的Box-Behnken试验设计。试验因素与水平见表2。运用上述软件所得到的最优结果对预测值进行验证,取3次试验均值[13]。
表2 发酵条件优化响应面试验因素与水平
Table 2 Factors and levels of response surface tests for fermentation conditions optimization
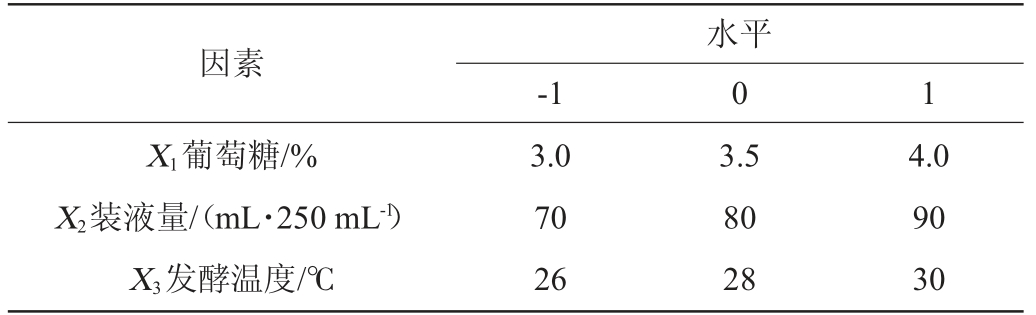
因素-1水平0 1 X1葡萄糖/%X2装液量/(mL·250 mL-1)X3发酵温度/℃3.0 70 26 3.5 80 28 4.0 90 30
1.3.11 数据处理与分析
通过Design-Expert.8.0.5b 软件对中心组合试验数据进行显著性检验。
2 结果与分析
2.1 菌株生长及发酵产酶酶活曲线
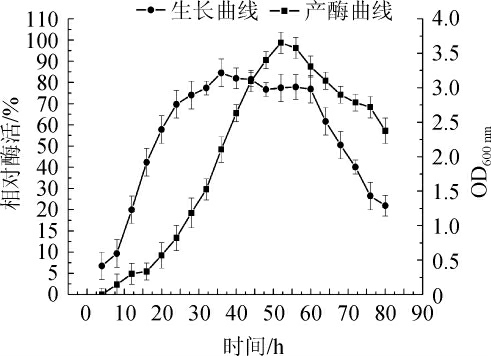
图1 菌株Q-06生长曲线与发酵产酶曲线
Fig. 1 Growth curve and enzyme production curve of strain Q-06
由图1生长曲线可发现,甾醇酯酶菌株Q-06以4 h作为分界线,4 h前为迟滞期;从4 h后菌株生长迅速,开始进入对数生长期,该时期的菌株活力最旺盛,生长速率常数R最大代时最短;35 h后菌株开始进入稳定期,该阶段菌株生长速率常数R=0,个数基本保持不变;60 h后菌株开始进入衰亡期,该时期菌株总数减少。从图1产酶曲线中还可看出,在4~20 h之间菌株Q-06发酵酶活较低,20~48 h酶活迅速增加,当发酵时间为50 h时,达到酶活性最高点,而后酶活性缓慢下降,因此可判断该菌株属于同型发酵。
2.2 发酵条件优化
2.2.1 不同种类的碳源及添加量对发酵产酶的影响
碳源种类的差异对菌株产酶效果影响较大。由图2可知,当发酵培养基以葡萄糖为发酵培养基碳源时,酶活力最高;以糊精为发酵培养基碳源时,产酶活力最低,因此选择葡萄糖作为最优碳源。
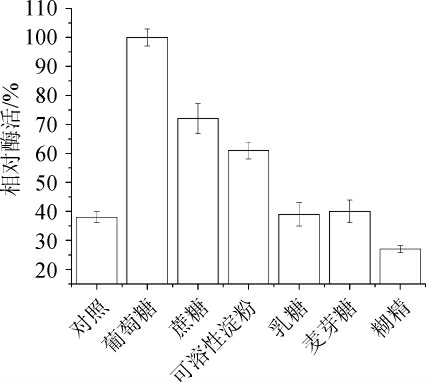
图2 不同类型的碳源对酶活的影响
Fig. 2 Effect of different carbon sources on enzyme activity
确定葡萄糖为菌株Q-06发酵产甾醇酯酶的最适宜碳源后,改变其添加水平,选出葡萄糖最适添加量,结果见图3。由图3可知,随着葡萄糖添加量的增加,菌株产甾醇酯酶的能力先升高后降低,当葡萄糖添加量为3%时,菌株产甾醇酯酶效果最好;因此,选择葡萄糖3%为发酵培养基最适碳源添加量。
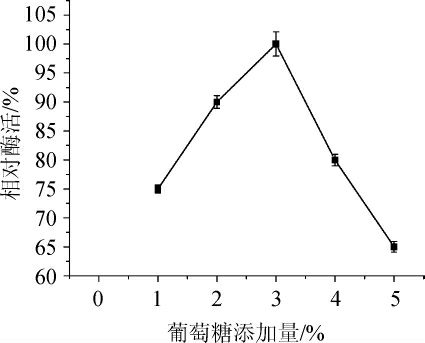
图3 葡萄糖添加量对酶活的影响
Fig. 3 Effect of glucose addition on enzyme activity
2.2.2 不同种类的氮源及添加量对发酵产酶的影响
为确定发酵培养基的最优氮源种类,分别选择不同种类的有机氮源和无机氮源添加于发酵培养基中,结果见图4。
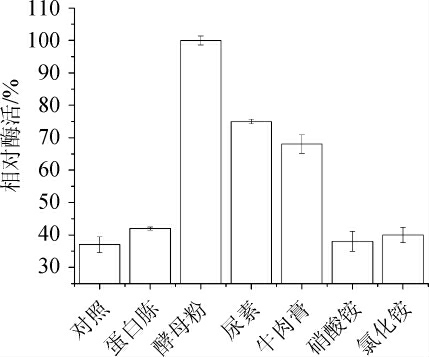
图4 不同种类氮源对酶活的影响
Fig. 4 Effect of different nitrogen sources on enzyme activity
由图4可知,当发酵培养基以酵母粉为氮源时,发酵产酶活力最高,其次是尿素和牛肉膏。因此,选择发酵产酶能力最高的酵母粉为最优氮源。
在确定酵母粉为菌株发酵产甾醇酯酶的最适宜氮源后,改变其添加量,选出适合发酵的最适氮源添加量,结果见图5。
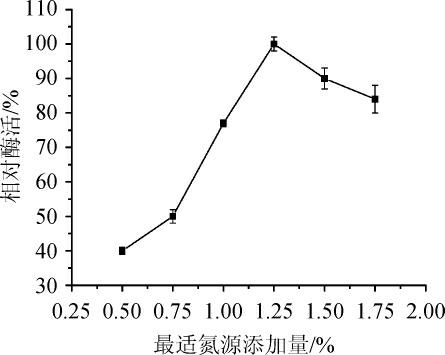
图5 酵母粉添加量对酶活的影响
Fig. 5 Effect of yeast powder addition on enzyme activity
由图5可知,随着酵母粉含量在0.50%~1.25%范围内的增加,甾醇酯酶相对酶活不断升高,当酵母粉添加量为1.25%,酶活最高,因此选择1.25%酵母粉作为发酵培养基中最适氮源添加量。
2.2.3 不同种类无机盐及添加量对发酵产酶的影响
由图6、7可知,无机盐(NH4)2SO4、MgSO4·7H2O、KH2PO4对发酵产酶均有一定的影响。当加入量为0.4%时加入KH2PO4的发酵液内相对活性最高。选出KH2PO4为最优无机盐,然后调整KH2PO4添加量为0.1%、0.2%、0.3%、0.4%、0.5%,考察不同浓度KH2PO4对酶活的影响,结果表明,无机盐KH2PO4最适添加量为0.4%。
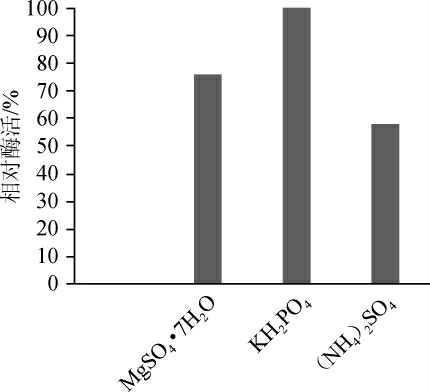
图6 不同种类无机盐对酶活的影响
Fig. 6 Effect of different inorganic salts on enzyme activity
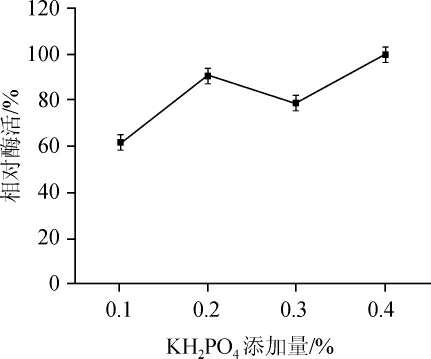
图7 不同KH2PO4添加量对酶活的影响
Fig. 7 Effect of different addition of KH2PO4 on enzyme activity
2.2.4 初始pH对发酵产酶的影响
适当的pH对菌株生长很重要,而且在生成产物时也需要适当的pH。由图8可知,当初始pH为7.5时,酶活最高;当初始pH为7.5~8.5时,仍存在80%以上的相对酶活,说明该菌株耐碱性较强;当pH<7.5时,产酶活力直线下降。初始pH为7.5时相对酶活最高,故最适发酵pH为7.5。
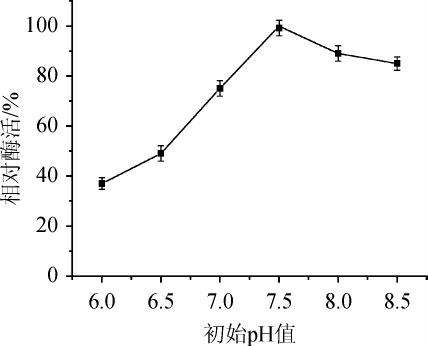
图8 初始pH值对发酵产酶的影响
Fig. 8 Effect of initial pH value on enzyme production by fermentation
2.2.5 培养温度对发酵产酶的影响
由图9可知,随着温度的升高,酶活先不断提高,当温度达到28℃时酶的活性达到最大,当温度继续升高时酶的活性出现下降趋势。这一结果说明了该菌株具备低温酶的特点,可以在工业生产中节约更多的能量,最适培养温度为28 ℃。
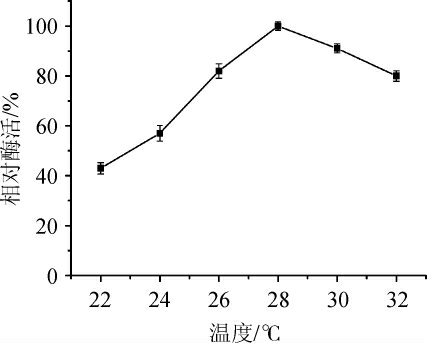
图9 培养温度对发酵产酶的影响
Fig. 9 Effect of culture temperature on enzyme production by fermentation
2.2.6 转速对发酵产酶的影响
发酵过程中,不同的转速也会影响菌株产酶,原因是转速调节着发酵过程的溶氧量,溶氧量的过高或过低直接影响菌株生长及后期酶的合成。由图10可知,转速<180 r/min时随着转速的加快相对酶活也不断提高,当转速提高到180 r/min以上对菌株产酶造成不良影响,导致相对酶活开始下降,当转速为180 r/min时其相对酶活最高,故最适转速为180 r/min。
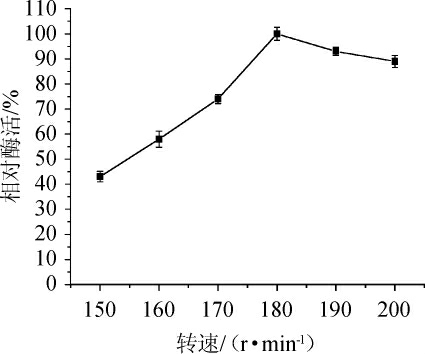
图10 转速对发酵产酶的影响
Fig. 10 Effect of rotation speed on enzyme production by fermentation
2.2.7 装液量对发酵产酶的影响
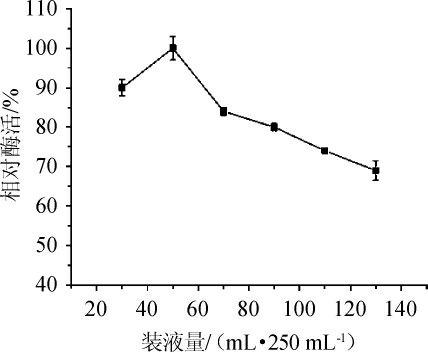
图11 装液量对发酵产酶的影响
Fig. 11 Effect of loading volume on enzyme production by fermentation
在一定程度上,摇瓶的装液量对酶活影响较大。过少的装液量不利于后期的中试生产的量产,降低企业的生产效率。由图11可知,当装液量为50 mL/250 mL时,发酵产酶活力最高,在装液量超过50mL/250 mL时,酶的活性开始下降,不利于发酵产酶,故最佳装液量为50 mL/250 mL。
2.2.10 接种量对发酵产酶的影响
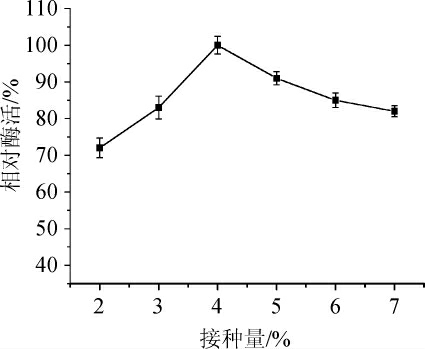
图12 接种量对发酵产酶的影响
Fig. 12 Effect of inoculum on enzyme production by fermentation
由图12可知,在接种量从2%提高到4%,相对酶活迅速提高,当以4%~6%的接种量进行接种时,相对酶活力均高于90%,在接种量高于5%时发酵过程中菌密度过大菌株生长受抑制产酶量降低,当接种量为4%时,相对酶活最高。
2.3 Plackett-Burman设计筛选显著因子
Plackett-Burman试验设计结果与显著性分析分别见表3和表4。由表4可知,葡萄糖、装液量、温度的P值均小于0.05,达到显著水平,即影响值均大于95%,对试验结果影响最显著。
表3 Plackett-Burman试验设计结果
Table 3 Results of Plackett-Burman tests design
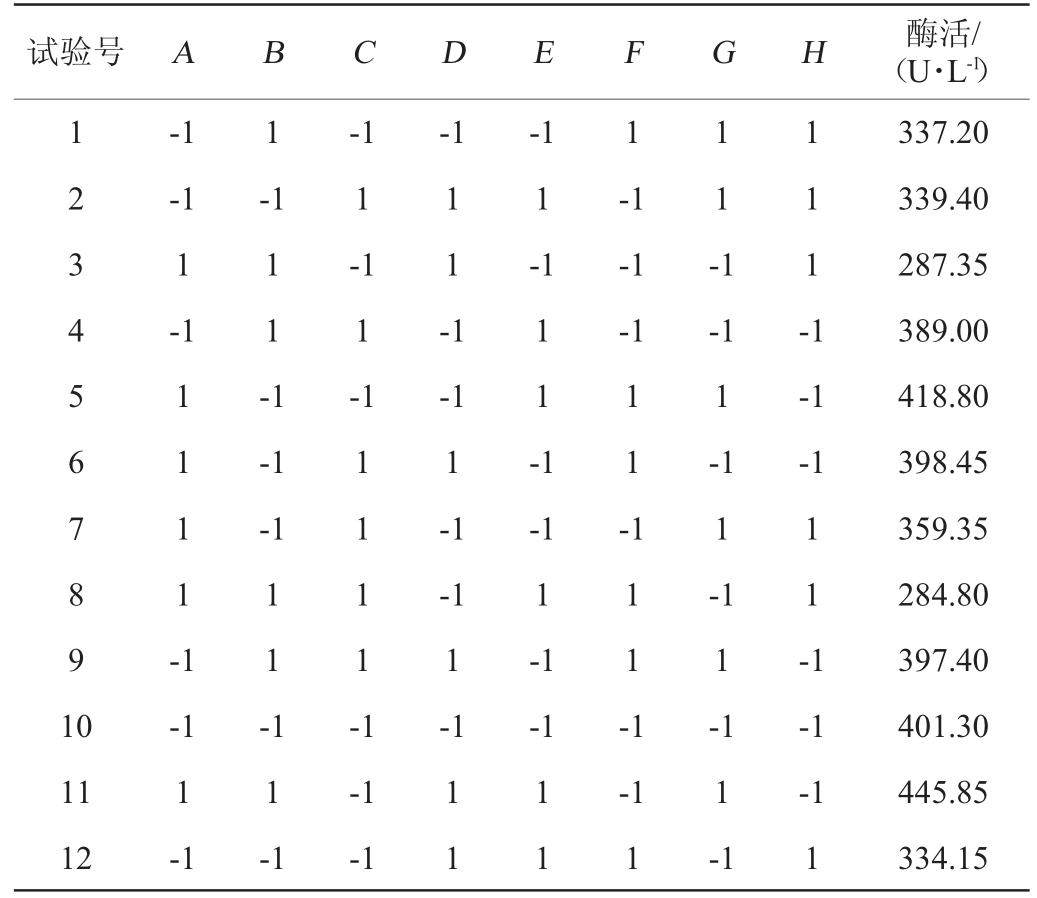
试验号 A B C D E F G H 酶活/(U·L-1)1 2 3 4 5 6 7 8 9 1 0-1-1 1-1 1-1 1-1 1 1 -1-1 1-1-1-1-1 1 1 -1 1 1 1 -1 1 1 1 1 -1 1 1 -1-1 1-1 1-1-1-1 1 1 -1 1 1 -1 1 1 1 -1-1-1 1 1 -1-1 1-1-1 1-1 1 1 --1 1-1-1 1 1 1 -1 11 12-1 1-1 1 1 -1-1-1 1 1 1 1-1 1-1 1-1 1-1 1-1 1-1-1-1 1 337.20 339.40 287.35 389.00 418.80 398.45 359.35 284.80 397.40 401.30 445.85 334.15
表4 Plackett-Burman试验设计显著性分析
Table 4 Significance analysis of Plackett-Burman tests design
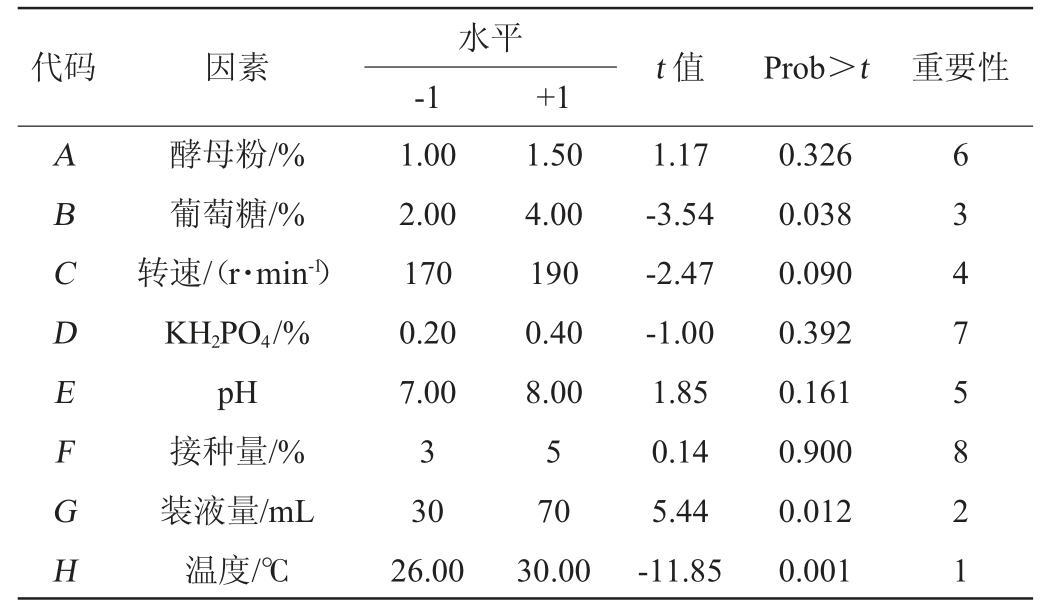
代码 因素 t 值 Prob>t 重要性水平-1 +1 ABCDEFGH酵母粉/%葡萄糖/%转速/(r·min-1)KH2PO4/%pH接种量/%装液量/mL温度/℃1.00 2.00 170 0.20 7.00 3 30 26.00 1.50 4.00 190 0.40 8.00 5 70 30.00 1.17-3.54-2.47-1.00 1.85 0.14 5.44-11.85 0.326 0.038 0.090 0.392 0.161 0.900 0.012 0.001 6 3 4 7 5 8 2 1
2.4 最陡爬坡试验设计及结果
在完成PB试验设计后,将葡萄糖和温度的值按照步长依次减小,装液量的值按照步长逐步增大,设计最陡爬坡试验,结果见表5。由表5可知,当葡萄糖添加量为3.5%,温度为28 ℃,装液量为80 mL/250 mL时,微生物产甾醇酯酶活性最大。所以选择以第2组实验作为中心组合实验的中心点,进行中心组合试验设计。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent tests

试验号 葡萄糖/% 装液量/(mL/250 mL-1) 温度/℃ 酶活/(U·L-1)1 2 3 4 4.0 3.5 3.0 2.5 70 80 90 100 30 28 26 24 395.46 432.89 416.65 368.79
2.5 响应面试验设计
通过PB试验和最陡爬坡试验确定的3个显著因素葡萄糖、装液量和温度后,再运用Design-Expert.V8.0.5b软件,设计3因素3水平的BB试验,响应面试验结果见表6。
表6 发酵条件优化Box-Benhnken试验结果
Table 6 Results of Box-Benhnken tests for fermentation conditions optimization
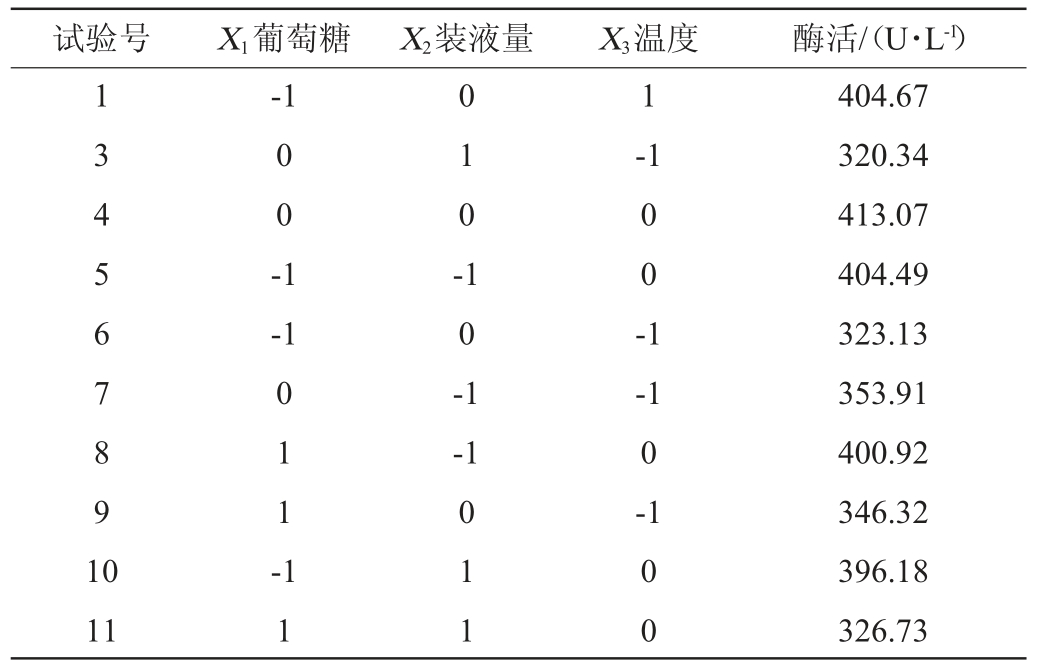
试验号 X1葡萄糖 X2装液量 X3温度 酶活/(U·L-1)1 3 4 5 6 7 8 9 1 0-1 1 0 0 -1 0 1 0 --1-1 0 0 -1 0 1 1 -1 0 -1-1-1 0-1 11 1 1 0 1 1 0 0 404.67 320.34 413.07 404.49 323.13 353.91 400.92 346.32 396.18 326.73
续表
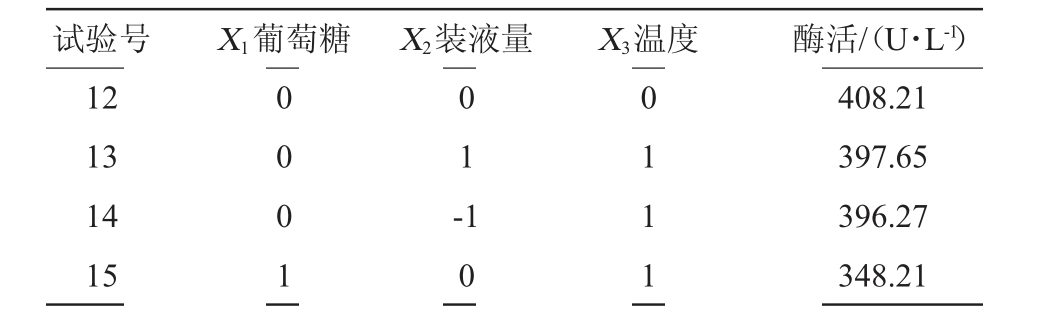
试验号 X1葡萄糖 X2装液量 X3温度 酶活/(U·L-1)12 13 14 15 0 0 0 1 0 1 -1 0 0 1 1 1 408.21 397.65 396.27 348.21
通过Design-Expert.8.0.5b 软件对中心组合试验数据进行显著性检验(见表7)和方差分析(见表8)。由此可以得到,菌株Q-06产甾醇酯酶酶活(Y)与影响发酵显著因素之间的回归方程如下:
表7 回归系数显著性检验
Table 7 Significance test of regression coefficients
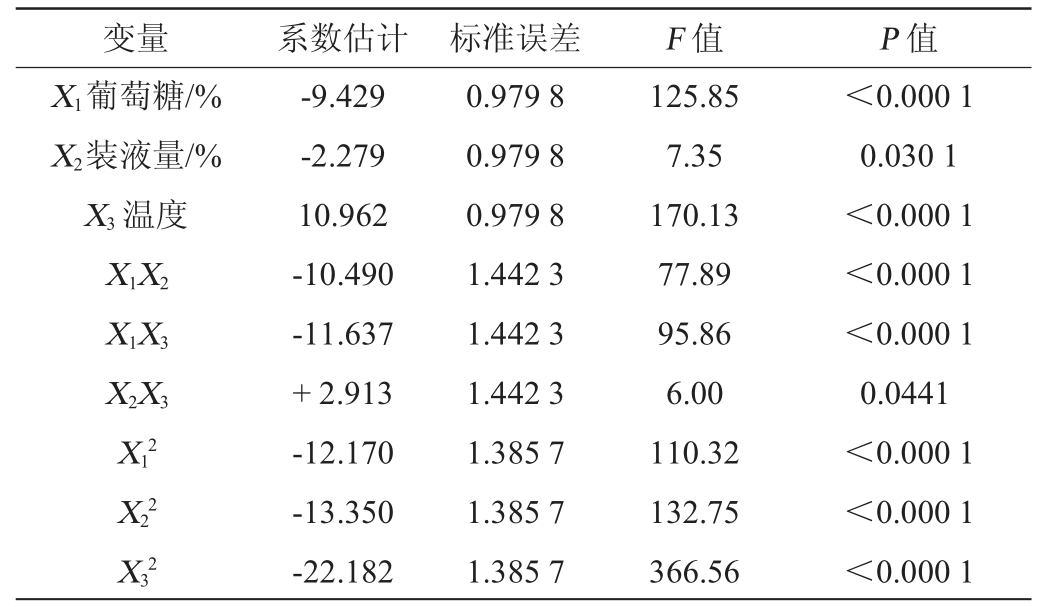
变量 系数估计 标准误差 F 值 P 值X1葡萄糖/%X2装液量/%X3 温度X1X2 X1X3 X2X3 X12 X22 X32-9.429-2.279 10.962-10.490-11.637+2.913-12.170-13.350-22.182 0.979 8 0.979 8 0.979 8 1.442 3 1.442 3 1.442 3 1.385 7 1.385 7 1.385 7 125.85 7.35 170.13 77.89 95.86 6.00 110.32 132.75 366.56<0.000 1 0.030 1<0.000 1<0.000 1<0.000 1 0.0441<0.000 1<0.000 1<0.000 1
表8 回归方程的方差分析
Table 8 Variance analysis of regression equation
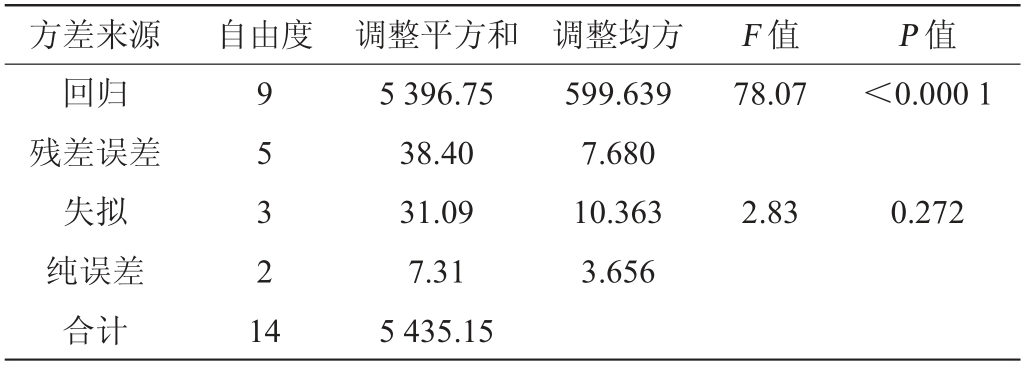
方差来源 自由度 调整平方和 调整均方 F 值 P 值回归残差误差失拟纯误差合计9 5 3 2 1 4 5 396.75 38.40 31.09 7.31 5 435.15 599.639 7.680 10.363 3.656 78.07<0.000 1 2.83 0.272
由表7和表8可知,该设计中失拟项P>0.05,不存在失拟因素,因此,该模型有意义[14]。在回归模型中,决定系数R2为99.37%,校正决定系数R2Adj为0.973 2,模型变异系数仅为2.68%。由此可以看出,该模型的拟合度较好,设计可靠。因此,可以使用该回归方程代替试验真实点分析和预测菌株实际发酵产酶结果。
统计软件Design-Expert.V8.0.6对回归方程进行分析,得响应面及等高线见图13,通过对回归方程进行分析,得到最佳工艺条件为,并根据实际操作条件调整为发酵温度28 ℃、葡萄糖添加量3.0%、装液量50 mL/250 mL,由优化前的360.00 U/L提高至479.64 U/L,是优化前的1.33倍。

图13 葡萄糖添加量、装液量及温度间交互作用对酶活性的影响的响应面及等高线
Fig. 13 Response surfaces plots and contour lines of effects of interaction between glucose addition, loading volume and temperature on enzyme activity
3 结论
为了提高莓实假单胞菌(Pseudomonas fragi)Q-06产低温胆固醇酯酶的能力,以单因素试验为基础,通过PB试验设计响应面试验,对菌株Q-06发酵产酶条件进行优化。结果表明,培养基配方中葡萄糖添加量3.0%,酵母粉添加量为1.3%,(NH4)2SO4添加量0.010%,MgSO4·7H2O添加量0.050%,KH2PO4 添加量0.400%。最适宜发酵温度为28 ℃,转速180 r/min,接种量4%,初始pH 7.5,装液量50 mL/250 mL。研究通过单因素及响应面法优化了发酵菌株发酵产酶的发酵条件。结果表明,发酵菌株Q-06产甾醇酯酶由优化前的360.00 U/L提高至479.64 U/L,是优化前的1.33倍。达到了优化目的,并为后续研究奠定了基础。
[1]任楠楠,王晓辉,迟乃玉,等.微生物甾醇酯酶的研究进展[J].中国酿造,2017,36(6):9-13.
[2]么婷婷,辛嘉英,王艳,等.植物甾醇酯的酶法合成[J].化学工程师,2016,30(9):4-9.
[3]曾诚,范远鑫,丁少军.甾醇酯酶菌株Chryseobacterium sp.的筛选及酶学性质研究[J].林产化学与工业,2013,33(3):43-49.
[4]刘振春,孙慧娟,耿存花,等.脂肪酶催化共轭亚油酸植物甾醇酯合成工艺的优化[J].西北农林科技大学学报(自然科学版),2014,42(6):173-179.
[5]朱振南,徐莉,张后今,等.响应面法优化皱褶假丝酵母脂肪酶催化合成甾醇共轭亚油酸酯[J].中国油脂,2013,38(7):40-43.
[6]王腾宇,王铭义,宋玉卿,等.响应面法优化生物酶法合成植物甾醇酯[J].食品科学,2011,32(4):59-63.
[7]任霞,吴忠义,黄丛林,等.拟南芥FT 基因原核表达载体的构建、表达和蛋白纯化[J].生物技术通报,2010(3):99-103.
[8]朱啟会,何腊平,张玲,等.降胆固醇双歧杆菌BZ11 的筛选及其耐受性评价[J].中国酿造,2017,36(3):54-58.
[9]陈琳,孟祥晨.响应面法优化植物乳杆菌代谢产细菌素的发酵条件[J].食品科学,2011,32(3):176-180.
[10] 张淑君,牟志美,姚娟,等.桑树内生真菌Macrophomina phaseolina MOD-1 原生质体制备条件的优化试验[J]. 蚕业科学,2012,38(2):216-223.
[11]刘国荣,张郡莹,王成涛,等.响应面法优化双歧杆菌B04 代谢产细菌素的发酵条件[J].食品科学,2013,34(3):147-152.
[12]金连豆,李晓艳,王晓辉,等.海洋胶红酵母菌CD-008 产超氧化物歧化酶发酵条件优化及酶分离纯化[J].中国酿造,2016,35(3):17-22.
[13]张亚慧,张玲,沈微,等.Burkholderia cepacia 胆固醇酯酶及其分子伴侣基因的串联表达及酶学性质的研究[J].工业微生物,2017,47(4):30-36.
[14]武翠玲,谭晓晶,姚明明,等.胆固醇酯酶高产菌株的筛选及动力学性质研究[J].中国酿造,2006,25(12):36-39.
[15]张庆芳,希伦,刘洋,等.海洋低温胆固醇氧化酶生产菌株诱变育种及酶学性质研究[J].中国酿造,2019,38(6):59-63.
[16]刘延波,邢星月,赵志军,等.高产脂肪酶菌株的筛选鉴定及产酶条件优化[J].中国酿造,2019(7):54-59.
[17]迟乃玉,肖景惠,倪瑞琪,等.海洋源低温微生物产苹果酸脱氢酶发酵条件优化[J].中国酿造,2019,38(6):59-63.
[18]高雅文,刘学军,修琳,等.响应面试验优化黄豆酱工艺条件及其色泽质构分析[J].中国酿造,2019,38(6):96-102.
[19]潘梓源,林佳漫,邓乃铨,等.桂圆酵素的发酵工艺优化及其酚类化合物生物转化分析[J].中国酿造,2019(7):95-99.
[20]曾丽萍,戴立威,吴姗姗,等.铁皮石斛发酵酒的工艺优化研究[J].中国酿造,2019,38(3):206-209.
[21]贾娟,王婷婷,杨雯雯,等.香梨发酵酒发酵工艺的优化及其香气成分研究[J].中国酿造,2019,38(5):101-107.