鲜湿发酵米粉是我国南方地区特色美食之一,口感爽滑、味道鲜美且食用便捷,深受消费者喜爱[1]。鲜湿发酵米粉经大米浸泡(发酵)、清洗、磨浆、熟化、成型、蒸粉、冷却、包装等工序制成[2]。中国南方常用“续渣法”发酵米粉,即将前次发酵液按适量比例接种至新鲜原料中,这种发酵方式能促进发酵,减少发酵时间[3]。发酵过程中微生物产生酸和酶等代谢产物改变大米化学成分,提高米粉蒸煮和食用品质。目前,已有学者对发酵米粉中微生物菌群组成进行了相关研究,然而不同地区样品研究结果不尽相同。LU Z H等[4]分离纯化发酵米粉中的微生物,发现米粉发酵液中优势菌群为乳酸杆菌(Lactobacillus)、乳酸链球菌(Streptococcus lactis)、酵母菌;马霞[5]从大米发酵液中分离得到1株优势菌株,经形态学特征、生理生化特性及16S rDNA基因序列分析鉴定其为乳酸乳球菌(Lactococcus lactis)。传统自然发酵米粉的发酵过程主要由自然环境和“续渣液”中微生物发酵完成,微生物种群的复杂和不确定性造成发酵时间随季节变化较大,企业生产产能效率受限,经济效益下降,发酵米粉规范管理和生产过程标准化进程缓慢。因此,无论是出于发酵条件优化,还是食品安全控制方面考虑,了解大米生产过程中发酵液菌相变化显得十分重要。
在发酵食品生产过程中,发酵微生物(优势菌)数量变化是决定发酵产品质量的重要指标,传统微生物菌落平板计数法费时费力且滞后,起不到预测作用[6],而预测微生物学能有效规避这些缺点。预测微生物学是一门交叉性学科,包含了数学、化学、微生物学和计算机技术等内容,将微生物数量变化趋势通过数学方法表达出来,不仅能预测发酵食品中优势菌生长规律,还能监测有害菌的生长变化,保证食品的发酵周期和安全性[7],从而为其进一步研究提供依据。预测微生物学常采用Exponential-linear模型、Logistic模型、Gompertz模型等基础数学模型,其中Gompertz模型能较好的预测微生物的生长趋势,Gompertz曲线呈S型,其形态特征是前后两段缓慢增长期中间夹着一段快速增长期,最具有代表性[8];修正的Gompertz模型可以描述一定环境下微生物数量随时间变化的关系[9]。目前,国内外利用Gompertz模型对食品基质中微生物生长模型的建立已有相关报道。刘亚兵等[10]运用Gompertz模型在冷却牛肉中建立了假单胞菌生长模型,有效地预测了冷却牛肉的货架期;LEE Y J等[11]运用Gompertz模型拟合了猪肉中金黄色葡萄球菌的生长曲线。Gompertz模型常应用于预测食品货架期[12],而应用于预测米粉发酵过程中优势菌生长趋势的报道较少。
本研究基于鲜湿发酵米粉生产工艺,探究不同发酵时期大米发酵液中微生物种类及其数量变化规律,并运用修正的Gompertz模型[13],采用统计学软件拟合微生物生长动力学模型,为进一步研究鲜湿发酵米粉生产过程中优势菌及其作用,提高生产效率,控制发酵周期,推进鲜湿发酵米粉标准制定奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
以湖南鲜湿米粉生产厂自然发酵大米发酵液作为试验材料,采集发酵0~4 d大米发酵液样品5组各3份,分别装入无菌采样瓶中,并编号0d1、0d2、0d3、1d1、1d2、1d3、2d1、2d2、2d3、3d1、3d2、3d3、4d1、4d2、4d3,带回实验室后置于冰箱保存,20 h内检测处理。
1.1.2 培养基
平板计数琼脂(plate count agar,PCA)培养基、MRS培养基、肠球菌培养基、孟加拉红培养基、结晶紫中性红胆盐葡萄糖琼脂(violet red bile glucose agar,VRBGA)培养基:北京陆桥生物技术有限责任公司。
1.2 仪器与设备
SW-CJ-1FD单人单面净化工作台:苏州净化设备有限公司;SPX-250BⅢ恒温培养箱:上海新苗医疗器械制造有限公司;FE28-pH计:梅特勒-托利多仪器有限公司;LDZX-50KBS立式高压蒸汽灭菌锅:上海申安医疗器械有限公司;CX23LEDRFS1C-生物显微镜:日本奥林巴斯工业有限公司。
1.3 试验方法
1.3.1 大米发酵液可培养微生物分离和计数
将发酵液样品按10倍梯度稀释后,取适当浓度的样品悬液,根据GB 4789.2—2016《食品安全国家标准食品微生物学检验菌落总数测定》[14]、GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[15]、GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》[16]、GB 4789.41—2016《食品安全国家标准食品微生物学检验肠杆菌科检验》[17]、葡萄球菌和微球菌的方法[18]分别对菌落总数、乳酸菌、霉菌酵母菌、肠杆菌和球菌进行培养和计数。
1.3.2 典型微生物形态特征观察
观察各培养基平板中微生物的菌落大小、颜色、形态、质地、光泽、隆起度、透明度和边缘结构等菌落形态,并对典型的细菌菌落和真菌菌落分别进行革兰氏染色和美蓝染色[19],于光学显微镜下观察其细胞形态和排列方式等菌体形态特征。
1.3.3 不同时期大米发酵液pH值的测定
采用pH计分别测定发酵0 d、1 d、2 d、3 d、4 d的大米发酵液的pH值,每个样品重复测定3次。
1.3.4 微生物生长动力学模型拟合[13]
采用Origin 9.0和SPSS25.0对可培养微生物试验数据结果进行统计,根据修正的Gompertz模型拟合微生物生长动力学模型,利用一级模型描述发酵时间与生物量的关系。修正的Gompertz模型如下:
式中:t为发酵时间,d;Nt为微生物在发酵时间t时的菌落总数的对数值,lg(CFU/mL);A为初始菌落数的对数值,lg(CFU/mL);C为随发酵时间无限增加时微生物增量的对数值,lg(CFU/mL);B为在发酵时间M时的相对最大比生长速率,d-1;M为达到相对最大比生长速率的所需时间,d。
其方程式是双指数函数,是一个非线性的微生物生长模型。根据该函数参数与微生物参数互换后可得出微生物生长的最大比生长速率v(d-1)、微生物生长迟滞期(lag-phase duration,LPD)(d)和微生物生长稳定期菌落总数的最大对数值Nmax(lg(CFU/mL)),其换算公式如下:
v=BC/e(e=2.7182);LPD=M-(1/B);Nmax=A+C。
2 结果与分析
2.1 可培养微生物形态特征
从选择性培养基中挑取典型菌落进行编号,观察菌落形态和菌体形态特征。在MRS培养基上共挑取了3种不同特征的菌落,分别编号为R1、R2、R3;在孟加拉红培养基上挑取类似霉菌和酵母的典型菌落,分别编号为M1、M2、J1;在肠球菌培养基上挑取典型菌落,分别编号为Q1、Q2;部分菌株的菌落大小、颜色、形态、质地、光泽、隆起度、透明度和边缘结构等和显微镜下细胞形态和排列方式见图1,具体描述见表1。

图1 部分典型菌落的菌落形态(A)及细胞形态(B)
Fig. 1 Colony morphology (A) and cell morphology (B) of partial typical colonies
由图1及表1可知,大米发酵液中微生物种类丰富,细菌主要为革兰氏阳性无芽孢菌,酵母菌形态单一,均呈圆形。米粉发酵过程中存在的乳酸菌可能为乳球菌和乳杆菌,这与前人报道一致[20];乳酸菌代谢产生的酸和酶具有消化淀粉、糖、蛋白质或脂肪的能力,对大米淀粉纯化提升米粉品质有着积极作用。LI N等[21]研究表明,乳酸菌发酵大米中蛋白质、脂肪、淀粉等含量发生变化,米粉弹性增强、吐浆率降低,口感柔韧顺滑。
表1 不同选择性培养基典型菌落的菌落及细胞形态特征
Table 1 Colony and cell morphological characteristics of typical colonies in different selective media
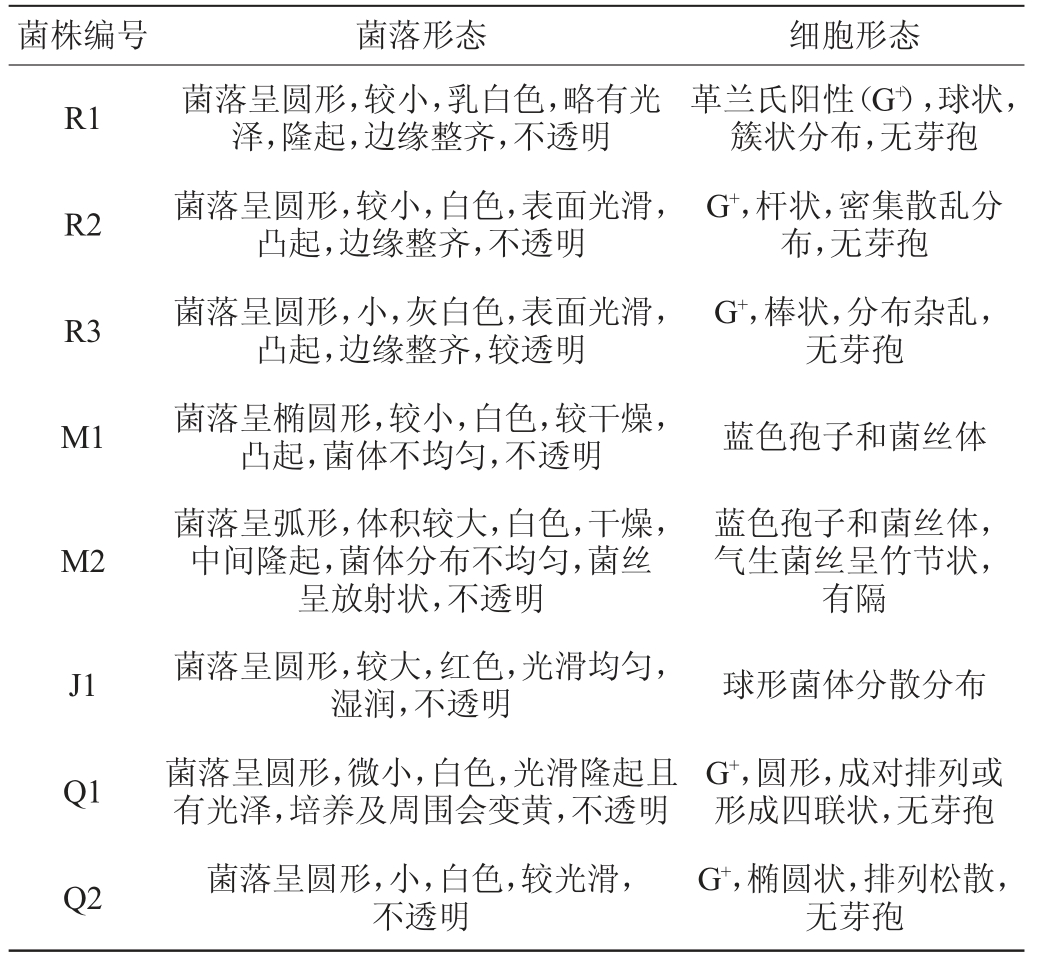
菌株编号 菌落形态 细胞形态R1 R2 R3 M1 M2 J1 Q1 Q2菌落呈圆形,较小,乳白色,略有光泽,隆起,边缘整齐,不透明菌落呈圆形,较小,白色,表面光滑,凸起,边缘整齐,不透明菌落呈圆形,小,灰白色,表面光滑,凸起,边缘整齐,较透明菌落呈椭圆形,较小,白色,较干燥,凸起,菌体不均匀,不透明菌落呈弧形,体积较大,白色,干燥,中间隆起,菌体分布不均匀,菌丝呈放射状,不透明菌落呈圆形,较大,红色,光滑均匀,湿润,不透明菌落呈圆形,微小,白色,光滑隆起且有光泽,培养及周围会变黄,不透明菌落呈圆形,小,白色,较光滑,不透明革兰氏阳性(G+),球状,簇状分布,无芽孢G+,杆状,密集散乱分布,无芽孢G+,棒状,分布杂乱,无芽孢蓝色孢子和菌丝体蓝色孢子和菌丝体,气生菌丝呈竹节状,有隔球形菌体分散分布G+,圆形,成对排列或形成四联状,无芽孢G+,椭圆状,排列松散,无芽孢
2.2 可培养微生物数量及变化规律
米粉发酵过程中大米发酵液微生物数量及变化规律见表2。
表2 大米发酵液微生物数量及其变化规律
Table 2 Quantity and change rule of microorganisms in rice fermentation broth

发酵时间/d 菌落总数/(CFU·mL-1) 乳酸菌/(CFU·mL-1) 霉菌酵母菌/(CFU·mL-1) 球菌/(CFU·mL-1) 肠杆菌/(CFU·mL-1) pH值0 1 2 3 4 2.79±0.12×107 1.34±0.33×108 1.95±0.28×108 2.30±0.27×108 2.48±0.20×108 2.50±0.50×106 3.13±0.31×107 1.63±0.27×108 2.43±0.17×108 2.56±0.28×108 2.20±0.75×102 2.53±0.23×103 1.21±0.10×103 7.65±1.54×102 2.18±1.00×102 7.35±0.98×102 5.23±0.76×102 9.30±1.30×101 3.50±0.50×101 1.50±0.50×101 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00 6.64±0.04 3.38±0.09 3.73±0.07 3.70±0.09 3.64±0.08
由表2可知,大米发酵液中菌落总数和真菌菌数变化趋势相似,呈先上升后下降或发酵后期趋于平稳的趋势。发酵0 d时菌落总数最大,乳酸菌次之,分别为2.79×107 CFU/mL、2.50×106 CFU/mL。发酵前期原料、环境和操作人员等因素造成菌落总数最高;发酵前加入的8%“续渣液”中主要菌群可能为乳酸菌,使得发酵0 d时乳酸菌菌落数较大。发酵1 d后各种微生物适应环境,菌落总数、乳酸菌菌数、霉菌酵母菌数均增加一个数量级;霉菌酵母培养基上霉菌数量较少,以酵母菌为主。从菌落平板计数结果来看,大米发酵液中乳酸菌和酵母菌数量最多,是大米发酵过程中的优势菌。乳酸菌代谢产生的乳酸能与酵母菌产生的酒精结合成乙酸乙酯,赋予米粉良好的香气[22]。发酵0~1 d,乳酸菌快速增长,此时乳酸菌适应发酵环境,诱导酶和有关中间代谢产物都已完全合成,酵母菌所产生的氨基酸和维生素能为乳酸菌的生长提供营养物质[23]。发酵2 d后乳酸菌数量增多,菌落总数增长趋于平缓,真菌、肠球菌数量减少。发酵2~4 d,乳酸菌增长速率相对放缓,这可能是随着发酵时间延长,乳酸菌作为发酵液中优势菌增长迅猛,与其他菌群争夺营养物质,在这种竞争环境下酵母菌数量逐渐减少,假丝酵母、酿酒酵母等酵母菌含有许多酶类如糖化酶、淀粉酶等,能将淀粉转化为单糖直接为乳酸菌提供营养物质[24]。酵母菌数量下降使乳酸菌可直接利用的营养物质减少和代谢产物积累出现反馈抑制作用导致乳酸菌增长速率缓慢。
可培养微生物数量不仅与发酵时间有关,同时受环境pH值影响。由表2亦可知,菌落总数发酵前期增长速率大于发酵中后期,发酵前期发酵液处于中性环境适合各类微生物生长,菌落总数快速增加;发酵后期菌落总数增长速率不如乳酸菌,一方面是因为随着乳酸菌数量的急剧增加,发酵液中有机酸含量大量积累,低pH值环境不适合于大多数微生物生长,其他微生物生长缓慢或受到抑制;另一方面乳酸菌代谢产生的抗菌肽,如细菌素,具有良好的抑菌作用[25]。发酵1 d后发酵液pH值迅速降低,pH值下降3.26,随后发酵液pH值变化不大,这与张玉荣等[26]报道一致。这可能是因为乳酸菌大量繁殖使发酵罐成为高密度环境,此时乳酸菌代谢产物积累和反馈抑制作用,乳酸菌产酸量达到峰值,发酵液中pH值不再发生大幅度变化[27]。前人报道酵母菌主要提高米粉的风味,乳酸菌提高米粉的食用品质[28],因而控制发酵时间和发酵环境中乳酸菌和酵母菌比例对发酵米粉品质有着重要作用。
2.3 菌落总数及乳酸菌生长动力学模型拟合
采用Gompertz模型,运用Origin9.0绘图软件对大米发酵液中的菌落总数及乳酸菌随时间变化情况进行拟合。利用Gompertz模型拟合菌落总数及乳酸菌生长预测曲线见图2,菌落总数及乳酸菌数生长预测曲线所对应的数学方程和模型参数分别见表3、表4。
Gompertz一级模型是专门用来描述微生物生长的函数,模型的决定系数R2描述了实验拟合参数的相关性,系数越接近1表示拟合度越高,参数之间的相关性越好[29]。由表3可知,菌落总数和乳酸菌总数的拟合度判定系数R2分别为0.953 5和0.999 2,拟合度判定系数R2值较高,均>0.95,说明Gompertz模型能很好的描述菌落总数和乳酸菌的生长曲线,以此生长动力学预测曲线为依据,可预测米粉生产过程中发酵液中菌落总数和乳酸菌的数量。方程拟合的初始菌落总数及乳酸菌数的对数值分别为7.51、6.43,最大菌落总数及乳酸菌数在第4天,分别为8.40、8.41,且由方程可以判断出发酵3 d时发酵液中菌落总数和乳酸菌数量相当。
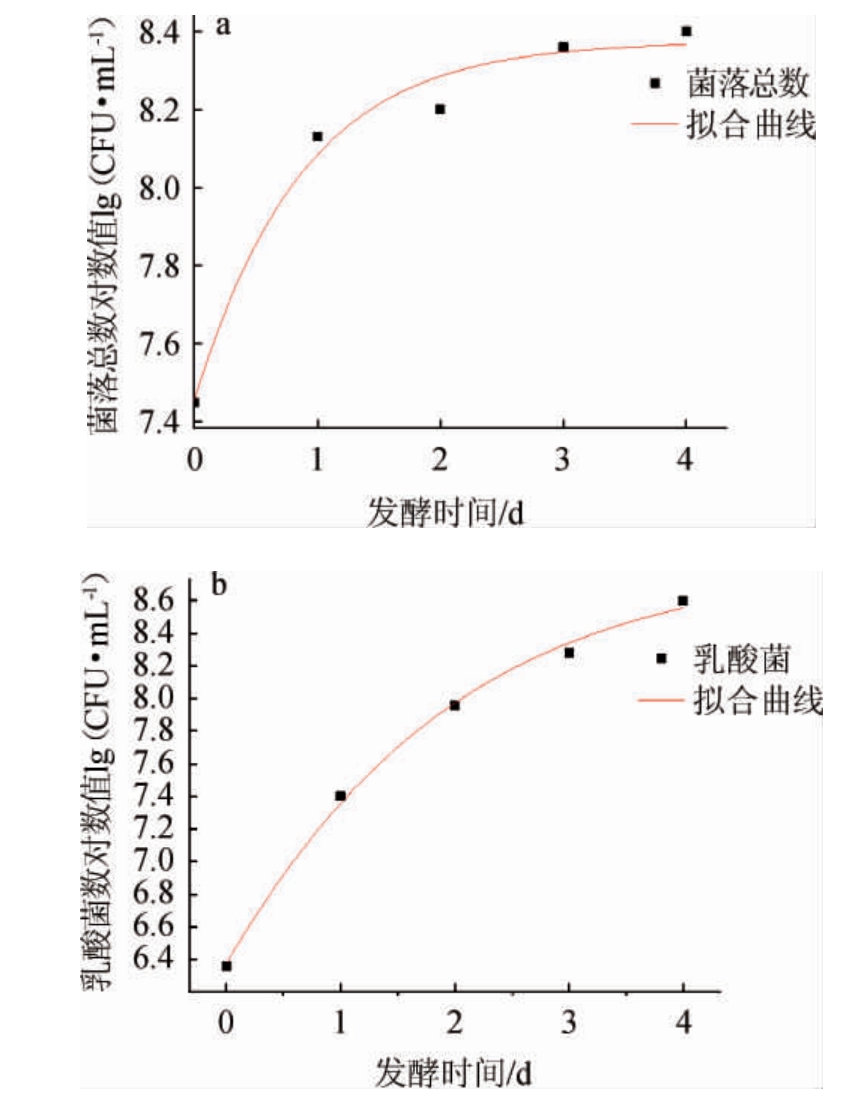
图2 菌落总数(a)及乳酸菌(b)生长曲线拟合
Fig. 2 Growth curve fitting of total bacterial count (a) and lactic acid bacteria (b)
表3 菌落总数和乳酸菌的生长动力学方程
Table 3 Growth kinetics equations of total bacterial count and lactic acid bacteria

种类 生长动力学方程 判定系数R2菌落总数0.953 5乳酸菌lg(Nt)=7.45+0.95×exp{-exp[2.718×0.656 63/0.95×(0.023 15-t)+1]}lg(Nt)=6.40+2.01×exp{-exp[2.718×1.417 56/2.01×(0.223 86-t)+1]}0.999 2
表4 菌落总数和乳酸菌生长动力学参数
Table 4 Growth kinetic parameters of total bacterial count and lactic acid bacteria

种类 A lg(CFU·mL-1) C lg(CFU·mL-1) B/d-1 M/d v/d-1 LPD/d Nmax/lg(CFU·mL-1)菌落总数乳酸菌7.45 6.40 0.95 2.01 1.878 7 1.916 9 0.555 4 0.745 5 0.656 63 1.417 56 0.023 15 0.223 86 8.40 8.41
由表4可知,乳酸菌的LPD值较菌落总数大,说明米粉发酵液中乳酸菌的延滞期较菌落总数长,这可能是由于发酵初期营养物质丰富,发酵液环境适宜,其他细菌迅速繁殖。乳酸菌的v值和M值均大于菌落总数,这说明乳酸菌最大比生长速率大于菌落总数,而达到最大比生长速率时间较菌落总数稍晚,但两者B值相差不大,说明在到达最大比生长速率时的相对最大比生长速率相差不大。发酵时间对米粉品质有重要作用,发酵时间过短,乳酸菌和酵母菌等微生物菌体浓度不够,对大米中碳水化合物发酵能力不强,米粉品质达不到要求;而长时间发酵的大米有酸味和腐败臭味,影响米粉品质[30]。
3 结论
本试验以不同发酵时间大米发酵液为研究对象,测定不同发酵时期发酵液中微生物菌落数量,并利用修正的Gompertz模型对菌落总数和乳酸菌总数进行一级拟合。平板计数结果表明,米粉生产过程中大米粉发酵液中数量最高的微生物为乳酸菌和酵母菌,修正的Gompertz模型对菌落总数和乳酸菌总数具有较高的拟合度,判定系数R2均>0.95。经拟合得出,菌落总数和乳酸菌总数的最大比生长速率分别为0.657 d-1、1.418 d-1,延滞期(LPD)分别为0.023 d、0.224 d,稳定期最大菌落数对数值分别为8.40、8.41。利用该模型可预测发酵液在不同发酵时间的乳酸菌及菌落总数变化趋势,这对不同阶段发酵液环境条件控制、米粉质量监控及保鲜储存等都有非常重要的意义。
[1]周显青,刘亚军,张玉荣.不同微生物发酵对于大米理化特性及米粉食味品质的影响[J].河南工业大学学报,2010,31(3):4-8.
[2]FU B X.Asian noodles:History,classification,raw materials,and processing[J].Food Res Int,2008,41(9):888-902.
[3]YANG Y,TAO W Y,LIU Y J,et al.Inhibition of Bacillus cereus by lactic acid bacteria starter cultures in rice fermentation[J]. Food Control,2008,19(2):159-161.
[4]LU Z H,PENG H H,CAO W,et a1.Isolation,characterization and identification of lactic acid bacteria and yeasts from sour Mifen,a traditional fermented rice noodle from China[J].J Appl Microbiol,2008,105(3):893-903.
[5]马霞.发酵对鲜湿米粉品质影响研究进展[J].中国酿造,2015,34(4):5-7.
[6]MCMEEKIN T,OLLEY J,RATKOWSKY D,et al.Predictive microbiology theory and application: Is it all about rates?[J]. Food Control, 2013,29(2):290-299.
[7]PIN C,AVENDAÑO-PEREZ G,COSCIANI-CUNICO E,et al.Modelling Salmonella concentration throughout the pork supply chain by considering growth and survival in fluctuating conditions of temperature,pH and Aw[J].Int J Food Microbiol,2011,145(1):96-102.
[8] TIMALAINA A, TIAN J P, WANG J. Mathematical and computational modeling for tumor virotherapy with mediated immunity[J]. Bull Math Biol,2017,79(1):1736-1758.
[9]张玉华,孟一,郭风军,等.基于预测微生物学的冷却牛肉货架期预测模型的建立[J].肉类研究,2019,33(11):61-66.
[10]刘亚兵,何腊平,高泽鑫,等.基于假单胞菌生长模型预测冷却牛肉的货架期[J].中国酿造,2017,36(8):114-119.
[11]LEE Y J,JUNG B S,KIM K T,et al.Predictive model for the growth kinetics of Staphylococcus aureus in raw pork developed using Integrated Pathogen Modeling Program(IPMP)2013[J].Meat Sci,2015,107:20-25.
[12]杨欢,刘毅,邵乐乐,等.真空包装狮子头货架期预测模型的建立[J].食品工业科技,2019,40(19):266-272.
[13]戴奕杰.冷却肉中假单胞菌生长动力学模型的建立及微生物预测预报[D].长沙:湖南农业大学,2011.
[14]中华人民共和国国家和计划生育委员会,国家食品药品监督管理总局.GB 4789.2—2016 食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2016.
[15]中华人民共和国国家和计划生育委员会,国家食品药品监督管理总局.GB 4789.35—2016 食品安全国家标准食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2016.
[16]中华人民共和国国家和计划生育委员会,国家食品药品监督管理总局.GB 4789.41—2016 食品安全国家标准食品微生物学检验肠杆菌科检验[S].北京:中国标准出版社,2016.
[17]中华人民共和国国家和计划生育委员会,国家食品药品监督管理总局.GB 4789.15—2016 食品安全国家标准食品微生物学检验霉菌和酵母菌计数[S].北京:中国标准出版社,2016.
[18]郑晓燕,林伟涛,徐世明,等.中式发酵干香肠中葡萄球菌和微球菌的分离筛选、鉴定和培养[J].中国酿造,2009,28(9):33-37.
[19]赖宏刚,蒋云升,张元嵩,等.真空包装冷鲜鸡中腐败菌微生物的分离鉴定[J].江苏农业科学,2018,46(17):198-201.
[20] LI Y, ZHENG X W, CHEN J Y, et al. Lactic acid bacteria diversity of fresh rice noodles during the fermentation process, revealed by culturedependent and culture-independent methods[J]. Biotech Biotechnol Equipment,2015,29(5):1-6.
[21]LI N,ZHANG B,ZHAO S,et al.Influence of Lactobacillus/Candida fermentation on the starch structure of rice and the related noodle features[J].Int J Biol Macromol,2019,121:882-888.
[22]肖勇生,黄安全,包珍,等.传统发酵米粉纯种发酵工艺优化[J].食品工业,2019,40(9):129-131.
[23]鲁战会,彭荷花,李里特,等.常德发酵米粉中的微生物分离纯化与鉴定[J].中国粮油学报,2006,21(3):23-26.
[24]杨冬雪,孙大庆,李洪飞,等.高产淀粉酶酵母菌的筛选和鉴定[J].安徽农学通报,2016,22(8):25-26,76.
[25]杨尚娇,倪亚雯,倪永清.新疆传统干酪中1 株产广谱细菌素乳酸菌的筛选及其生物学特性[J].中国酿造,2015,34(1):38-42.
[26]张玉荣,王云光,周显青,等.发酵碎米理化性质的变化及与米粉品质的关联性[J].粮食与饲料工业,2013(11):20-24,27.
[27]朱承亮.乳酸菌高密度发酵技术的研究[D].杭州:浙江大学,2008.
[28]易翠平,任梦影,周素梅,等.纯种发酵对鲜湿米粉品质的影响[J].食品科学,2017,38(4):20-25.
[29]靳玉龙,白婷,刘变芳,等.冷鲜猪肉中细菌总数Gompertz 生长预测模型的建立[J].肉类工业,2016(5):22-25.
[30]陶华堂.发酵大米理化特性变化与米粉品质形成机理[D].郑州:河南工业大学,2013.