乳酸菌是一类能够发酵碳水化合物并且产生乳酸的无芽孢、革兰氏阳性细菌[1]。近年来,大量的研究都证实了乳酸菌具有益生特性,特别是在改善人体肠道微环境方面发挥重要作用[2-3]。食品加工过程中,特别是诸如传统发酵香肠、发酵酸鱼、火腿、酱油、奶酪、泡菜等发酵食品的制备过程中往往会加入大量的食用盐,赋予产品风味和抑制杂菌的同时延长食品的保质期[4-6],但高浓度的盐在一定程度上会抑制发酵过程中乳酸菌的生长,盐胁迫会损伤细胞膜结构,进而导致胞内各种代谢紊乱甚至细胞死亡[7-8],但是最近的研究显示,盐胁迫具有提高鼠李糖乳杆菌(Lactobacillus rhamnosus)的富硒能力的作用[9]。
新疆拥有牧草地面积约0.511亿km2,是我国重要的畜牧业大省[10],其中伊犁牧区是新疆最主要的畜牧业基地之一。新疆少数民族有收集动物乳制作发酵奶制品的传统,从牧区奶制品和环境中挖掘菌种资源并加以保护成为一项重要工作[11-12],蒋艾廷等[13]从新疆塔城传统酸奶中筛选出具有优良产酸性能的30株乳酸菌,并对其自溶度和蛋白酶活力进行了研究;金丹等[14]从新疆塔城地区酸马奶中分离了53株乳酸菌,并筛选出5株能耐受13%乙醇的乳酸菌;张亚川等[15]从新疆伊犁州乳品中初步分离纯化出71株乳酸菌,并从中筛选出3株符合酸乳发酵菌种要求的德氏乳杆菌(Lactobacillus delbrueckii)。目前研究主要集中于乳酸菌的生理特性、生理学功能及其在工业中的应用,对高渗情况下乳酸菌发酵性能的研究较少,而乳酸菌发酵剂的生产性能(包括产香性、产粘性、产酸性)和抗逆性(耐酸耐胆盐能力)直接关系到最终发酵制品的性能,同时也是影响产品质量的一个因素。
本研究利用传统分离技术从新疆牧区土壤中筛选耐盐乳酸菌,通过形态观察及分子生物学技术对其进行鉴定,并对其发酵特性,特别是在高渗环境下(7%、8%NaCl)的发酵性能(耐酸耐胆盐能力)进行研究,以期获得发酵性能好和抗逆性强的优良发酵乳酸菌菌株,为高盐发酵食品的商业发酵剂开发提供研究基础,确保发酵乳等制品有一定的活菌数,食用后能在肠道中定植。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
土样来源于新疆维吾尔自治区伊犁哈萨克自治州额敏县牧区,具体信息见表1。
表1 土样来源
Table 1 Source of soil samples

土样编号 来源1 2 3 4天山牧场牧一村11号样撒花海9号样八连沟9号样阿克塔斯12号样
1.1.2 试剂
无水乙醇(纯度≥99.7%):天津市富宇精细化工有限公司;细菌基因组总脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京天根生化科技有限公司;猪胆盐(纯度≥90%):上海麦克林生化科技有限公司;革兰氏染液:北京索莱宝生物科技有限公司。
1.1.3 培养基
MRS液(固)体培养基:青岛高科技工业园海博生物技术有限公司。含碳酸钙的MRS(CaCO3-MRS)固体培养基:MRS固体培养基中添加1.5%的碳酸钙。
1.2 仪器与设备
TC-512聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:英国Techne公司;T100 Power Pac Universal电泳仪、Universal Hood ⅡGel DOC XR凝胶成像系统:美国BioRad公司;CX21FS1光学显微镜:日本Olympus公司;LAC-5040S标准型pH计:上海精密科学仪器有限公司;Bnp-9272智能生化培养箱:上海精宏试验设备有限公司;5424R高速冷冻离心机:德国Eppendorf公司;Synergy 2多功能酶标仪:美国BIOTEK仪器有限公司。
1.3 方法
1.3.1 乳酸菌的分离
称取1.0 g土壤样品,加入10 mL无菌生理盐水,混匀,静置10 min后取上清液1 mL加至20 mL含有7% NaCl的MRS液体培养基中,37 ℃静置培养48 h。取菌液在CaCO3-MRS平板上划线,37 ℃培养48 h[16]。挑取溶钙圈较大、革兰氏染色为阳性、接触酶试验为阴性并具有乳酸菌典型形态学特征的菌落,在MRS固体培养基上再次划线分离纯化后斜面保存备用[17]。
1.3.2 筛选耐盐乳酸菌的筛选
将分离纯化得到的乳酸菌菌株进行活化并培养16~18 h后,以2%(V/V)的接种量分别接种至NaCl含量为7%、8%、9%、10%的MRS肉汤培养基中,37 ℃培养24 h,通过培养基浑浊情况的变化筛选出耐盐乳酸菌[18]。
1.3.3 耐盐乳酸菌的分子生物学鉴定
根据DNA提取试剂盒说明书步骤提取目标耐盐乳酸菌菌株的DNA,以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')对筛选菌株的16S rDNA序列进行PCR扩增。PCR扩增体系:10×Buffer 2.5 μL,10 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)0.5 μL,10 μmol/L引物各0.5 μL,Taq酶1.25 U,模板2 μL,双蒸水(ddH2O)定容至25 μL。PCR扩增程序:95 ℃预变性10 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸30 s,34个循环;72 ℃再延伸10 min。采用1%琼脂糖凝胶电泳检测PCR扩增产物特异性。将电泳检测合格的PCR扩增产物送至上海生工生物有限公司进行测序。将测序基因序列提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,选取同源性较高的模式菌株的16S rDNA序列,采用软件Mega5.0构建系统发育树。
1.3.4 筛选菌株在高渗环境下的生长曲线和产酸能力
按2%的接种量将活化培养至对数生长末期的菌株分别接种于含7%、8%NaCl的MRS肉汤培养基中,37 ℃恒温培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600nm值和pH值,绘制乳酸菌的生长曲线和产酸曲线。
1.3.5 筛选菌株在高渗环境下的耐酸、耐胆盐胁迫能力
耐酸性能的测定:将活化好的筛选菌株按2%的接种量分别接种到含7%、8%NaCl,pH值为3.0、4.6的MRS液体培养基中,37 ℃条件下培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600nm值,绘制乳酸菌的生长曲线,并且每隔2 h取样,测定pH值,绘制产酸变化曲线。
耐胆盐性能的测定:将活化好的筛选菌株按2%的接种量分别接到含7%、8% NaCl,0.10%、0.15%胆盐的MRS液体培养基中,37 ℃条件下培养48 h,每隔2 h取样在波长600 nm条件下测定样品的OD600 nm值,绘制乳酸菌的生长曲线,并且每隔2 h取样,测定pH值,绘制产酸变化曲线。
1.3.6 筛选菌株耐盐性能的测定
将培养至对数末期的菌液,按2%的接种量分别接种于含10%和12%NaCl的MRS液体培养基中,37 ℃条件下胁迫3 h后进行涂布于MRS固体培养基,37 ℃培养48 h后进行菌落计数(N),同时对接种液进行菌落计数(N0),计算存活率,其计算公式如下:
2 结果与分析
2.1 耐盐乳酸菌菌株的分离与筛选
从27个土壤样品中共分离纯化得到64株疑似乳酸菌,通过筛选共获得4株耐盐乳酸菌,编号分别为a、b、c、d。4株乳酸菌均能在含8%NaCl的MRS液体培养基中生长,其中菌株c能够在含9%NaCl的MRS液体培养基中生长,在含10%NaCl的MRS液体培养基中4株菌的生长被明显抑制。
2.2 耐盐乳酸菌菌株的鉴定
2.2.1 形态观察
对筛选出的4株耐盐乳酸菌菌株进行形态学观察,结果见图1。

图1 耐盐乳酸菌的菌落形态及细胞形态
Fig. 1 Colony and cell morphology of salt tolerant lactic acid bacteria
由图1可知,在MRS固体培养基上,4株耐盐乳酸菌的菌落均呈乳白色,并且中央隆起具有湿润表面,边缘整齐,呈乳白色,革兰氏染色结果均为阳性,个体微小,周身无鞭毛与芽孢,符合乳酸菌基本特征。
2.2.2 分子生物学鉴定
4株耐盐乳酸菌菌株的系统发育树见图2。
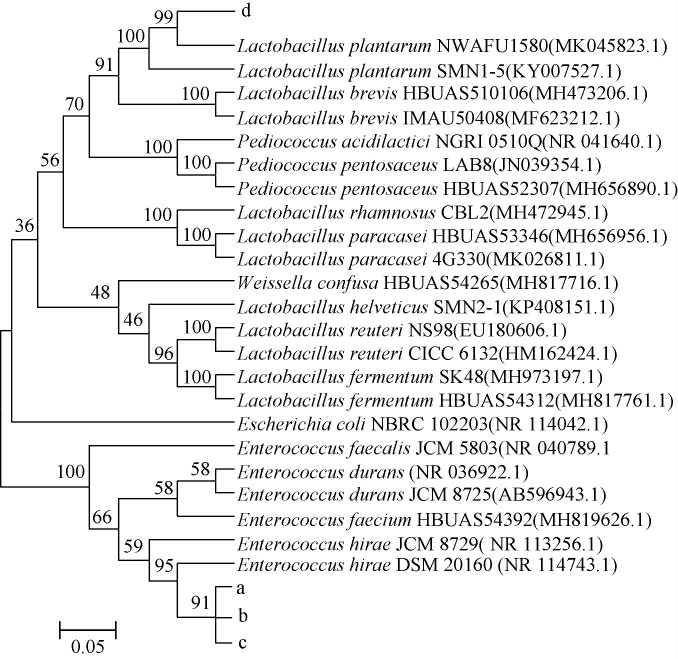
图2 基于16S rDNA基因序列耐盐乳酸菌菌株的系统发育树
Fig. 2 Phylogenetic tree of salt tolerant lactic acid bacteria based on 16S rDNA gene sequences
由图2可知,菌株a、b、c与海氏肠球菌(Enterococcus hirae)聚于一支,亲缘关系最近;菌株d与植物乳杆菌(Lactobacillus plantarum)聚于一支,亲缘关系最近,因此鉴定菌株a、b、c均为为海氏肠球菌(Enterococcus hirae),菌株d为植物乳杆菌(Lactobacillus plantarum)。
2.3 耐盐乳酸菌的发酵特性
2.3.1 耐盐乳酸菌的生长特性
邬慧颖[19]研究盐胁迫响应基因对菌体分裂增殖的影响结果发现,盐胁迫响应基因膜转运体基因feoA的缺失会使迟滞期被延长并影响菌体的分裂增殖。由图3可知,L.plantarumd d在7%NaCl含量下的最终OD600nm值为1.866,而在8% NaCl含量下的最终OD600 nm值为0.760,E. hirae a、b、c在7%NaCl含量下的最终OD600nm值分别为0.898、0.773、0.873,而在8%NaCl含量下的最终OD600 nm值分别为0.105、0.086、0.117,结果表明,随着NaCl含量的增加,各菌株的生长受到了不同程度的抑制,其中L.plantarumd d的生长特性相对于其他三株更好,E.hirae a、b、c差别不大。
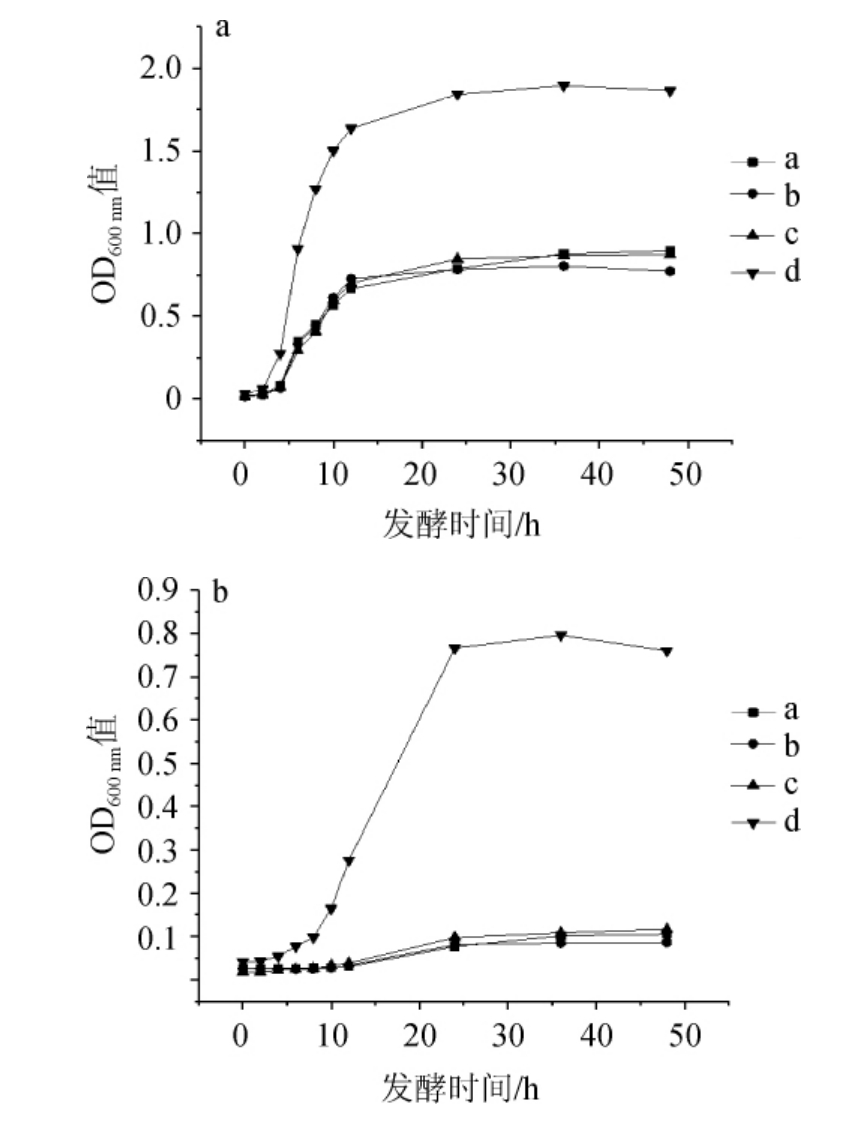
图3 在NaCl含量7%(a)及8%(b)条件下耐盐乳酸菌的生长曲线
Fig. 3 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions
2.3.2 耐盐乳酸菌的产酸特性
由图4可知,随着NaCl含量的升高,各菌株的产酸速率明显降低。L.plantarum d在7%NaCl含量下的最终pH值为3.48,在8%NaCl含量下的最终pH值为3.79,E.hirae a、b、c在7%NaCl含量下的最终pH值分别为4.01、4.08、3.97,而在8%NaCl含量下的最终pH值分别为4.99、5.09、4.63,结果表明,随着NaCl含量的增加,各菌株的产酸受到了不同程度的抑制。其中L.plantarumd d的产酸特性相对于其他三株更好,E.hirae a、b、c差别不大。
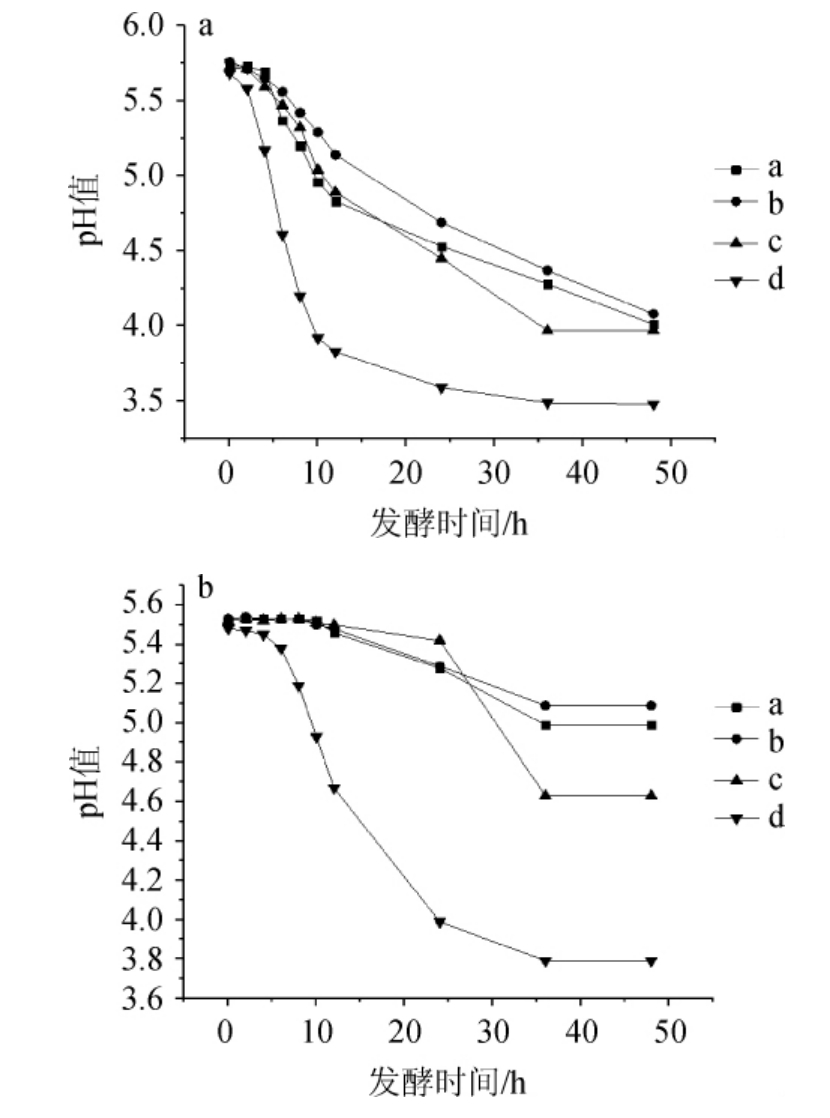
图4 耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线
Fig. 4 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions
2.3.3 耐盐乳酸菌的耐酸性能研究
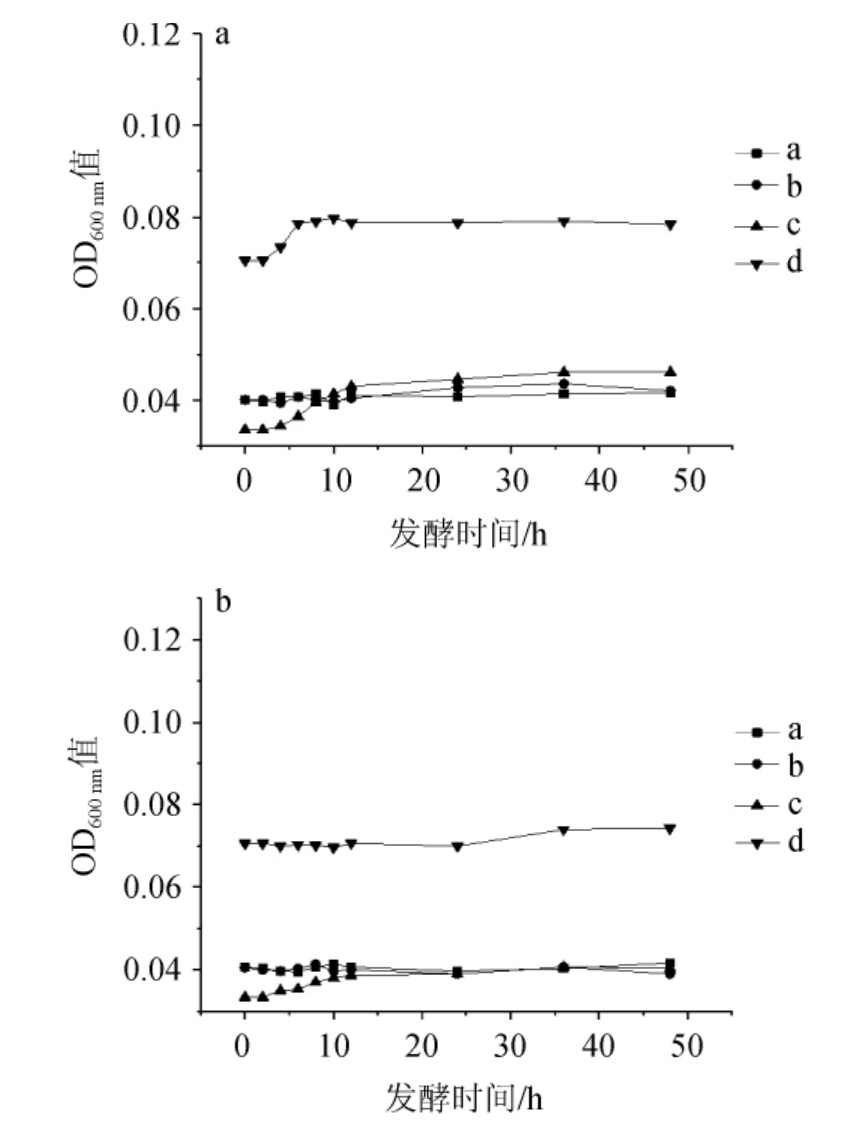
图5 pH3.0时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线
Fig. 5 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at pH 3.0
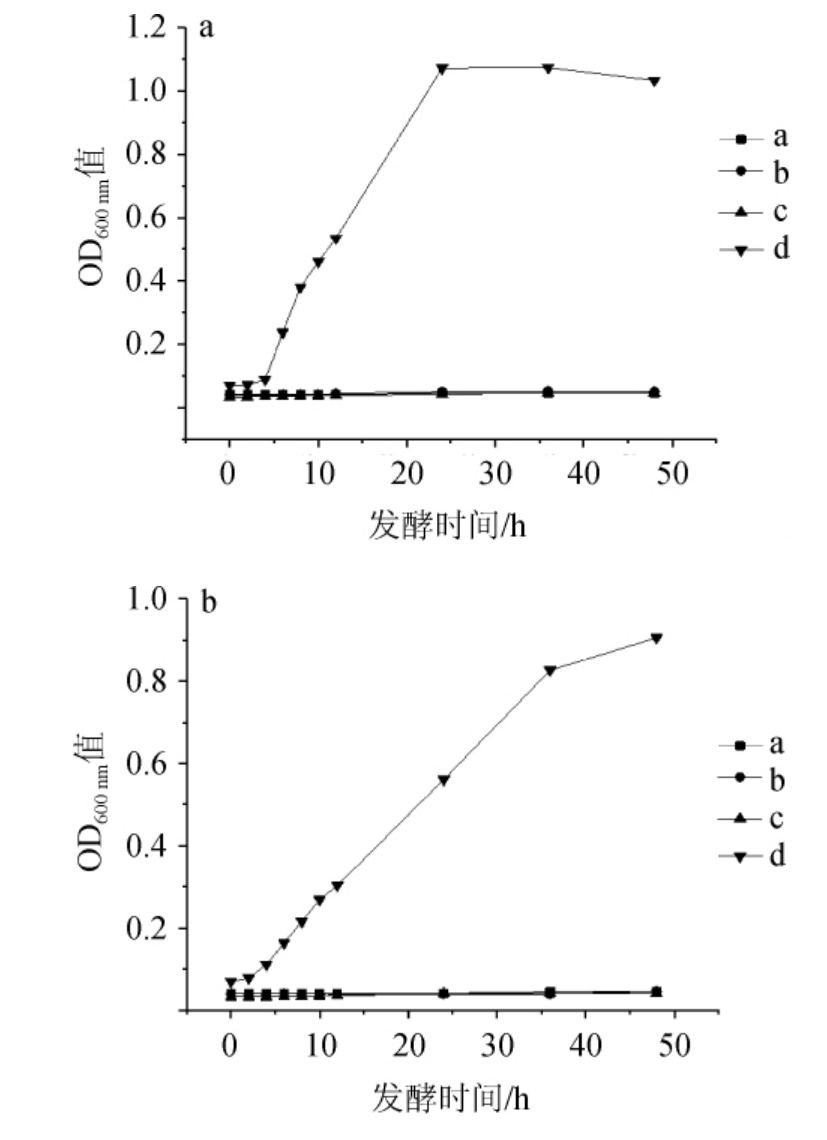
图6 pH4.6时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线
Fig. 6 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at pH 4.6
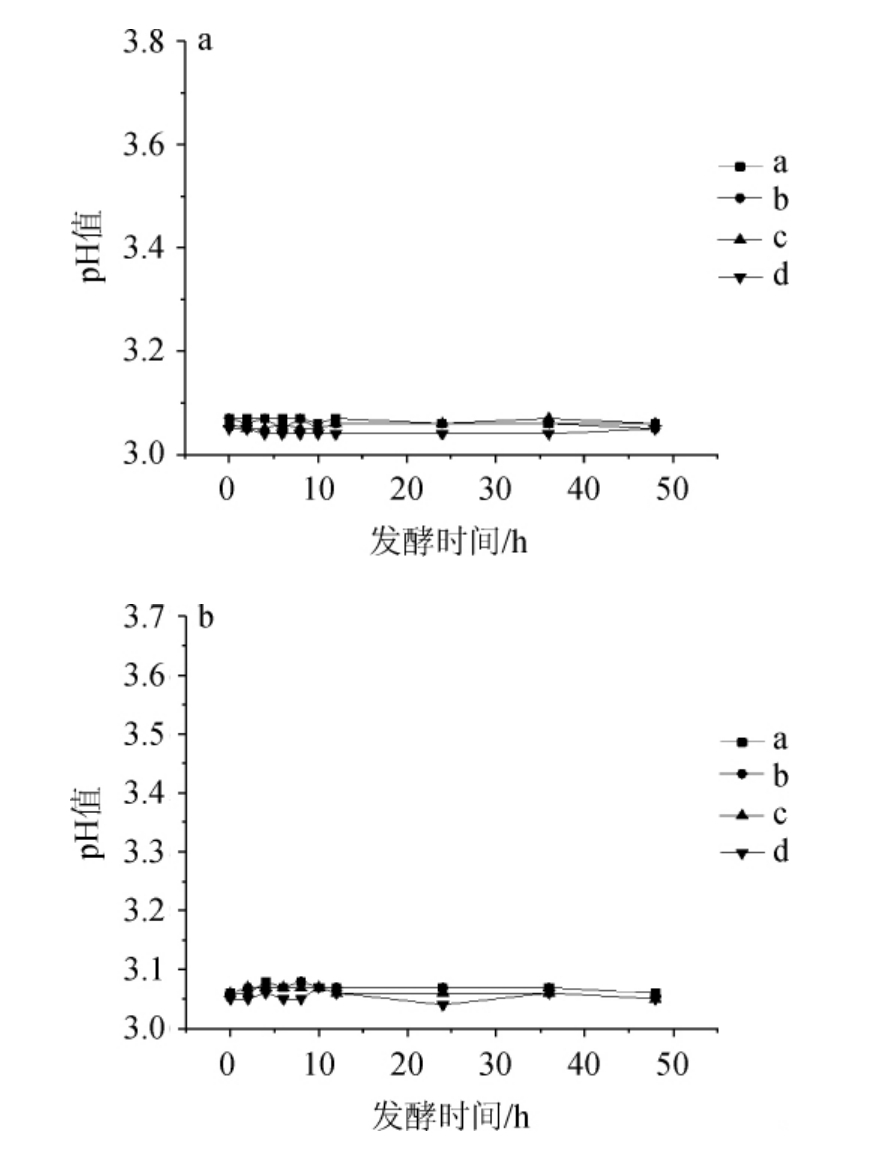
图7 pH3.0时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线
Fig. 7 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at pH 3.0
由图5可知,在7%和8%NaCl含量下,E.hirae a、b、c和L.plantarum d在pH 3.0的酸性环境,均未出现明显的生长。结果表明,在pH 3.0的酸性环境,7%和8% NaCl含量下,E.hirae a、b、c和L.plantarum d 生长均受到明显抑制。
由图6可知,在7%和8%NaCl含量下,L.plantarum d比E.hirae a、b、c更适应pH 4.6的酸性环境,出现明显的生长,同时8%NaCl含量使E.hirae a、b、c和L.plantarum d的生长受到抑制。
由图7可知,在7%和8%NaCl含量下,pH 3.0的酸性环境中E.hirae a、b、c和L.plantarum d几乎不产酸,生长受到明显抑制。
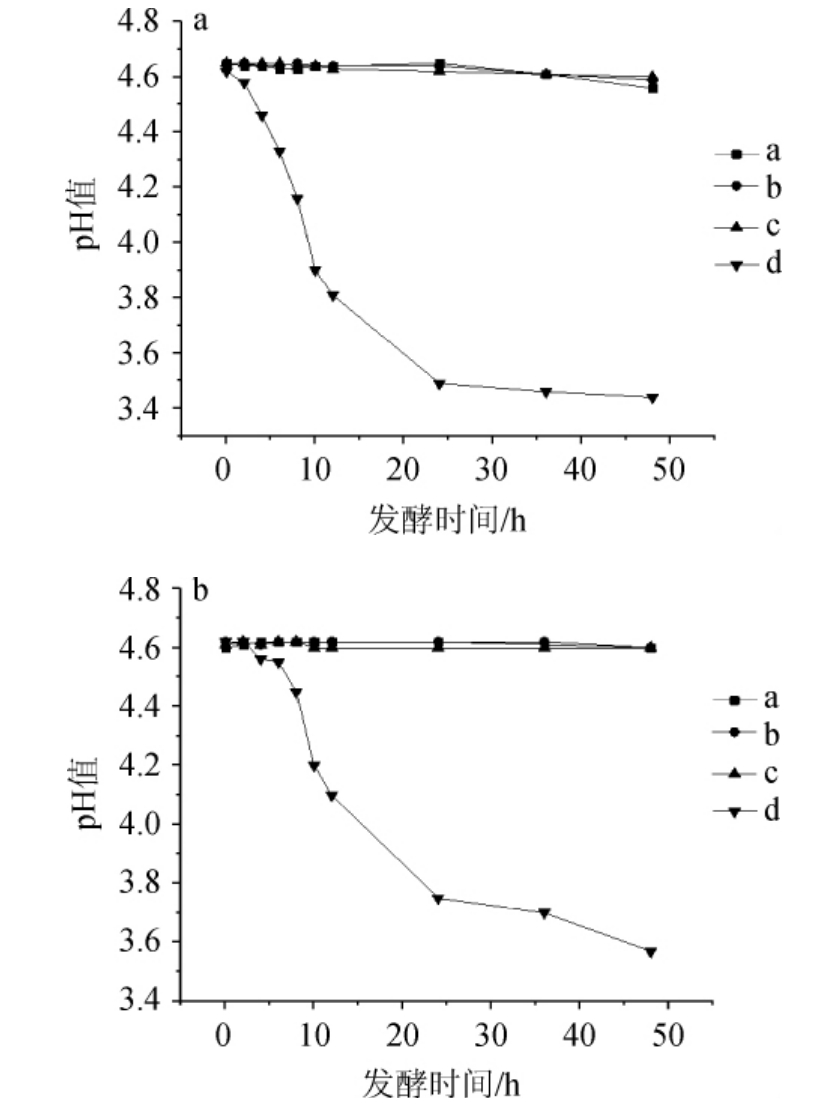
图8 pH4.6时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线
Fig. 8 Acid production curves of salt tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at pH 4.6
由图8可知,产酸情况的变化也应证了OD600 nm值的变化结果,在7%和8%NaCl含量下,pH 4.6的酸性环境中E.hirae a、b均在24 h开始产酸,但pH下降幅度不大。E.hirae c几乎不产酸,生长受到明显抑制。L.plantarum d在培养2 h后pH值开始迅速降低,36 h后逐渐停止产酸,最终pH值分别下降至3.42和3.56。
结果表明,在7%、8%NaCl胁迫下,L.plantarum d的酸耐受性较好。
2.3.4 耐盐乳酸菌的耐胆盐性能研究
乳酸菌需能够耐受胃液中的强酸与肠道内的高浓度胆盐,并在人体内大量存活才能发挥其益生作用[20]。由图9可知,在0.10%胆盐胁迫下,在7%和8%NaCl含量条件下,E.hirae a、b、c具有较好的胆盐胁迫抗性,且均在培养24 h达到对数生长末期,而L.plantarum d未有明显生长趋势。海氏肠球菌中E.hirae c抗性最好,E.hirae b最差,0.10%的胆盐对L.plantarum d的抑制作用明显。
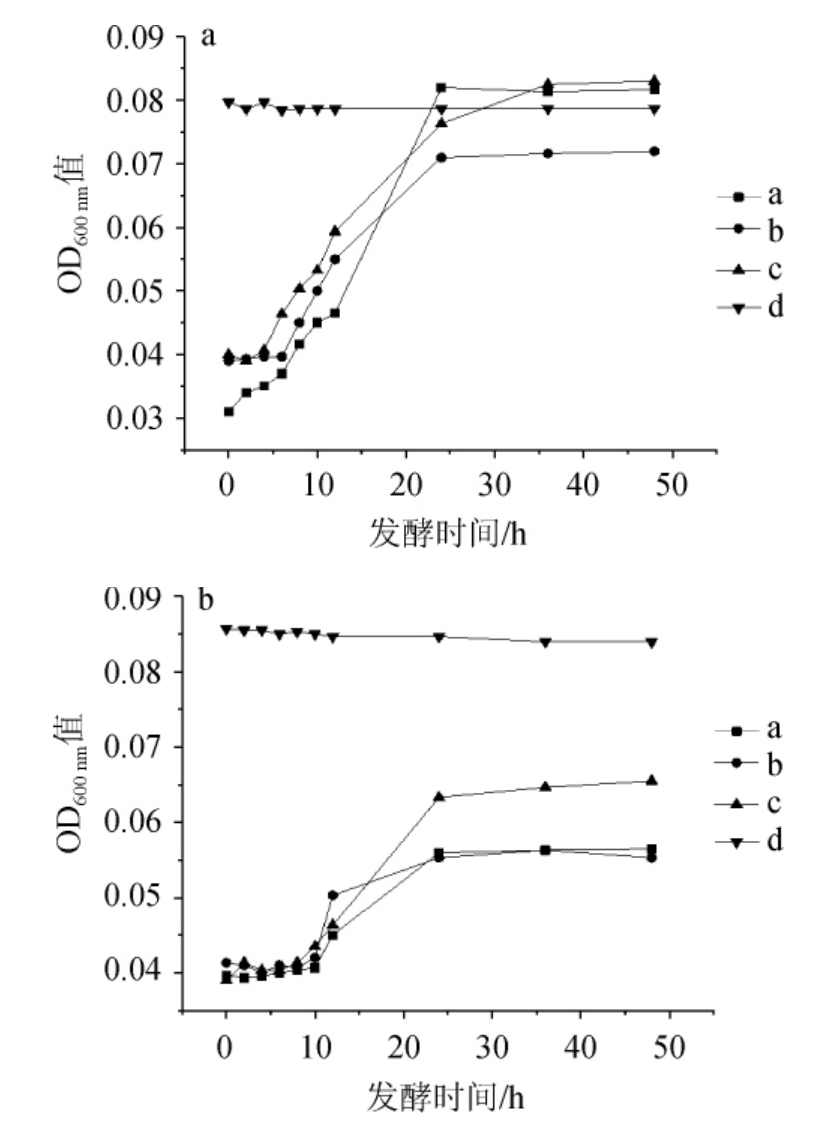
图9 0.10%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线
Fig. 9 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at 0.10% bile salt
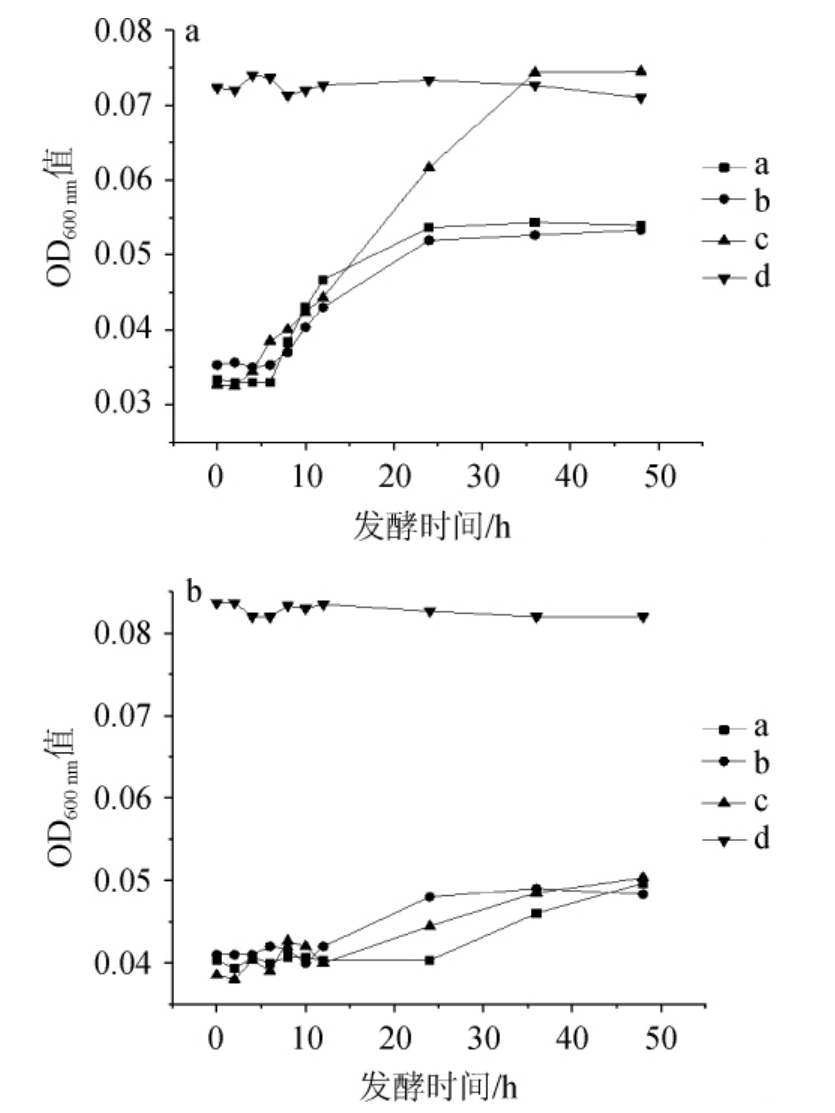
图10 0.15%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的生长曲线
Fig. 10 Growth curves of salt tolerant lactic acid bacteria under 7% (a)and 8% (b) NaCl concentration conditions at 0.15% bile salt
由图10可知,4株菌在0.15%胆盐中的生长趋势与在0.10%胆盐中类似,海氏肠球菌均能生长而植物乳杆菌L.plantarum d未有明显生长趋势,但值得指出的是,E.hirae c在7%NaCl含量下的生长速度和对胆盐的抗性要明显优于E.hirae a和E.hirae b,而在8%NaCl含量下E.hirae c没有表现出类似的优势,这说明在面对胆盐胁迫时,NaCl含量的改变可能会影响到菌株的胁迫抗性。
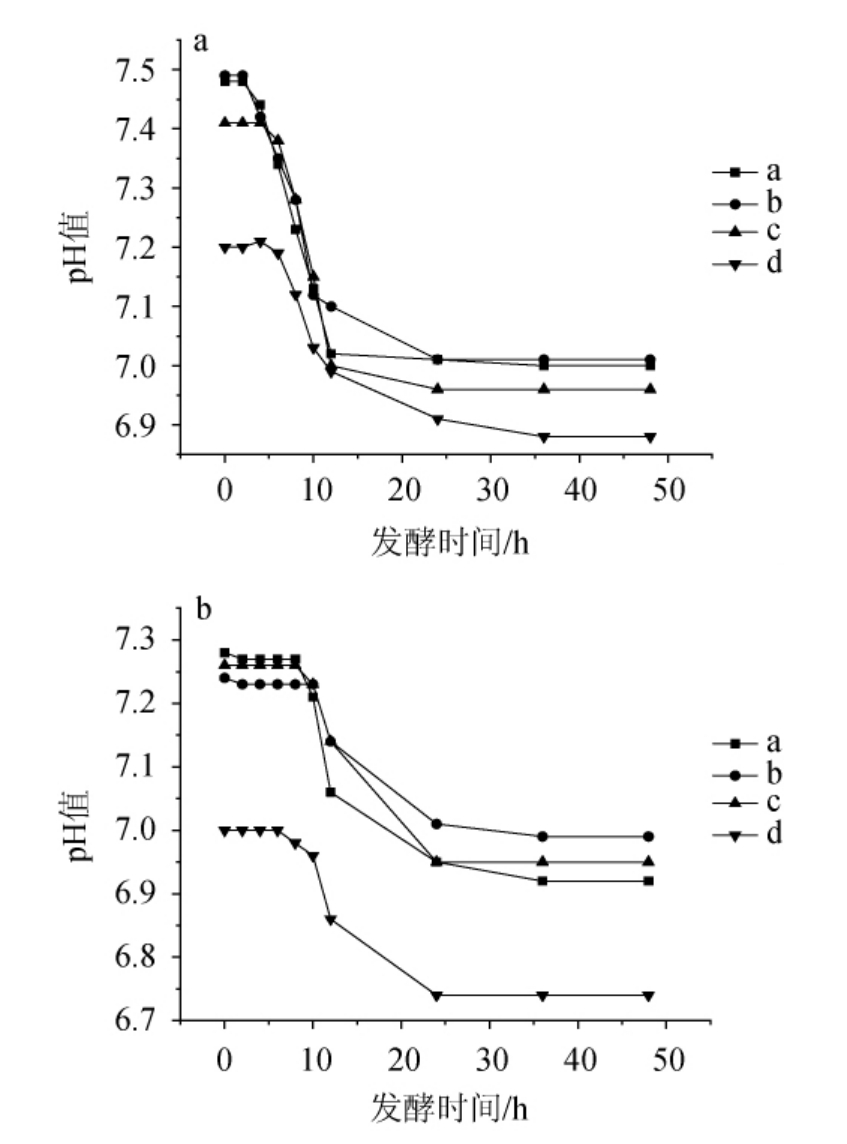
图11 0.10%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线
Fig. 11 Acid production curves of salt-tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at 0.10% bile salt
由图11可知,在0.10%胆盐的环境中,E.hirae a、b在7%NaCl含量下培养2 h后产生大量有机酸,pH值迅速下降,12 h左右pH值趋于稳定;在8%NaCl含量下,培养10 h左右pH值迅速下降,12~24 h期间,pH值的下降速率明显减小。E.hirae c在7%NaCl含量下,培养6 h左右pH值迅速下降,24 h时产酸停止;在8%NaCl含量下,培养8 h左右pH值迅速下降,24 h左右产酸停止。L.plantarum d在7%和8%NaCl含量下产酸性能均优于海氏肠球菌,但是在8%NaCl含量时,产酸在培养24 h后即停止。
由图12可知,在0.15%胆盐的环境中,7%NaCl含量下,E.hirae a、b在8 h左右pH值开始下降,24 h产酸停止;在8%NaCl含量下,E.hirae a、b、c的产酸曲线几乎相同,12 h开始产酸,pH值迅速下降,24h左右pH值下降减缓。L.plantarum d在7%NaCl含量下,8 h左右pH值迅速下降,与其他3株菌不同的是12 h左右产酸停止,而在8%NaCl含量下,其延滞时间比海氏肠球菌更短。
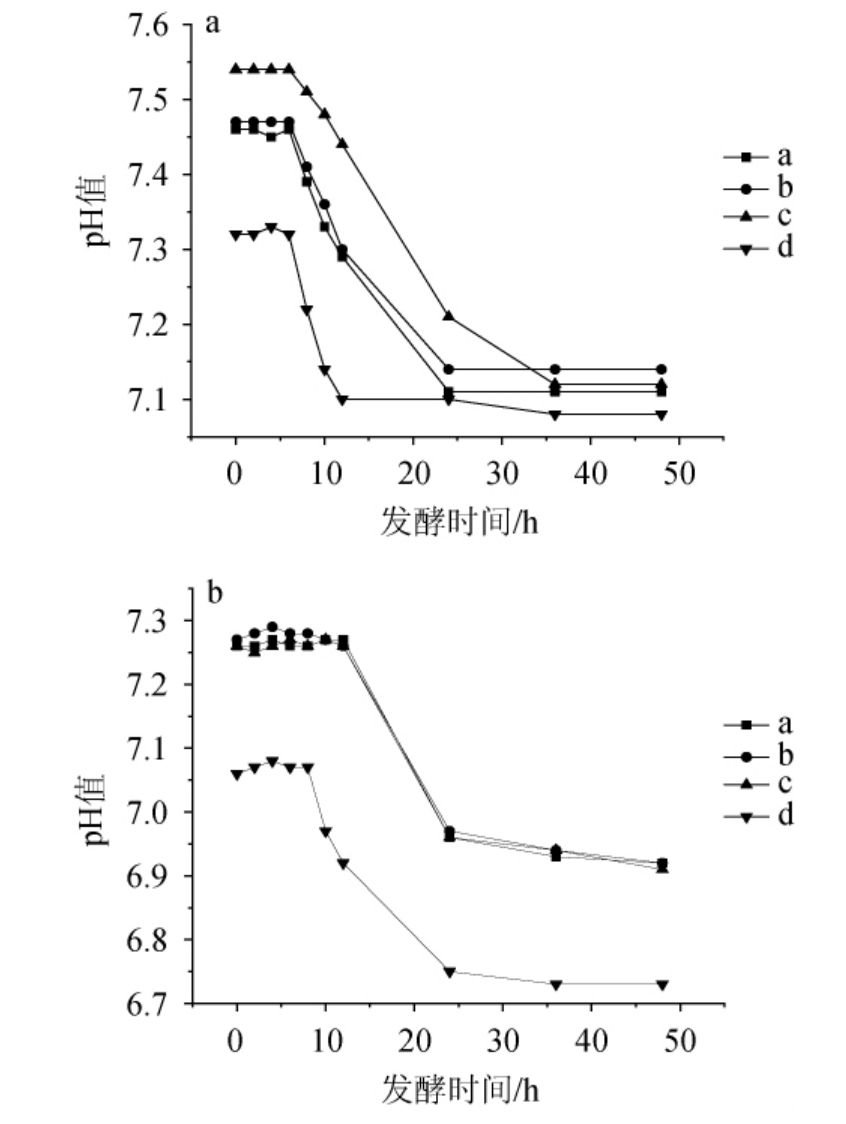
图12 0.15%胆盐时耐盐乳酸菌在NaCl含量7%(a)及8%(b)条件下的产酸曲线
Fig. 12 Acid production curves of salt-tolerant lactic acid bacteria under 7% (a) and 8% (b) NaCl concentration conditions at 0.15% bile salt
结果表明,在7%、8%NaCl胁迫下,E.hirae a、b、c胆盐耐受性较好。
2.4 耐盐乳酸菌的耐盐性能研究
对筛选出的耐盐乳酸菌分别用10%与12%的NaCl胁迫3 h,进一步考察其对NaCl的耐受性,结果见图13。由图13可知,4种耐盐乳酸菌对盐的耐受性差异显著(P<0.05)。在10%的NaCl含量下,E.hirae a、b、c、L.plantarum d的存活率分别为45.89%、60.69%、47.34%、41.58%;在12%的NaCl含量下,E.hirae a、b、c、L.plantarum d的存活率分别为43.72%、56.13%、39.24%、35.70%。由此可知,E.hirae b对盐的耐受性最好,E.hirae c和E.hirae a次之,L.plantarum d对盐的耐受性最差。
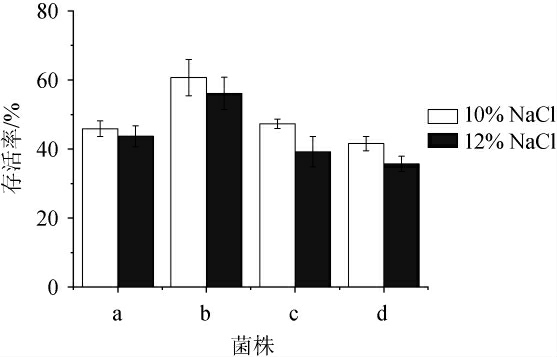
图13 耐盐乳酸菌对盐的耐受性
Fig. 13 Tolerance of salt tolerant lactic acid bacteria to salt
3 结论
从新疆维吾尔自治区伊犁哈萨克自治州额敏县的土壤样品中分离出64株乳酸菌,从中筛选出4株耐盐乳酸菌(a、b、c及d),通过形态观察及分子生物学技术鉴定菌株a、b及c均为海氏肠球菌(Enterococcus hirae),菌株d为植物乳杆菌(Lactobacillus plantarum)。在高盐胁迫(7%、8%NaCl)下,L.plantarum d的生长特性、产酸及耐酸性能最好,但耐胆盐能力最差,E.hirae a、b、c的耐胆盐胁迫能力更佳;在10%和12%的NaCl含量下胁迫3 h,4株菌的存活率均能维持在36%以上,其中E.hirae b的耐盐能力最佳,存活率最高。
[1] STILES M E, HOLZAPFEL W H. Lactic acid bacteria of foods and their current taxonomy[J].Int J Food Microbiol,1997,36(1):1-29.
[2]赵芳,李艳琴,李彬春.模拟人体胃肠道环境筛选益生乳杆菌[J].微生物学通报,2016,43(6):1396-1403.
[3]章文明,汪海峰,刘建新.乳酸杆菌益生作用机制的研究进展[J].动物营养学报,2012,24(3):389-396.
[4]林城杏.传统高盐发酵酸鱼乳酸菌菌群结构及强化发酵作用研究[D].贵阳:贵州大学,2019.
[5]温荣欣,扈莹莹,殷小钰,等.食盐添加量对哈尔滨风干肠脂质和蛋白氧化及挥发性化合物形成的影响[J].食品科学,2020,41(2):29-36.
[6]林松洋,郝利民,刘鑫,等.乳酸菌耐盐分子机制研究进展[J].食品科学,2018,39(3):295-301.
[7]ZOTTA T,PARENTE E,RICCIARDI A.Viability staining and detection of metabolic activity of sourdough lactic acid bacteria under stress conditions[J].World J Microbiol Biotechn,2009,25(6):1119-1124.
[8]FONSECA F,PÉNICAUD C,TYMCZYSZYN E E,et al.Factors influencing the membrane fluidity and the impact on production of lactic acid bacteria starters[J].Appl Microbiol Biot,2019,103(17):6867-6883.
[9]徐颖,邬淑芳,杨芙莲,等.盐胁迫促进鼠李糖乳杆菌富硒的效果[J].食品科学,2020,41(6):179-183.
[10]穆少波.构建新疆现代畜牧产业体系研究[J].实事求是,2018(4):77-84.
[11]赵顺先,关统伟,向慧平,等.基于高通量测序技术的新疆传统干奶酪乳酸菌多样性分析[J].四川农业大学学报,2018,36(5):688-695.
[12]王江月,王亮,巩小芬,等.新疆不同地区开菲尔粒中乳酸菌的分离鉴定及筛选[J].中国乳品工业,2018,46(8):4-8.
[13]蒋艾廷,李宝坤,金丹,等.新疆塔城传统酸奶中乳酸菌的多样性及发酵特性分析[J].食品工业科技,2017,38(15):128-134.
[14]金丹,蒋彩虹,蒋艾廷,等.塔城地区酸马奶中耐乙醇乳酸菌的筛选与鉴定[J].中国酿造,2017,36(3):48-52.
[15]张亚川,蔡静静,剡文莉,等.新疆伊犁地区乳品中发酵菌种的筛选及产酸性能研究[J].中国乳品工业,2019,47(7):4-7,18.
[16]凌代文.乳酸细菌分类鉴定及实验方法[J].微生物学通报,1999(1):23.
[17]梁恒宇,马莺,程建军,等.自然发酵黄豆酱中嗜盐乳酸菌的分离、鉴定与筛选[J].中国酿造,2006,25(8):24-27.
[18]林龙镇,邹卫玲,李安章,等.产酸、耐酸乳酸菌的分离鉴定及益生特性[J].华南农业大学学报,2018,39(2):95-102.
[19]邬慧颖.保加利亚乳杆菌盐胁迫响应基因对菌体分裂增殖的影响[D].哈尔滨:哈尔滨工业大学,2018.
[20]赵小茜,魏旭丹,陈戴玲,等.乳酸菌耐酸耐胆盐机制研究进展[J].乳业科学与技术,2017,40(3):33-36.