白酒是世界上六大蒸馏酒之一,距今约有2 000多年的历史。白酒中主体成分为乙醇和水,约占98%,其余2%~3%为白酒风味物质,这些微量风味物质决定了白酒的品质和价值。迄今为止,已鉴定出白酒中含有1 000多种风味物质,包括醇类、醛类、酮类、酸类、酯类、有机氮和含硫化合物等[1-2]。通过剖析酒内香气成分,研究其与工艺的关系,将白酒划分为浓香型、酱香型、清香型、米香型等12种香型。浓香型白酒具有香味浓郁、口感柔和、尾净绵长的特点,消费群体巨大,在各香型白酒中销售占比最大,近几年均维持在51%以上。
浓香型白酒采用窖池发酵,己酸乙酯是公认的主体风味物质[3-4],其对白酒的风格和质量具有关键作用。作为己酸乙酯合成的前体物质—己酸,主要由窖泥中己酸菌合成。优良己酸菌有助于窖泥质量和基酒品质的提升,因此,选育高产己酸菌株、基于产酸机制改善菌株产酸性能,有助于以更加科学的方式将己酸菌应用于生产,提高浓香型白酒优级品率。
1 己酸菌的筛选
自1964年10月茅台试点期间首次发现茅台窖底香的主要成分是己酸乙酯以来,国内白酒行业相关科研工作者进行了大量己酸菌筛选的工作[5-6]。此外,因己酸还能作为重要的能源前体物质[7-8]、抗菌剂以及饲料添加剂[9],国内外能源行业相关科研工作者将己酸菌视为中链脂肪酸(C4~C8)生产的优势平台,也进行了大量己酸菌筛选工作[10-11]。目前,已经筛选出的产己酸菌株主要包括梭菌属(Clostridium)、瘤胃菌科(Ruminococcaceae)、巨球型菌属(Megasphaera)、芽孢杆菌属(Bacillus)等,具体信息见表1。
表1 己酸菌筛选及产酸情况
Table 1 Screening and acid production of caproic acid-producing bacteria

菌株编号 名称 来源 电子供体 适宜温度/℃ 适宜pH值 产酸情况 文献3231B N6 DSM555 JZZ GK13 IEH 97212T BS-1 xsk1 xsk2 K-2 CPB6 H2 NCIMB 702410 MH C78 A57 A17克氏梭菌(Clostridium kluyveri)C.kluyveri C.kluyveri C.kluyveri丁酸梭菌(Clostridium butyricum)绿硫细菌(Clostridium tepidum sp.)球孢梭菌(Clostridium sporosphaeroides)Clostridium guangxiense;Clostridium kogasensis速生梭菌(Clostridium celerecrescens)Ruminococcaceae Ruminococcaceae埃氏巨型球菌(Megasphaera elsdenii)M.elsdenii巨大芽孢杆菌(Bacillus megaterium)梭形芽孢杆菌(Bacillus fusiformis)地衣芽孢杆菌(Bacillus licheniformis)牛瘤胃窖泥河的泥土窖泥窖泥胀瓶的非乳蛋白奶昔污水处理厂污泥样品窖泥窖泥窖泥窖泥牛瘤胃奶牛瘤胃乙醇乙醇乙醇乙醇乙醇葡萄糖半乳糖醇乙醇乙醇乳酸葡萄糖蔗糖果糖[12][6][11][13][14][15][16][17][18][5][19][20][10]窖泥葡萄糖39 37 34 37 35 45~50 37 37 35 30~40 37 37 30~40 34 34 37 7.6 7.0 6.8 6.5-6.0~9.5 6.8 6.0 7.0 5.0~6.5 6.0~7.0 6.0 5.5~7.5 7.0 6.5 7.0 12.8 g/L(3 d)3.05 g/L(6 d)萃取发酵,4.64 g/L/d 4.36 g/L(7 d)4.96 g/L(14 d)210~380 mg/L萃取发酵,32 g/L(16 d)4.51 g/L(10 d)2.5 g/L(10 d)5.47 g/L(15 d)补料发酵,16.6 g/L(6 d)加丁酸钠,16.73 g/L(5 d)分批补料发酵,6.68 g/L萃取发酵,28.42 g/L(6 d)加丁酸钠,9.7 g/L(7 d)2.14 g/L 1.70 g/L 1.04 g/L[21]
梭菌属(Clostridium),主要筛选自窖泥或污泥水,多为革兰氏阳性菌(丁酸梭菌(C.butyricum)为革兰氏阴性菌),严格厌氧,包括C.kluyveri、C.sporosphaeroides等菌株。菌落呈白色或灰白色圆形、扁平,表面光滑且周围有较为明显的透明圈,单菌呈杆状且都能形成孢子。在这些菌中,克氏梭菌(C.kluyveri)最早由BARKER H A[22]从荷兰代尔夫特运河的泥浆中分离而来,已被视为中链脂肪酸生产的模式菌株。该菌株对底物的要求比较苛刻,仅能以乙醇、丙醇、丁醇等作为电子供体,不能利用葡萄糖、半乳糖等糖类物质。
瘤胃菌科(Ruminococcaceae)同样筛选自窖泥,菌落形态及单菌形态与梭菌属相似。某些菌株细胞表面还有荚膜,周生鞭毛,可以游动,如Ruminococcaceae H2。菌株CPB6则是近年来在浓香型白酒窖泥中分离到的一株可以利用乳酸高产己酸的菌株,通过分批补料发酵,己酸的最高生产速率可以达到5.29 g/(L·d),与之前报道的以乙醇作为底物生产己酸相比,生产能力明显提高。据报道,类似于玉米秸秆、甘蔗废料等木质纤维素基质可用于生产大量乳酸,基于这些研究,利用含乳酸的废渣发酵生产己酸或许是一个较好的思路[5,23]。
埃氏巨型球菌(Megasphaera elsdenii)主要筛选自瘤胃,严格厌氧,革兰氏阴性菌。在强化梭菌培养基(reinforced clostridial medium,RCM)上呈现微黄色、凸面、不透明的菌落,边缘规则。不能形成孢子,没有鞭毛,双球菌生长的球形微生物,单个细胞平均尺寸为0.8~1.2 μm[10]。其中菌株MH在以果糖为底物的培养基中加入乙酸钠、丙酸钠、丁酸钠,可以合成C5~C8的中链脂肪酸,具有较强的碳链延伸能力[24]。
2 己酸合成途径
厌氧微生物合成中链脂肪酸是依赖逆向β氧化作用,以低碳酸为底物与乙酰辅酶A缩合成β-羰基脂肪酰辅酶A,再经过脱氢、脱水以及还原作用形成多两个碳的酰基辅酶A[25](图1)。如克氏梭菌(C.kluyveri)利用乙醇和乙酸为底物产己酸时,乙醇发生氧化作用生成乙酰辅酶A,再与作为电子受体的乙酸基于逆向β氧化作用进行两次碳链延长合成己酰辅酶A。
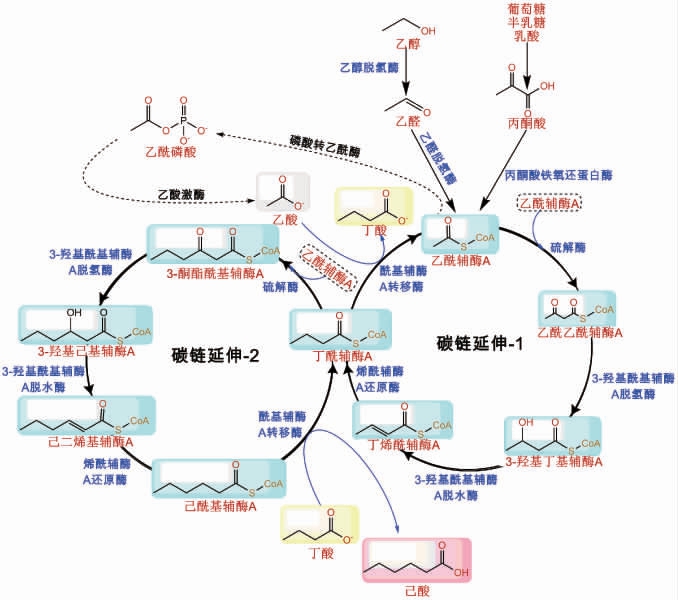
图1 己酸合成途径
Fig. 1 Synthetic pathway of caproic acid
新生成的己酰辅酶A有3个去向,一是继续参加下一轮的逆向β氧化循环生成更长碳链的酰基辅酶A;二是经过还原作用生成对应醇类物质;三是脱去辅酶A基团生成己酸。己酸具体的合成途径可以概括为三个步骤:
(一)乙酰辅酶A的生成:乙醇在乙醇脱氢酶(alcohol dehydrogenase,ADH)作用下生成乙醛,又在乙醛脱氢酶(aldehyde dehydrogenase,ALH)作用下进一步生成乙酰辅酶A,并产生能量。全基因组测序结果得出克氏梭菌(C.kluyveri)中包含2个编码乙醛脱氢酶和3个编码乙醇脱氢酶的基因,将乙醇脱氢酶纯化后经质谱分析发现3种ADH同工酶,表明3种基因均能在克氏梭菌(C.kluyveri)体内表达;2个Ald基因编码的蛋白序列相同,因此无法确定2个基因的表达情况[26]。能够利用葡萄糖、半乳糖、乳酸等底物的菌株则均是通过丙酮酸作为中间体生成乙酰辅酶A,然后发生逆向β氧化延长碳链,合成中链脂肪酸。瘤胃菌科梭菌CPB6因缺失编码乙醛脱氢酶的基因而不能利用乙醇合成乙酰辅酶A生成己酸,且与克氏梭菌(C.kluyveri)相比,编码合成己酸的关键酶的基因也存在较大的差异[27]。
(二)丁酰辅酶A的生成(第一次链延伸)及丁酸形成:2个乙酰辅酶A首先缩合生成乙酰乙酰辅酶A,再经过脱氢、脱水及还原作用相继生成3-羟基丁酰辅酶A、丁烯酰辅酶A和丁酰辅酶A。在此过程中主要的作用酶为硫解酶、3-羟基酰基辅酶A脱氢酶、3-羟基酰基辅酶A脱水酶及酰基辅酶A脱氢酶。在一些产酸菌株中,编码硫解酶的基因存在差异,如拜氏羧菌(Clostridium beijerinckii)、丁酸羧菌、瘤胃菌科梭菌CPB6中存在两个编码硫解酶的基因,克氏梭菌(C.kluyveri)基因组中存在3个编码硫解酶的基因,分别为ThlA1、ThlA2、ThlA3,排列成为一个基因簇。杨娇等[28]将3种编码酶提取纯化后进行体外酶活实验,结果表明,基因Thl1对C4的催化效率相对较低,转录组分析得出,相比较于C2底物,ThlA2基因编码的酶对C3、C4有更高的亲和力,ThlA3基因则对短碳链C2亲和力高,这与胡烈杰[29]的研究结果一致。编码3-羟基酰基辅酶A脱氢酶的基因有Hbd1、Hbd2、PaaH1等基因,其中Hbd1与Hbd2基因存在于克氏梭菌(C.kluyveri)中。Hbd1基因为还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)依赖型,对NADPH具有高催化活力;以乙酸作为底物,Hbd2基因的表达量并不高,而以丙酸为底物时表达量高,推测其作用底物可能不是3-羟基丁酰辅酶A[29]。编码3-羟基酰基辅酶A脱水酶的基因有Crt1、Crt2,编码烯酰辅酶A还原酶的相关基因有Bcd基因簇、EtfAB基因簇、Ter等。部分丁酰辅酶A与乙酸在酰基辅酶A转移酶的作用下发生反应,脱去辅酶A基团生成丁酸和新的乙酰辅酶A;克氏梭菌(C.kluyveri)中编码酰基辅酶A转移酶的主要基因为Cat3。
(三)己酰辅酶A的生成(第二次链延伸)及己酸形成:丁酰辅酶A与乙酰辅酶A发生缩合作用形成己酰辅酶A,中间产物包括3-酮基己酰辅酶A、3-羟基己酰辅酶A、己基-2-烯醇辅酶A,主要作用酶与首次碳链延伸参与酶一致。其中部分己酰辅酶A与丁酸在酰基辅酶A转移酶作用下合成己酸。由于酰基辅酶A转移酶具有广泛的催化活性,因此推测己酰辅酶A也可能通过与乙酸直接反应来合成己酸,ZHU X等[23]以菌株CPB6为出发菌株,通过实验发现在己酰辅酶A充足的情况下,分别加入乙酸、丁酸均能产生己酸,证实了这一猜测。也存在少量的己酰辅酶A参与下一轮的逆向β氧化,继续进行碳链的延伸。但是由于乙酰辅酶A在碳链延伸过程中会消耗大量的能量并伴随氢气(H2)的产生,同时己酸本身对己酸菌生长性能及生理过程有抑制作用,在己酸浓度达到91.3 mmol/L时影响显著[30],受到能量代谢、H2压力、己酸胁迫等方面的影响,进一步的碳链延伸愈加困难[31]。
此外,有研究还发现,克氏梭菌(C.kluyveri)基因组中编码中链脂肪酸合成作用酶的基因簇前存在一个氧化还原感应全细胞转录阻遏蛋白基因Rex,对中链脂肪酸的合成起到全局调控作用,其中crt1和cat3基因受到Rex基因的调控[32]。
3 己酸合成的改进策略
3.1 发酵条件及培养基组成优化
选择适宜的发酵条件和配比合理的培养基是提高己酸菌产酸量行之有效的措施。WANG H等[33]为提高菌株CPB6产酸效率,通过响应面优化得出在以蔗糖13.30 g/L、乳酸22.35 g/L、丁酸16.48 g/L作为底物时,己酸生产速率可以达到6.50 g/(L·d),较优化前提升1.2 g/(L·d)以上。本实验室从某浓香型酒厂富集得到复合己酸菌液,对其产酸条件及培养基组成进行了优化。得到最佳发酵条件为发酵温度33 ℃、接种量5%、发酵时间11 d。最佳发酵培养基的组成为乙酸钠16.44 g/L、硫酸铵12.13 g/L、生物素0.13 g/L、碳酸钙10.0 g/L、磷酸氢二钾0.25 g/L、硫酸镁0.25 g/L、酵母浸粉6.25 g/L、乙醇25 mL/L、对氨基苯甲酸0.625 g/L。在此优化培养工艺下,获得的己酸菌发酵液中己酸产量达18.93 g/L,比初始发酵工艺的发酵液(7.03 g/L)提高了169%[34]。
3.2 混菌发酵
研究表明,与纯种发酵相比,混菌发酵利用微生物之间的合作和相互作用使微生物生长和代谢更加的稳定和高效[35]。目前,已研究的与己酸菌具备共同作用促进己酸产量提升的菌株主要包括羧状芽孢杆菌(Bacillus carboxylosus)、甲烷菌、放线菌及酵母菌。
(1)羧状芽孢杆菌
两种梭状芽孢杆菌产生交互作用,其中一种梭状芽孢杆菌的产物是另一种梭状芽孢杆菌利用的底物,这种代谢在梭状芽孢杆菌中非常普遍。永达尔梭菌(C.ljungdahlii)l利用克氏梭菌(C.kluyveri)产生的H2和CO2合成乙酸和乙醇,为其合成中链脂肪酸提供前体物质[36]。在外源加入乙醇的条件下,产琥珀酸丝状杆菌(Fibrobacter succinogenes)S85、生黄瘤胃球菌(Ruminococcus flavefaciens)FD-1与克氏梭菌(C.kluyveri)共培养,利用纤维素产生琥珀酸和乙酸,为其产己酸提供前体物质[37]。WEIMER P J等[38]将奶牛瘤胃中的混合菌与克氏梭菌(C.kluyveri)共培养,培养48~72 h内己酸产量达到6.1 g/L。KIM S G等[39]以产丁酸的酪丁酸梭菌(Clostridium.tyrobutyricum)和可利用乙酸为底物产己酸的己酸巨球型菌(Megasphaera hexanoica)依次进行发酵,并结合使用纤维膜生物反应器,己酸质量浓度增加至10.08 g/L,最高的生产速率为0.69 g/(L·h)。
(2)甲烷菌
产甲烷菌可以与己酸菌发生种间氢转移作用,己酸菌在厌氧呼吸中产生的H2和CO2可以作为产甲烷菌利用的底物,产甲烷菌通过氢代谢电子调节作用,从热力学角度为己酸菌代谢碳化合物提供有利条件。早期有研究表明,产己酸的菌株是梭状芽孢杆菌与甲烷菌的共栖种,二者分离后各自都只能产乙酸、丁酸、CO2和H2,直到后来不断有产己酸纯种分离出来。通过宏基因组分析得到浓香型白酒窖泥中甲烷菌种群丰度约为19%,包含7.25%的氢甲烷菌,并存在多种与甲烷形成相关的关键基因,推测氢甲烷菌的存在同己酸菌发生种间氢转移,利于提高己酸的产生[40],生产实践也证明甲烷菌的加入促进了己酸的产生[41]。
(3)放线菌
郭威等[42-43]通过筛选,从窖泥中筛选获得一株优良放线菌白骨壤链霉菌(Streptomyces avicenniae)GW01,该菌株单独自身不能产己酸,与己酸菌混合培养发酵比己酸菌纯种发酵产酸量提高约31%,进一步研究发现,其与产酸相关的促进因子可能是一种黑色素。
(4)酵母菌
嵇翔等[44]将克氏梭菌(C.kluyveri)与酿酒酵母共培养,己酸产量由最初纯培养的6.35 g/L提升至7.09 g/L,初步探讨了其作用机制,为酵母菌的存在改善了厌氧环境,提高了乙酸及丁酸的转化率。
3.3 菌株改造及诱变
为了改善己酸的合成,研究者希望通过菌株改造的方法寻找突破口。以大肠杆菌(Escherichia coli)为出发菌株,LIM J H等[45]通过敲除Pta基因以维持氧化还原平衡,过表达编码乙酰辅酶A乙酰转移酶的基因AtoB、3-羟基酰基辅酶A脱氢酶的基因Hbd、烯酰辅酶水合酶的基因Crt、反式烯酰辅酶A还原酶的基因Ter、硫酯酶的基因TESB,构建了产丁酰辅酶A的菌株。在此基础上,再次外源引入钩虫贪铜菌(Cupriavidus necator)中编码β-酮硫解酶的基因BktB并使用菌株M.elsdenii MH中编码乙酰辅酶A转移酶的基因Mhact替代AtoB,构建可以以葡萄糖为底物合成己酸的工程菌,其发酵36 h时己酸产量最高为528 mg/L[46]。
以马克斯克鲁维酵母(Kluyveromyces marxianus)为出发菌株,过表达基因AtoB、BktB、Crt、Hbd、MCT1、Ter和TES1获得菌株H4A,以半乳糖为唯一碳源发酵48 h时,己酸产量为145 mg/L。基因AtoB编码的乙酰辅酶A乙酰转移酶可以实现乙酰乙酰辅酶A的快速积累,但由于该酶具有强逆转活性,反而引起后期前体物质乙酰乙酰辅酶A的不足,菌株H4A产酸并不稳定。酿酒酵母(Saccharomyces cerevisiae)中编码丙二酰辅酶A酰基载体蛋白转酰酶的基因MCT1能够同时利用乙酰辅酶A和丙二酰辅酶A来缓慢增加乙酰乙酰辅酶A的含量,反应可逆性非常低,以其代大肠杆菌的基因AtoB则可以实现产酸稳定,己酸产量为142 mg/L[47]。
以赖氨酸芽孢杆菌(Lysinibacillus fusiformis)为出发菌,转染SigB突变基因,获得耐高乙醇和低pH值胁迫的优良己酸产生菌L.fusiformis-pBE3-ep-SigB,重组菌株的己酸产量达到2.54 g/L,是出发菌株产量的271.68%[48]。
4 己酸菌在白酒生产中的应用
窖泥作为己酸菌的栖息地,其微生物群系丰富,错综复杂。上千年的实践经验证明了窖池窖龄与白酒品质密切相关,老窖才能出好酒。科学的数据揭示了老窖泥中微生物群系丰度高,己酸菌为重要优势种群之一[49-50]。传统人工窖泥需要经过20年以上的积淀才能酿造出一般品质以上的酒,人工窖泥中加入窖泥培养菌剂能够有效促进窖泥老熟,有利于窖泥中有益功能微生物的快速富集,进而促进乙醇和其他酯类物质的积累,获得高品质窖泥。鲁少文等[51]在人工窖泥中加入能够利用乳酸合成己酸的瘤胃梭菌,35 d即获得最高己酸乙酯产量,同时形成了良好的微生物群落。泸州老窖[52]、赊店酒厂[53]在人工窖泥中使用类似窖泥培养菌液,所产酒质优良,己酸乙酯含量与老窖泥所产酒相近。
长时间的生产发酵过程,也使得窖泥中营养物质消耗或失调、乳酸亚铁及乳酸钙等有害物质累积、有益功能微生物数量减少,需要有效的养护才能保证窖泥的质量。己酸菌对窖池养护起关键作用,优良己酸菌培养的窖泥生产出的浓香型白酒,不仅主体香成分己酸乙酯含量高,而且香气细腻合适,口味柔和干净[54]。生产实践证明,窖泥中添加以己酸菌为主的窖泥培养菌剂对窖泥功能微生物数量[55]、白酒中己酸乙酯含量、优级率提升效果明显。桑其明等[56]使用己酸菌、甲烷杆菌等混合制剂养护窖泥,改善了窖泥板结退化的现象,己酸乙酯含量增加164%,窖香较明显且酒体变得较醇厚、干净。洋河酒厂将绵柔型窖泥功能菌菌液用于窖泥,发酵成熟的窖泥中以己酸菌为代表的功能菌数量达到108个/g以上,解决了以往改造后的窖池第一排无优级酒的状况,同时,出酒率达到了34%以上,比同期平均出酒率提高近3.5%,每年新增经济效益1 400~2 000万元[57]。同样的技术手段也用于景芝酒厂[58]、丰谷酒厂[59]等,均取得良好的效果。
5 结论与展望
己酸菌是窖泥培养菌剂的基础菌株,目前窖泥培养菌剂的使用在不少酒厂取得良好收效,但也存在己酸乙酯产量不高、酒质提升不明显等问题,究其原因在于所选用的己酸菌产酸性能不佳,因此,优良己酸菌的选育以及产酸性能的改善仍是今后研究的重点。
菌种分离仍然是获得高产己酸菌的基本手段,但己酸菌多为严格厌氧菌,分离培养困难,已经分离出的纯种数量非常有限。针对这些特殊生境中的微生物,可以借助高通量培养技术、原位培养等分离方法,结合生物信息学获知微生物生理功能特征,实现有效分离。
通过混菌发酵或分子改造的方法也是改善己酸生产的有效策略。从已改造的菌株来看,逆向β氧化途径可以实现在大肠杆菌和酵母菌中的异源表达,克服了厌氧环境的限制,但菌株的己酸产量很低,难以满足工业化的生产应用。大肠杆菌、酵母菌等模式菌株对己酸敏感性强,较低浓度的己酸即抑制了菌株的生长,导致了产酸不能持续进行。因此,研究己酸对菌株的抑制机制,通过筛选或分子改造的方法获得己酸高耐受性菌株意义重大。梭菌属(Clostridium)、瘤胃菌科(Ruminococcaceae)等自身就能合成己酸,相比于一些模式菌株,原则上应该是更好的出发菌株。据目前文献报道,这些菌株的改造目的多为中链醇的生产,鲜有关于中链脂肪酸合成方面的报道。中链醇在这些厌氧生物中合成也是经逆向β氧化途径,这为通过改造厌氧微生物提高己酸产量提供了可靠参考。
总之,通过选育优良菌株、采用不同措施提高产酸性能,在此基础上进一步获得“增己”效果显著、适用广泛的菌剂,并最终实现规模化的应用,这将对提升浓香型白酒的品质有极大的推动作用。
[1]孙宝国,吴继红,黄明泉,等.白酒风味化学研究进展[J].中国食品学报,2015,16(9):1-8.
[2]FAN W,SHEN H,XU Y.Quantification of volatile compounds in Chinese soy sauce aroma type liquor by stir bar sorptive extraction and gas chromatography-mass spectrometry[J].J Sci Food Agr,2011,91(7):1187-1198.
[3]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microbiol,2016,82(8):2506-2515.
[4] ZHENG J, LIANG R, WU C, et al. Discrimination of different kinds of Luzhou-flavor raw liquors based on their volatile features[J].Food Res Int,2014,56:77-84.
[5]ZHU X,TAO Y,LIANG C,et al.The synthesis of n-caproate from lactate:a new efficient process for medium-chain carboxylates production[J]. Sci Rep,2015,5:14360.
[6] HU X L, DU H, XU Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[7]AGLER M,SPIRITO C,USACK J,et al.Development of a highly specific and productive process for n-caproic acid production:applying lessons from methanogenic microbiomes[J].Water Sci Technol,2014,69(1):62-68.
[8] STEINBUSCH K J, HAMELERS H V, PLUGGE C M, et al. Biological formation of caproate and caprylate from acetate: fuel and chemical production from low grade biomass[J].Energ Environ Sci,2011,4(1):216-224.
[9]CAVALCANTE W D A,LEITÃO R C,GEHRING T A,et al.Anaerobic fermentation for n-caproic acid production:A review[J].Process Biochem,2017,54:106-119.
[10]JEON B S,KIM S,SANG B I.Megasphaera hexanoica sp.nov.,a mediumchain carboxylic acid-producing bacterium isolated from a cow rumen[J].Int J Syst Evol Micr,2017,67(7):2114-2120.
[11]GILDEMYN S,MOLITOR B,USACK J G,et al.Upgrading syngas fermentation effluent using Clostridium kluyveri in a continuous fermentation[J].Biotechnol Biofuels,2017,10(1):83.
[12]WEIMER P J,STEVENSON D M.Isolation,characterization,and quantification of Clostridium kluyveri from the bovine rumen[J].Appl Microbiol Biot,2012,94(2):461-466.
[13]彭兵,祝熙,李忠奎,等.窖泥高产己酸菌分离鉴定及培养条件优化的研究[J].中国酿造,2016,35(5):43-46.
[14]郭艺山,苏江滨,陈茂彬.利用16s rDNA 测序对一株高产己酸菌株的鉴定[J].酿酒,2013,40(4):72-75.
[15] DOBRITSA A P, KUTUMBAKA K K, WERNER K, et al. Clostridium tepidum sp.nov.,a close relative of Clostridium sporogenes and Clostridium botulinum Group I[J].Int J Syst Evol Micr,2017,67(7):2317.
[16]JEON B S,MOON C,KIM B C,et al.In situ extractive fermentation for the production of hexanoic acid from galactitol by Clostridium sp. BS-1[J].Enzyme Microb Tech,2013,53(3):143-151.
[17]谢圣凯,陈建新.窖泥中己酸菌的筛选及其运用[J].酿酒科技,2018(9):44-51.
[18]薛正楷,薛原.一株窖泥己酸菌株的多相鉴定及产酸研究[J].酿酒科技,2016(6):65-71.
[19]朱晓军.浓香型白酒窖泥产酸菌群培养及新型己酸合成菌的鉴定与特性分析[D].无锡:江南大学,2018.
[20]CHOI K,JEON B S,KIM B C,et al.In situ biphasic extractive fermentation for hexanoic acid production from sucrose by Megasphaera elsdenii NCIMB 702410[J].Appl Biochem Biotech,2013,171(5):1094-1107.
[21]赵辉,敞颜,王葳,等.浓香型白酒窖泥中高产己酸兼性厌氧细菌的分离鉴定[J].食品科学,2012,33(5):177-182.
[22] BARKER H A. The production of caproic and butyric acids by the methane fermentation of ethyl alcohol[J]. Arch Mikrobiol, 1937, 8(1):415-421.
[23] ZHU X, ZHOU Y, WANG Y, et al. Production of high-concentration n-caproic acid from lactate through fermentation using a newly isolated Ruminococcaceae bacterium CPB6[J].Biotechnol Biofuels,2017,10(1):102.
[24]JEON B S,CHOI O,UM Y,et al.Production of medium-chain carboxylic acids by Megasphaera sp. MH with supplemental electron acceptors[J].Biotechnol Biofuels,2016,9(1):129.
[25] DELLOMONACO C, CLOMBURG J M, MILLER E N, et al. Engineered reversal of the beta-oxidation cycle for the synthesis of fuels and chemicals[J].Nature,2011,476(7360):355-359.
[26]SEEDORF H,FRICKE W F,VEITH B,et al.The genome of Clostridium kluyveri,a Strict anaerobe with unique metabolic features[J].P Natl Acad Sci USA,2008,105(6):2128-2133.
[27] TAO Y, ZHU X, WANG H, et al. Complete genome sequence of Ruminococcaceae bacterium CPB6: A newly isolated culture for efficient n-caproic acid production from lactate[J].J Biotechnol,2017,259:91-94.
[28]杨娇,任聪,徐岩.克氏梭菌硫解酶的鉴定及其功能研究[J].微生物学报,2019,59(1):79-92.
[29]胡烈杰.克氏梭菌链延伸生理机制的初步研究[D].济南:山东大学,2016.
[30] CANDRY P, DAELE T V, DENIS K, et al. A novel high-throughput method for kinetic characterisation of anaerobic bioproduction strains,applied to Clostridium kluyveri[J].Sci Rep,2018,8(1):9724.
[31]GONZÁLEZCABALEIRO R,LEMA J M,RODRíGUEZ J,et al.Linking thermodynamics and kinetics to assess pathway reversibility in anaerobic bioprocesses[J].Energ Environ Sci,2013,6(12):3780-3789.
[32]HU L,HUANG H,YUAN H,et al.Rex in Clostridium kluyveri is a global redox-sensing transcriptional regulator[J]. J Biotechnol, 2016, 233: 17-25.
[33]WANG H,LI X,WANG Y,et al.Improvement of n-caproic acid production with Ruminococcaceae bacterium CPB6:selection of electron acceptors and carbon sources and optimization of the culture medium[J]. Microb Cell Fact,2018,17(1):99.
[34]胡智慧,谌柄旭,任雪,等.白酒生产用己酸菌发酵液发酵条件及培养基组成的优化[J].中国酿造,2018,37(4):16-22.
[35] OLESKOWICZ-POPIEL P.Designing reactor microbiomes for chemical production from organic waste[J].Trends Biotechnol,2018,36(8):747-750.
[36]RICHTER H,MOLITOR B,DIENDER M,et al.A narrow pH range supports butanol,hexanol,and octanol production from syngas in a continuous co-culture of Clostridium ljungdahlii and Clostridium kluyveriwith in-line product extraction[J].Front Microbiol,2016,7:1773.
[37] KENEALY W R,CAO Y, WEIMER P J. Production of caproic acid by cocultures of ruminal cellulolytic bacteria and Clostridium kluyveri grown on cellulose and ethanol[J].Appl Microbiol Biot,1995,44(3-4):507-513.
[38] WEIMER P J, NERDAHL M, BRANDL D J. Production of medium-chain volatile fatty acids by mixed ruminal microorganisms is enhanced by ethanol in co-culture with Clostridium kluyveri[J].Bioresource Technol,2015,175:97-101.
[39] KIM S G, JANG S, LIM J H, et al. Optimization of hexanoic acid production in recombinant Escherichia coli by precise flux rebalancing[J].Bioresource Technol,2018,247:1253-1257.
[40]TAO Y,WANG X,LI X,et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strongflavour liquor[J].Microb Biotech,2017,10(6):1603-1615.
[41]张志伟. 浓香型白酒窖泥微生物的研究[D]. 济南:齐鲁工业大学,2018.
[42]郭威,黄宇,谢逾群,等.促己酸菌产己酸的优良放线菌的筛选[J].酿酒,2016,43(3):47-51.
[43]郭威,管健,陈茂彬,等.放线菌促己酸菌产己酸的促进因子探究[J].酿酒科技,2016(10):48-52.
[44]嵇翔,徐岩,穆晓清,等.克氏梭菌和酿酒酵母混合培养提高己酸产量[J].食品与生物技术学报,2017,36(9):922-926.
[45]LIM J H,SEO S W,KIM S Y,et al.Refactoring redox cofactor regeneration for high-yield biocatalysis of glucose to butyric acid in Escherichia coli[J].Bioresource Technol,2013,135:568-573.
[46]KIM H,JEON B S,PANDEY A,et al.New coculture system of Clostridium spp.and Megasphaera hexanoica using submerged hollow-fiber membrane bioreactors for caproic acid production[J]. Bioresource Technol, 2018,270:498-503.
[47]CHEON Y,KIM J S,PARK J B,et al.A biosynthetic pathway for hexanoic acid production in Kluyveromyces marxianus[J].J Biotechnol,2014,182:30-36.
[48]薛正楷,杨根庆,张宿义.一株耐高乙醇和低pH 己酸产生菌Lysinibacillus fusiformis-pBE3-ep-SigB 的构建[J]. 中国酿造,2018,37(5):162-168.
[49] HU X L, DU H, XU Y. Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[50] LIANG H, LI W, LUO Q, et al. Analysis of the bacterial community in aged and aging pit mud of Chinese Luzhou-flavour liquor by combined PCR-DGGE and quantitative PCR assay[J].J Sci Food Agr,2015,95(13):2729-2735.
[51]鲁少文,魏翠翠,李泽华,等.新型己酸菌强化对人工窖泥培养过程中的原核微生物群落结构及酸、酯含量的影响[J].应用与环境生物学报,2019,25(6):1-13.
[52]刘小刚,熊燕飞,敖宗华,等.人工老熟窖泥对固态酿造白酒质量的影响研究[J].酿酒科技,2018(11):26-29.
[53]赵志军,位宁,刘延波,等.窖泥中酯化型细菌的筛选及产酶条件优化[J].中国酿造,2019,38(9):74-79.
[54]屈光伟,殷成浩,赵二欢,等.酯化红曲和复合己酸菌的应用研究[J].酿酒,2018,45(4):61-64.
[55]文成兵,张文学,杨官荣,等.提高浓香型大曲酒窖泥质量的研究[J].酿酒,2018,45(6):66-69.
[56]桑其明,王超凯,陕小虎,等.浓香型窖泥养护液的研究和应用[J].酿酒科技,2017(4):71-75.
[57]王亚庆,张海燕,郭风雪.浅谈创新窖泥功能菌培养技术在提升绵柔型白酒产质量中的应用[J].酿酒,2019,46(1):57-60.
[58]赵德义,曹建全,刘雪,等.己酸菌逐级扩大培养过程关键工艺研究[J].酿酒,2019,46(2):47-50.
[59]杜礼泉,饶家权,唐聪,等.窖泥功能菌液在窖泥养护中的应用[J].酿酒,2019,46(1):61-64.