食醋在我国有3 000多年的悠久历史,是古代科学文化技术传承的重要组成[1-2]。我国传统食醋的酿造大多采用固态发酵工艺,食醋的发酵过程大致可以分为酒精发酵阶段和醋酸发酵阶段[3]。在酒精发酵阶段由含糖或淀粉的原料,通过微生物的作用产生乙醇;在醋酸发酵阶段,众多微生物共同作用,其中醋酸菌将乙醇氧化为乙酸,乳酸菌将还原糖代谢产生乳酸,从而形成食醋的主体风味[4]。有机酸是食醋酸味的主要来源,对食醋的风味品质起到至关重要作用。
食醋中的有机酸可分为挥发性酸和不挥发酸。挥发酸以乙酸为主,约占有机酸总量的80%,构成食醋香气的中心。不挥发酸以乳酸为主,约占有机酸总量的20%。纯的乙酸具有刺激性的臭味,由于乳酸等不挥发酸的存在,使食醋酸味绵长、柔和可口[5]。有机酸不仅具有很强的杀菌和抑菌能力,还可以防止食物中维生素C(vitamin C,VC)的破坏[6]。有机酸等风味物质的生成与其中微生物的代谢作用密切相关,微生物通过直接或间接(产生相关酶系)的代谢方式,将原料中的营养物质不断转化成风味物质[7]。食醋发酵过程中主要包括醋酸菌、乳酸菌、芽孢菌等细菌以及霉菌、酵母菌等真菌。其中醋酸菌和乳酸菌分别是醋酸和乳酸的最主要生产者,两者合占总微生物的90%以上,是醋酸发酵阶段最重要的微生物[7]。醋酸菌能够通过乙醇脱氢酶的作用将乙醇迅速氧化成乙酸,乳酸菌则通过乳酸脱氢酶等的作用将还原糖等代谢生成乳酸以及其他多种有机酸。
温度和溶氧对食醋酿造过程产酸有重要影响,翻醅是传统固态食醋醋酸发酵阶段的一个重要工艺[8-11],通过翻醅补充氧气和进行物质交换,改变温度、溶氧等微生物生长代谢的主要环境。本研究对食醋固态发酵发酵过程中温度和翻醅频次影响有机酸的产生规律进行研究,分析不同温度(25~45 ℃)和不同翻醅频次(12~48 h/次)条件下有机酸的生产情况,并进一步分析了温度和翻醅条件对醋酸菌和乳酸菌关键产酸基因表达的影响。由于传统食醋的醋酸发酵过程中醋酸菌和乳酸菌占总微生物的95%以上,Acetobacter pasteurianus占醋酸菌的95%以上,Lactobacillus helveticus占乳酸菌的65%以上[4,12]。本研究以这两株微生物作为产酸表达的研究对象,从分子和代谢水平阐释温度和翻醅对食醋发酵过程中有机酸生成的影响,为食醋行业技术进步奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
巴氏醋杆菌(Acetobacter pasteurianus)CP-A11、瑞士乳杆菌(Lactobacillus helveticus):筛选自食醋发酵过程,本实验室保存。
1.1.2 化学试剂
RNA plus试剂盒、Revert Aid TM第一链DNA合成试剂盒:大连宝生物有限公司。
1.1.3 培养基
MRS培养基:葡萄糖2%,蛋白胨1%,牛肉提取物1%,酵母提取物0.5%,无水乙酸钠0.5%,吐温80 0.1%,柠檬酸铵0.2%,磷酸氢二钾0.2%,硫酸镁0.058%,硫酸锰0.025%,调节pH为6.2~6.8。121 ℃灭菌20 min。
葡萄糖酵母浸膏(glucose yeast,GY)培养基:葡萄糖2%,酵母膏2%,乙醇3.5%(V/V)。121 ℃灭菌20 min。
1.1.4 引物
根据醋酸菌乙醇脱氢酶和乳酸菌乳酸脱氢酶的特异性基因片段,设计特异性引物用于反转录酶-聚合酶链锁反应(reverse transcription-polymerase chain reaction,RT-PCR)分析,如表1所示。
表1 实验所用引物
Table 1 Primers used in the experiment

1.2 仪器与设备
GHP-9270恒温培养箱:上海一恒科技有限公司;5418型小型高速离心机、Mastercycler® nexus X2 PCR基因扩增仪:德国Eppendorf公司;DZKW-C电热恒温水浴锅:河北黄华市航空仪器厂;StepOnePlusTM ABI Step-One Plus Real Time PCR System:美国Applied Biosystems公司;SBA-40C生物传感分析仪:山东省科学院生物研究所。
1.3 方法
1.3.1 取样
根据山西老陈醋发酵工艺,采集醋酸发酵阶段样品,采用五点取样法分别采集传统醋酸发酵1 d、3 d、5 d、7 d、9 d的样品分别代表醋酸发酵的前期、中前期、中期、中后期和后期。采样位置距离醋醅表面30 cm,相同发酵时期的醅样平行采集三份,每份约100 g,装入无菌取样袋,置于冰盒中运回实验室,保存于-80 ℃冰箱中。
1.3.2 固态食醋发酵
在实验室条件下模拟固态酿造工艺。将原材料高粱等粉碎为四到六瓣后,加入温水蒸煮1.5~2.0 h,然后按高粱∶大曲粉=1∶0.625的比例拌曲。混合均匀后,置于酒精发酵缸(约1.5 m深)中进行为期12 d的酒精发酵。取发酵结束酒醪,按照酒醪∶麸皮∶稻壳=5.0∶1.1∶0.6的比例混合均匀制成醋醅[13],装入5 L的发酵容器中,以发酵第3天的醋醅为火醅接种进行醋酸发酵。
1.3.3 食醋固态发酵过程理化指标分析
对食醋固态发酵过程主要理化指标进行分析,温度变化使用温度计在取样前测定。将温度计插入醋醅以下约30 cm处,待温度计的示数稳定后读数;溶氧含量使用MG01便携式气体检测仪在取样前测定。将气体收集管插入醋醅以下约30 cm处,打开开关进行测量,记录仪器读数;生物量测定采用细胞干质量法[14]。
总酸、不挥发酸、还原糖、氨基酸态氮和有机酸等指标参照NIE Z等[15]的方法进行测定,乙醇含量采用生物传感分析仪进行测定;醋醅样品中总糖的检测采用山西老陈醋国家标准GB/T 19777—2013《地理标志产品山西老陈醋》中斐林试剂法[16]。
1.3.4 发酵条件对醋酸菌和乳酸菌基因转录水平分析
采用实时荧光定量聚合酶链式反应(real-time fluorescent quantitative-polymerase chain reaction,RT-FQ-PCR)的方法进行醋酸菌代谢醋酸和乳酸菌代谢乳酸的关键酶(乙醇脱氢酶和乳酸脱氢酶)基因的转录分析。将醋酸菌和乳酸菌分别在GY和MRS培养基中活化后接入灭菌后的醋醅中,然后分别在不同温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、翻醅(12 h、24 h、36 h、48 h)条件下培养至醋酸发酵中期,收集菌悬液。总RNA采用RNA plus试剂盒进行分离。用DNase I处理去除残留的DNA。采用Takara cDNA合成试剂盒,将核糖核酸(ribonucleic acid,RNA反转录为互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA),然后进行实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RT-FQ-PCR),结果分析采用2-△△Ct法。
2 结果与分析
2.1 传统食醋醋酸发酵过程分析
2.1.1 食醋醋酸发酵阶段理化指标变化
山西老陈醋是我国著名传统食醋,采用固态发酵工艺生产。醋酸发酵阶段是食醋产酸的主要阶段,也是食醋中其他风味物质形成的重要阶段。总酸和乙醇是食醋醋酸发酵阶段的重要指标。测定食醋醋酸发酵阶段总酸、不挥发酸、乙醇、氨基酸态氮和还原糖含量的变化情况,结果见图1。
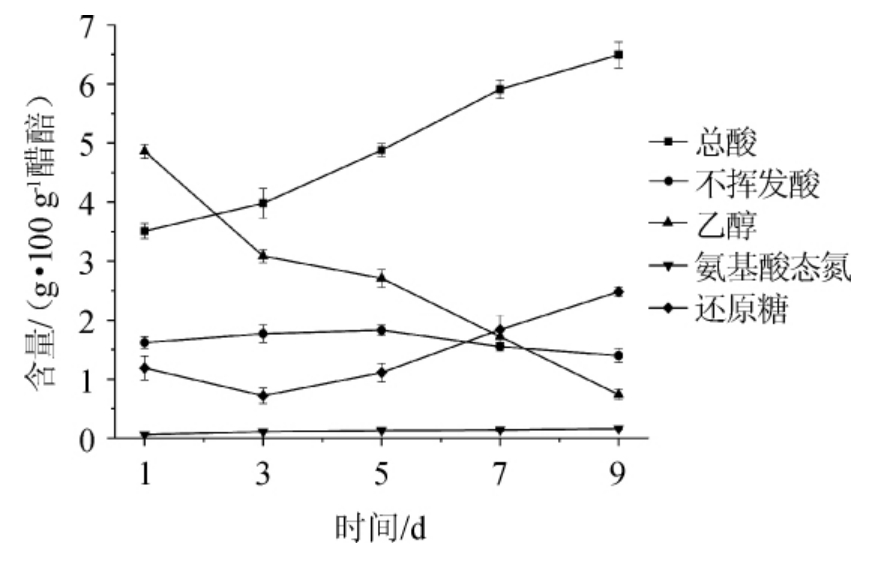
图1 山西老陈醋醋酸发酵过程曲线
Fig.1 Curves of acetic acid fermentation process of Shanxi aged vinegar
由图1可知,醋酸发酵过程中乙醇和总酸分别呈现下降和上升的趋势,乙醇的消耗和总酸生成的平均速率分别为0.515 g/(100 g·d)和0.373 g/(100 g·d)。不挥发酸含量呈现先上升后下降趋势,从发酵前期的1.62 g/100 g上升至发酵中期的1.83 g/100 g,随后下降至1.39 g/100 g。不挥发酸的降低与醋酸发酵中后期乳酸菌相对丰度降低,醋酸菌大量繁殖积累,乳酸和其他不挥发酸被醋酸菌等微生物分解代谢有关[17]。还原糖含量在发酵过程中呈现先下降后上升的趋势,还原糖含量在发酵中前期最低(0.72 g/100 g),随后逐渐升高至发酵后期的2.48 g/100 g。在醋酸发酵过程中,还原糖主要来源于大分子多糖的分解,用于微生物的生长代谢,其中乳酸菌是醋酸发酵阶段浓度最高的微生物,他们主要利用还原糖生长和代谢,醋酸发酵过程还原糖的变化趋势与乳酸菌的相对丰度变化趋势一致[15]。氨基态氮含量呈现略微升高的趋势,从发酵前期的0.06 g/100 g缓慢升高至发酵后期的0.16 g/100 g,其含量与醋醅中的高分子蛋白质或多肽的不断分解有关。不挥发酸和氨基态氮等物质能为醋醅提供良好的缓冲体系,使pH值均处于3.8~4.1之间,在该pH范围内适合醋酸菌、乳酸菌生长代谢,同时能够抑制体系中杂菌的生长[18]。
2.1.2 食醋醋酸发酵阶段有机酸含量变化
有机酸是食醋酸味物质的主要来源,也是构成食醋风味特征的最主要成分,丰富的有机酸能够赋予食醋独特的风味与口感。乙酸和乳酸是食醋中最主要的有机酸,占有机酸总量的90%以上,且两者的比例对食醋的风味有重要影响[18]。还原糖、乙醇分别与乳酸和乙酸的生成密切相关,因此进一步分析了发酵过程有机酸的变化。山西老陈醋醋酸发酵过程中有机酸含量的变化情况,结果见图2。
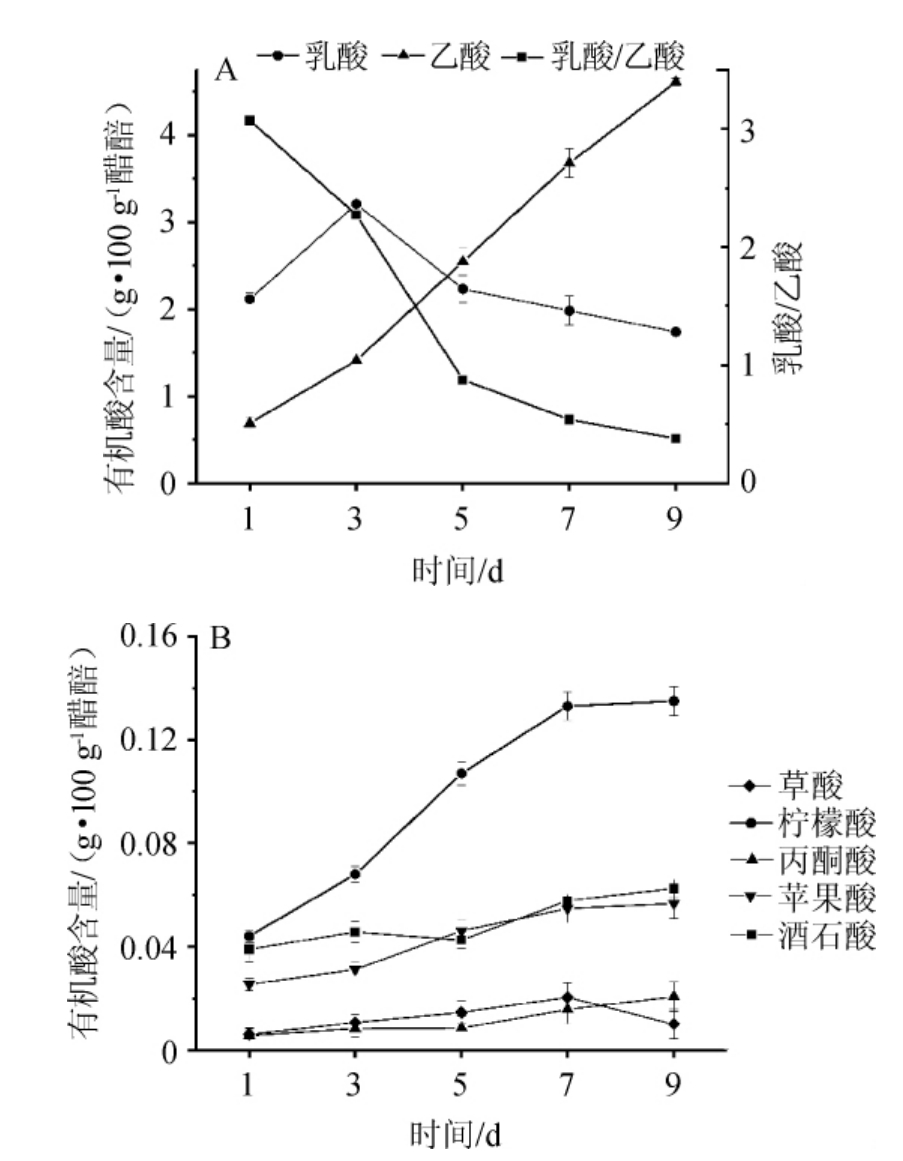
图2 山西老陈醋发酵过程中有机酸含量的变化
Fig.2 Changes of organic acids contents during Shanxi aged vinegar fermentation
由图2可知,乙酸含量在整个发酵过程中呈上升趋势,其生成速率先升高后略微降低。乳酸含量呈先升高后降低趋势,可能由于发酵中后期乳酸菌的相对丰度下降,并且乳酸作为中间代谢产物或碳源被其他微生物代谢[2]。醋酸发酵前期,乳酸的合成速率高于分解速率,乳酸含量不断升高,而随着酸度和温度等外界条件的变化,微生物群落逐步演替,使得发酵中期、中后期和后期乳酸的合成速率小于分解速率,进而使乳酸含量逐步降低。随着乙酸含量的快速升高,乳酸/乙酸在整个发酵过程中呈现逐步下降的趋势(图2A)。其他有机酸主要包括柠檬酸、草酸、丙酮酸、酒石酸和苹果酸(图2B),其中,柠檬酸的含量相对较高,在整个发酵过程中呈明显增长趋势。这些有机酸虽然含量相对较低,但能够增加食醋口感的丰富度,并且和乳酸等形成的缓冲体系,可缓解乙酸的刺激性,使食醋酸而不涩,醇厚绵长[19]。
2.1.3 食醋醋酸发酵阶段有机酸与理化性质的关系
发酵过程中有机酸相对含量及其与发酵过程主要理化性质之间的关系见图3。
由图3可知,乳酸和乙酸两种有机酸始终合占总有机酸的95%以上,其中乳酸所占百分比含量呈快速下降趋势,乙酸所占百分比呈快速上升的趋势。由图3A可知,除乳酸和乙酸外,其他有机酸合占总有机酸5%左右。由图3B可知,乳酸和发酵中前期(3 d)和中期(5 d)样品相关性最大,乙酸和发酵中后期(7 d)和后期(9 d)样品相关性最大,说明乳酸和乙酸主要在这些时期积累。与发酵中前期和中期样品相关性最大的理化指标是温度,而溶氧含量则与发酵中后期和后期的样品有最大的负相关性,说明发酵过程中温度和氧气含量对乙酸和乳酸的生成有很大的影响。

图3 山西老陈醋发酵过程中有机酸含量与理化性质的关系分析
Fig.3 Correlation between organic acids and physicochemical properties during Shanxi aged vinegar fermentation
2.2 温度和翻醅对食醋固态发酵产酸的影响
温度和溶氧是反映发酵状态的重要指标,山西老陈醋醋酸发酵过程中温度和溶氧含量变化见图4。由图4可知,发酵过程中温度呈现先升高后下降的趋势,温度在发酵中期最高,达到47 ℃。醋醅的热量主要源自发酵过程中微生物的代谢,在发酵的中前期、中期和中后期始终维持在43 ℃以上,说明这一时期微生物代谢更为活跃,溶氧含量则呈现与温度相反的趋势。
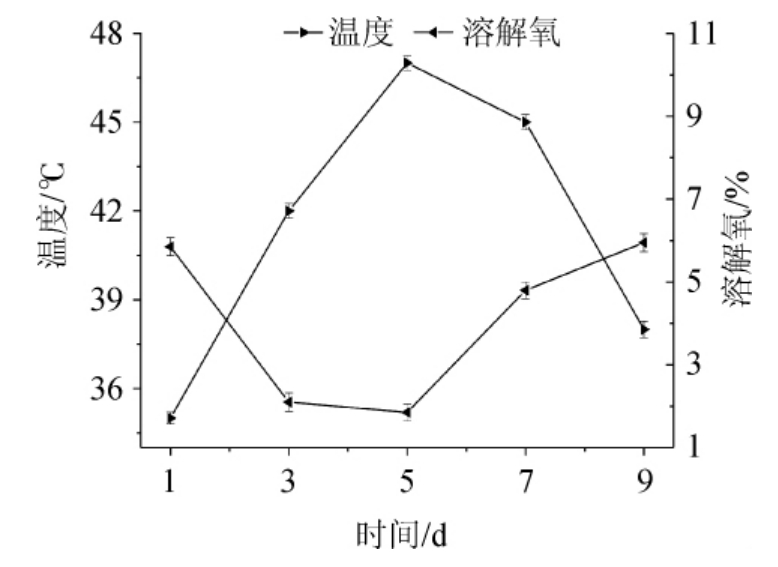
图4 山西老陈醋发酵过程中温度和溶氧量变化
Fig.4 Changes of temperature and dissolved oxygen contents during Shanxi aged vinegar fermentation
2.2.1 温度和翻醅对食醋固态发酵总酸含量的影响
总酸是反映食醋发酵状态的重要指标,反映了发酵过程微生物整体代谢活性、原料利用率和发酵效率等情况[15]。分析不同温度(25~45 ℃)和不同翻醅频次(12~48 h/次)条件下总酸的生产情况,结果见图5。由图5可知,醋酸发酵过程,生物量呈现先增加后降低的趋势,主要原因在于随着发酵时间延长,醋醅中酸度增加,同时乙醇、糖类等应用物质浓度降低,使微生物丰度下降、产酸速率下降[15]。由图5A和5B可知,30 ℃和35 ℃条件下微生物的生长和产酸速率均最大,说明在该温度条件下微生物的代谢活性最高。醋酸菌和乳酸菌的最适生长温度分别为30 ℃和37 ℃左右,因此该温度范围最有利于乙酸和乳酸菌的生长和代谢[20]。由图5C和5D可知,随着翻醅频次的增加,微生物生长和产酸速率增加。其原因在于,固态发酵体系水分活度低,营养物质交换不充分,翻醅有利于增加氧气浓度及营养物质的扩散,从而促进了微生物的生长和代谢。
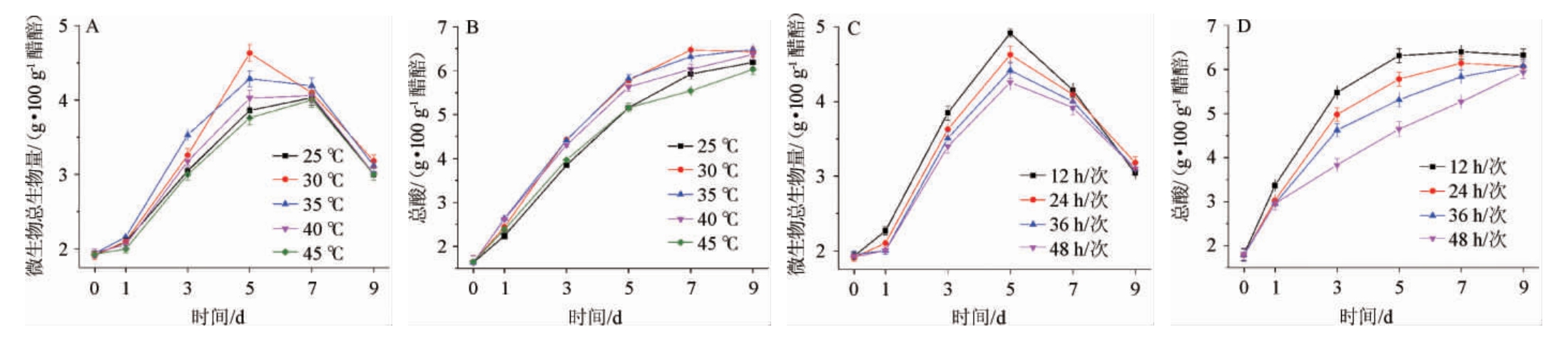
图5 温度和翻醅对微生物生长和产酸的影响
Fig.5 Effect of temperature and Cupei-turning on growth and acid production of microorganisms
2.2.2 温度和翻醅对乙酸生成的影响
醋酸发酵过程中乙酸主要通过醋酸菌氧化乙醇生成。山西老陈醋醋酸发酵过程醋醅温度逐渐增加,发酵中期温度一般维持在40 ℃以上,甚至达到45 ℃[13]分析不同温度(25~45 ℃)和不同翻醅频次(12~48 h/次)条件下乙酸的生产情况,结果见图6。由图6A和图6B可知,乙酸在30 ℃条件下生成速率最高,45 ℃条件下合成速率最慢,对应的乙醇消耗分别在30 ℃和45 ℃有最大和最小消耗速率。由图6C和6D可知,随着翻醅频次的增加,乙酸合成速率迅速增加,相应的乙醇消耗速率也更快。温度和翻醅频次(对应不同浓度氧含量)对食醋固态发酵过程中乙酸的生成都有重要的影响,相比来说,翻醅频次对乙酸的生成影响更大。其原因在于,醋酸菌为好氧微生物,在充足氧气的条件下才能更快速将乙醇氧化成乙酸。
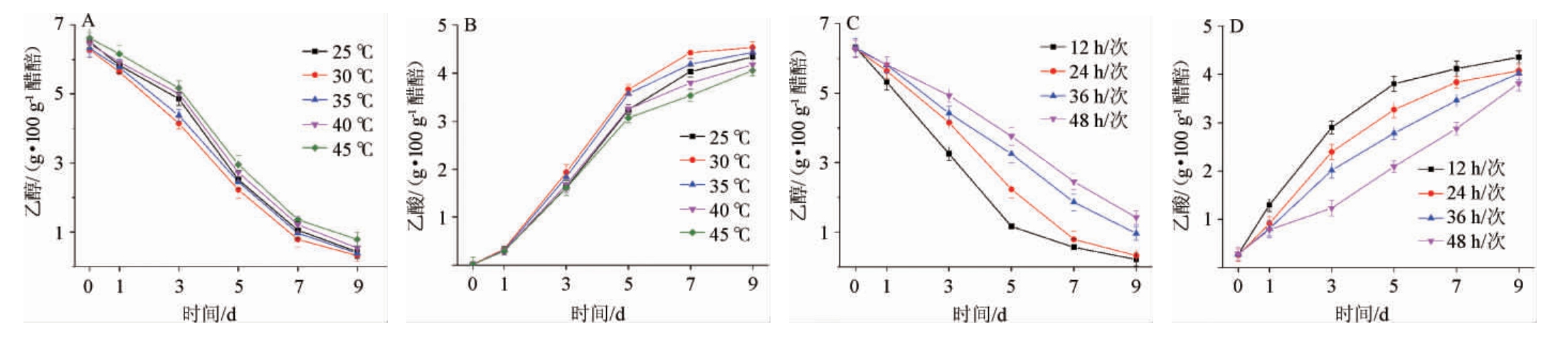
图6 温度和翻醅对乙酸生成的影响
Fig.6 Effect of temperature and Cupei-turning on acetic acid production
2.2.3 温度和翻醅对乳酸生成的影响
乳酸作为食醋中最主要不挥发酸对食醋的品质有至关重要的影响[17]。分析不同温度(25~45 ℃)和不同翻醅频次(12~48 h/次)条件下乳酸的生产情况,结果见图7。由图7可知,固态食醋醋酸发酵阶段乳酸含量呈略微升高后迅速下降的趋势,乳酸含量的下降可能与乳酸菌相对丰度的下降和醋酸菌等微生物的代谢消耗有关。乳酸合成速率分别在40 ℃时最大[0.293 g/(100 g·d)],25 ℃时最小[0.169 g/(100 g·d)]。发酵过程中总糖含量下降速率与乳酸含量平均增长速率相似,表明发酵过程中乳酸菌等微生物主要通过代谢糖类等物质生成乳酸。由图7A和7B可知,在发酵中后期,乳酸浓度开始下降,其中30 ℃条件下乳酸下降速率最大,其原因为醋酸菌可以通过乳酸脱氢酶将乳酸转化成丙酮酸,进而转化成其他风味物质[21],30 ℃下醋酸菌的代谢活性最强。因此,虽然30 ℃时醋酸的生成速率较大,但醋酸菌的高代谢活性导致了发酵结束乳酸浓度偏低。由图7C和7D可知,随着翻醅频次的增加,发酵中前期乳酸含量逐渐降低。两者相比较,温度对乳酸的生成影响更大。
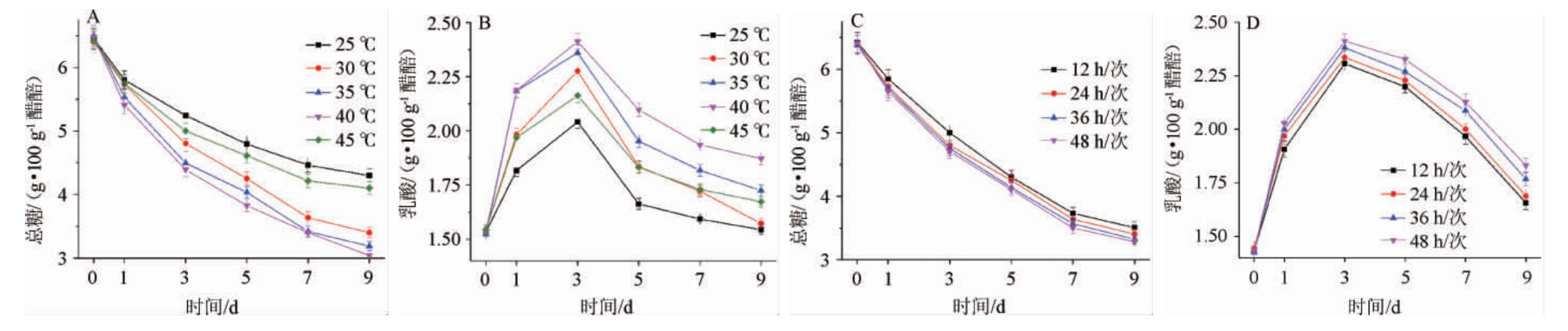
图7 温度和翻醅对乳酸生成的影响
Fig.7 Effects of temperature and Cupei-turning on lactic acid production
2.3 温度和翻醅对主要微生物关键产酸基因转录的影响
2.3.1 温度和翻醅对巴氏醋杆菌乙酸合成代谢的影响。
分析不同温度(25~45℃)和不同翻醅频次(12~48h/次)条件下乙醇脱氢酶(alcohol dehydrogenase,ADH)基因转录水平和乙酸生成量见图8。由图8A可知,30 ℃条件下A.pasteurianus的ADH基因的转录水平最高,且随着温度的增加ADH基因转录水平降低。由图8B可知,与ADH基因相对转录量对应,30 ℃时乙酸平均生成速率最大,并且随温度增加而降低。翻醅与ADH基因的转录和乙酸生成呈正相关,随着翻醅频次的增加,ADH基因转录水平和乙酸生成速率逐渐增大。以上结果表明,翻醅频次较温度对醋酸菌的乙酸合成代谢影响更大。
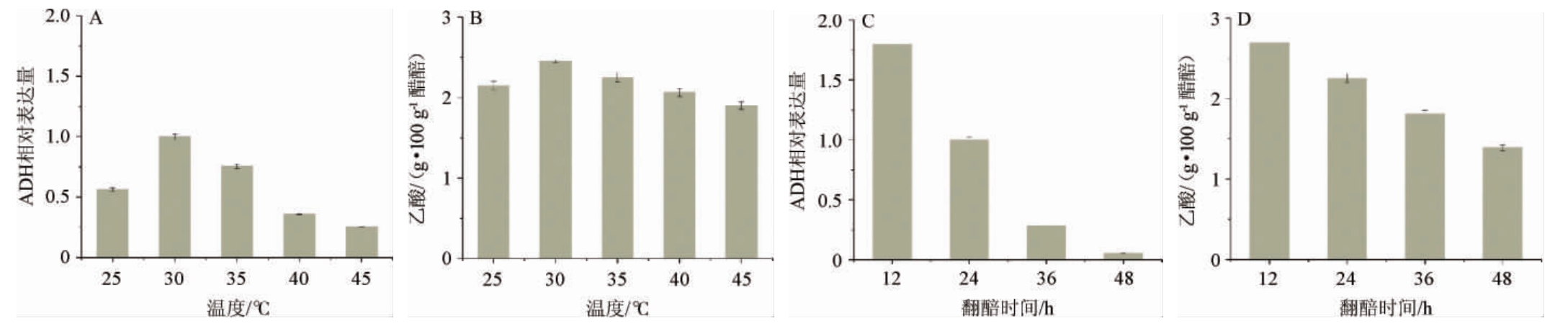
图8 温度和翻醅对巴氏醋杆菌的乙酸合成代谢的影响
Fig.8 Effect of temperature and Cupei-turning on acetic acid anabolism of Acetobacter pasteurianus
2.3.2 温度和翻醅对瑞士乳杆菌乳酸合成代谢的影响
分析不同温度(25~45℃)和不同翻醅频次(12~48h/次)条件下乳酸脱氢酶(lactic dehydrogenase,LDH)基因转录水平和乳酸生成量见图9。由图9A和图9B可知,随着温度增加,瑞士乳杆菌LDH基因转录水平和乳酸的生产量逐渐增加,在40 ℃条件下均达到最大。由图9C和9D可知,随着翻醅频率的增加,LDH基因转录水平和乳酸的生成逐渐降低。以上结果表明,温度较翻醅频次对乳酸菌的乳酸合成代谢影响更大。
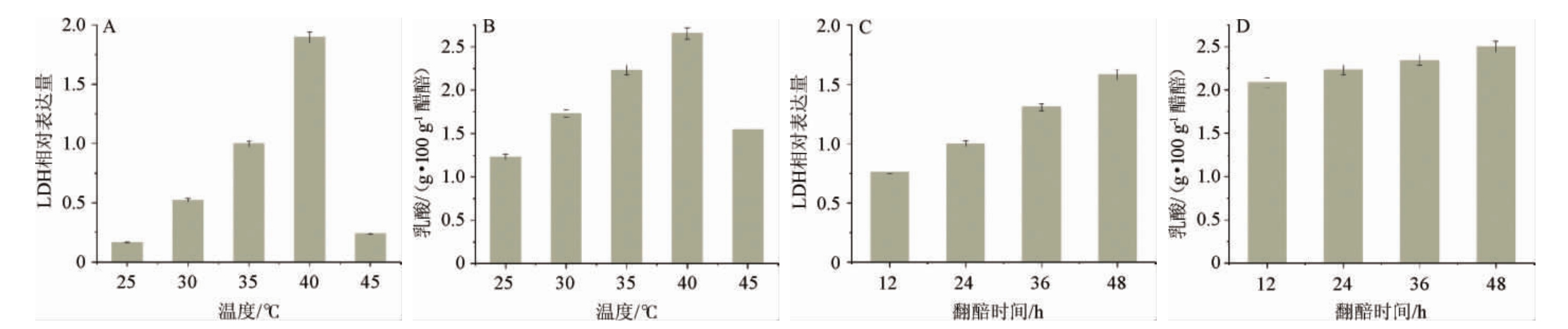
图9 温度和翻醅对瑞士乳杆菌乳酸合成代谢的影响
Fig.9 Effects of temperature and Cupei-turning on lactic acid anabolism of Lactobacillus helveticus
3 结论
乙酸和乳酸是山西老陈醋中最重要的有机酸,翻醅对其生产速率及两者的比例有较大的影响。山西老陈醋翻醅工艺主要通过影响醋醅中温度和氧气浓度等发酵条件影响乳酸菌和醋酸菌的有机酸合成代谢。其中,翻醅有利于降低温度,增加氧气浓度,从而促进醋酸菌的生长和乙酸生成相关基因的表达,从而促进乙酸的生成。而乳酸菌则更适合在较高温度下生长和代谢,翻醅操作过频将限制乳酸菌的生长和乳酸脱氢酶的表达,进而影响乳酸的生成。
[1]聂志强,汪越男,郑宇,等.传统食醋酿造过程中微生物群落的多样性及功能研究进展[J].中国酿造,2012,31(7):1-6.
[2]FERRI M,SERRAZANETTI D I,TASSONI A,et al.Improving the functional and sensorial profile of cereal-based fermented foods by selecting Lactobacillus plantarum strains via a metabolomics approach[J].Food Res Int,2016,89(Pt 3):1095-1105.
[3]陈涛,桂青,郭俊陆,等.传统工艺山西老陈醋发酵及熏蒸过程中风味与功能成分的变化分析[J].中国酿造,2017,36(2):15-20.
[4]NIE Z,ZHENG Y,XIE S,et al.Unraveling the correlation between microbiota succession and metabolite changes in traditional Shanxi aged vinegar[J].Sci Rep,2017,7(1):e9240.
[5]聂佳慧,李艺,秦雪梅.谷物酿造传统食醋化学成分研究进展[J].食品科学,2018,39(19):322-335.
[6]ZHENG Y,CHANG Y,XIE S,et al.Impacts of bioprocess engineering on product formation by Acetobacter pasteurianus[J]. Appl Microbiol Biot,2018,102(15):2535-2541.
[7]LI S,LI P,FENG F,et al.Microbial diversity and their roles in the vinegar fermentation process[J].Appl Microbiol Biot,2015,99(12):4997-5024.
[8]颜文凤.多功能食醋固态发酵罐的开发与研究[J].现代食品,2018,4(16):47-49.
[9]郎繁繁,田莉,王如福,等.山西老陈醋传统发酵工艺参数建模[J].中国酿造,2017,36(2):131-136.
[10]朱瑶迪,邹小波,徐艺伟,等.镇江香醋固态发酵过程中温度的监控与分析[J].中国食品学报,2016,16(2):124-129.
[11]胡本高.液态深层发酵与固态发酵食醋风味差别探讨[J].食品工业,2004,(5):27-28.
[12]NIE Z,ZHENG Y,WANG M,et al.Exploring microbial succession and diversity during solid-state fermentation of Tianjin duliu mature vinegar[J].Bioresource Technol,2013,148(8):325-333.
[13]程光胜.山西老陈醋[M].南京:南京出版传媒集团,2015:106-118.
[14]朱玛骁骐.ε-聚赖氨酸发酵动力学及提取工艺研究[D].镇江:江苏大学,2016.
[15]NIE Z,ZHENG Y,DU H,et al.Dynamics and diversity of microbial community succession in traditional fermentation of Shanxi aged vinegar[J].Food Microbiol,2015,47:62-68.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19777—2013 地理标志产品山西老陈醋[S].北京:中国标准出版社,2013.
[17]ZHENG Y,MOU J,NIU J,et al.Succession sequence of lactic acid bacteria driven by environmental factors and substrates throughout the brewing process of Shanxi aged vinegar[J].Appl Microbiol Biot,2018,102(6):2645-2658.
[18]HO C W,LAZIM A M,FAZRR S,et al.Varieties,production,composition and health benefits of vinegars:A review[J].Food Chem,2016,221:1621-1630.
[19]WU L,LU Z,ZHANG X,et al.Metagenomics reveals flavour metabolic network of cereal vinegar microbiota[J].Food Microbiol,2017,62:23-31.
[20]ZHU Y,ZHANG F,ZHANG C,et al.Dynamic microbial succession of Shanxi aged vinegar and its correlation with flavor metabolites during different stages of acetic acid fermentation[J].Sci Rep,2018,8(1):e8612.
[21]GUAN B,ZHAO J,CAI M,et al.Analysis of volatile organic compounds from Chinese vinegar substrate during solid-state fermentation using a colorimetric sensor array[J].Anal Methods,2014,6:9383-9391.