随着生活水平的提高,人们对健康的关注度逐渐提高,益生菌受到了广泛的关注,其中双歧杆菌属(Bifidobacterium)是一种厌氧的革兰氏阳性杆菌属[1],菌体不运动、细胞呈杆状、一端有时呈分叉状[2],是最早的定植于母乳喂养健康新生儿肠道中的益生菌,广泛存在于人和动物的消化道、口腔等环境中,具有维护肠道菌群平衡、改善乳糖不耐症、抑制病原菌、提高免疫、改善人体精神状态等功效[3-6]。双歧杆菌特殊的生长条件和高营养要求使得双歧杆菌的生长较为缓慢,国内外大量的研究主要集中在寻找能够促进双歧杆菌生长繁殖的物质,即促生长因子。促生长因子(bifidus factor,BF)是指可以促进微生物生长繁殖的一大类天然及合成物质。常见的促生长因子有寡聚糖类、多糖类(如云芝多糖水提物)、短链脂肪酸类物质,天然植物及中草药的提取物、蛋白及其水解产物(肽类)等[7-14]。其中已经证实的肽类促生长因子包括酪蛋白经胰蛋白酶作用产物;富含核蛋白的动物组织,如一些陆生和水生动物的胰脏、肝脏经植物蛋白酶处理后的产物,且上述肽类双歧因子具有广泛的促生长效应,对多种双歧均有促生长作用[15-19]。目前肽类双歧因子促生长机理尚不明确。
我国鲟鱼养殖业日渐扩大[20],鲟鱼加工量也在迅速增长。然而鲟鱼体型较大,加工过程中产生大量的内脏、鱼皮、鱼骨等下脚料,占总质量的50%以上,直接丢弃容易造成资源浪费和环境的污染。其中鲟鱼肝脏营养价值较高,富含维生素E、维生素A、维生素D和铁等矿物质元素以及蛋白质。有学者以鲟鱼肝为原料提取出了蛋白磷酸酶2A,这是酶抑制法检测微囊藻毒素所使用的主要蛋白酶[21]。也有学者测定了鲟鱼肝中脂溶性维生素A、D、E、K含量,发现鲟鱼肝中维生素E含量较高[22]。以上研究为鲟鱼肝的综合利用提供了参考。研究发现,鲟鱼肝中含有金属硫蛋白(metallothionein,MT),其主要参与微量元素的储存、运输和代谢[23-27],由于金属硫蛋白富含半胱氨酸,可为二硫键的合成提供原料,而含硫的肽以及二硫键对双歧杆菌的生长促进活性密切相关[28],这为其开发肽类双歧因子提供了可能性。因此,利用鲟鱼肝制备生物活性肽有利于最大限度地利用水产资源,蛋白酶解后得到的肽类物质也具有作为双歧杆菌促生长因子的开发潜力。
本研究以鲟鱼肝为原料,通过单因素和响应面优化法确定出最佳酶解条件,以6种双歧杆菌为模式菌株,考察酶解产物对双歧杆菌的促生长效果,研究结果可为多肽类双歧杆菌促生长物质的开发以及为水产品加工过程中下脚料的综合利用提供新思路。
1 材料与方法
1.1 材料与试剂
鲟鱼肝:取自西伯利亚鲟-史氏鲟杂交种;青春双歧杆菌、两歧双歧杆菌、动物双歧杆菌、长双歧杆菌、短双歧杆菌和婴儿双歧杆菌:本实验室分离保藏;十二烷基硫酸钠(sodium dodecyl sulfate,SDS):艾万拓股份有限公司;二硫苏糖醇(dithiothreitol,DTT):上海源叶生物科技有限公司;二奎啉甲酸(bicinchoninic acid,BCA)法蛋白定量试剂盒:碧云天生物有限公司;邻苯二甲醛(o-phthaldialdehyde,OPA)、四硼酸钠:北京化工厂;L-亮氨酸、碱性蛋白酶(200 000 U/g):北京酷来搏科技有限公司;中性蛋白酶(60 000 U/g)、牛血清白蛋白标准品:北京索莱宝科技有限公司;木瓜蛋白酶(100 000 U/g):南宁庞博生物工程有限公司;胃蛋白酶(400 000 U/g):西格玛奥德里奇(上海)贸易有限公司;胰蛋白酶(250 000 U/g):宝如亿(北京)生物技术有限公司;半胱氨酸盐酸盐、MRS肉汤培养基:北京奥博兴生物技术有限公司。
1.2 仪器与设备
DNP-9102型恒温培养箱:上海精宏试验设备有限公司;TGL-20M型台式高速离心机、TG16W型微量高速离心机:长沙平凡仪器仪表有限公司;FA1004型电子分析天平:上海天平仪器厂;WH-3型微型漩涡混合仪:上海沪西分析仪器厂;SCL-1300型垂直流洁净工作台:北京赛伯乐试验仪器有限公司;EF28型pH计:梅特勒-托利多仪器(上海)有限公司;SPX-250B-Z型电热恒温水浴锅:上海博讯实业有限公司;722S紫外分光光度计:上海棱光技术有限公司。
1.3 方法
1.3.1 鲟鱼肝蛋白酶解液的制备
鲟鱼肝→切块→脱脂→沥干→搅碎→加水匀浆→调节体系pH值→恒温酶解→沸水浴灭酶(100 ℃、10 min)→冷却→离心(8 000 r/min、10 min)→取上清液→酶解液
1.3.2 水解度测定
参照罗艳华等[29-30]对蛋白水解度测定方法中OPA法测定水解度。
1.3.3 蛋白酶种类筛选
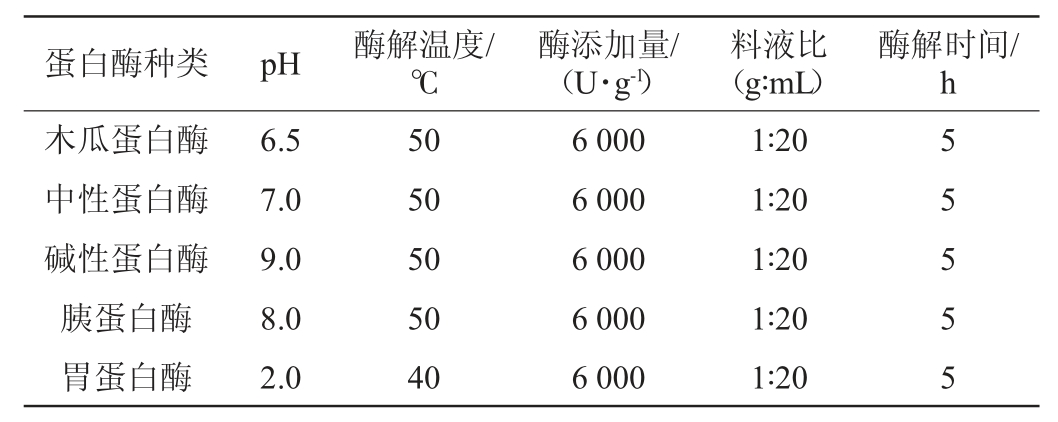
使用胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶分别对相同量的鱼肝进行单酶酶解,并根据各蛋白酶使用说明,分别在其最适pH和温度条件下添加相同量的酶,并以相同的料液比酶解相同时间,酶解后进行高温灭酶,测定水解度。考察各蛋白酶对鲟鱼肝蛋白水解度的影响,具体酶解条件如表1所示。
表1 鲟鱼肝蛋白酶解工艺条件
Table 1 Enzymatic hydrolysis process conditions of sturgeon liver protein
1.3.4 鲟鱼肝酶解条件优化单因素试验
选取水解度较高组使用的蛋白酶,设计5因素5水平单因素试验,分别考察酶解时间(4 h、5 h、6 h、7 h、8 h)、酶解初始pH值(7、8、9、10、11)、酶解温度(37 ℃、40 ℃、45 ℃、50 ℃、55 ℃)、料液比(1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL))与酶添加量(2 000 U/g、4 000 U/g、6 000 U/g、8 000 U/g、10 000 U/g)对鲟鱼肝蛋白水解度的影响。
1.3.5 Plackett-Burman试验
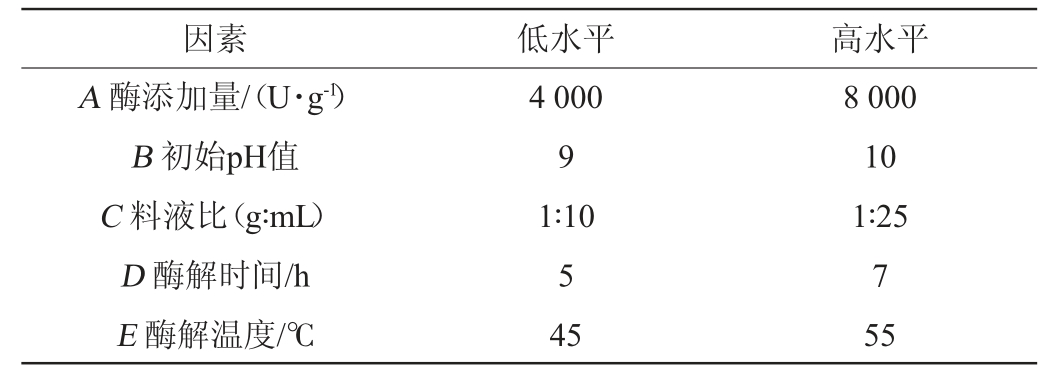
根据单因素试验的结果,参考PLACKETT R L等[31]试验方法,分别在试验因素的最大响应区间中选择高低两水平,使用Design-Expert 8.0.6软件设计Plackett-Burman试验,具体方案如表2所示。
表2 Plackett-Burman试验因素与水平
Table 2 Factors and levels of Plackett-Burman tests
1.3.6 最陡爬坡试验
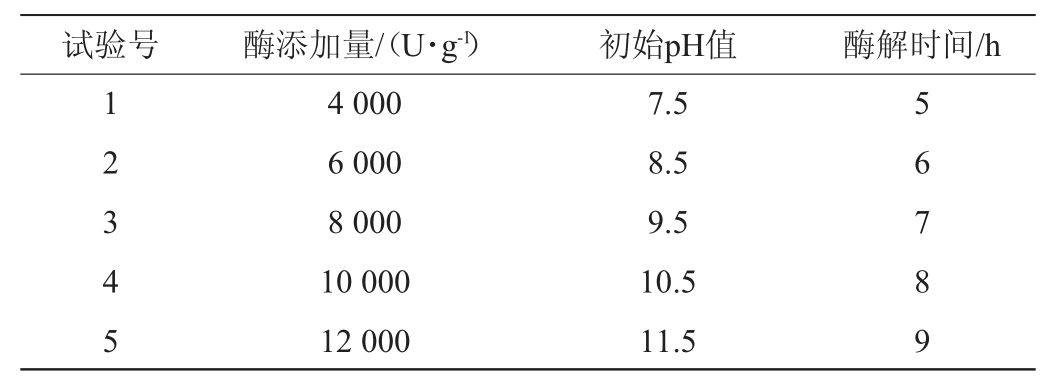
根据Plackett-Burman试验结果的贡献率大小得到的3个显著因素及效应值来设计最陡爬坡试验的变化方向和步长[32]。在所选择的显著因素中,若效应值为正,则变化方向为增加;若效应值为负,则变化方向为减少;效应值绝对值越大,变化步长应越小,反之应越大。最陡爬坡试验具体设计方案如表3所示。
表3 最陡爬坡试验设计
Table 3 Design of the steepest ascent tests
1.3.7 Box-Behnken响应面试验
以最陡爬坡试验结果中的拐点作为中心点,由Plackett-Burman试验中筛选出的显著影响因素为试验因素,并以水解度(Y)为响应值,通过Design-Expert 8.0.6软件设计3因素3水平的Box-Behnken响应面试验。具体方案如表4所示。对水解度值进行二次多元回归方程拟合,得到各因素与水解度响应值之间的二次多元回归方程,根据此方程确定最优解,得到最优酶解条件。
表4 Box-Behnken试验因素与水平
Table 4 Factors and levels of Box-Behnken tests

1.3.8 回归模型验证
根据响应面模型优化得到的最佳酶解条件进行验证试验,比较模型预测值与实际值,验证模型的正确、有效性。
1.3.9 鲟鱼肝酶解产物对双歧杆菌体外生长的影响
鲟鱼肝酶解液冻干粉的制备:鲟鱼肝→切块→脱脂→沥干→搅碎→加水调节料液比为1∶10(g∶mL),调节体系pH值为10.04,酶添加量5.27%→恒温45 ℃酶解8.6h→沸水浴灭酶(100 ℃,10 min)→酶解液→冷却→离心(8 000 r/min、10 min)→取上清液→微滤→40 ℃旋转蒸发→冷冻干燥48 h→鲟鱼肝酶解液冻干粉。
在无菌无氧操作条件下,取双歧杆菌冻干粉,用MRS肉汤培养基溶解,于(37±1)℃厌氧培养48 h,然后以3%的接种量连续传代培养活化。活化后,传代3代以上进行试验。
在MRS基础培养基中添加不同质量的鲟鱼肝酶解液冻干粉配制出不同质量浓度的培养基(不添加、0.1 mg/mL、0.2 mg/mL、0.3 mg/mL、0.4 mg/mL、0.5 mg/mL),调节pH值为7.6左右充氮、灭菌;每种菌以3%的接种量分别接种于对应的培养基中,分别于(37±1)℃厌氧静置培养,24 h后取出发酵液,测定发酵液中活菌数。
1.3.10 数据处理与分析
使用Microsoft Excel2016、SPSS 25.0进行方差分析、绘制统计图表;Design-Expert 8.0.6进行Plackett-Burman试验与Box-Behnken试验设计及结果分析。各处理组间的差异比较选择TukeyHSD法,P<0.05时有统计学意义。
2 结果与分析
2.1 蛋白酶种类筛选试验结果
蛋白酶的种类不同,其作用位点、方式及其所结合的底物特性将不同,从而酶解效果不同。由图1可知,各蛋白酶对鲟鱼肝的酶解能力不同,碱性蛋白酶酶解鲟鱼肝的水解度最高,为40.44%,酶解效果显著优于其他酶。因此,选用碱性蛋白酶作为目标酶,进行后续酶解条件参数优化。
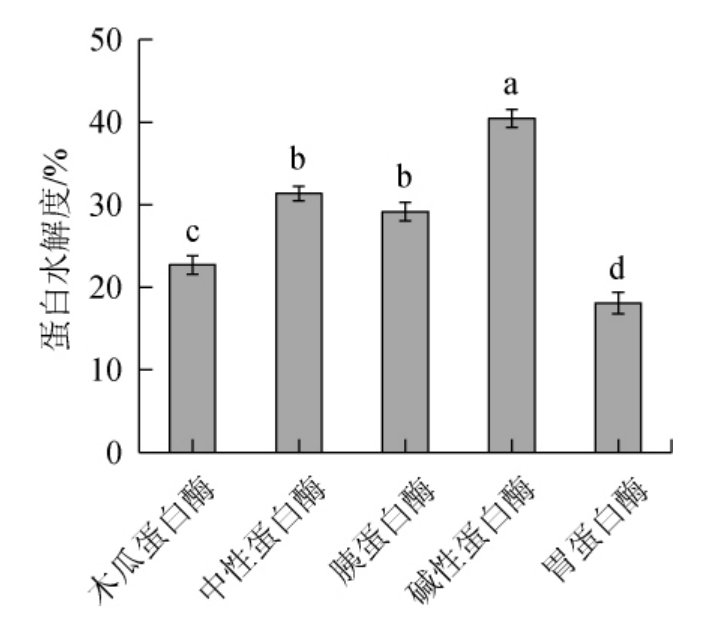
图1 不同种类蛋白酶对鲟鱼肝蛋白水解度的影响
Fig.1 Effect of different protease types on the hydrolysis degree of sturgeon liver protein
不同字母表示差异显著(P<0.05)。下同。
2.2 鲟鱼肝酶解条件优化单因素试验结果
由图2(a)可知,蛋白水解度随着酶解温度的升高呈先增加后减少的趋势;酶解温度在37~50 ℃范围内,随着酶解温度的升高,蛋白水解度增加;酶解温度为50 ℃时,蛋白水解度最高,为46.62%,继续升高酶解温度至55 ℃,蛋白水解度未进一步提升。可能是因为酶解温度低酶催化效率低;而酶解温度过高时酶的活性结构破坏,酶活力下降。因此,选择最适酶解温度为50 ℃。
由图2(b)可知,蛋白水解度随着酶添加量的增加呈现上升趋势;酶添加量为1%~3%(2 000~6 000 U/g)范围增加时,水解度升高速度较快;酶添加量为4%时(8 000 U/g),蛋白水解度最高,为53.76%,继续增加酶添加量对蛋白水解度无进一步提升作用。出现此现象原因可能是相同时间下蛋白酶添加至一定量时,蛋白已基本被酶作用完,所以继续增加酶的用量酶解效果提升不显著。因此,选择最佳酶添加量为4%(8 000 U/g)。
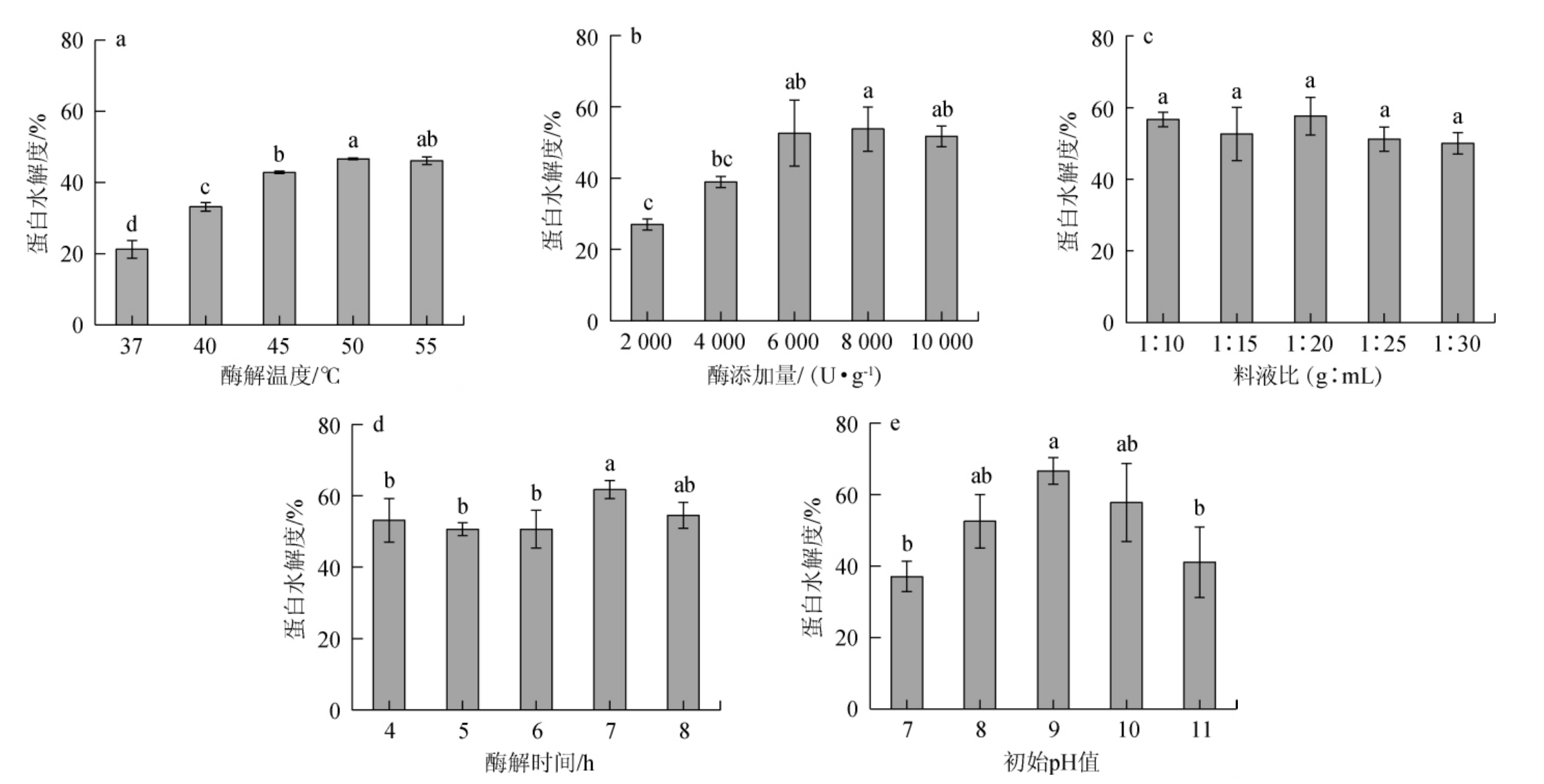
图2 各因素对鲟鱼肝蛋白水解度的影响
Fig.2 Effect of various factors on the hydrolysis degree of sturgeon liver protein
由图2(c)可知,不同料液比各处理组间蛋白水解度无显著差异(P>0.05),原因可能是因为实际试验过程为边振荡边酶解,振荡作用促进了酶在体系中的分散、均匀分布,并及时将蛋白表面已水解的肽分散使得酶时刻与底物充分接触,同时克服了因料液比提高时体系黏度增大而使蛋白酶分散不均,因此减小了不同处理组间的差异。
由图2(d)可知,蛋白质水解度随着酶解时间的增加呈现增加的趋势;酶解时间为7 h时,蛋白水解度最高,为61.71%,进一步提升时间,水解度未显著提升(P>0.05),说明7 h左右时酶解反应已基本结束。因此选择7 h为最佳酶解时间。
由图2(e)可知,鱼肝蛋白质水解度随初始pH值的提升呈现先增加后降低的趋势;当体系的初始pH值在7~9范围内逐渐升高时,鲟鱼肝蛋白的水解度呈上升趋势,体系初始pH为9时,水解度最高,为66.61%,继续提升pH,酶解效果变差,水解度下降。出现这一变化的原因是酶发挥催化作用存在一最适pH,此pH下酶活性最高,催化蛋白水解效果最优,偏离最优pH值之后,蛋白酶活性下降,催化效果变差。因此,选择最佳pH值为9。
2.3 Plackett-Burman试验结果
在单因素基础上,由Plackett-Burman试验考察单因素的贡献率与效应值,确定主要影响因素。试验考察酶添加量(A)、初始pH值(B)、料液比(C)、酶解时间(D)、酶解温度(E)5个因素对鲟鱼肝蛋白水解度(Y)的贡献率。根据各单因素试验结果选择的高低两个水平,试验设计与结果如表5所示。
表5 Plackett-Burman试验设计与结果
Table 5 Design and results of Plackett-Burman tests
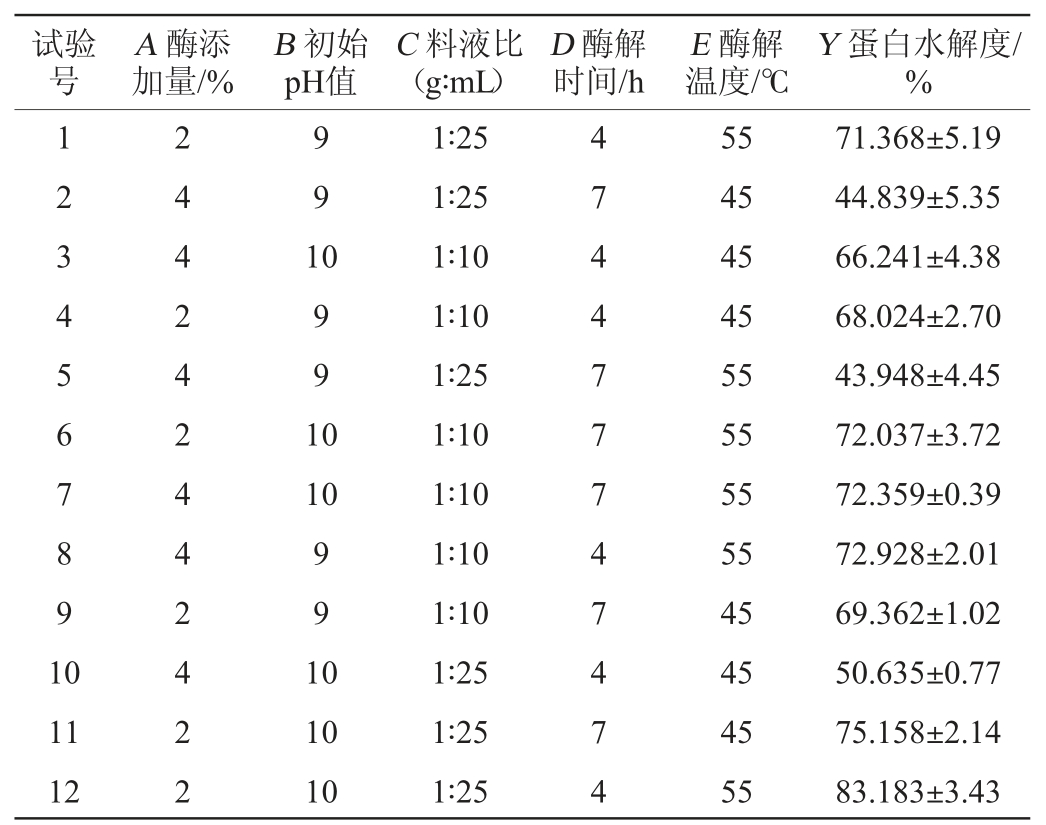
注:酶添加量单位换算:1%=2 000 U/g,下同。
使用Design-Expert 8.0.6软件对Plackett-Burman试验结果进行效应分析和方差分析,结果如表6所示。
表6 Plackett-Burman试验效应分析
Table 6 Effect analysis of Plackett-Burman tests
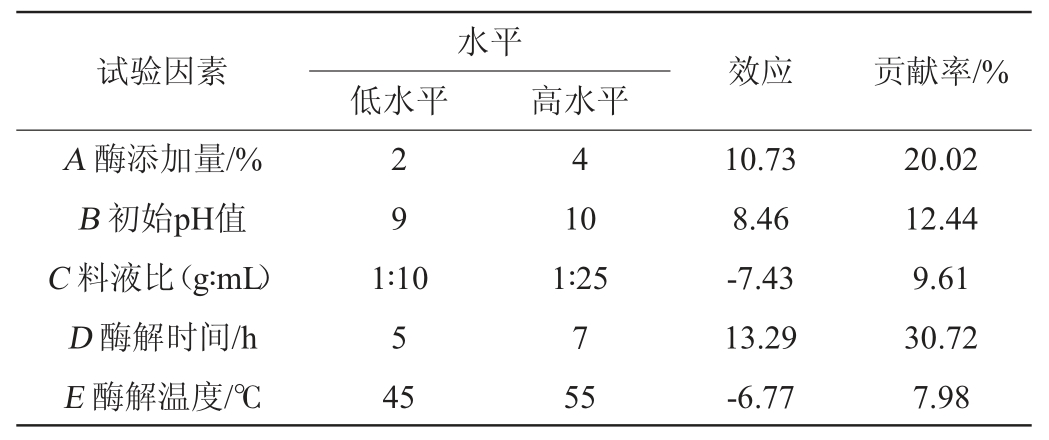
由表6可见,酶添加量(A)、初始pH值(B)、酶解时间(D)3因素的效应值为正,应该增加,料液比(C)、酶解温度(E)2因素的效应值为负,应该减小。其中贡献率大小表示各因素对该试验结果影响的大小,由贡献率的大小可得到这5个因素对模型影响的大小依次为酶解时间>酶添加量>初始pH值>料液比>酶解温度。因此,最终选择酶解时间、酶添加量和初始pH值共3个因素进行下一步的最陡爬坡试验。
2.4 最陡爬坡试验结果
如图3所示,最陡爬坡试验结果呈现先增高后降低的趋势,在4号试验点处出现最高点和拐点,该点处酶添加量5%(10 000 U/g)、初始pH值10.5、酶解时间8 h,此时鱼肝蛋白水解度达到最大,为80.95%。选择该点作为下一步Box-Behnken响应面试验设计的中心点。

图3 最陡爬坡试验结果与分析
Fig.3 Results and analysis of the steepest ascent tests
2.5 Box-Behnken响应面试验结果
利用Design-Expert 8.0.6软件对酶解时间、酶添加量和初始pH值设计3因素3水平的Box-Behnken试验,结果见表7,方差分析结果如表8所示。所选择的回归模型的P值小于0.01,表明整体模型对试验结果具有显著的影响;而失拟项的P值为0.685 6>0.05,失拟项检验不显著,模型选择适当。蛋白水解度(Y)对酶添加量(X1)、初始pH值(X2)和酶解时间(X3)的多元二次回归方程为:
表8 Box-Behnken试验设计与结果
Table 8 Design and results of Box-Behnken tests
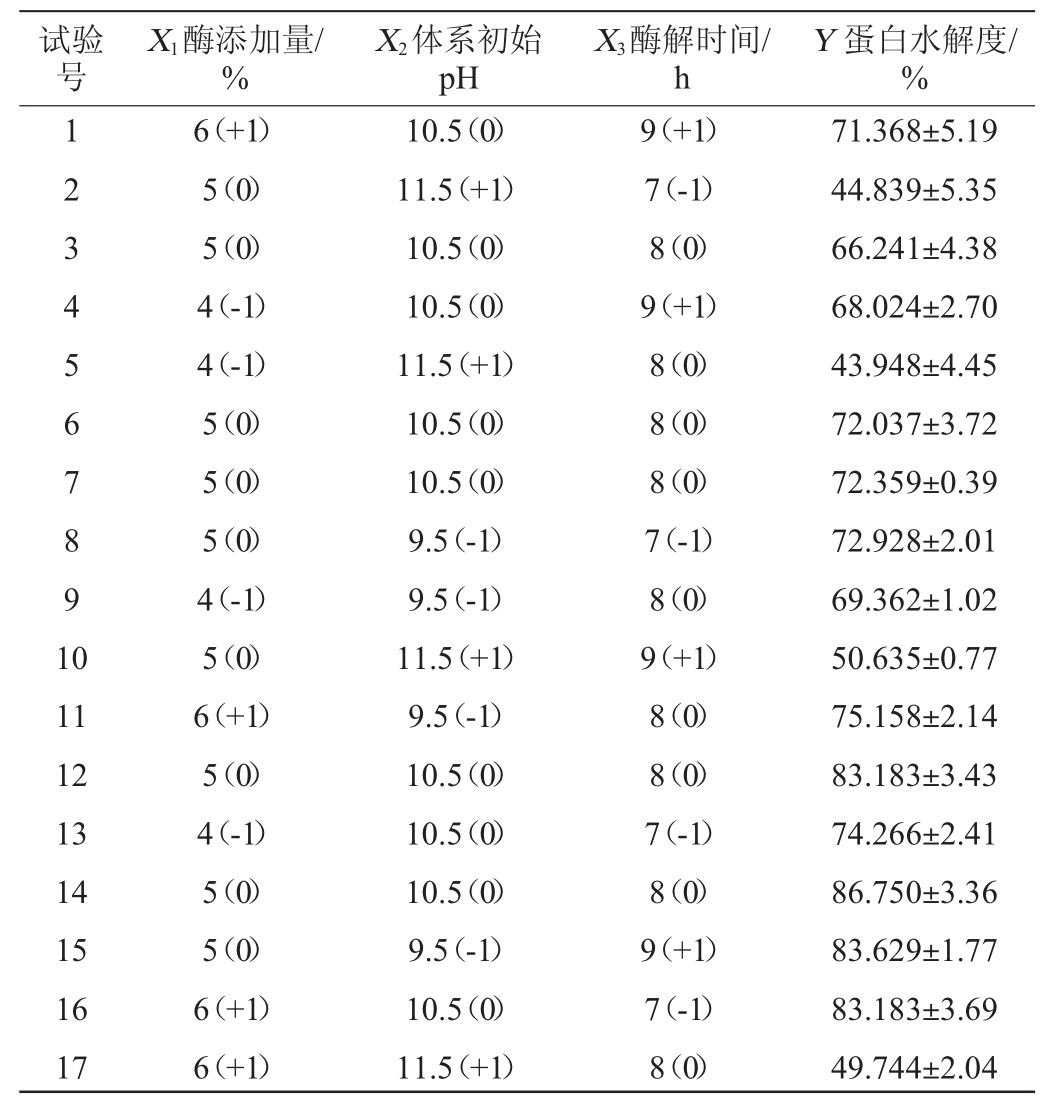
表9 回归模型方差分析结果
Table 9 Variance analysis of regression model
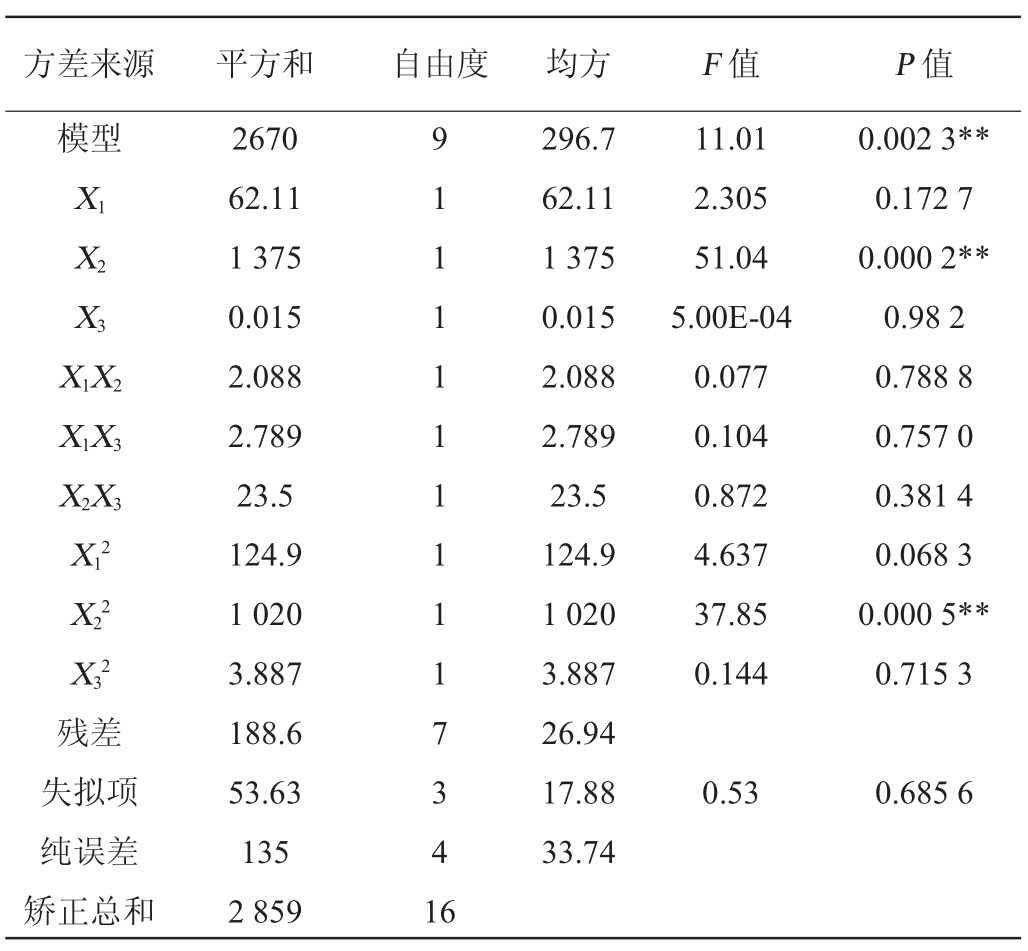
注:**表示P<0.01。
由所得方程可知,二次项系数为负值,其所代表的抛物面开口向下,表明方程具有最大值。由Design-Expert 8.0.6分析计算,得出最优酶解条件为酶添加量10 540 U/g、初始pH值10.04、酶解时间8.60 h,此时水解度可达83.86%。
2.6 回归模型结果验证
在优化得到的条件下,根据实际条件,设置酶添加量5.3%(10 540 U/g)、初始pH 10.0、酶解时间8.6h、料液比1∶10(g∶mL)、酶解温度45 ℃进行3组平行酶解试验,以对优化结果进行验证。鲟鱼肝蛋白水解度的平均值为81.70%,与预测值拟合度达97.42%,实际值与模型预测值基本一致,模型可信。
2.7 鲟鱼肝酶解产物对双歧杆菌生长的影响
由图4可知,6种双歧杆菌在添加有鲟鱼肝酶解液冻干粉的培养基中均能够生长增殖,且在一定质量浓度条件下生长效果较在基础MRS培养基更优。对不同双歧杆菌而言,培养基中鲟鱼肝酶解液冻干粉质量浓度并不全是越高越好。对于短双歧杆菌、动物双歧杆菌和长双歧杆菌,随着培养基体系中酶解产物质量浓度的提高,双歧杆菌活菌数呈现先升高后降低的趋势;青春双歧杆菌和婴儿双歧杆菌的活菌数随体系中鲟鱼肝蛋白酶解产物质量浓度的升高总体上呈现显著的上升趋势;而对于两歧双歧杆菌,培养基中酶解产物浓度为0.1 mg/mL的情况下便达到了显著的促生长效果(P<0.05),且在试验范围内,继续提升添加量,促生长效果不再显著提升(P>0.05)。不同菌种的结果出现差异的原因可能是菌种之间生长特性的不同以及其各自对酶解产物体系中各类物质利用情况的差异。由于加入的蛋白酶解产物组成比较复杂,成分并不单一;同时菌株对酶解产物的利用也是一个复杂的过程,且菌株间存在差异,促生长机理还需要进一步的研究。
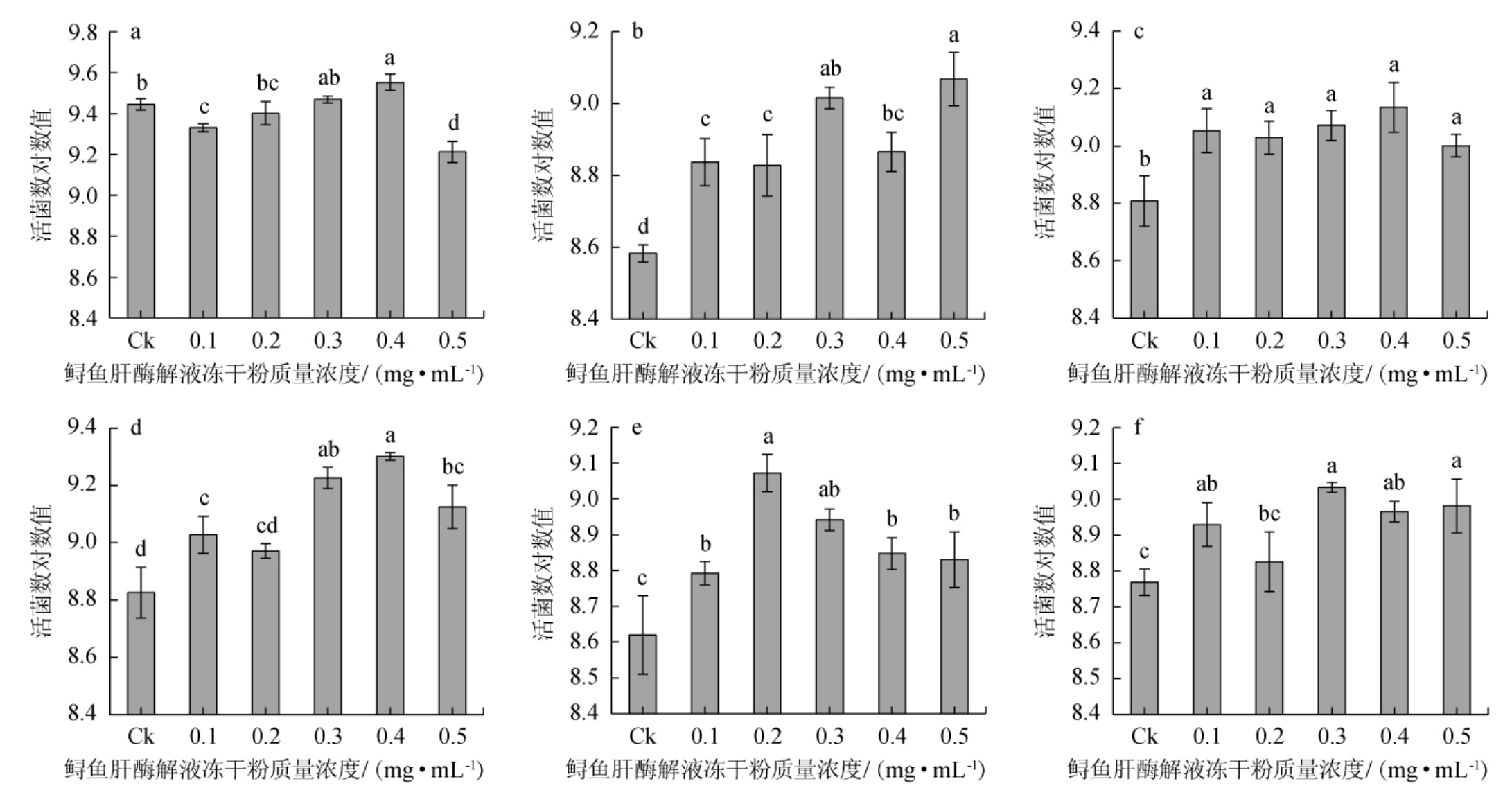
图4 鲟鱼肝蛋白酶解产物对双歧杆菌体外生长活菌数的影响
Fig.4 Effect of sturgeon liver protein enzymatic hydrolysate on the viable Bifidobacterium count in vitro
Ck为未加鲟鱼肝酶解液冻干粉;(a)短双歧杆菌;(b)青春双歧杆菌;(c)两歧双歧杆菌;(d)动物双歧杆菌;(e)长双歧杆菌;(f)婴儿双歧杆菌。
在试验水平范围内,对于短双歧杆菌、两歧双歧杆菌和动物双歧杆菌,鲟鱼肝蛋白酶解液冻干粉质量浓度为0.4 mg/mL时的促增殖效果最好,在这一条件下相对于基础培养基对照组,活菌数均显著提高,且差异显著(P<0.05);对于青春双歧杆菌、长双歧杆菌和婴儿双歧杆菌而言,鱼肝酶解液冻干粉质量浓度分别为0.5 mg/mL、0.2 mg/mL、0.3 mg/mL时促增殖效果最好,在对应条件下相对于基础培养基对照组,活菌数显著提高,且差异显著(P<0.05)。
3 结论
本研究在单因素试验的基础上,利用Plackett-Burman试验确定了酶解主要影响因素酶添加量、初始pH值、酶解时间,最陡爬坡试验确定了中心点,Box-Behnken响应面试验确定了二次多项回归模型,最终确定最优酶解条件:酶添加量5.3%(10 540 U/g),体系pH10.0,酶解时间8.6 h,酶解温度45 ℃,料液比1∶10(g∶mL)。此条件下最终水解度可达83.86%。
结果表明鲟鱼肝蛋白酶解产物具有作为一种双歧杆菌促生长因子的开发潜力,并为鲟鱼副产品综合利用提供了新思路。
[1]马迪,姜宁,张爱忠,等.双歧杆菌表达体系的研发现状及前景展望[J].黑龙江畜牧兽医,2017(21):84-87.
[2]刘宪夫,牛琴,覃树林,等.双歧杆菌分类、生理功能及应用研究进展[J].生物产业技术,2017(3):100-105.
[3]JIN Y,XU H,CHEN Y,et al.Therapeutic effect of Bifidobacterium combined with earlyenteral nutrition in the treatment of severe acute pancreatitis:a pilot study[J].Eur Rev Med Pharmacol Sci,2018,22(12):4018-4024.
[4]曹振辉,刘永仕,潘洪彬,等.乳酸菌的益生功能及作用机制研究进展[J].食品工业科技,2015,36(24):366-370,377.
[5]XIANG R,TANG Q,CHEN X Q,et al.Effects of zinc combined with probiotics on antibiotic-associated diarrhea secondary to childhood pneumonia[J].J Trop Pediatrics,2019,65(5):421-426.
[6]INOUE T,KOBAYASHI Y,MORI N,et al.Effect of combined bifidobacteria supplementation and resistance training on cognitive function,body composition and bowel habits of healthy elderly subjects[J].Beneficial Microbes,2018,9(6):843-853.
[7]刘露,张雁,池建伟,等.山药低聚糖对2 种双歧杆菌的体外促生长作用[J].食品科学,2017,38(6):130-135.
[8]李平兰,张篪.寡糖类双歧因子的生理活性功能及其在食品中的应用[J].中国酿造,1998,17(5):11-13.
[9]胥振国,蔡玉华,刘修树,等.双歧杆菌研究进展及应用前景[J].中国生物制品学杂志,2017,30(2):215-220.
[10]WARD R E,NIÑONUEVO M,MILLS D A,et al.In vitro fermentability of human milk oligosaccharides by several strains of bifidobacteria[J].Mol Nutr Food Res,2007,51(11):1398-1405.
[11]APARNA H S,SALIMATH P V.Acidic glycoproteins of buffalo colostrums and their influence on the growth of Bifidobacterium bifidus[J]. Nutr Res,1999,19(2):295-303.
[12]李纳.两株益生乳酸菌培养优化及其肠道功能评价[D].泰安:山东农业大学,2018.
[13]PROULX M,WARD P,GAUTHIER S F,et al.Comparison of bifidobacterial growth-promoting activity of ultrafiltered casein hydrolyzate fractions[J].Dairy Sci Technol,1994,74(2):139-152.
[14]SHIHATA A,SHAH N P.Proteolytic profiles of yogurt and probiotic bacteria[J].Int Dairy J,2000,10(5):401-408.
[15]李继珩.双歧因子和双歧杆菌[J].生化药物杂志,1985(4):18-22.
[16]LEVESQUE J,AICARDI,GAUTIER.Role of bifidus factor II in establishment and maintenance of bifidus flora in infants[J]. Sem Hop,1959,35(4/1):262-268.
[17]ZBIKOWSKI Z,ZIAJKA S.Hydrolyzed casein as a source of bifidus factor[J].Nahrung,1986,30(3-4):415-416.
[18]YOSHIOKA S.Studies on the bifidus factor.II.Studies on the growthpromoting effect of various substances on bifidus bacilli[J].Nihon Shonika Gakkai Zasshi,1964,68:235-238.
[19]ROSE C S,GYORGY P.Bifidus factor 2 for growth of Lactobacillus bifidus[J].Proc Soc Exp Biol Med,1963,112(4):923-926.
[20]黄薇,史亚军.北京市鲟鱼产业价值链分析[J].中国农学通报,2013,29(17):75-79.
[21]刘细霞,贾离离,侯建军,等.鲟鱼肝中蛋白磷酸酶2A 的提取工艺优化[J].湖北师范大学学报(自然科学版),2019,39(1):5-9.
[22]孙伟红,冷凯良,邢丽红,等.高效液相色谱串联质谱法同时测定大黄鱼肝和鲟鱼肝中的脂溶性维生素[J].分析试验室,2010,29(S1):313-315.
[23]宁凤,傅俊江,陈汉春.金属硫蛋白及其生物学功能[J].中国生物化学与分子生物学报,2017,33(9):893-899.
[24]李广彦.湖北天峡鲟业有限公司三项科技成果通过鉴定[J].渔业致富指南,2008(1):12.
[25]姚冬儿,杨慧琳,斯兴开,等.基于响应面优化的褶牡蛎中金属硫蛋白提取工艺研究[J].现代食品科技,2018,34(2):189-190,245.
[26]SI M F,LANG J H.The roles of metallothioneins in carcinogenesis[J].J Hematol Oncol,2018,11(1):107-127.
[27]ZHOU S,WANG J,YIN X,et al.Nrf2 expression and function,but not MT expression,is indispensable for sulforaphane-mediated protection against intermittent hypoxia-induced cardiomyopathy in mice[J]. Redox Biol,2018,19:11-21.
[28]张火云.双歧因子促双歧杆菌生长机制的研究进展[J].江苏食品与发酵,2007(1):21-23.
[29]罗艳华,王全杰,陈沛海,等.蛋白水解物水解度测定方法的研究[J].皮革与化工,2017,34(2):26-31.
[30]NIELSEN P M,PETERSEN D,DAMBMANN C.Improved method for determining food protein degree of hydrolysis[J].J Food Sci,2001,66(5):642-646.
[31]PLACKETT R L,BURMAN J P.The design of optimum multifactorial experiments[J].Biometrika,1946,33(4):305-325.
[32]王瑶,李琪,李平兰.植物乳杆菌LPL-1 产细菌素发酵培养基优化[J].农业机械学报,2018,49(9):311-317.