火龙果(Hylocereus undulatus Britt)又称红龙果,一般为深红色表皮,白色或红色果肉。火龙果富含多种有益健康的营养成分,如磷、钾、镁等多种矿质元素和维生素[1-2],其果肉中的碳水化合物大多是天然葡萄糖,容易吸收,还含有丰富的植物白蛋白和氨基酸[3]。火龙果含有丰富的花青素类物质,以红心火龙果为最。花青素在自然界中分布极为广泛,为许多植物性食物提供鲜艳的颜色[4]。花青素被认为是类黄酮的一种,具有保护心血管弹性[5]、预防肥胖[6-7]、改善人体视力[8]和预防癌症[9-11]等药理作用及生物活性[12]。近年来,大量文献资料也陆续报道了花青素和花色苷在治疗癌症和细菌感染等方面的作用[13]。
火龙果果皮占其果总质量的1/3左右,通常作为废弃物丢弃。但火龙果皮中有很高含量的花青素类物质,可用于提取功能性成分作为保健产品、食品添加剂的配方。有许多研究证实可以通过简单、经济的方式获取火龙果皮中的功能性成分[14-15],超声辅助提取火龙果皮花色苷为159.15 mg/100 g[16],花青素为98.45 mg/100 mg[17]。火龙果皮因其具有高附加值,也被用于作为发酵原料、制作果皮粉等[18]。
将火龙果皮发酵为富含天然营养物质和生物活性物质[19]的发酵饮料,既可以利用果皮开发新型的保健产品,又可以使火龙果皮中的花青素得到充分的利用。花青素类物质在生产加工过程中,由于各种因素的影响并不稳定,容易降解。目前,有关于花青素保存和发酵饮料制备的研究较多,但以火龙果皮为原料酿造发酵饮料的研究还很少。本试验以红心火龙果果皮为原料酿造发酵饮料,先通过单因素试验,得到料水比,酶添加量,初始糖度和酵母菌接种量4个影响因素的最优水平,再用响应曲面试验分析多因素间的交互作用,确定最优的发酵工艺条件,为花青素在酿造过程中的保藏奠定基础。
1 材料与方法
1.1 材料与试剂
红心火龙果、白砂糖(食品级):市售;纤维素酶(50000U/g)、果胶酶(40 000 U/g):南宁东恒华道生物科技有限责任公司;Angel安琪高活性干酵母:安琪酵母股份有限公司;乳酸菌:北京陆桥技术股份有限公司;儿茶素标准品(纯度≥98%):酷尔化学科技有限公司;香草醛(纯度≥98%):国药集团化学试剂有限公司;无水甲醇、无水乙醇、浓盐酸(均为分析纯):天津市福晨化学试剂厂。
1.2 仪器与设备
JY1002电子天平:上海蒲春计量仪器有限公司;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;HHS-4S电子恒温不锈钢水浴锅:上海光地仪器设备有限公司;BCD-215KS电冰箱:青岛海尔股份有限公司;ZHWY-200B恒温振荡培养箱:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 工艺流程及操作要点
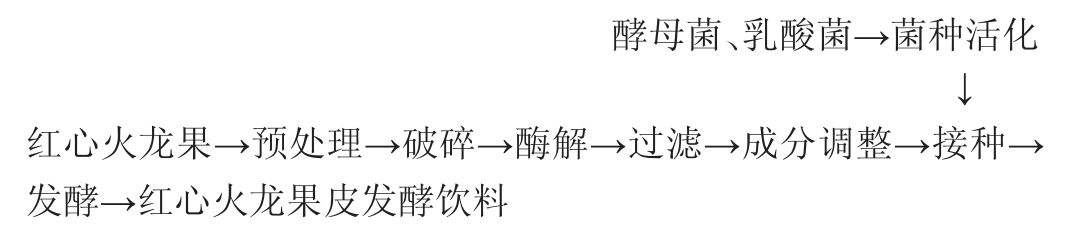
操作要点
预处理:挑选新鲜,无霉变,无病虫害的红心火龙果,用清水洗净后晾干红心火龙果表面的水分,撕下果皮,将果皮切碎备用。
破碎:按料水比称取红心火龙果皮和蒸馏水,一同加入果汁机中破碎,得到果浆。
酶解:取150 mL果浆置于250 mL发酵瓶中,调节pH至5左右,向其中加入0.4%纤维素酶和果胶酶复合酶解,置于50 ℃水浴中酶解2.5 h,酶解结束后90 ℃灭酶30 s。纤维素酶添加量为0.4%[20]。
过滤:将酶解后的果浆使用80目滤布过滤除去果渣,收集果汁备用。
成分调整:向果汁中加入白砂糖糖粉,调节果汁的糖度。
灭菌:采用巴氏杀菌的方式对火龙果皮汁进行杀菌,85 ℃杀菌15 min后冷却至室温。
菌种活化:取一定量的酵母菌和乳酸菌,分别用10倍蒸馏水溶解,35 ℃恒温水浴锅中活化40 min备用[21]。
接种:向果汁中接种酵母菌和乳酸菌混合发酵,乳酸菌接种量为0.1%[21]。
发酵:将接种后的果汁置于恒温培养箱中静置培养,35 ℃培养6 d得到发酵饮料[22]。
1.3.2 花青素含量的测定
参考朱曼利等[23]的研究,用儿茶素标准曲线代替原花青素绘制标准曲线,测定发酵液花青素含量。分别吸取1.0 mg/mL儿茶素标准溶液0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL于刻度试管中,用无水甲醇定容至1 mL,加入5 mL 5 g/100 mL的香草醛甲醇溶液,4 mL 10%盐酸甲醇溶液,混匀后,35 ℃条件下显色反应20 min,在波长500 nm处测定吸光度值,以儿茶素标准溶液质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制标准曲线[24]得到标准曲线回归方程y=0.155 8x+0.298 0,相关系数R2为0.990 5。
1.3.3 花色苷含量的测定
取1 mL火龙果酒发酵液于试管中,加入9 mL盐酸-乙醇溶液,置于暗处反应15 min,然后用盐酸-乙醇溶液作空白对照,在波长535 nm处测吸光度值。
式中:A535 nm为波长535 nm处的吸光度值;98.2为花色苷在535 nm处的平均消光系数;10为稀释倍数。
1.3.4 总酸度的测定
发酵饮料中的酸类物质为多种弱酸的混合物,可以使用酸碱滴定法用强碱滴定测定总酸度,参照GB/T 12456—2008《食品中总酸的测定》。
1.3.5 火龙果皮发酵饮料发酵工艺优化试验
调整料水比分别为1∶15、2∶15、1∶5、4∶15、1∶3(g∶mL);果胶酶添加量分别为0.2%、0.4%、0.6%、0.8%、1.0%;初始糖度分别为14%、16%、18%、20%、22%;酵母菌接种量分别为0.1%、0.2%、0.3%、0.4%、0.5%。采用单一变量控制法进行单因素试验,所有分组样品发酵完成后对各组中花青素、花色苷含量及总酸度进行测定。
1.3.6 响应曲面优化试验
根据Box-Behnken试验设计原理,选择4个单因素中对花青素、花色苷含量及酸度影响较大的3个因素:果胶酶添加量(A)、初始糖度(B)和酵母菌接种量(C)为变量,在料水比为1∶5(g∶mL)的水平下建立响应曲面回归模型,以花青素含量(Y1)、花色苷含量(Y2)、酸度(Y3)为响应值,按照3因素3水平进行响应曲面法试验。响应曲面试验设计因素水平编码表见表1。
表1 红心火龙果皮发酵饮料发酵工艺优化响应曲面试验设计因素与水平
Table 1 Factors and levels of response surface tests for optimization of fermentation technology of fermented red dragon fruit peel beverage

2 结果与分析
2.1 单因素试验结果
2.1.1 料水比对花青素、花色苷含量及酸度的影响
以料水比为变量酿造发酵饮料,分别测定发酵饮料中花青素、花色苷的含量和总酸度。结果见图1。
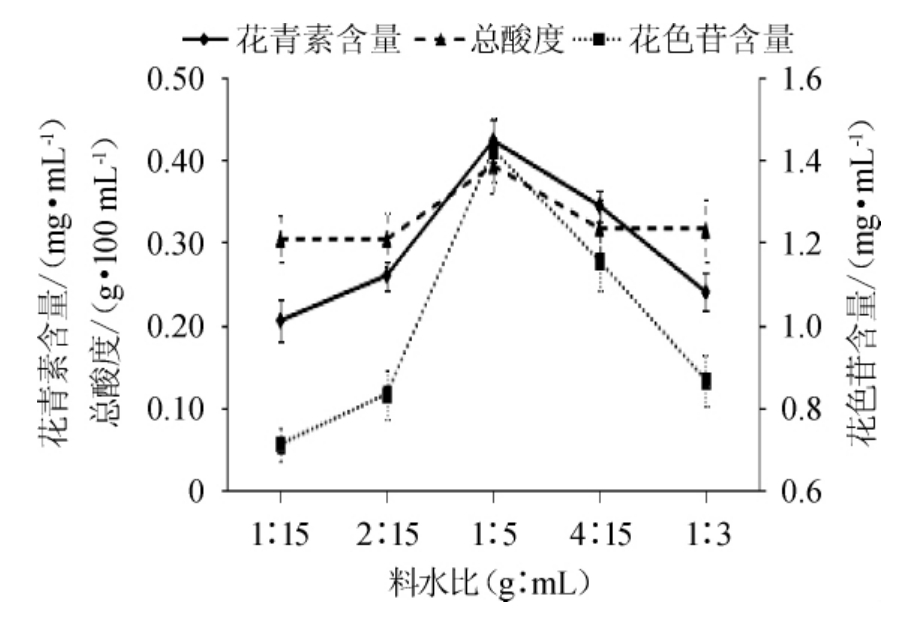
图1 料水比对花青素、花色苷含量及酸度的影响
Fig.1 Effect of liquid-solid ratio on anthocyanin,anthocyanins contents and acidity
由图1可知,在试验范围内,随着料水比的增加,花青素含量和花色苷含量都呈现增大的趋势,并在料水比为1∶5(g∶mL)时,二者都有最大的保留率。但是,当料水比继续增大时,花青素、花色苷含量反而逐渐降低。可能是在料水比较低时,初始发酵液中含有的花青素、花色苷总量较少,在发酵结束后发酵液中所保留的色素浓度也比较低。随着料水比的增大,初始发酵液中含有的花青素、花色苷总量也随着增大,从而有较高的保留率。在料水比超过1∶5(g∶mL)之后,虽然此时初始发酵液中的色素含量较高,但过高的料水比使得发酵不充分,导致此时发酵液的酸度降低,而花色素苷会随着酸性的降低降解为查耳酮,导致其含量的下降。酸度的变化情况也与色素相似,在料水比逐渐增大至1∶5(g∶mL)时有最大值,这可能是随着料水比的增加,可溶物固形物含量和其他的营养物质也随之增加,利于酵母菌和乳酸菌生长;但当料水比过高时,发酵液的浓度过高,水分活度的降低和溶解氧的减少影响了酵母菌和乳酸菌的生长。因此,料水比选择为1∶5(g∶mL)比较合适。
2.1.2 果胶酶添加量对花青素、花色苷含量及酸度的影响
以果胶酶添加量为变量酿造发酵饮料,分别测定发酵饮料中花色素、花色苷的含量和总酸度。结果见图2。
由图2可知,在试验范围内,随着果胶酶添加量的逐渐增大,发酵饮料中的花青素、花色苷含量也逐渐增大。这是因为在果胶酶添加量较低时,加入的所有果胶酶都能够与底物结合并发生反应,此时发生的是酶催化反应的一级反应,所以随着果胶酶添加量的增加,花青素和花色苷的释放量也增加。但当果胶酶添加量达到0.8%时,花青素和花色苷含量达到最大值,这是由于与酶结合发生反应的底物的量是一定的,此时底物已经被充分反应,再继续增大果胶酶添加量,不能够增大花青素、花色苷的释放量。酸度也在果胶酶添加量0.8%时出现最大值,这是由于此时的酶浓度已经达到最适,能够使可溶固形物和其他营养物质被充分释放,最利于酵母菌和乳酸菌生长。因此,选择0.8%的果胶酶添加量较为合适。
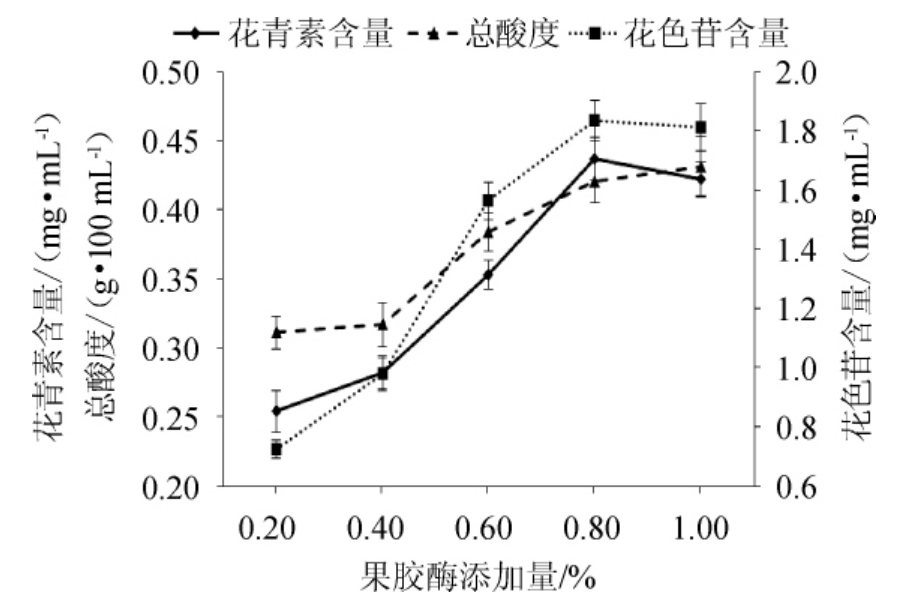
图2 果胶酶添加量对花青素、花色苷含量及酸度的影响
Fig.2 Effect of pectinase addition on anthocyanin,anthocyanins contents and acidity
2.1.3 初始糖度对花青素、花色苷含量及酸度的影响
以初始糖度为变量酿造发酵饮料,分别测定发酵饮料中花色素、花色苷的含量和总酸度。结果见图3。
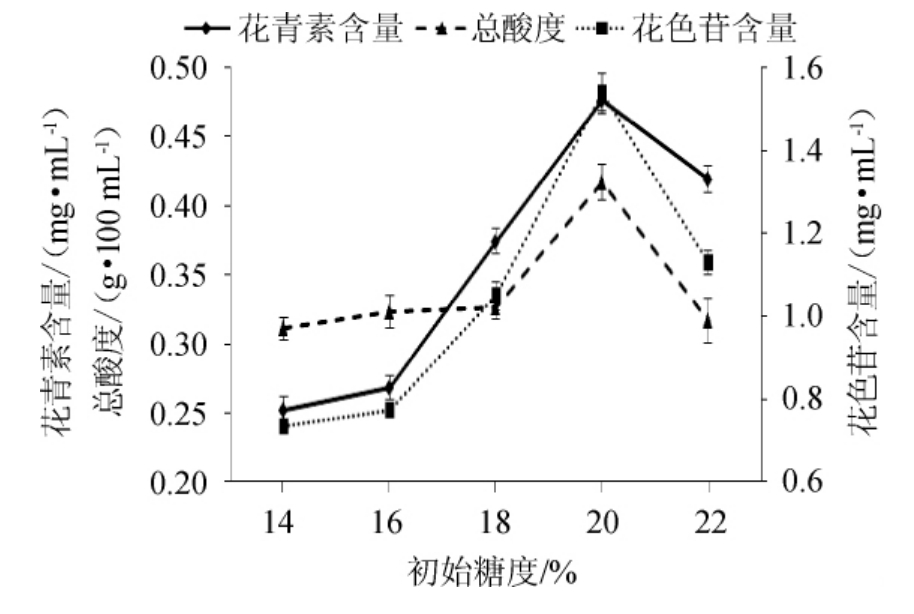
图3 糖度对花青素、花色苷含量及酸度的影响
Fig.3 Effect of sugar content on anthocyanin,anthocyanins contents and acidity
由图3可知,在试验范围内,随着初始糖度的逐渐增大,发酵饮料的花青素、花色苷含量逐渐增大,但在初始糖度过高时,花青素和花色苷在发酵液中的含量又有所减小。这是由于在初始发酵液中的糖类物质含量较低时,溶解氧较多,水分活度也较大,加快了花青素类物质的分解。在初始发酵液中的糖类物质含量较高时,由于水分活度的降低和溶解氧浓度的下降,使得花青素和花色苷的分解速度降低,所以高浓度糖能够使花青素和花色苷保持稳定。同时,适宜的糖度也有利于酵母菌生长,可以加快酒精的产生,有利于色素的溶解。但在初始糖度为22%时,此时高浓度的糖分子能与色素分子争夺水分子,影响了花青素和花色苷的溶解释放,而且此时糖度过高,抑制了酵母的生长和发酵,使得酒精的产生变慢,不利于色素的溶出。发酵液的初始糖度也影响酵母和乳酸菌的生长,从而影响有机酸的产生。因此,选择初始糖度为20%,更有利于色素的保留和发酵饮料制备。
2.1.4 酵母菌接种量对花青素、花色苷含量及酸度的影响
以酵母菌接种量为变量,分别测定发酵饮料中花色素、花色苷的含量和总酸度。结果见图4。
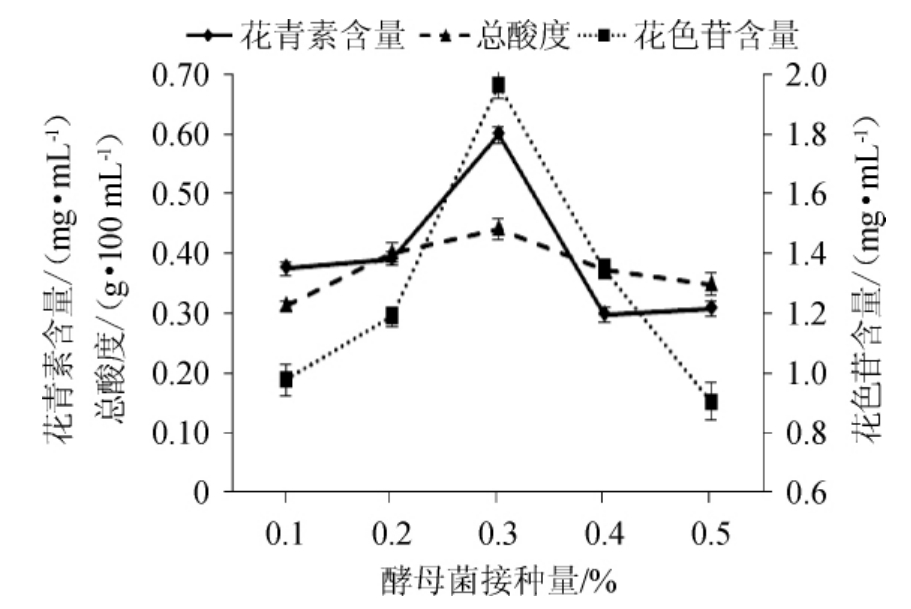
图4 酵母菌接种量对花青素、花色苷含量及酸度的影响
Fig.4 Effect of yeast inoculum on anthocyanin,anthocyanins contents and acidity
由图4可知,在验证范围内,花青素和花色苷含量随着酵母菌接种量的增大而呈现出先增大,后减小的趋势。这是因为,当酵母接种量很低时,乙醇和有机酸的产率也比较低,不利于花青素和花色苷的保存。随着接种量的增大,发酵液中的乙醇含量和酸度也在增大,降低了花色素苷的降解速率。但酵母接种量过高时,发酵液中的酵母浓度会高很多,在发酵初期酵母的迅速增殖,会导致糖类在短时间内迅速被消耗,增大发酵液的水分活度,并且大量的细胞代谢物也会加快花色素苷的降解,从而降低花青素和花色苷的含量。同时,过高浓度和过低浓度的初始菌群数量都不利于发酵饮料的酿造,因此,选择酵母菌接种量为0.3%较为合适。
2.2 响应曲面试验结果分析
根据Box-Behnken试验设计原理,选择对花青素、花色苷含量及酸度影响较大的3个因素,果胶酶添加量(A)、初始糖度(B)和酵母菌接种量(C)为变量,在料水比为1∶5(g∶mL)的水平下建立响应曲面回归模型,总酸度(Y)为响应值。结果见表2,方差分析见表3。
以总酸度为响应值,进行多元二次回归拟合分析,确定其方程为:酸度=0.44-0.032A-0.008 1B-0.003C-0.017AB-0.015AC+0.000 75BC-0.061A2-0.036B2-0.07C2。
表2 红心火龙果皮发酵饮料发酵工艺优化响应面试验设计与结果
Table 2 Design and results of response surface tests for optimization of beverage fermentation technology of fermented red dragon fruit peel beverage
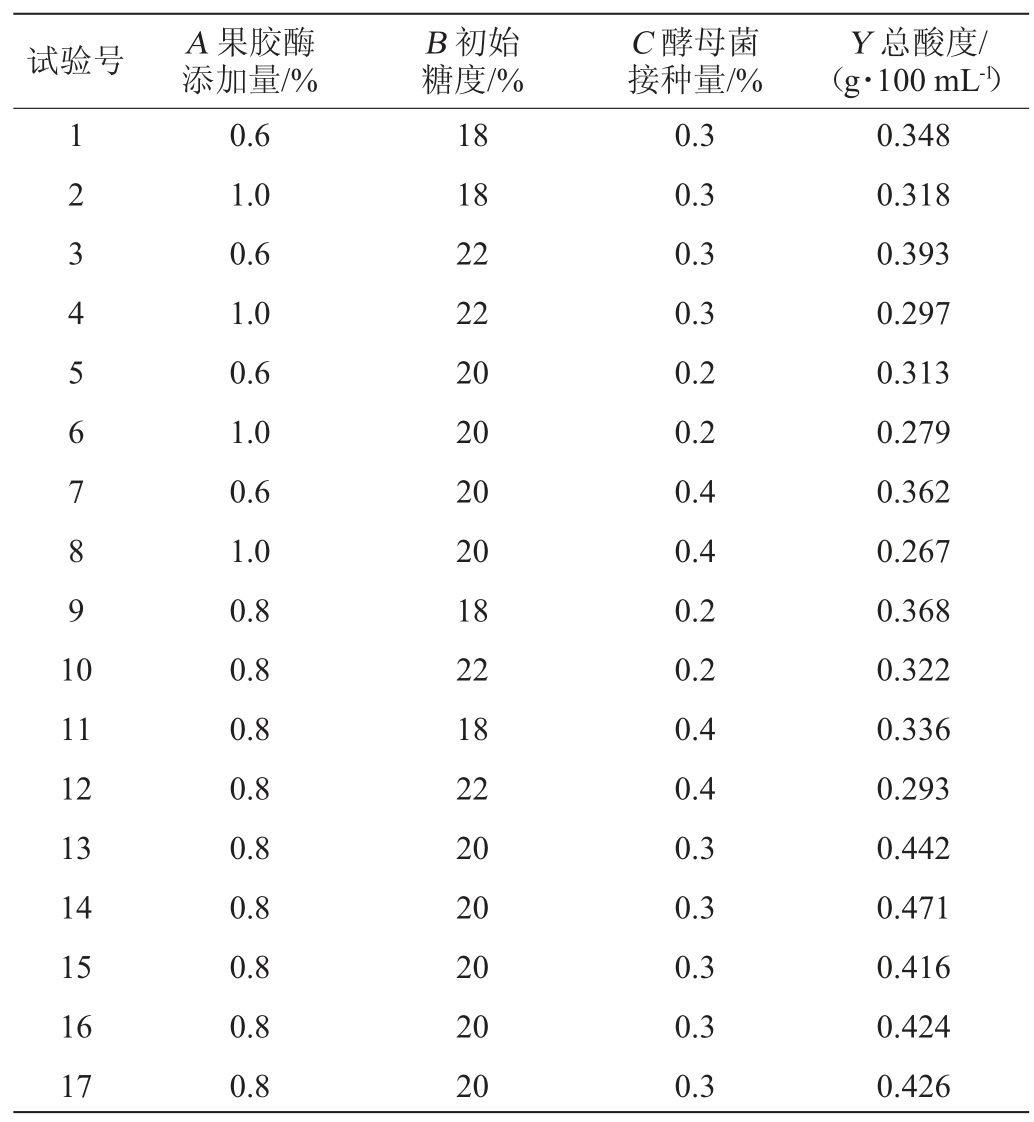
表3 二次回归模型方差分析
Table 3 Variance analysis of quadratic regression model
注:“*”表示统计结果显著,P<0.05;“*”表示统计结果极显著,P<0.01。
对表2中Y进行方差分析,结果见表3。该回归模型P值=0.003 7<0.05极其显著,说明模型建立良好,失拟项P值=0.262 3>0.05不显著。说明该模型中,酸度与其他变量之间对应关系良好。复相关系数R2为0.923 5,修正复相关系数R2Adj为0.825 2,说明有82.52%的试验符合该模型,由于试验中的其他因素干扰,仅有17.48%的试验不符合该模型,该模型可适用于大多数情况,与实际符合情况良好。因素A、A2、B2、C2均达到显著水平(P<0.05),说明响应值酸度与其他变量因素之间也有交互作用。根据F值,各因素对发酵饮料的酸度的影响次序为A>B>C。
2.3 验证试验
根据响应曲面试验设计,以酸度为评价指标,得到最佳的发酵工艺为料水比1∶5(g∶mL),酶添加量0.78%,初始糖度20.02%,酵母菌接种量0.29%。在此工艺下,花青素含量的理论值为0.600 mg/mL,花色苷含量的理论值为1.894 mg/mL,总酸度的理论值为0.438 g/100 mL。
在其他条件不变的情况下,为方便实际操作,修订最佳工艺条件为果胶酶添加量0.8%,初始糖度20%,酵母菌接种量0.3%。严格按照上述方法在该工艺条件下酿造发酵饮料,得到花青素含量为0.61 mg/mL,花色苷含量为1.90 mg/mL,总酸度为0.44 g/100 mL。花青素含量的相对误差为0.8%,花色苷含量的相对误差为0.2%,酸度的相对误差为0.5%,三个响应值的相对误差皆小于1%,且其结果均比响应曲面理想值略高,表明响应曲面设计可信性高,准确度好,符合实际情况。
2.4 火龙果发酵饮料的品质指标分析
2.4.1 感官指标
色泽:深红色,色泽均匀有光泽;口味:口感柔和醇正,微酸不刺激;香气:有火龙果清香味,伴有发酵香气;组织状态:液态,均匀无结块。
2.4.2 理化指标
花青素含量为0.61 mg/mL,花色苷含量为1.90 mg/mL,总酸度为0.44 g/100 mL,酒精含量为0.13%vol。
2.4.3 微生物指标
细菌总数≤10CFU/mL,大肠杆菌菌群<3MPN/100mL,未检出致病菌。
3 结论
本试验以红心火龙果皮为原料,通过响应曲面法优化红心火龙果皮发酵饮料的发酵工艺,确定饮料品质最佳的发酵工艺为料水比1∶5(g∶mL),酶添加量0.8%,初始糖度20%,酵母菌接种量0.3%,该工艺条件下制得的发酵制品花青素含量为0.61 mg/mL,花色苷含量为1.90 mg/mL,酸度为0.44 g/100 mL,发酵制品颜色呈鲜红色,液体通透,口感自然醇厚,入口绵滑细腻。这为火龙果皮的进一步开发利用提供了理论依据。
[1]吴邦超.火龙果加工产品的研究进展[J].新农业,2019(3):6-7.
[2]XU L,ZHANG Y,WANG L.Structure characteristics of a water-soluble polysaccharide purified from dragon fruit(Hylocereus undatus)pulp[J].Carbohydr Polym,2016,146:224-230.
[3]冯玲,贺洁,谭强,等.火龙果研究及加工进展[J].轻工科技,2018,34(6):10-12,62.
[4]乔廷廷,郭玲.花青素来源、结构特性和生理功能的研究进展[J].中成药,2019,41(2):388-392.
[5]CASSIDY A.Berry anthocyanin intake and cardiovascular health[J]. Mol Asp Med,2018,61:76-82.
[6]LEE Y M,YOON Y,YOON H,et al.Dietary anthocyanins against obesity and inflammation[J].Nutrients,2017,9(10):1089.
[7]JAMAR G,DEBORA ESTADELLA,PISANI L P.Contribution of anthocyanin-rich foods in obesity control through gut microbiota interactions[J].Biofactors,2017,43(4):507-516.
[8]YASMIN T,STONE S,VINSON G A,et al.Berry anthocyanins as novel antioxidants in human health and disease prevention[J]. Mol Nutr Food Res,2010,51(6):675-683.
[9]LIPPERT E,RUEMMELE P,OBERMEIER F,et al.Anthocyanins prevent colorectal cancer development in a mouse model[J].Digestion,2017,95(4):275-280.
[10]LIN B W,GONG C C,SONG H F,et al.Effects of anthocyanins on the prevention and treatment of cancer[J].Brit J Pharmacol,2017,174(11):1226-1243.
[11]MUNAGALA R,AQIL F,JEYABALAN J,et al.Exosomal formulation of anthocyanidins against multiple cancer types[J]. Cancer Lett,2017,393:94-102.
[12]卓毓光,刘儒华.花青素稳定性影响因素与应用研究进展[J].广东化工,2018,45(24):70-72.
[13]王化,周丽萍.花色苷的提取及分析研究进展[J].国土与自然资源研究,2018(6):85-88.
[14]但德苗,余侠,胡珊珊,等.超声波辅助法提取火龙果果皮多糖工艺优化及其抗氧化活性研究[J].农产品加工,2018(12):32-36.
[15]沈锐,赵壮志,李磊,等.火龙果皮中果胶的提取工艺优化及理化性质分析[J].食品研究与开发,2018,39(12):71-78.
[16]李玲,郭丽萍.超声辅助提取火龙果果皮花色苷及稳定性研究[J].食品工业科技,2017,38(6):298-303,323.
[17]赵巨堂,刘冉,彭清秀,等.超声波辅助提取火龙果皮花青素工艺研究[J].现代食品,2018(11):178-182.
[18]岳珍珍,邢颖,岳艳霞,等.火龙果果皮加工利用现状[J].现代食品,2019(7):17-19,22.
[19]唐超,江惠娟,苏二正.食用酵素的研究进展[J].生物加工过程,2018,16(3):84-90.
[20]董银卯,何聪芬,王领,等.火龙果酵素生物活性的初步研究[J].食品科技,2009,34(3):192-196.
[21]刘鑫,朱丹,牛广财,等.蓝莓酵素发酵工艺优化[J].中国酿造,2018,37(3):171-175.
[22]战伟伟,魏晓宇.蓝靛果椰子复合酵素发酵工艺优化[J].中国酿造,2017,36(1):191-195.
[23]马冰雪,潘腾,任中清.火龙果果皮花青素提取工艺研究[J].北京农业,2013(12):213-215.
[24]朱曼利.火龙果酵素中原花青素含量测定方法的建立[J].中国酿造,2017,36(4):184-187.