腺苷(adenosine),化学名为9-β-D-呋喃核糖基腺嘌呤[1],指由腺嘌呤的N-9与D-核糖的C-1通过β糖苷键连接而成的化合物,其磷酸酯为腺苷酸。腺苷可直接进入心肌经磷酸化生成腺苷酸,参与心肌能量代谢,同时还参与扩张冠状血管,增加冠脉血流量[2-4],是合成-磷酸腺苷(adenosine monophosphate,AMP)、环腺苷酸(cyclic adenosine monophosphate,cAMP)、三磷酸腺苷(adenosine triphosphate,ATP)的主要原料,ATP已被广泛应用于治疗心不全、脑动脉硬化及肌肉萎缩等疾病[5-6]。此外,腺苷还是一种抑制性神经传导物,在神经传递中起重要作用[7-8]。
腺苷的生产方法主要有化学合成法、核糖核酸(ribonucleic acid,RNA)水解法和发酵法[9-10]。化学合成法是以不同化学物质为底物进行化学合成腺苷,该方法合成腺苷存在着成本偏高,反应繁琐,产量低,收率低等一系列问题。RNA水解法是利用磷酸二酯酶水解酵母RNA,得到4种5'-核苷酸,然后进一步水解脱磷酸,该方法的缺陷是同时会得到4种核苷物质[11],导致产物不易分离。而发酵法是通过选育解除了终产物反馈抑制的枯草芽孢杆菌(Bacillus subtilis)[12]或短小芽孢杆菌(Bacillus pumilus)进行直接发酵,发酵过程中提供充足的营养使菌体大量繁殖并生产腺苷。发酵法生产腺苷成本较低,原料易得,且生产过程相对简单,产苷效率较高,因此,在腺苷生产中占据绝对优势。日本早在七十年代就开始了腺苷发酵生产工艺技术的研究,并不断取得技术上的突破,迄今已进入大规模工业生产阶段[11]。腺苷作为药物,也首先由日本于1989年投入美国市场,随后又在法国、比利时、英国等多个国家获得批准[13]。目前我国的腺苷生产方法主要依靠化学法和酶法,成本较高,污染比较严重,我国发酵法生产腺苷起步较晚,仅有几家公司可以利用直接发酵法生产腺苷并达到工业化规模,与国外相比,我国利用发酵法生产腺苷的产量低,生产效率低[11]。
前期研究发现,黄嘌呤和谷氨酰胺对菌株生长及产腺苷非常重要,当发酵液中缺乏黄嘌呤时,菌株停止生长和产腺苷,只有发酵液中黄嘌呤达到一定浓度时菌体才持续生长和产腺苷[11]。谷氨酰胺是腺苷合成的前体物质,为了调节发酵过程中pH的变化,发酵过程中补加了大量的氨水,这会影响谷氨酰胺合成酶的活力,进而影响腺苷的产量[11]。因此,本研究以解除了终产物反馈抑制的Bacillus subtilis XGL为出发菌株,从添加方式和添加量两个方面来探究黄嘌呤和谷氨酰胺对Bacillus subtilis XGL生产腺苷的影响,以期找到黄嘌呤和谷氨酰胺最适添加量和最适添加方式,从而进一步提高腺苷产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
枯草芽孢杆菌(Bacillus subtilis)XGL(此菌株是经紫外诱变筛选得到的,是组氨酸和黄嘌呤缺陷型菌株):天津科技大学代谢工程研究室。
1.1.2 化学试剂
MnSO4·H2O(分析纯):天津市化学试剂六厂;葡萄糖、MgSO4·7H2O(均为分析纯):天津市耀华化工厂;FeSO4·7H2O(分析纯):天津化学试剂三厂;KH2PO4·3H2O(分析纯):天津塘沽化学试剂厂;米浆(纯度40%):河北梅花味精集团有限公司;黄嘌呤(纯度99.9%)、L-谷氨酰胺(纯度98.5%):北京索莱宝科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
活化培养基[14]:牛肉膏10 g/L,葡萄糖2 g/L,氯化钠2.5 g/L,蛋白胨10 g/L,酵母粉5 g/L,黄嘌呤50 mg/L,组氨酸50 mg/L,琼脂30 g/L。pH 7.0~7.2,121 ℃高压灭菌20 min。
种子培养基[15]:葡萄糖25 g/L,豆浓20 g/L,酵母粉5 g/L,MgSO4·7H2O 0.4 g/L,维生素B1(vitamin B1,VB1)1 mg/L,维生素H 1 mg/L,玉米干粉25 g/L(121 ℃高压灭菌20 min),磷酸二氢钾1.5 g/L,蛋白胨8 g/L,黄嘌呤100 mg/L,组氨酸50 mg/L。pH 6.4~6.7,115 ℃高压灭菌15 min。
发酵培养基[16]:葡萄糖100 g/L,豆浓50 g/L,酵母粉25 g/L,MgSO4·7H2O 5 g/L,VB1 2 mg/L,维生素H 2 mg/L,玉米干粉25 g/L(121 ℃高压灭菌20 min),味精12 g/L,磷酸氢二钾4.5 g/L,葡萄糖酸钠1.5 g/L,黄嘌呤100 mg/L,组氨酸50 mg/L,氯化钙2 g/L,FeSO4·7H2O 6 mg/L,硫酸锰6 mg/L。pH 7.0~7.2,115 ℃高压灭菌15 min。
1.2 仪器与设备
BIOTECH-5BG 5 L自动控制发酵罐:上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪:山东省科学院生物研究所;Agilent 1200高效液相色谱(high performance liquid chromatography,HPLC)仪:美国Agilent公司;752型紫外分光光度计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 枯草芽孢杆菌XGL的培养
菌种活化与扩培:用接种环挑取斜面培养基保藏的菌种划线于斜面培养基,32℃条件下恒温培养10~12h。然后将其接种于茄形瓶培养基,32 ℃条件下恒温培养10~12 h,待用。
种子液的制备:用无菌水冲洗茄形瓶培养基上的菌体,然后接种至装有3L种子液的5 L发酵罐中,设置温度为32℃,pH 为7.0(采用氨水调节pH值),转速为200 r/min,通风量为2 L/min,培养10~13 h。菌体量(OD600 nm值)生长至15时为种子液。
菌株的发酵:按15%(V/V)的接种量将种子液接种于发酵培养基,装液量3L/5L,设置温度为32℃,转速为200 r/min。发酵过程中通过自动流加氨水调节pH,pH前期控制在7.0左右,后期控制在6.4左右。发酵过程中需要调节通风量将溶氧前期控制在30%~40%之间,后期控制在10%~20%之间。发酵20 h后测定发酵液中的糖质量浓度,糖质量浓度控制在5~30 g/L之间。后续如果糖浓度偏低通过自动流加80%的葡萄糖溶液。
1.3.2 黄嘌呤的添加时机及添加方式
黄嘌呤添加时机:发酵培养基中黄嘌呤的初始质量浓度为100 mg/L,在发酵16 h或32 h时,一次性补加0.2 g/L的黄嘌呤。发酵过程中每隔4 h测定菌体生物量及腺苷产量。
黄嘌呤添加方式:发酵培养基中黄嘌呤的初始质量浓度为100 mg/L,若黄嘌呤的添加方式为加入底料的方式,则在发酵培养基中再加入0.2 g/L的黄嘌呤。若采用一次性补加的方式,则在发酵16 h后一次性补加0.2 g/L的黄嘌呤。若采用分批次补加的方式,则分别在16 h、24 h、32 h、40 h、48 h、52 h时分别加入33 mg/L的黄嘌呤。若采用流加的方式,则在发酵16 h后持续流加质量浓度为3 g/L的黄嘌呤溶液200 mL。发酵过程中每隔4 h测定菌体生物量、葡萄糖消耗速率及腺苷产量。
1.3.3 谷氨酰胺的添加量及添加方式
在黄嘌呤最佳添加条件下进一步研究谷氨酰胺对枯草芽孢杆菌(Bacillus subtilis)XGL产腺苷的影响。
底物中谷氨酰胺添加量:分别在发酵培养基中添加0、3 g/L、6 g/L、9 g/L、12 g/L谷氨酰胺。发酵过程中每隔4 h测定菌体生物量、葡萄糖消耗速率及腺苷产量,发酵56 h计算糖苷转化率。
谷氨酰胺流加量:在发酵培养基中添加6 g/L的谷氨酰胺,在此基础上在发酵32 h以后持续向发酵罐里流加0、3 g/L、6 g/L、9 g/L、12 g/L的谷氨酰胺。发酵过程中每隔4 h测定菌体生物量、葡萄糖消耗速率及腺苷产量,发酵56 h计算糖苷转化率。
1.3.4 分析检测
菌体量的测定:通过分光光度计测定发酵液在波长600nm下的吸光度值[17];糖含量的测定:发酵液经13000r/min离心2 min后,取上清液,经适当稀释,采用SBA-40E生物传感器进行检测;葡萄糖补加量测定:用电子天平记录80%葡萄糖液的补加量;腺苷产量的测定:采用高效液相色谱法检测发酵液中腺苷的含量[18-21]。葡萄糖消耗速率及糖苷转化率计算公式如下:
1.3.5 数据处理
所有试验重复3次,取平均值;采用Origin 2018软件作图;采用SPSS17.0进行单因素方差分析。
2 结果与分析
2.1 黄嘌呤对枯草芽孢杆菌XGL产腺苷的影响
2.1.1 黄嘌呤的添加时机对枯草芽孢杆菌XGL产腺苷的影响
黄嘌呤添加时机对枯草芽孢杆菌XGL生物量及腺苷产量的影响见图1。

图1 黄嘌呤的添加时机对枯草芽孢杆菌XGL生物量(a)及腺苷产量(b)的影响
Fig.1 Effect of xanthine addition time on biomass(a)and adenosine production(b)of Bacillus subtilis XGL
由图1可知,在发酵前期,发酵培养基中添加有一定量的黄嘌呤,菌体长势较快,腺苷产量较低。当发酵16 h时,添加0.2 g/L黄嘌呤,与未添加黄嘌呤组相比,菌体生长速率加快,且腺苷产量升高。当发酵32 h时,添加0.2 g/L黄嘌呤,与未添加黄嘌呤组相比,菌体开始大量生长,且腺苷产量增加;与发酵16 h时添加黄嘌呤组相比,菌体生长速度变快,但腺苷产量较低。结果表明,菌体出现长势缓慢、腺苷产量较低的现象可能是由于黄嘌呤的缺乏导致的,因此,在发酵16 h时,向发酵液中及时添加0.2 g/L的黄嘌呤,以确保发酵液中黄嘌呤的量,从而促进菌体的持续生长和腺苷的生产。
2.1.2 黄嘌呤添加方式对枯草芽孢杆菌XGL产腺苷的影响
黄嘌呤添加方式对枯草孢杆菌XGL生物量、葡萄糖消耗速率及腺苷产量的影响见图2。
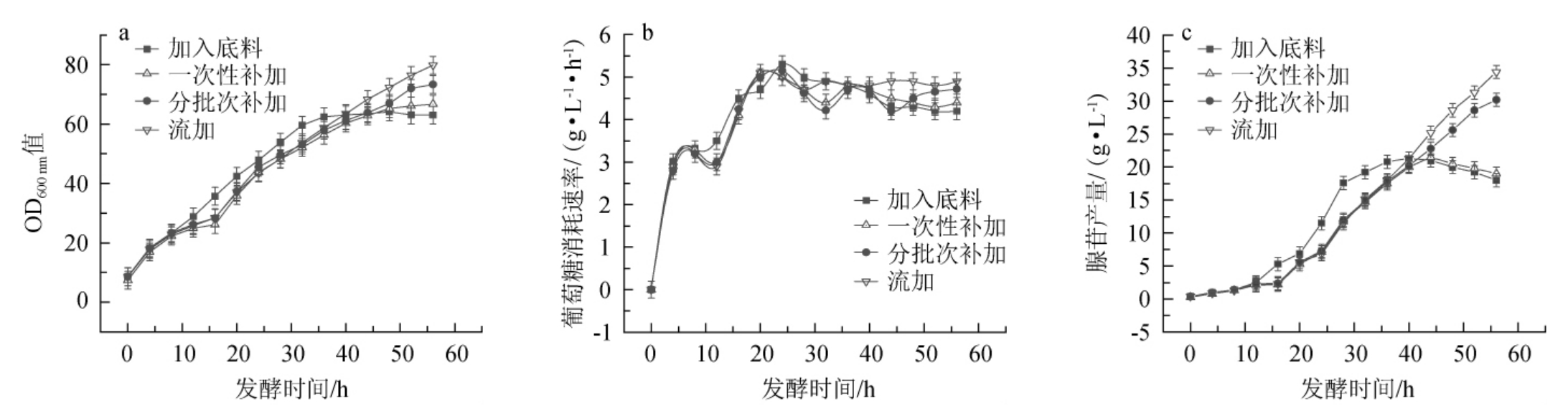
图2 黄嘌呤添加方式对枯草芽孢杆菌XGL生物量(a)、葡萄糖消耗速率(b)及腺苷产量(c)的影响
Fig.2 Effect of xanthine addition method on biomass(a),glucose consumption rate(b)and adenosine production(c)of Bacillus subtilis XGL
由图2可知,在底料中直接加入0.2 g/L黄嘌呤后,在发酵前期,菌体OD600 nm值快速上升,但发酵35 h后,OD600 nm值基本保持不变;前期葡萄糖消耗速率较高,后期趋于平稳;菌体在前期大量生产腺苷,且腺苷产量明显高于其他几种添加方式,但发酵后期腺苷产量趋于平稳后下降,分析原因可能是黄嘌呤不足导致的。在发酵16 h一次性补加0.2 g/L黄嘌呤时,添加黄嘌呤之后,菌体快速生长,葡萄糖消耗速率加快,腺苷产量增加;发酵44~48 h时,菌体生长开始变缓,葡萄糖消耗速率及腺苷产量开始降低。在发酵16 h后分批次补加或流加黄嘌呤后,菌体快速持续的生长,葡萄糖消耗速率增大,同时腺苷产量持续升高,且流加黄嘌呤后,腺苷产量最高。发酵56 h时,四种添加方式下腺苷的最终产量分别为18.0 g/L、19.0 g/L、30.2 g/L、34.4 g/L,结果表明,持续流加黄嘌呤的方式对于腺苷的发酵生产效果最好。
2.2 谷氨酰胺对枯草芽孢杆菌XGL产腺苷的影响
2.2.1 底物中谷氨酰胺不同添加量对枯草芽孢杆菌XGL产腺苷的影响
底物中谷氨酰胺添加量对枯草芽孢杆菌XGL菌体量、葡萄糖消耗速率、腺苷产量及糖苷转化率的影响见图3。
由图3a可知,在发酵初期,不同的谷氨酰胺添加量下菌体量无明显差异;在发酵中后期,随着谷氨酰胺添加量的增加生物量呈先增加后减少的趋势,且当谷氨酰胺添加量为6 g/L时,生物量最大,发酵56 h时,生物量达84.6。
由图3b可知,不添加谷氨酰胺时葡萄糖消耗速率最低,随着谷氨酰胺添加量的增加葡萄糖消耗速率呈先增加后减少的趋势,且当谷氨酰胺添加量为6 g/L时,葡萄糖消耗速率最大,发酵28 h时,葡萄糖消耗速率达5.65 g/(L/h)。说明底物中谷氨酰胺的添加有助于发酵中后期菌体的生长和葡萄糖消耗速率的增加。
由图3c可知,随着底物中谷氨酰胺添加量的增加腺苷产量呈先增加后平稳的趋势,当谷氨酰胺添加量为6 g/L时,腺苷产量最高,发酵56 h时,腺苷产量达42.5 g/L,说明添加谷氨酰胺可以提高腺苷产量。由此可见,谷氨酰胺的最适添加量为6 g/L。
由图3d可知,在不添加谷氨酰胺时,糖苷转化率为13.2%,在添加了谷氨酰胺后糖苷转化率有所提升。当谷氨酰胺添加量为6 g/L时,糖苷转化率达到了16%。

图3 底物中谷氨酰胺添加量对枯草芽孢杆菌XGL生物量(a)、葡萄糖消耗速率(b)、腺苷产量(c)及糖苷转化率(d)的影响
Fig.3 Effect of glutamine addition in substrate on biomass(a),glucose consumption rate(b),adenosine production(c)and glycoside conversion rate(d)of Bacillus subtilis XGL
2.2.2 发酵过程中谷氨酰胺流加量对枯草芽孢杆菌XGL产腺苷的影响
为探究在整个发酵过程中是否保持一定浓度的谷氨酰胺有利于菌体产腺苷,在发酵中期后(32 h)向发酵罐中流加不同质量浓度的谷氨酰胺,考察流加不同质量浓度的谷氨酰胺对枯草芽孢杆菌XGL菌体量、葡萄糖消耗速率、腺苷产量及糖苷转化率见图4。
由图4可知,随着谷氨酰胺流加质量浓度的增加,生物量及葡萄糖消耗速率会有小幅的增加,腺苷产量也在增加,但当谷氨酰胺的流加质量浓度达到6 g/L时,生物量、葡萄糖消耗速率及腺苷产量均达到峰值。当发酵56 h时,生物量及腺苷产量分别为86.8、45.8 g/L,相比于底物中直接添加6 g/L的谷氨酰胺腺苷产量(42.5 g/L)提高7.8%;相比于不添加谷氨酰胺时,腺苷产量(34.4 g/L)提高33%。

图4 流加不同质量浓度的谷氨酰胺对枯草芽孢杆菌XGL生物量(a)、葡萄糖消耗速率(b)、腺苷产量(c)及糖苷转化率(d)的影响
Fig.4 Effect of different concentrations of glutamine on biomass(a),adenosine production(b),adenosine production(c)and glycoside conversion rate(d)of Bacillus subtilis XGL
由图4亦可知,糖苷转化率随着谷氨酰胺流加质量浓度的增加先升高,当流加的谷氨酰胺的质量浓度达到6 g/L时,糖苷转化率达到了16.3%。相比于底物中直接添加6 g/L谷氨酰胺增加了0.3%。
综上所述,在发酵32 h后可以流加6 g/L的谷氨酰胺提高腺苷产量。分析原因可能是谷氨酰胺是腺苷合成的前体,且在发酵中后期随着氨水的流加,发酵液中铵根离子增多,菌体代谢受到影响,谷氨酰胺合成酶的活力下降,进而影响腺苷的合成。
3 结论
在含有100 mg/L黄嘌呤的发酵培养基中,当枯草芽孢杆菌(Bacillus subtilis)XGL发酵16 h后,持续向发酵液中流加3 g/L的黄嘌呤溶液200 mL可以使腺苷产量达到34.4 g/L,相比于不补充黄嘌呤时腺苷产量(11.2 g/L)提高207%。在此基础上,再向底物中添加6 g/L谷氨酰胺,在发酵32 h后持续向发酵液中流加6 g/L的谷氨酰胺,腺苷产量达到45.8 g/L,相比于不添加谷氨酰胺腺苷产量(34.4 g/L)提高33%。因此,在B.subtilis XGL发酵过程中,可以通过流加一定量的黄嘌呤和谷氨酰胺的方法提高腺苷产量。
[1]刘玥.腺苷生产菌XGL 的定向改造及其发酵过程控制[D].天津:天津科技大学,2014.
[2]MAURER G,WILKENS J L,GRIESHABER M K.Modulatory effects of adenosine and adenine nucleotides on different heart preparations of the American lobster,Homarus americanus[J].J Exp Biol,2008,211(5):661-670.
[3]HO W Y,LU P J,HSIAO M,et al.Adenosine modulates cardiovascular functions through activation of extracellular signal-regulated kinases 1 and 2 and endothelial nitric oxide synthase in the nucleus tractus solitarii of rats[J].Circulation,2008,117(6):773-780.
[4]王超明,何菊华,刘玥,等.有机氮源对腺苷发酵的影响[J].发酵科技通讯,2014,43(4):7-10.
[5]王红连,张佳俊,赵黎明,等.枯草芽孢杆菌JSIM-X-13-4 突变株腺苷发酵研究[J].食品与发酵工业,2006,32(12):44-47.
[6]李宁,董会娜,祖昕,等.酶法高通量测定发酵液中的腺苷含量[J].食品与发酵工业,2015(2):167-172.
[7]LINDEN J.Adenosine in tissue protection and tissue regeneration[J].Mol pharmacol,2007,67(5):1385-1387.
[8]LASLEY R D,KONYN P J,HEGGE J O,et al.Effects of ischemic and adenosine preconditioning on interstitial fluid adenosine and myocardial infarct size[J].Am J Physiol,1995,269(4 Pt 2):H1460-H1466.
[9]SCHMID R D.Pocket Guide to Biotechnology and Genetic Engineering[M].New York:John Wiley&Sons Inc,2003:198-200.
[10]张群.腺苷微生物发酵生产技术研究[J].食品与生物技术学报,2018,37(5):560.
[11]杜姗姗.腺苷工程菌的构建及其发酵过程优化[D].天津:天津科技大学,2013.
[12]李情敏,何名芳,张凤英,等.枯草芽孢杆菌液态发酵的研究[J].中国酿造,2016,35(2):43-47.
[13]刘玥,何菊华,徐庆阳,等.微生物发酵法生产腺苷的研究进展[C]//中国生物发酵产业年会,2013.
[14]焉兆萍,宋士良,陆克文.枯草芽孢杆菌发酵培养基及发酵条件优化[J].国外畜牧学(猪与禽),2019,39(1):53-57.
[15]刘芳,廖先清,周荣华,等.枯草芽孢杆菌BZJN1 发酵培养基和培养条件的优化[J].湖北农业科学,2019,58(20):93-96.
[16]阙斐.枯草芽孢杆菌液体发酵培养基成分优化研究[J].广州化工,2017,45(18):68-70.
[17]张玉富,熊海波,徐庆阳,等.生物素及膜偶联间歇透析发酵对黄色短杆菌生产L-亮氨酸的影响[J].食品与发酵工业,2019,45(9):19-24.
[18]席桂同.高效液相色谱法测定灵芝提取物中尿苷和腺苷含量[J].世界中医药,2014(7):934-936.
[19]张鑫喆,赵琳琳,徐方旭,等.HPLC 不同流动相测定蛹虫草中虫草素和腺苷的比较[J].黑龙江农业科学,2018(4):130-132.
[20]金文闻,陈雪敏,杨飘,等.国产玛咖中腺苷含量的高效液相色谱分析[J].食品科学,2016,37(12):148-151.
[21]安超,马赛箭,薛文娇,等.HPLC 法测定冬虫夏草菌丝体及发酵液中核苷类成分[J].食品研究与开发,2017(1):139-143.