百香果(Passiflora coerulea L.),学名西番莲,是西番莲科多年生草本植物,在我国主要栽培于广西、江西和云南等地[1]。紫皮百香果果汁中富含多酚、黄酮、类胡萝卜素和维生素C(vitamin C,VC)等生物活性物质[2],果皮中富含果胶、纤维素和花色苷等活性成分[3],均具有极高的食用价值。研究表明,百香果具有抗炎[4]、抗氧化[5]、降糖[6]、抗焦虑[7]和抗衰老[8]等功效。将百香果全果酿造成果酒,既能保留百香果中的营养物质,又能将果皮副产物综合利用,提升果酒的价值。市场上百香果酒主要使用百香果汁以酒精浸提法制得而非正规发酵[9],这大大降低了百香果酒的香气、口感和营养价值。经发酵产生的百香果全果酒为全天然食品,特征香气突出,口感醇厚,酸甜适口,可以促进人体代谢与血液循环,改善心脑血管健康和抗衰老[10-11]。同时,百香果中具有抗氧化能力的多酚类、多糖类和花色苷类化合物在酒精发酵中逐渐浸出[12],这些物质可以清除自由基,达到保健的功效[13]。
目前,在我国市售百香果果汁酒较常见,但未见百香果全果酒的踪迹,且百香果皮利用率极低,造成副产品的极大浪费。此外,国内外关于百香果果汁、果汁酒和全果酒的抗氧化性能鲜见报道。本研究以紫皮百香果为原料发酵百香果全果酒,通过单因素试验结合响应面法,确定百香果全果酒的最适酿造工艺,并通过1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS+)、羟基自由基(·OH)和还原能力这四个抗氧化体系来评价其与百香果果汁酒和原汁的抗氧化活性,以期为百香果的深加工、果皮的综合利用提供新思路,为百香果全果酒的开发提供理论指导。
1 材料与方法
1.1 材料与试剂
“紫香一号”百香果:采自广西崇左某农户果园,于-80 ℃冰箱超低温保藏。全果酒、果汁酒、原果汁:本实验室自制。
果胶酶(酶活4 000 U/g)、纤维素酶(酶活10 000 U/g)、焦亚硫酸钾、小苏打、白砂糖(均为食品级):宁夏和氏璧生物技术有限公司;葡萄酒活性干酵母RV171:安琪酵母股份有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)(均为分析纯):北京索莱宝科技有限公司;没食子酸、磷酸氢二钠、磷酸二氢钠、抗坏血酸、过硫酸钾、铁氰化钾、双氧水、三氯乙酸、三氯化铁、硫酸亚铁、水杨酸(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
BSA124S电子天平:赛多利斯科学仪器(北京)有限公司;JYL-C012料理机:九阳股份有限公司;pHS-3E实验室pH计:上海佑科仪器仪表有限公司;SHP-250智能生化培养箱:上海鸿都电子科技有限公司;WFJ 2100可见分光光度计:尤尼柯(上海)仪器有限公司;HH-4恒温水浴锅:常州国华电器有限公司;LXJ-ⅡB离心机:上海安寿科学仪器厂;KW500-B硅藻土过滤器:郑州玉祥机械设备有限公司;10英寸三级精密膜过滤器:烟台帝伯士自酿机有限公司。
1.3 试验方法
1.3.1 百香果全果酒发酵工艺流程
百香果→预处理→破碎打浆→调节pH→酶解→加硫→接种酵母→主发酵→陈酿→倒罐→澄清→精滤→脱气→灭菌→灌装→百香果全果酒
1.3.2 操作要点
原料预处理:选取无病害、新鲜成熟、表皮紫色且无机械损伤的百香果,解冻后用无菌水清洗干净,沥干水分。
破碎打浆:全果打浆不易操作,因此先取出百香果果肉,用200目滤布过滤去籽,注意避免果籽破碎,防止油脂进入果汁影响发酵,收集百香果原果汁,备用。将百香果皮切成1~2 cm2的小块,用料理机打浆,备用。
调节pH:用小苏打调节百香果汁pH值为3.5左右。
酶解:原汁中添加0.08%果胶酶和0.08%纤维素酶,果皮浆中添加0.15%果胶酶和0.15%纤维素酶,40 ℃水浴加热4 h。
加硫:添加100 mg/L焦亚硫酸钾,防止氧化变质和杂菌污染。
菌种活化:取适量酵母RV171,按料液比1∶9(g∶mL)加入无菌水,37 ℃水浴活化25 min,按不同酵母接种量接种。
主发酵:考虑成本因素,按料液比1∶1(g∶mL)填料,全果酒发酵液为原果汁加果皮浆,果汁酒发酵液为原果汁加无菌水,并添加适量白砂糖,料液装至发酵罐的70%,密封发酵,控制发酵温度和时间,使用单向阀排气,基本无气泡产生,判断为主发酵结束。
陈酿:将酒液转移至储酒罐中,发酵液装至容器的90%,使用单向阀排气,放于2 ℃冷库贮藏,静置发酵2个月。
澄清:用过滤面积8.5 mm的硅藻土过滤器粗滤1次,以产生澄清的酒液。
精滤:酒液用0.22 μm的精密膜过滤器精滤,使酒液达到最佳的感官品质。
脱气:将储酒罐置于水浴锅中,80 ℃脱气10 min。
灭菌:采巴氏灭菌法,将储酒罐置于水浴锅中,65 ℃恒温加热30 min。
灌装:确保在无菌条件下灌装,计量准确,封口可靠,喷码清晰。
1.3.3 分析检测
酒精度的测定:参照GB 5009.225—2016《酒中乙醇浓度的测定》酒精计法;可溶性固形物含量:使用手持式阿贝折光仪测定。
1.3.4 百香果全果酒发酵工艺优化单因素试验
选择影响百香果全果酒发酵效果的四个因素:初始糖度(16%、18%、20%、22%、24%)、酵母接种量(0.01%、0.02%、0.03%、0.04%、0.05%)、发酵温度(19 ℃、22 ℃、25 ℃、28 ℃、31 ℃)、发酵时间(3 d、4 d、5 d、6 d、7 d)进行单因素试验,测定百香果全果酒的酒精度和可溶性固形物含量。每组试验均重复三次,取平均值。
1.3.5 百香果全果酒发酵工艺优化响应面试验设计
以单因素试验结果为依据,运用DesignExpert10.0软件,利用Box-Behnken试验设计,以A(初始糖度)、B(酵母接种量)、C(发酵温度)为3个因素,以百香果全果酒酒精度(Y)为响应值,共设计17组响应面优化试验。Box-Behnken试验设计因素与水平见表1。
表1 Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken tests design

1.3.6 百香果果酒品质的感官评定标准
感官评定标准参照蔡文超等[14]方法。感官评定小组由10人组成,对百香果果酒的色泽、香气、口感和形态进行评分,满分100分,具体评分细则见表2。
表2 百香果果酒的感官评定标准
Table 2 Sensory evaluation standards of passion fruit wine

1.3.7 百香果汁酒和全果酒抗氧化能力的测定
(1)DPPH自由基清除能力的测定
精确吸取不同体积(0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL)的百香果全果酒、果汁酒和原汁于试管中,用蒸馏水补至2.0 mL,再分别加入0.2 mmoL/L的DPPH溶液2 mL,振荡混匀,避光放置30 min,之后在波长517 nm处测定吸光度值Ai;以蒸馏水替代样品为空白对照,测得吸光度值为A0;以0.15%维生素C(vitamin C,VC)溶液为阳性对照。DPPH自由基清除率计算公式如下:
(2)ABTS+自由基清除能力的测定
精确吸取不同体积(0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL)的百香果全果酒、果汁酒和原汁于试管中,用蒸馏水补至2.0 mL,分别加入ABTS+工作液2 mL,振荡混匀,避光放置30 min,之后在波长734 nm处测定吸光度值Ai;以蒸馏水替代样品为空白对照,测得吸光度值为A0;以0.15%VC溶液为阳性对照。ABTS+自由基清除率计算公式如下:
(3)·OH清除能力的测定
精确吸取不同体积(0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0mL)的百香果全果酒、果汁酒和原汁于试管中,用蒸馏水补至2.0 mL,依次加入6 mmoL/L的FeSO4溶液2 mL和6 mmoL/L的H2O2溶液2 mL,振荡混匀,避光放置10 min,之后加入6 mmol/L的水杨酸溶液2 mL,振荡摇匀,避光反应30 min,在波长510 nm处测定吸光度值Ai;以蒸馏水替代样品为空白对照,测得吸光度值为A0;以蒸馏水替代水杨酸,测得吸光度为Aj;以0.15%VC溶液为阳性对照。·OH清除率计算公式如下:
(4)还原能力的测定
精确吸取不同体积(0.4 mL、0.8 mL、1.2 mL、1.6 mL、2.0 mL)的百香果全果酒、果汁酒和原汁于试管中,用蒸馏水补至2.0 mL,分别加入0.2 moL/L pH=6.6的磷酸盐缓冲液(phosphate buffer solution,PBS)2.5 mL和1%的铁氰化钾溶液2.5 mL,振荡混匀,50 ℃水浴20 min,之后迅速冷却,加入10%三氯乙酸溶液2 mL,然后在4 000 r/min条件下离心10 min,取2 mL上清液,加入0.1%的三氯化铁溶液0.5 mL,再加入3.5 mL蒸馏水,振荡混匀,之后在波长700 nm处测定吸光度值A;以0.15%VC溶液作为阳性对照。以吸光度值反映样品还原能力,吸光度值越大,其还原能力越大,抗氧化活性越强。
1.3.8 数据分析
使用Excel 2016整合试验数据,采用Origin 8.5制图,Design Expert 10进行响应面优化设计,使用SPSS 20.0显著性差异分析。
2 结果与分析
2.1 百香果全果酒发酵工艺优化单因素试验
2.1.1 不同初始糖度对百香果全果酒发酵效果的影响
由图1可知,酒精度和可溶性固形物含量随着初始糖度在16%~20%范围内的增加而增大;初始糖度为20%~24%时,酒精度升高趋势变缓,可溶性固形物含量继续增大,说明初始糖度>20%之后,发酵醪糖度过大,一方面酵母发酵所需底物过剩,造成糖的浪费;另一方面渗透压升高,抑制了酵母的活性,发酵速率变慢,甚至引发副反应[15],口感也会随之下降。因此,考虑到经济成本等原因,确定最适初始糖度为20%。
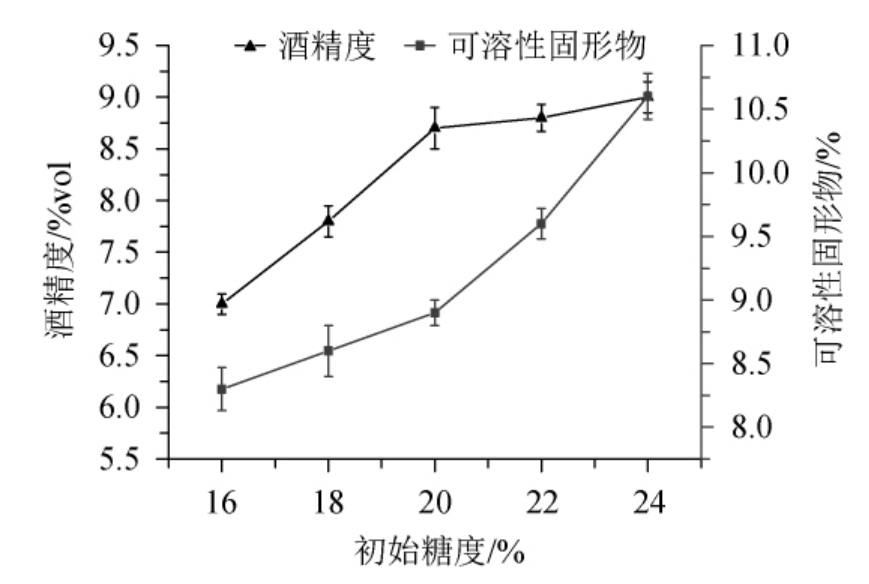
图1 不同初始糖度对百香果全果酒发酵的影响
Fig.1 Effect of different initial sugar contents on the fermentation of whole passion fruit wine
2.1.2 不同酵母接种量对百香果全果酒发酵效果的影响
由图2可知,酒精度随酵母接种量在0.01%~0.04%范围的增大而上升,而可溶性固形物含量呈下降的趋势。发酵醪中酵母接种量的多少决定着酵母菌生长速率、发酵速率和呼吸产能等变量的大小[16]。酵母接种量<0.04%之前,发酵醪中酵母菌数量较少,发酵不完全,酒精度不高,接种量为0.04%时酵母菌数量增加,发酵速率加快,底物消耗增多,酒精度达到相对较高值,发酵较为充分。但随着酵母接种量的继续增大,酒精度只略有增大,可能是因为酵母菌浓度增加,底物消耗加快,使酵母间的竞争愈加剧烈,代谢加快,使代谢产物不断累积,导致温度升高[17],这些对自身生长都起抑制作用。因此,确定最适酵母接种量为0.04%。
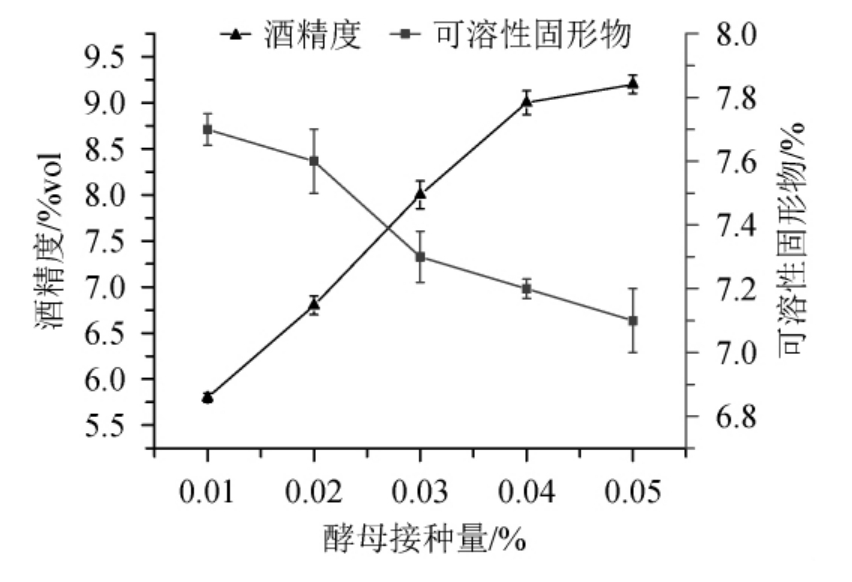
图2 不同酵母接种量对百香果全果酒发酵的影响
Fig.2 Effect of different yeast inoculum on the fermentation of whole passion fruit wine
2.1.3 不同发酵温度对百香果全果酒发酵效果的影响
由图3可知,随着发酵温度在19~31 ℃范围内的增加,酒精度和可溶性固形物含量分别呈上升和下降的趋势。发酵温度在发酵过程中尤为重要,它极大地影响着酵母的生长代谢和发酵速率[18]。温度过高,酵母菌繁殖迅速,发酵周期短,但代谢过于旺盛,代谢产物积累过多,造成提前老化,影响果酒风味的形成;温度过低,酵母生长缓慢,发酵周期长[19]。当发酵温度升至28 ℃时,酒精度升高趋势变缓,此时酵母代谢较为旺盛,产酒能力达到较高值,若继续升高温度,酒精度升高缓慢,且会对发酵产生不利影响。因此,确定最适发酵温度为28 ℃。
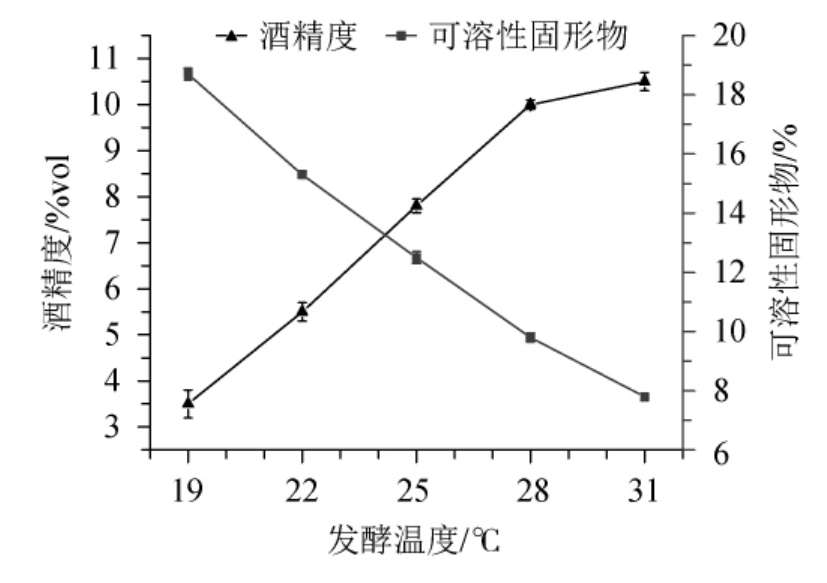
图3 不同发酵温度对百香果全果酒发酵的影响
Fig.3 Effect of different fermentation temperature on the fermentation of whole passion fruit wine
2.1.4 不同发酵时间对百香果全果酒发酵效果的影响
由图4可知,酒精度随发酵时间在3~5 d范围内的增大而上升,而可溶性固形物含量呈下降的趋势,发酵时间>5 d后趋势均变缓。发酵开始后5 d是发酵初期,百香果全果酒酒精度增幅明显,说明在这期间,酵母菌繁殖旺盛,数量和体积不断增加,发酵速率较快,百香果全果酒酒精度不断增加,在发酵时间5 d时酒精度达到相对较大值,且随着发酵时间的继续延长,酒精度增加不大,可能是酵母菌老化程度加大,活性降低,产酒能力下降[20]。因此,确定最适发酵时间为5 d。
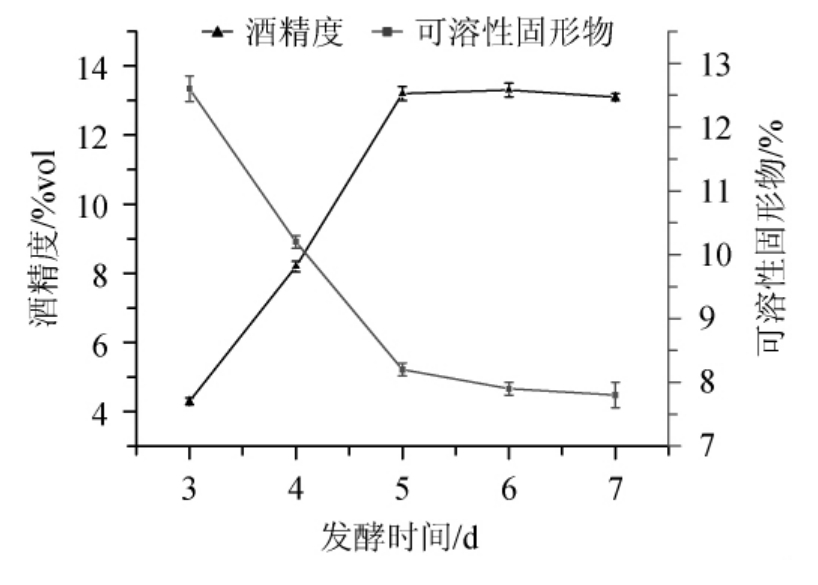
图4 不同发酵时间对百香果全果酒发酵的影响
Fig.4 Effect of different fermentation time on the fermentation of whole passion fruit wine
2.2 百香果全果酒发酵工艺优化响应面试验结果与分析
2.2.1 响应面试验的结果
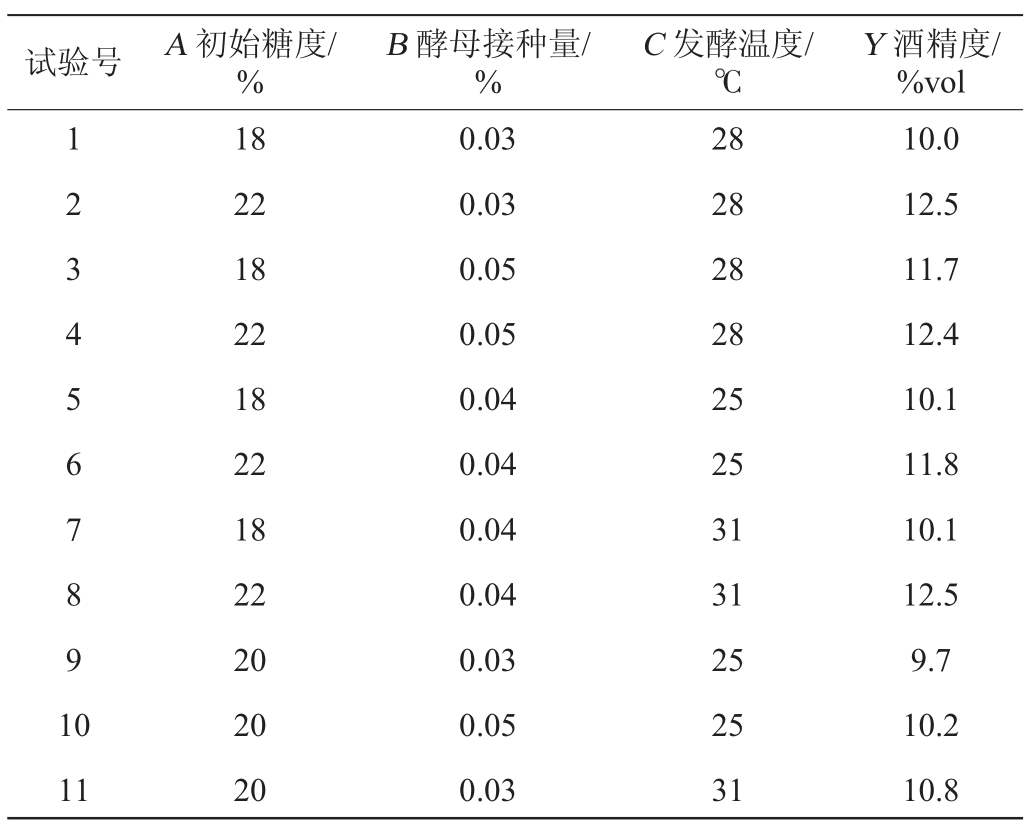
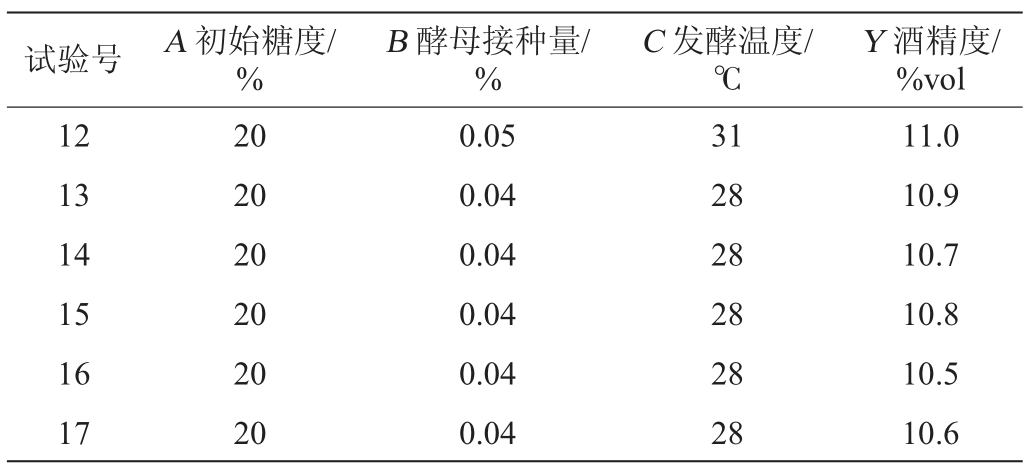
根据单因素试验结果,选取了对百香果全果酒发酵影响较大的3个因素,即初始糖度(A)、酵母接种量(B)、发酵温度(C),以酒精度(Y)为响应值,17组响应面优化试验及结果见表2。
表2 Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken tests
续表
2.2.2 响应面回归模型的建立与分析
运用Design-Expert 10.0软件,以初始糖度(A)、酵母接种量(B)、发酵温度(C)为影响因素,百香果全果酒酒精度(Y)为响应值,得到17组试验条件与响应值之间的回归方程:
Y=13.54+0.85A+0.51B+1.49C-0.37A2-1.52B2-0.65C2-0.45AB+0.035AC+0.38BC
运用Design-Expert 10.0软件对表2数据进行方差分析,结果见表3。由表3可知,模型中F值=247.87,P<0.000 1,说明模型极显著(P<0.01);失拟项P值=0.3680>0.05,说明失拟项不显著,回归模型可以接受;决定系数R2=0.996 0,调整决定系数R2adj=0.992 0,说明实际酒精度与模型预测酒精度拟合程度高。因此,该模型能够很好地表述各个因素与响应值之间的关系,对百香果全果酒酒精度进行分析和预测具有可行性。
表3 回归模型的方差分析
Table 3 Variance analysis of regression model
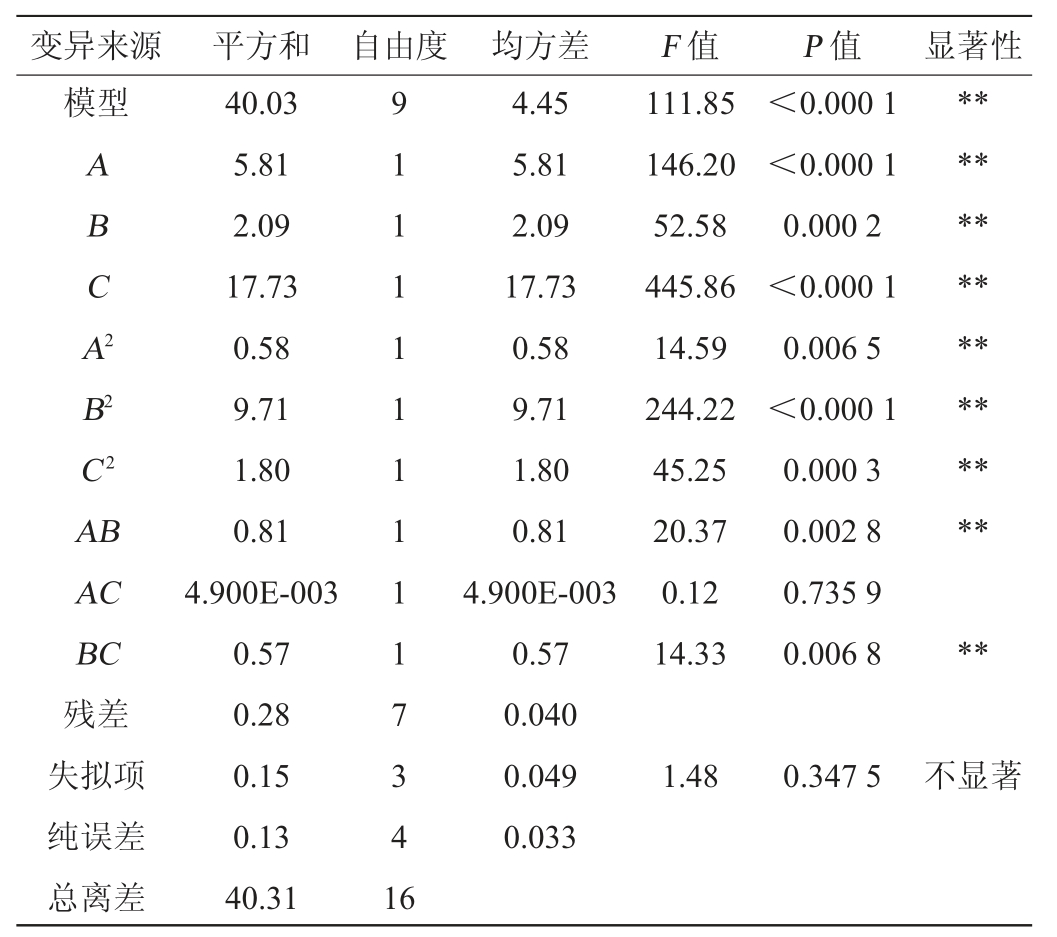
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
根据表3显著性检验可知,一次项A、B、C、二次项A2、B2、C2、交互项AB、BC对结果影响极显著(P<0.01),其他因素对结果影响不显著(P>0.05)。根据F值和P值,各因素对酒精度影响的主次顺序为发酵温度(C)>初始糖度(A)>酵母接种量(B)。
2.2.3 响应曲面各因素交互作用分析
响应曲面图是对二元线性回归方程形象化的描绘[21],依据A、B、C三因素中两因素交互作用与响应值之间的关系,得到的三维响应曲面和等高线,结果见图5。
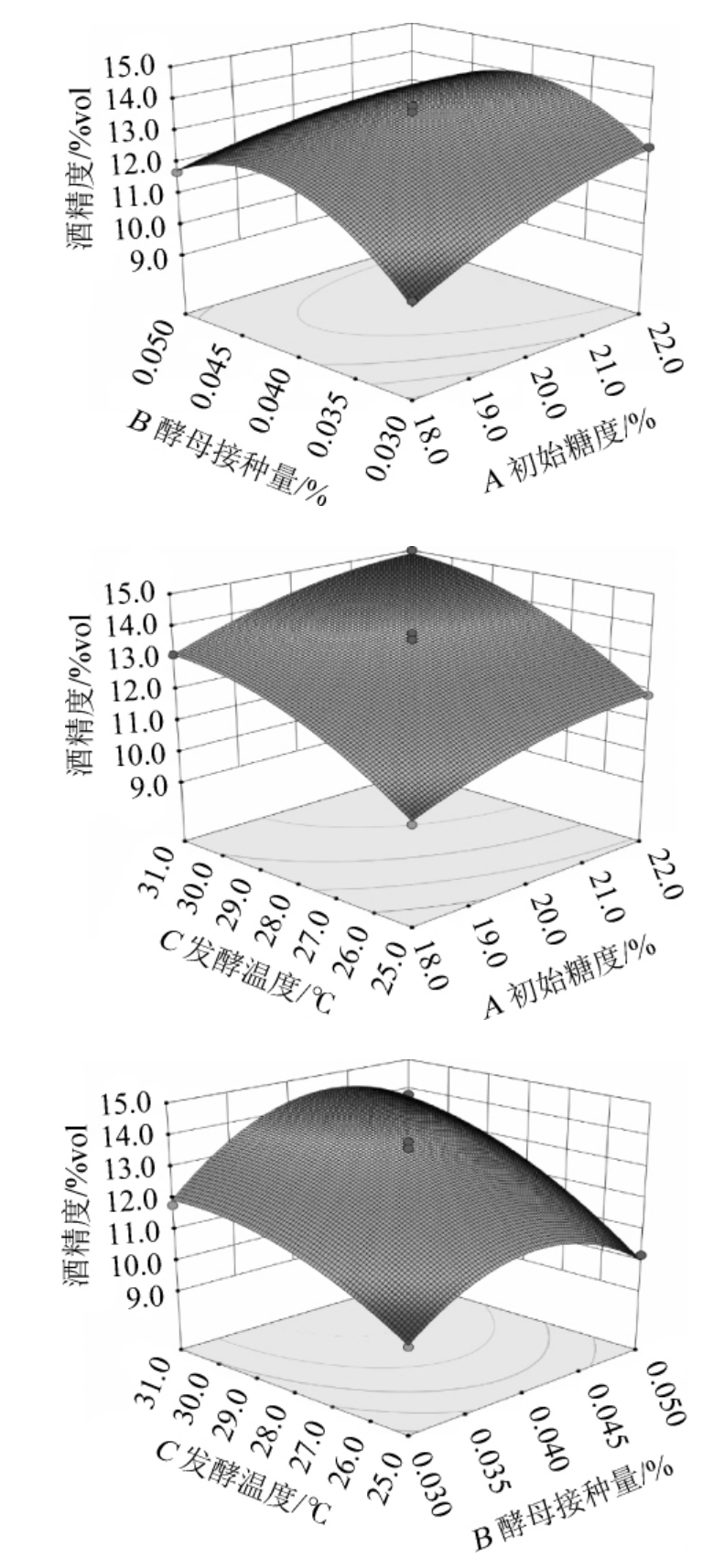
图5 各因素交互作用对百香果全果酒酒精度影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between each factors on alcohol contents of whole passion fruit wine
响应面坡度越陡,说明两因素间交互作用越显著[22]。由图5可知,AB、BC间曲面较为陡峭,说明初始糖度与酵母接种量、酵母接种量与发酵温度之间的交互作用显著(P<0.01),对酒精度影响较大;AC响应曲面拱形程度不高,说明初始糖度与发酵温度间交互作用不显著(P>0.05),与方差分析中结果一致。
2.3 验证试验
利用Desig-Expert 10.0软件得到百香果全果酒最适发酵工艺条件为初始糖度20.6%、酵母接种量0.043%、发酵温度28.7 ℃、发酵时间5 d,酒精度模型预测值为11.4%vol。为了方便实际操作,将发酵工艺条件修正为初始糖度21%、酵母接种量0.04%、发酵温度29 ℃、发酵时间5 d。在此优化条件下进行3次平行验证试验,酒精度实际值为11.9%vol,与预测值基本一致,说明响应面分析得到的百香果全果酒酿造工艺参数可靠。
2.4 百香果汁酒和全果酒感官评分结果
百香果果汁酒呈淡黄色,酒液澄清透亮,果香明显,酒香浓郁,入口醇厚但口感稍酸,无悬浮沉淀,感官评分为82.3分。百香果全果酒呈橙红色,酒液澄清透亮,果香明显,略带木香味,酒香浓郁,酒体醇厚但口感稍酸,无悬浮沉淀,感官评分为85.6分。因此,全果酒比果汁酒感官评分高,这是因为全果酒中溶入了果皮中的花色苷等物质,使酒体色泽比果汁酒饱和度更高,且香气更丰富。
2.5 百香果汁酒和全果酒抗氧化能力的比较分析
2.5.1 DPPH自由基清除能力的比较
由图6可知,全果酒、果汁酒、原果汁三种样品及VC的DPPH自由基清除率随样品用量的增加而增大。样品用量在0.4~1.2 mL之间时,三种样品的DPPH自由基清除率持续上升,在样品用量到达1.2 mL时,此时三种样品均已达到较高的自由基清除效果,全果酒、果汁酒和原果汁的清除率分别为97.16%、96.63%和95.90%,继续增大样品体积,三种溶液对DPPH自由基的清除率略有上升且增长缓慢。三种样品对DPPH自由基的清除能力均小于VC溶液,相互之间差异显著(P<0.05)。由此可知,三种样品对DPPH自由基清除效果大小顺序为全果酒>果汁酒>原汁。
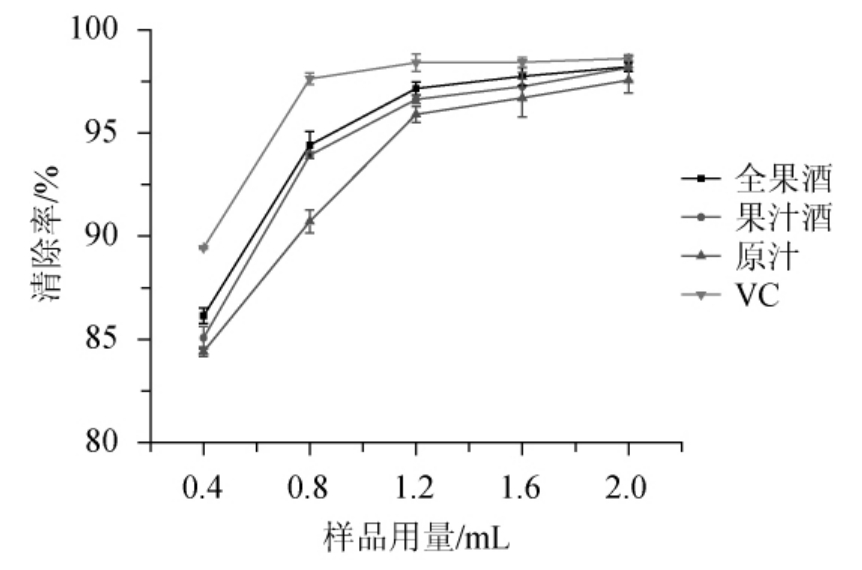
图6 DPPH·清除能力的比较
Fig.6 Comparison of scavenging ability of DPPH·
2.5.2 ABTS+自由基清除能力的比较
由图7可知,三种样品及VC的ABTS+自由基清除率随样品用量的增加而增大。在用量为0.2 mL时,全果酒、果汁酒和VC溶液已达到较高的自由基清除效果,对应的自由基清除率分别为98.47%、94.84%和98.14%,而原汁为90.40%,四者间差异极显著(P<0.05)。原汁在体积为0.4时增速变缓,清除率为98.55%。由此可知,全果酒的ABTS+自由基清除能力最强。
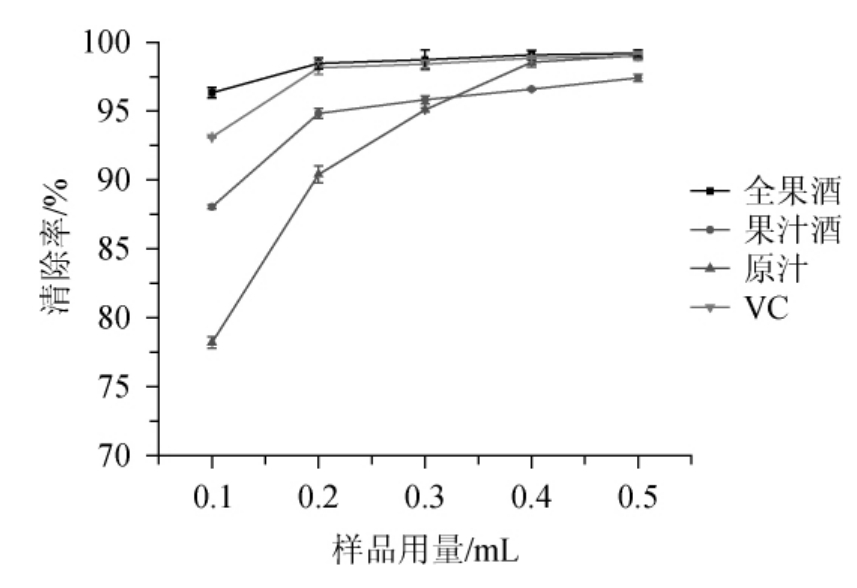
图7 ABTS+·清除能力的比较
Fig.7 Comparison of scavenging ability of ABTS+·
2.5.3 ·OH自由基清除能力的比较
由图8可知,三种样品及VC的·OH清除率随样品用量的增加而增大。其中全果酒和果汁酒在用量为0.4 mL时已达到较高的自由基清除效果,清除率分别为98.90%和98.05%,此时VC和原汁的清除率为73.47%和80.51%;在用量为0.4~1.2 mL时,VC的清除能力快速上升,在1.2 mL时清除能力达到较高值99.39%;原汁的清除率在试验范围内呈持续上升的趋势,未稀释的原汁清除率为93.82%,与其他三种溶液之间存在显著差异(P<0.05)。由此可知,·OH清除效果大小顺序为全果酒>果汁酒>原汁。

图8 ·OH清除能力的比较
Fig.8 Comparison of scavenging ability of·OH
2.5.4 还原能力的比较
由图9可知,三种样品及VC的还原能力随样品用量的增加呈现良好的上升趋势。在试验范围内,三种样品的还原能力均小于VC溶液,且在样品用量为2.0 mL时,全果酒、果汁酒和原汁的还原能力分别为VC溶液的98.15%、91.20%和61.11%,相互之间差异显著(P<0.05)。由此可知,三种样品的还原能力大小顺序为全果酒>果汁酒>原汁。
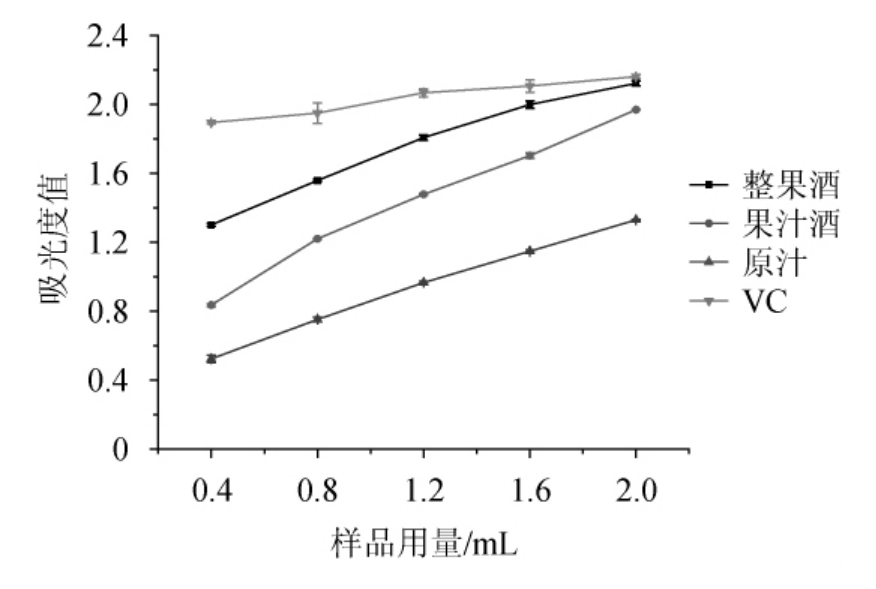
图9 还原能力的比较
Fig.9 Comparison of reduction capacity
3 结论
本试验运用响应面法确定了百香果全果酒的最适酿造工艺,结果表明,百香果全果酒最适发酵工艺条件为初始糖度21%、酵母接种量0.04%、发酵温度29 ℃、发酵时间5 d。在此优化发酵工艺条件下,酒精度为11.9%vol。通过四个抗氧化体系(DPPH·、ABTS+·、·OH、还原能力)对比了百香果全果酒、果汁酒和原汁的体外抗氧化活性,结果表明,自由基清除率和还原能力均随样品用量的增加而增大,抗氧化特性的大小顺序为全果酒>果汁酒>原汁。总体而言,百香果全果酒是一种具有高抗氧化活性的功能型果酒,以期为推广百香果深加工和果皮综合利用提供了新思路,且对百香果酿造酒的开发具有指导意义。
[1]任新军,彭琼生.西番莲品种比较研究[J].云南热作科技,1998,21(1):13-16.
[2]袁启凤,严佳文,王红林,等.百香果品种‘紫香1 号’果实糖、酸和维生素成分分析[J].中国果树,2019(4):43-47.
[3]刘纯友,殷朝敏,黄永春,等.百香果皮多糖的分离纯化、结构特性及生物活性研究进展[J].食品工业科技,2018,39(8):335-340.
[4]CORDOVA F M,ZIBADI S,WATSON R R.Chapter 47-Antioxidant and anti-inflammatory actions of passion fruit peel extract in modifying osteoarthritis,hypertension,and asthma[M].San Diego:Academic Press,2013:633-639.
[5]TALCOTT S T,PERCIVAL S S,JENNIFER P M,et al.Phytochemical composition and antioxidant stability of fortified yellow passion fruit(Pas-siflora edulis)[J].J Agr Food Chem,2003,51(4):935.
[6]QUEIROZ M D S R.Effect of the yellow passion fruit peel flour(Passiflora edulis f.flavicarpa.)in insulin sensitivity in type 2 diabetes mellitus patients[J].Nutr J,2012,11(1):89.
[7]SAMAD N,MUNEER A,ULLAH N,et al.Banana fruit pulp and peel involved in antianxiety and antidepressant effects while invigorate memory performance in male mice:Possible role of potential antioxidants[J].Pakist J Pharmaceut Sci,2017,30(3):989-995.
[8]MATSUI Y,SUGIYAMA K,KAMEI M,et al.Seeking a new anti-skinaging material:piceatannol and its derivatives from passion fruit(Passiflora edulis)seed[J].Acs Sympos,2013,11(29):189-202.
[9]吕庆峰.近现代中国葡萄酒产业发展研究[D].杨凌:西北农林科技大学,2013.
[10]霍丹群,蒋兰,马璐璐,等.百香果功能研究及其开发进展[J].食品工业科技,2012,33(19):391-395.
[11]郭正忠,黄星源,蔡冠英.西番莲果酒的发酵工艺研究[J].酿酒,2017,44(4):96-98.
[12]朱文娴,夏必帮,廖红梅.西番莲的功能活性成分及加工与综合利用研究进展[J].食品与机械,2018,34(12):181-184.
[13]刘亚娜.红树莓酒酿造工艺及其抗氧化活性的研究[D].大庆:黑龙江八一农垦大学,2016.
[14]蔡文超,单春会,李文新,等.响应面法优化沙棘酒的发酵工艺[J].中国酿造,2018,37(1):133-138.
[15]宗绪岩,白彬阳,杨金山,等.蓝靛果酒酿造工艺优化[J].包装与食品机械,2018,37(5):13-17.
[16]LIU D F,ZHANG H T,LIN C C,et al.Optimization of rice wine fermentation process based on the simultaneous saccharification and fermentation kinetic model[J].Chinese J Chem Eng,2016,24(10):1406-1412.
[17]肖世娣,王菁,薛逸轩,等.响应面-主成分分析法优化仙人掌发酵酒工艺[J].食品工业科技,2019,40(15):113-119.
[18]吴树坤,邓杰,范勇,等.山葡萄酒发酵动力学及抗氧化活性研究[J].食品与发酵工业,2018,44(4):42-48.
[19]谢思,赵晓燕,杨舒郁,等.郫县豆瓣自然与恒温后熟发酵工艺的对比分析[J/OL].食品科学:1-11(2019-11-23).http://kns.cnki.net/kcms/detail/11.2206.TS.20190620.1403.018.html.
[20]罗跃中,李忠英,李继睿,等.高效酒精酵母菌选育及其特性研究[J].中国酿造,2013,32(8):71-74.
[21]涂宗财,唐平平,郑婷婷,等.响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J].食品与发酵工业,2017,43(5):160-166.
[22]范丽霞,胡晓苹,刘文波,等.响应面试验优化链霉菌Z331-A 的发酵条件[J].中国酿造,2018,37(4):77-82.