猕猴桃果酒是以猕猴桃果汁为原料,经全部或部分发酵酿制而成的发酵酒[1]。猕猴桃果酒的制作工艺较为简单,一般将猕猴桃洗净后破碎入罐经接种、发酵和过滤澄清即可[2]。猕猴桃果酒的酿制过程其本质上是以酵母菌为主的多种微生物生长代谢的过程[3],微生物的生长代谢不仅有利于猕猴桃果酒发挥抗氧化和保健功效,同时亦赋予了其特殊的滋味和风味[4]。近年来,研究人员围绕猕猴桃果酒的原料[5],原料的处理方式[6]对果酒品质的影响,酿酒菌株的筛选[7]和发酵工艺的优化[8]进行了大量的研究。随着消费升级,消费者对于猕猴桃果酒自身的口感和风味显得尤为关注,然而目前却少有研究人员对猕猴桃果酒发酵过程中品质的变化进行研究。
虽然可参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》中约束的感官评鉴法对果酒的滋味和风味进行评价,然而该方法对于鉴评人员的要求较高且描述较为模糊,容易受主观因素影响。近年来,电子舌和电子鼻被广泛的应用于食品品质的评价[9]。电子舌采用人工脂膜技术对食品中各感官指标进行数字化的评价,具有结果准确性高和可重复等优点[10],而电子鼻通过多组传感器实现了食品中典型挥发性物质含量的评价[11],两种技术相结合更是广泛的应用于红酒[12]、啤酒[13]、白酒[14]和黄酒[15]的品质评价。
本研究使用电子舌和电子鼻技术,结合多元统计学方法对猕猴桃果酒发酵过程中品质的变化规律进行了探究,以期对后续猕猴桃果酒工艺的改善提供一定的参考。
1 材料与方法
1.1 材料与试剂
徐香猕猴桃、白砂糖:市售。RW葡萄酒·果酒专用酵母(食品级):安琪酵母股份有限公司;内部溶液、阴离子溶液、阳离子溶液、参比溶液(均为分析纯):日本Insent公司;果胶酶(5万U/g)、偏重亚硫酸钾(分析纯):烟台帝伯仕自酿机有限公司。
1.2 仪器与设备
SA 402B电子舌:日本Insent公司;PEN3电子鼻:德国Airsense公司;250B数显生化培养箱型:金坛市荣华仪器制造有限公司;XP07亚力西全自动打浆机:喜来家电器有限公司。
1.3 实验方法
1.3.1 猕猴桃果酒样品制作
将成熟的猕猴桃打浆→添加偏重亚硫酸钾(0.1g/L)→按质量比添加0.08%果胶酶→调节pH值至3.5、糖度至22°Bx→按照0.2‰鲜果的比例接种酵母→控温发酵(23 ℃、7 d)→酒渣分离→后发酵(15~18 ℃、22 d)→澄清→5 000 r/min离心10 min,上清液备用。猕猴桃果酒发酵过程中分别于1 d、4 d、7 d、10 d、13 d、16 d、19 d和22 d进行取样,同时对未发酵的果汁样品进行留样。
1.3.2 猕猴桃果酒总酸和酒精度的测定
参照GB/T 12456—2008《食品中总酸的测定》中酸碱滴定法对果酒样品中的总酸含量进行测定[16],其中总酸含量以酒石酸计算;参照GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》中密度瓶法对果酒样品的酒精度进行测定[17]。
1.3.3 使用电子舌对不同发酵时间猕猴桃果酒样品进行测定
取40mL果酒样品和80mL超纯水混合均匀,10000r/min离心10 min后取上清液抽滤,滤液备用。参照于博等[18]测定米酒滋味的方法,对不同发酵时间果酒样品的5 个基本味(酸味、苦味、涩味、咸味和鲜味)和3 个基本味的回味(涩的回味、苦的回味和鲜的回味)进行分析,以未发酵的果汁样品为对照组,各组样品各指标的强度减去对照组样品的强度即为该样品滋味指标的相对强度。
1.3.4 使用电子鼻对不同发酵时间猕猴桃果酒样品进行测定
PEN3电子鼻共配备W1C、W1S、W1W、W2S、W2W、W3C、W3S、W5C、W5S和W6S共10 组传感器,可实现样品挥发性风味物质中10 种典型类型物质的测定。参照杨成聪等[19]测定黄酒风味的方法,取15 mL果酒样品于电子鼻样品瓶中,60 ℃保温30 min后室温平衡10 min,选取各传感器53 s、54 s和55 s时的响应值纳入分析,并计算其平均值为测试值,平行试验3 次。
1.3.5 统计学分析
使用主成分分析(principal component analysis,PCA)和聚类分析(cluster analysis,CA)对不同发酵时间果酒品质整体结构进行差异性分析;使用冗余分析(redundancy analysis,RDA)和曼-惠特尼检验(mann-whiney test)对与发酵时间显著相关的滋味和风味指标进行甄别。使用Canoco 4.5软件做冗余分析并绘制双序图,使用PAST 3软件做主成分分析,其他分析均使用Matlab 2016b;其他图使用origin 2017绘制。
2 结果与分析
2.1 猕猴桃果酒发酵过程中品质的变化趋势
本研究参考国标中的测定方法对不同发酵时间果酒样品的总酸和有机酸的含量进行测定,结果见图1,滋味指标强度箱型见图2。
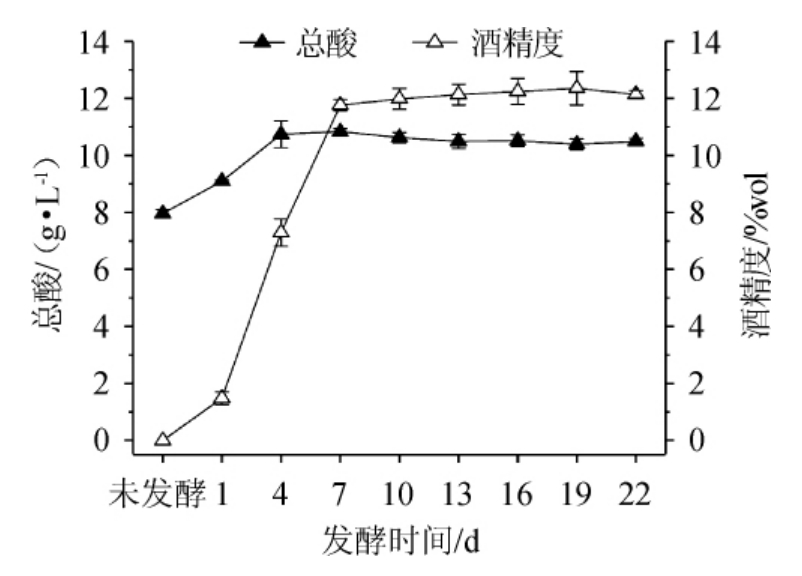
图1 发酵过程中猕猴桃果酒总酸含量和酒精度的变化
Fig.1 Changes of total acid and alcohol content in kiwifruit win during fermentation process
由图1可知,总酸含量在发酵前4 d呈现出快速的上升趋势,而随着发酵时间的延长,总酸的含量趋于平稳,这可能由于自然环境或者果皮中带入的乳酸菌利用糖类物质产生了乳酸[20-21]。酒精度在前7 d呈现快速的上升趋势,究其原因可能在于果酒刚发酵时,酵母菌大量生长,并将发酵液中的糖类物质转化为酒精,从而使发酵液中的酒精度含量升高[22],而7 d后酒精的变化趋于稳定。
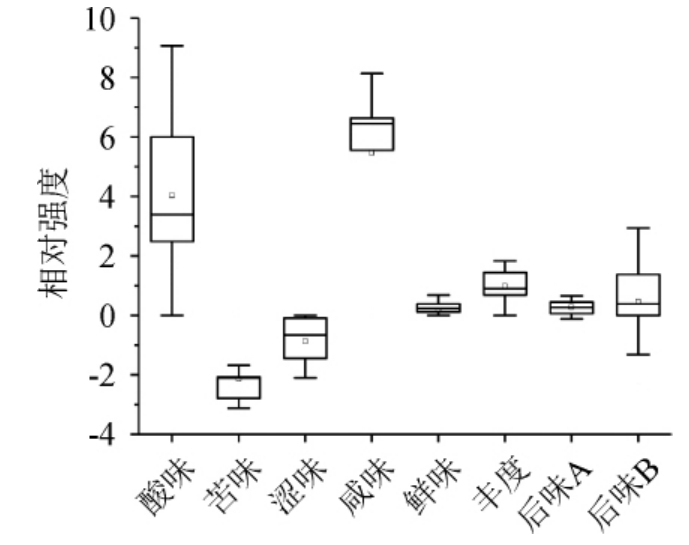
图2 发酵过程中猕猴桃果酒滋味指标强度的箱型图
Fig.2 Box diagram of relative intensity of each taste indexes of kiwifruit wine during fermentation process
由图2可知,酸味、苦味、涩味、咸味、丰度(鲜的回味)和后味B(苦的回味)6 个滋味指标的极差值均大于1,即不同发酵时间的果酒其滋味品质可通过感官品鉴加以识别[23]。酸味和后味B(苦的回味)的极差值较之其他滋味指标较大。由此可见,在猕猴桃果酒发酵过程中酸味和苦味的后味是变化最为明显的2个滋味指标。本研究进一步使用电子鼻对猕猴桃果酒发酵过程中各风味指标进行了测定,结果如表1所示。
表1 发酵过程中猕猴桃果酒风味指标强度
Table 1 Relative intensity of each flavor indexes in kiwifruit wine during fermentation process
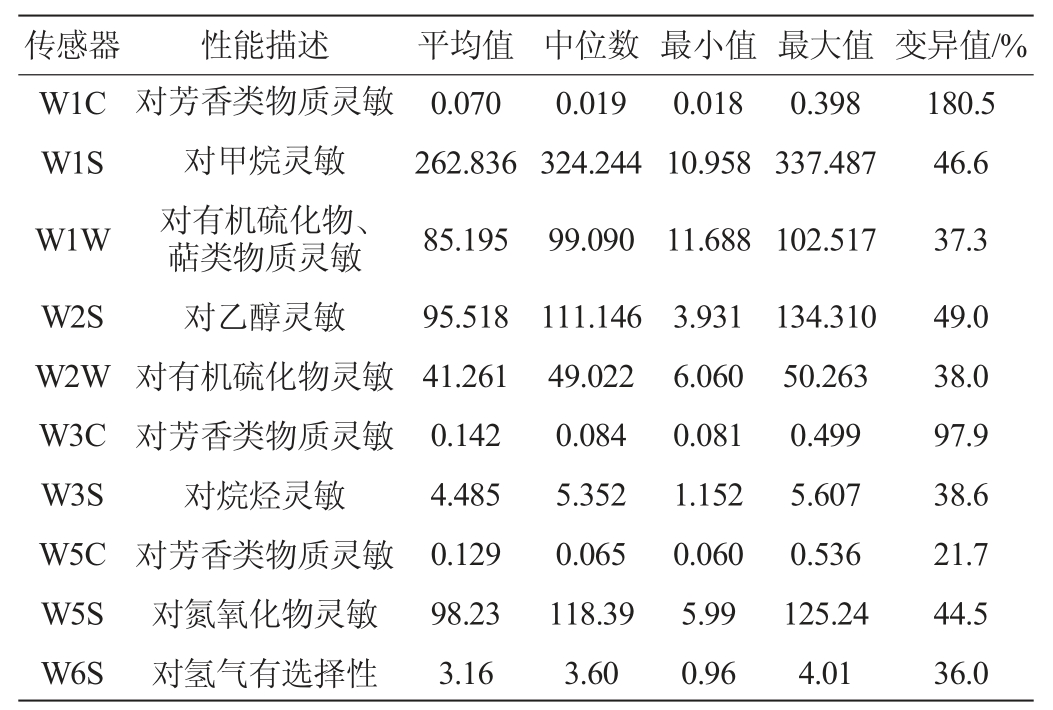
由表1可知,传感器W1C、W3C和W2S对不同发酵时间的猕猴桃果酒响应值差异较大,其变异值分别为180.5%、97.9%和49.0%,由此可见,在发酵过程中猕猴桃果酒挥发性风味物质中的芳香物质和乙醇含量发生了较为明显的变化。
2.2 基于多元统计学方法不同发酵时间猕猴桃果酒品质的评价
基于猕猴桃果酒的滋味和风味指标,本研究对不同发酵时间果酒进行了主成分分析,因子载荷图如图3所示。

图3 发酵过程中猕猴桃果酒品质的因子载荷图
Fig.3 Factor loading map of the quality of kiwifruit wine during fermentation process
由图3可知,PC1主要由W5C、W1C、W3C、W3S、W1S、W6S、W5S、W2W、W2S、W1W和咸味11 个品质指标组成并占全部变量权重的77.23%,而PC2则主要由后味B(苦味的后味)、后味A(涩味的回味)、鲜味、苦味、丰度、酸味和涩味7个品质指标构成并占全部变量权重的13.47%。由此可见,构成PC1的指标基本为风味品质指标,而构成PC2的指标全部为滋味品质指标。发酵不同阶段猕猴桃果酒样品品质的因子得分及聚类分析见图4。
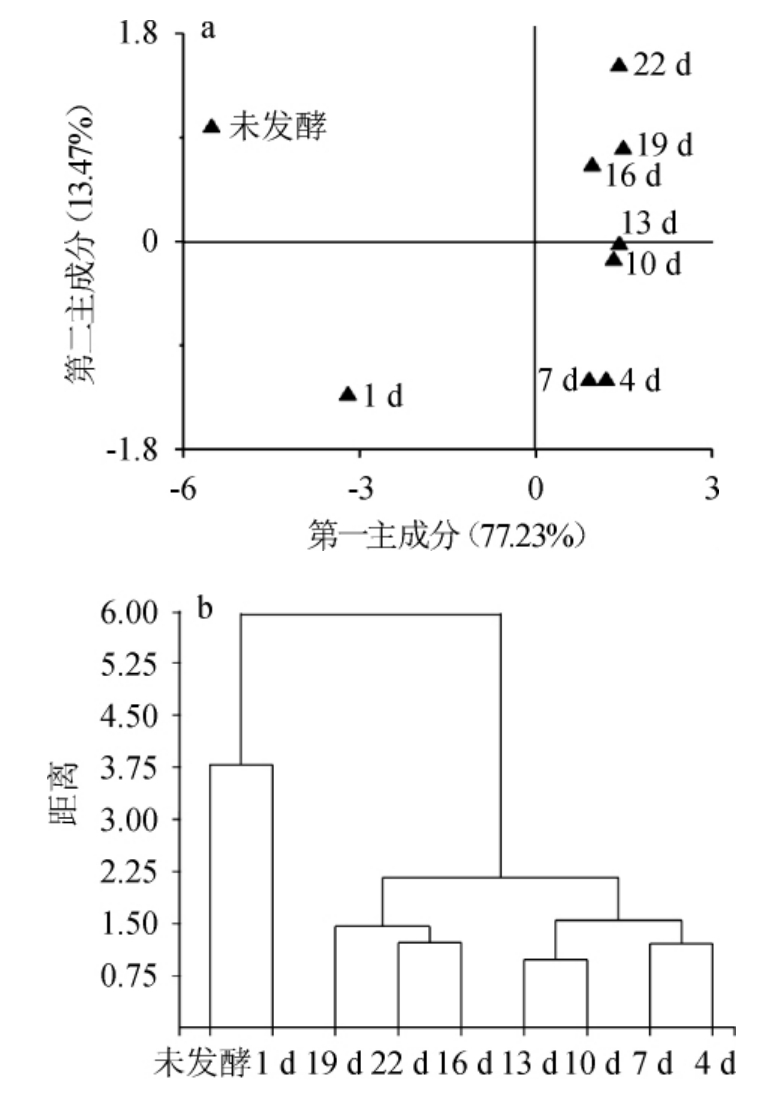
图4 发酵过程中猕猴桃果酒品质的因子得分图(a)和聚类分析(b)
Fig.4 Factor score map(a)and cluster analysis(b)based on quality of kiwifruit wine during fermentation process
由图4a可知,虽然果酒样品在四个象限内均有分布,但亦呈现出一定的聚类趋势,其中未发酵的猕猴桃果汁样品分布在第二象限,发酵1 d的果酒样品分布在第三象限,发酵4~10 d的果酒样品分布在第四象限,发酵13 d的果酒样品分布在X轴正方向,而发酵16~22 d的果酒样品则分布在第一象限。值得一提的是,发酵前4 d时随着发酵时间的延长样品的空间排布整体偏向X轴正方向,而发酵7 d后随着发酵时间的延长样品的空间排布整体偏向Y轴正方向。由此可见,发酵4 d可能是猕猴桃果酒品质形成的关键时间点之一,此时样品已经初步具备了猕猴桃果酒的品质。结合因子载荷图亦可知,发酵7 d后,随着发酵时间的延长猕猴桃果酒的苦味和后味B(苦味的回味)等滋味品质逐渐增强,而气味品质并未发生明显的变化。
由图4b可知,不同发酵时间的果酒样品整体上可分为3个聚类,其中聚类I由未发酵的猕猴桃果汁和发酵1 天的果酒样品构成,聚类II由发酵4 d、7 d、10 d和13 d的样品构成,而聚类Ⅲ由发酵16 d、19 d和22 d的样品构成。此结果与主成分分析结果相一致,由此可见,发酵4 d时样品已经初步具备了猕猴桃果酒的品质,而当发酵时间延长至16 d时其品质可能会进一步发生明显的变化。
2.3 猕猴桃果酒发酵过程中关键指标的甄别
本研究以聚类I、聚类II和聚类Ⅲ为分组依据,使用冗余分析对与发酵时间显著相关的滋味和风味指标进行了甄别,结果如图5所示。
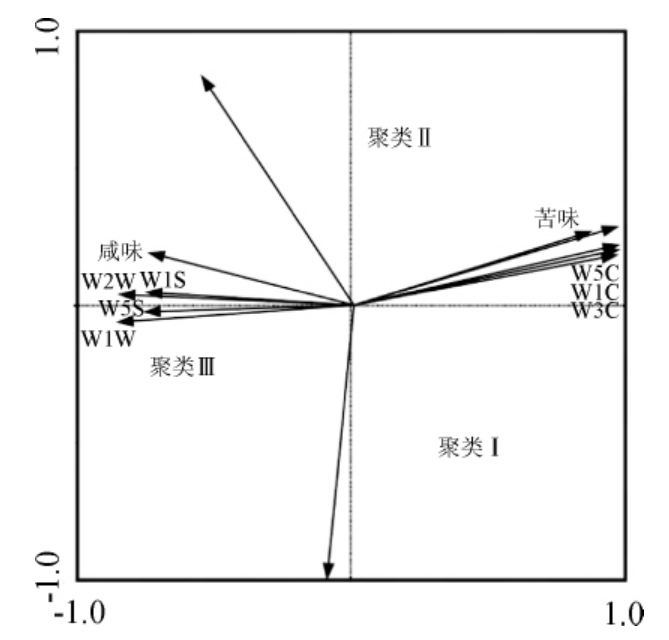
图5 冗余分析双序图
Fig.5 Biplot of redundancy analysis
由图5可知,咸味、苦味、W2W、W1S、W5S、W1W、W5C、W1C和W3C等9个评价指标与RDA双序图约束轴上的样品具有良好的赋值相关,可以代表与发酵时间显著相关的品质评价指标。其中W1C、W3C和W5C位于聚类I一侧,说明这3个品质评价指标的相对强度在未发酵的猕猴桃果汁和发酵1 d的猕猴桃果酒样品中较大,而咸味、W1S、W2W、W5S和W1W则位于聚类Ⅲ一侧,说明这5个品质评价指标的相对强度在发酵4 d以后的猕猴桃果酒样品中较大。
本研究对RDA甄别出的9个品质评价指标进行了进一步分析,其随发酵时间变化的趋势如图6所示。由图6可知,发酵前4 d时,电子鼻传感器W5S、W1S、W1W和W2W对猕猴桃果酒的响应值明显增强,而电子鼻传感器W1C、W3C和W5C的响应值呈现明显下降趋势,同时猕猴桃果酒的咸味呈明显上升趋势,而苦味呈明显下降趋势。发酵4 d后各传感器的响应值基本趋于稳定,由此可见,发酵4 d时样品已经初步具备了猕猴桃果酒的风味品质,这与主成分分析和聚类分析结果一致。
由图6亦可知,当发酵时间延长至16 d后,猕猴桃果酒的咸味呈现明显上升的趋势,且传感器W1S对猕猴桃果酒的响应值明显偏高,虽然经过RDA判定传感器W2W、W5S和W1W响应值亦为导致不同发酵时间果酒品质存在较大差异的指标,但在发酵16 d后上述3个传感器对猕猴桃果酒响应值的变化不明显。W1S主要对甲烷类挥发性风味成分敏感,咸味亦为猕猴桃果酒的缺陷型指标,由此可见,发酵16 d后猕猴桃果酒的品质开始下降。

图6 发酵过程中猕猴桃果酒部分品质指标的变化
Fig.6 Changes of partial quality indexes of kiwifruit wine during fermentation process
3 结论
采用徐香猕猴桃进行果酒制备时,发酵4 d时总酸含量趋于稳定,发酵7 d时酒精趋于稳定,发酵4 d时发酵液已经具备了猕猴桃果酒的滋味和风味品质,发酵16 d后猕猴桃果酒的品质开始下降,所以猕猴桃果酒的发酵时间不宜超过16 d。
[1]PARK Y S,IM M H,HAM K S,et al.Quantitative assessment of the main antioxidant compounds,antioxidant activities and FTIR spectra from commonly consumed fruits,compared to standard kiwi fruit[J].LWT-Food Sci Technol,2015,63(1):346-352.
[2]冯尚坤.营养型猕猴桃酒发酵工艺优化[J].中国酿造,2015,34(2):172-175.
[3]黎星辰,马力,曹琳,等.不同酿酒酵母发酵猕猴桃酒香气成分研究[J].食品科技,2016,41(7):72-77.
[4]黎星辰,唐敏,曹琳,等.不同酿酒酵母对猕猴桃酒理化性质、抗氧化能力及感官的影响[J].食品科技,2016,41(6):16-20.
[5]赵宁,魏新元,樊明涛,等.发酵方法及品种对猕猴桃酒多酚和抗氧化性的影响[J].食品科学,2017,38(21):86-92.
[6]陈红梅,王沙沙,尹何南,等.不同工艺处理对野生猕猴桃酒品质的影响[J].食品科学,2018,39(4):233-240.
[7]LEE H Y,SEO W T,JEONG S H,et al.Physicochemical characteristics and volatile flavor compounds of produced mixture wine with kiwi and permission fruits using wild yeast,Saccharomyces cerevisiae Y28[J].Korean J Microbiol,2016,52(1):98-109.
[8]WANG B,PENG B.A feasibility study on monitoring residual sugar and alcohol strength in kiwi wine fermentation using a fiber-optic FT-NIR spectrometry and PLS regression[J].J Food Sci,2017,82(2):358-363.
[9]PERIS M,ESCUDER-GILABERT L.Electronic noses and tongues to assess food authenticity and adulteration[J].Trends Food Sci Technol,2016,58(12):40-54.
[10]DI ROSA A R,LEONE F,CHELI F,et al.Fusion of electronic nose,electronic tongue and computer vision for animal source food authentication and qualityassessment-A review[J].J Food Eng,2017,210(10):62-75.
[11]LOUTFI A,CORADESCHI S,MANI G K,et al.Electronic noses for food quality:A review[J].J Food Eng,2015,144(1):103-111.
[12]RODRIGUEZ-MENDEZ M L,APETREI C,GAY M,et al.Evaluation of oxygen exposure levels and polyphenolic content of red wines using an electronic panel formed by an electronic nose and an electronic tongue[J].Food Chem,2014,155(7):91-97.
[13]NERY E W,KUBOTA L T.Integrated,paper-based potentiometric electronic tongue for the analysis of beer and wine[J].Anal Chimica Acta,2016,918(4):60-68.
[14]KIM J S,JUNG H Y,PARK E Y,et al.Flavor analysis of commercial Korean distilled spirits using an electronic nose and electronic tongue[J].Kore J Food Sci Technol,2016,48(2):117-121.
[15]YU H Y,ZHAO J,LI F,et al.Characterization of Chinese rice wine taste attributes using liquid chromatographic analysis,sensory evaluation,and an electronic tongue[J].J Chromatogr B,2015,997(8):129-135.
[16]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 12456—2008《食品中总酸的测定》[S].北京:中国标准出版社,2008.
[17]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[S].北京:中国标准出版社,2016.
[18]于博,郭壮,汤尚文,等.不同发酵时间米酒滋味品质变化的研究[J].食品研究与开发,2015,36(10):15-18.
[19]杨成聪,刘丹丹,葛东颖,等.基于气相色谱-质谱联用技术结合电子鼻评价浸米时间对黄酒风味品质的影响[J].食品与发酵工业,2018,44(8):265-270.
[20]樊双喜,钟其顶,李国辉,等.近红外光谱法快速检测黄酒的酒精度、总糖和总酸[J].中国酿造,2015,34(2):135-138.
[21]沈颖,刘晓艳,白卫东,等.果酒中有机酸及其对果酒作用的研究[J].中国酿造,2012,31(2):29-32.
[22]信春晖,许玲,董乔娟,等.酿酒微生物对酒体质量及风格的影响[J].酿酒,2016,43(2):38-47.
[23]DOI M.Evaluation of kokumi taste of Japanese soup stock materials using taste sensor[J].Sensor Mater,2011,23(8):493-499.