植酸是一种天然有机化合物,主要存在于豆类、谷类等一些种子的胚芽组织中,螯合金属离子为植酸盐[1-2]。植酸酶是一类可分解植酸或植酸盐生成肌醇和磷酸的酶类。植酸酶根据来源可分为动物植酸酶、植物植酸酶和微生物植酸酶[3]。前两类植酸酶存在活力低和稳定性差的问题,而微生物植酸酶易生产、活力高和稳定,应用最广、研究最深入。研究发现产植酸酶的微生物包括细菌(大肠杆菌、枯草芽孢杆菌和乳杆菌等)、酵母菌(啤酒酵母和毕赤酵母等)和真菌(曲霉、根霉和毛霉)。
植酸酶目前主要用于饲料添加剂,其在食品工业中的研究较少。由于人和单胃动物缺乏分解植酸盐的植酸酶,植酸盐与肠道内物质如蛋白质和矿物质反应,不仅降低单胃动物对磷等金属离子的吸收和利用,还影响蛋白质等营养物质的消化吸收,因此,使用植酸酶降低食品中植酸盐含量有重要的研究价值。目前,食品用植酸酶主要由基因工程构建的真菌产生,这类酶对热敏感,在高温条件下易不可逆失活,所以增加肠道中可分解植酸盐的微生物对营养物质的吸收有重要的补充意义。发酵乳品是筛选分解植酸盐益生菌的宝贵资源库,富含大量可分解植酸盐的酵母菌,如酿酒酵母(Saccharomyces cerevisiae)、马克思克鲁维酵母(Kluyveromyces marxianus)和库德毕赤酵母(Pichia kudriavzevii)等[4-5]。GREPPI A等[6]从发酵乳品中筛选到一株库德毕赤酵母(Pichia kudriavzevii),其胞外植酸酶酶活性可达49.17 mU/mL,具有应用潜力。我国《可用于保健食品的真菌名单》包含酿酒酵母(Saccharomyces cerevisiae)、产朊假丝酵母(Cadida atilis)和乳酸克鲁维酵母(Kluyveromyces lactis),而在许多工业发酵或者自发酵食物中存在众多不在名单中的酵母菌种[4-5,7-8]。在此背景下,发酵食物是一个摄入酵母菌的重要途径。
为发掘和保护新疆牧区传统发酵驼乳中的益生酵母菌资源,本研究以新疆伊犁地区不同牧区的12份发酵驼乳为原料,采用酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基分离,富含植酸二钾的培养基初筛及降解植酸盐能力的测定从中筛选可降解植酸盐的酵母菌,通过形态观察、生理生化试验及5.8S rDNA ITS1/ITS4区域序列同源性分析鉴定菌种,并测定其耐酸及耐胆盐性能。以期筛选到具有降解植酸盐的酵母菌,为后期在发酵食品中的应用提供基础数据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
12份发酵驼乳样品:采集自新疆伊犁州国营牧场、巴音傲瓦乡牧区、伊克乌图布拉格牧场、精河小海子牧区、精河阔岱管护站牧区,均是哈萨克族、蒙古族和维吾尔族牧民采用传统方法发酵而成。
1.1.2 试剂
胆盐、植酸二钾、胃蛋白酶、硝酸钾、亚硝酸钠(均为分析纯):生工生物工程(上海)股份有限公司;酵母膏、蛋白胨、葡萄糖、蔗糖、乳糖、麦芽糖、D-半乳糖、棉子糖、可溶性淀粉(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
YPD培养基[9]:葡萄糖20 g/L,酵母膏10 g/L,蛋白胨20 g/L,121 ℃高压灭菌15 min。
Phy+培养基[10]:葡萄糖20 g/L,氯化钾1.7 g/L,硫酸二胺7.5 g/L,七水硫酸镁0.74 g/L,植酸二钾1.85 g/L,121 ℃高压灭菌15 min。
Phy-培养基[10]:葡萄糖20 g/L,氯化钾1.7 g/L,硫酸二胺7.5 g/L,七水硫酸镁0.74 g/L,121 ℃高压灭菌15 min。
Phy基础培养基[10]:葡萄糖20 g/L,磷酸二氢钾3.5 g/L,硫酸二胺7.5g/L,七水硫酸镁0.74g/L,121℃高压灭菌15min。
以上为液体培养基,固体培养基添加20 g/L的琼脂粉。
1.2 仪器与设备
W-CJ-1CG超净工作台:苏州净化设备有限公司;DNP-9272电热恒温培养箱:上海精宏试验设备公司;5417R高速冷冻离心机:德国Eppendorf公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:美国Techne公司;MLS-3750型高温高压灭菌锅,日本SANYO公司;722S可见分光光度计:上海欣茂仪器有限公司。
1.3 试验方法
1.3.1 酵母菌的分离纯化
取500 μL发酵驼乳于4.5 mL无菌生理盐水中,按10倍梯度进行稀释,均匀涂布于YPD培养基,在28 ℃条件下培养48 h,观察并记录菌落特征,挑取单个菌落进行美兰染色,镜检,观察并记录细胞形态,将不同形态的酵母菌重复划线纯化,直至形态单一,保存在30%的甘油中,-80 ℃超低温冰箱保存。
1.3.2 分解植酸盐酵母菌的筛选[6]
菌株的活化:将甘油管中的酵母菌在YPD固体培养基上划线活化,28 ℃条件下培养48 h,连续活化三代至长势良好。
种子液的制备:将活化好的单菌落接种于5mLYPD液体培养基中,28 ℃、150 r/min条件下培养24 h;按2%(V/V)的接种量接种于50 mL YPD液体培养基中,28 ℃、150 r/min条件下培养24 h得到种子液。
按2%(V/V)的接种量将种子液接种于YPD液体培养基中,28 ℃、150 r/min条件下培养24 h,4 ℃条件下经5 000×g离心10 min,收集菌泥,无菌生理盐水清洗3次后,用无菌生理盐水重悬。按2%(V/V)的接种量将菌种重悬液分别接种于YPD液体培养基、Phy+液体培养基及Phy-液体培养基,于28 ℃、150 r/min条件下培养24 h,采用分光光度计调整培养液的OD600nm值=0.1;将菌种重悬液梯度稀释,吸取100 μL分别涂布于YPD固体培养基、Phy+固体培养基及Phy-固体培养基,于28 ℃条件下培养,三种培养基中均生长的菌株为可分解植酸盐的酵母菌。
1.3.3 分解植酸盐能力的测定
将筛选得到的酵母菌的种子液按2%(V/V)的接种量接种于Phy液体基础培养基中,28 ℃、150 r/min条件下培养。用Phy液体基础培养基将培养液具体浓度稀释到108 CFU/mL,吸取100 μL于Phy+固体培养基中的牛津杯中,在28 ℃条件下培养,采用游标卡尺分别测定培养24 h和48 h的透明圈直径。透明圈直径>1 cm被认为具有分解植酸盐的能力[6]。
1.3.4 菌株的鉴定
(1)形态观察[11]
对筛选菌株的菌落形态、细胞形态、繁殖方式进行观察。
(2)生理生化试验[11]
通过糖发酵试验、碳源同化试验、氮源同化试验、类淀粉化合物生成试验、产酯试验、产酸试验等生理生化特征对筛选菌株进行鉴定。
(3)分子生物学鉴定[12-13]
将筛选得到的菌株接种于YPD液体培养基中,28 ℃条件下培养36 h,取1 mL菌液,12 000 r/min离心1 min,收集菌泥,采用酵母菌基因组脱氧核糖酸(deoxyribonucleic acid,DNA)提取试剂盒(离心柱型)提取DNA。以基因组DNA为模板,使用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')对菌株的5.8 S rDNA ITS区域序列进行PCR扩增。PCR扩增体系:DNA模板2 μL,ITS 1(10 μmol/L)2 μL,ITS 4(10 μmol/L)2 μL,2×Taq PCR MasterMix 25 μL,加双蒸水(ddH2O)补充至50 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性45 s,55 ℃退火45 s,72 ℃延伸50 s,共36个循环;72 ℃再延伸10 min。PCR扩增产物经1%的琼脂糖凝胶电泳检测,胶回收后送至生工生物工程(上海)股份有限公司测序,测序结果在美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行BLAST比对,选取同源性较高的模式菌株的5.8 SrDNAITS区域序列,采用MEGA软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.5 菌株耐酸耐胆盐能力的测定[14]
按照2%(V/V)的接种量将种子液接种于YPD液体培养基中,28 ℃、150 r/min条件下培养24 h至对数期末期形成菌种原液。将200 μL制备好的菌种原液分别加入pH 4.0和含0.3%胆盐的10 mL YPD液体培养中,混匀后置于28 ℃、150 r/min条件下培养,分别在培养2 h、4 h后取出,菌种原液中活菌数为初始菌落,使用平板计数法测得菌落数,并计算存活率,其计算公式如下:
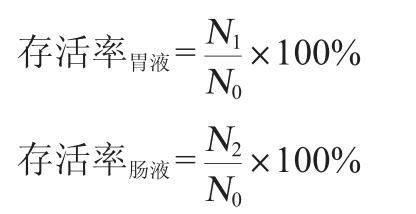
式中:N0为初始菌落数,CFU/mL;N1和N2分别是模拟胃液2 h和模拟肠液4 h后的菌落数,CFU/mL。
2 结果与分析
2.1 分解植酸盐酵母菌的分离和筛选
通过YPD培养基从12份发酵驼乳中共分离纯化得到284株酵母菌,通过Phy+培养基及Phy-培养基初步筛选得到15株可分解植酸盐的酵母菌,菌株编号分别为D7-10、DW1-1、D7-6、G1-16、DY1-13、G1-10、TY1-2、BJ9-4、BJ9-5、BJ9-12、DY1-2、TS1-1、TXMY1-2、B13-3和H1-3。
2.2 分解植酸盐能力的测定
对15株酵母菌分解植酸盐的能力进行测定。结果见图1。
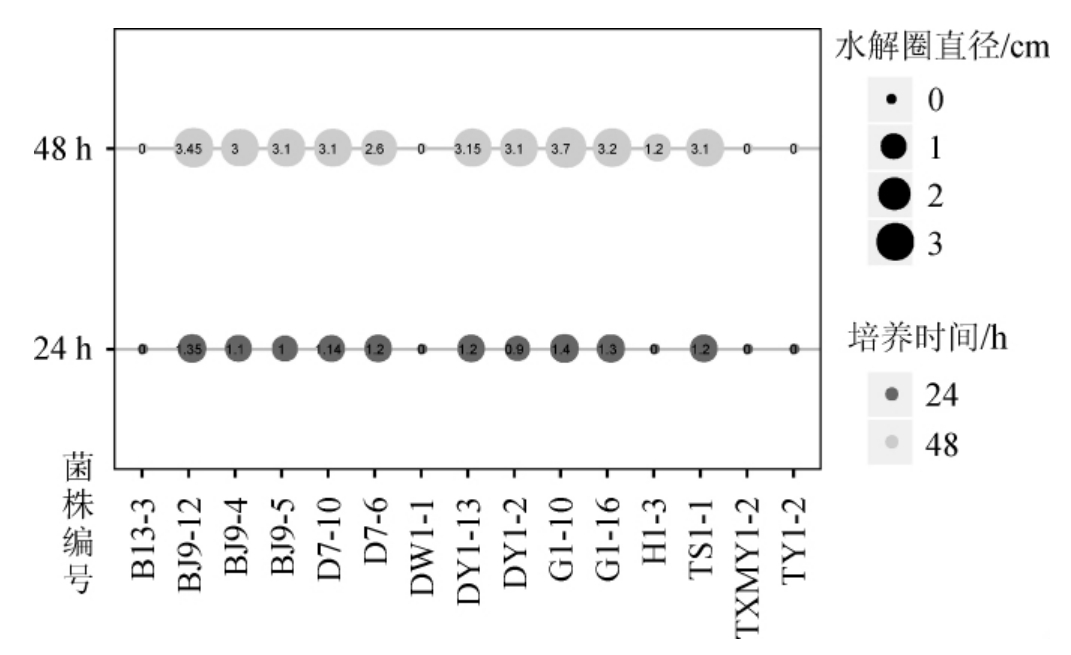
图1 15株酵母菌分解植酸盐能力的测定结果
Fig.1 Determination results of phytate degradation ability of 15 strains of yeast
由图1可知,除酵母菌B13-3、DW1-1、TXMY1-2和TY1-2不能形成透明圈外,其余酵母菌都可形成透明圈,且培养48 h时的透明直径显著大于24 h的透明圈直径(P<0.01),其中酵母菌H1-3仅在培养48 h时才形成透明圈。在培养48 h时,各酵母菌的透明圈直径差异不显著(P>0.05)。结果表明,可分解植酸盐的酵母菌有11株。
2.3 可分解植酸盐酵母菌株的鉴定
2.3.1 形态观察及生理生化试验结果
11株可分解植酸盐酵母菌株的菌落形态、细胞形态、繁殖方式见表1,生理生化试验结果见图2。
表1 11株酵母菌菌株的形态观察结果
Table 1 Results of morphology observation of 11 strains of yeast
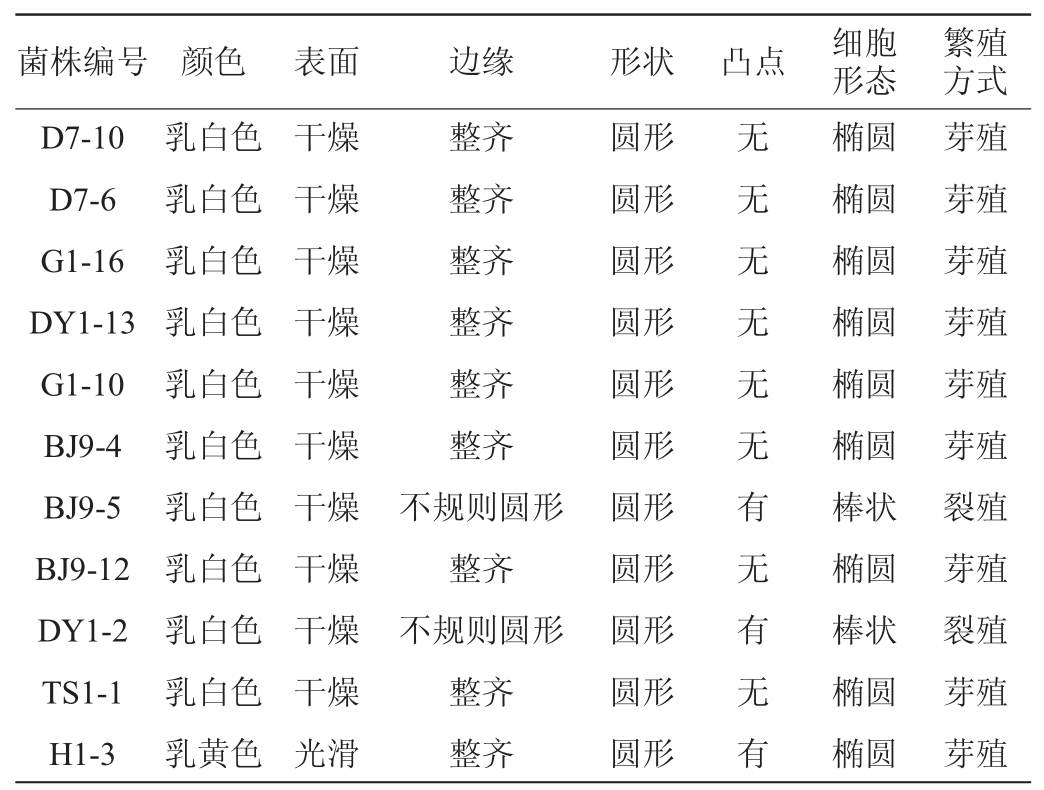
由表1可知,除菌株H1-3外,其余10株酵母菌的菌落均为乳白色,表面干燥,而菌株H1-3的菌落为乳黄色且表面光滑;大部分菌株菌落边缘整齐,少数菌株呈不规则圆形;大部分菌株细胞形态呈椭圆,少数呈棒状;繁殖方式为裂殖或芽殖。
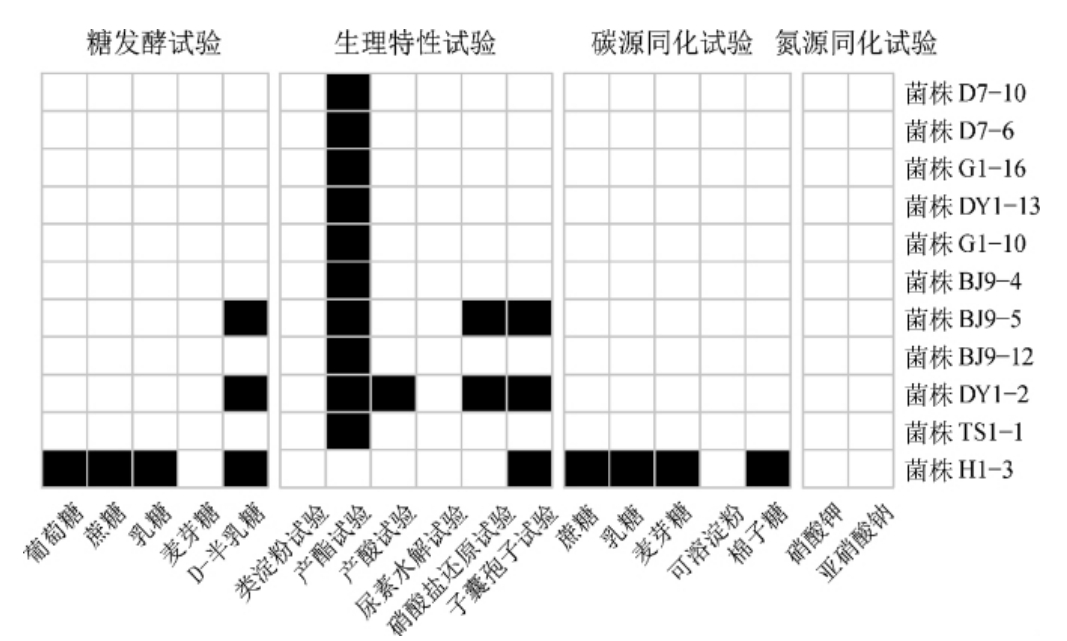
图2 11株酵母菌生理生化试验结果
Fig.2 Results of physiological and biochemical tests of 11 strains of yeast
白色表示阴性反应,黑色表示阳性反应。
由图2可知,所有菌株不可发酵麦芽糖、不可同化硝酸钾和亚硝酸钠;除菌株H1-3外,其余菌株不可发酵葡萄糖、蔗糖、乳糖,不可同化蔗糖、乳糖、麦芽糖和棉子糖。
结合表1酵母菌的菌落形态和图2生理生化试验鉴定结果,并查阅《酵母菌的特征与鉴定手册》[13],初步将分离到的11株菌株归属于3个不同的属,即酵母菌D7-10、D7-6、G1-16、DY1-13、G1-10、BJ9-4、BJ9-12和TS1-1为毕赤酵母属(Pichia);酵母菌H1-3为克鲁维酵母属(Kluyveromyces);酵母菌BJ9-5、DY1-2为地霉属(Geotrichum)。
2.3.2 分子生物学鉴定结果
11株可分解植酸盐的酵母菌的系统发育树见图3。
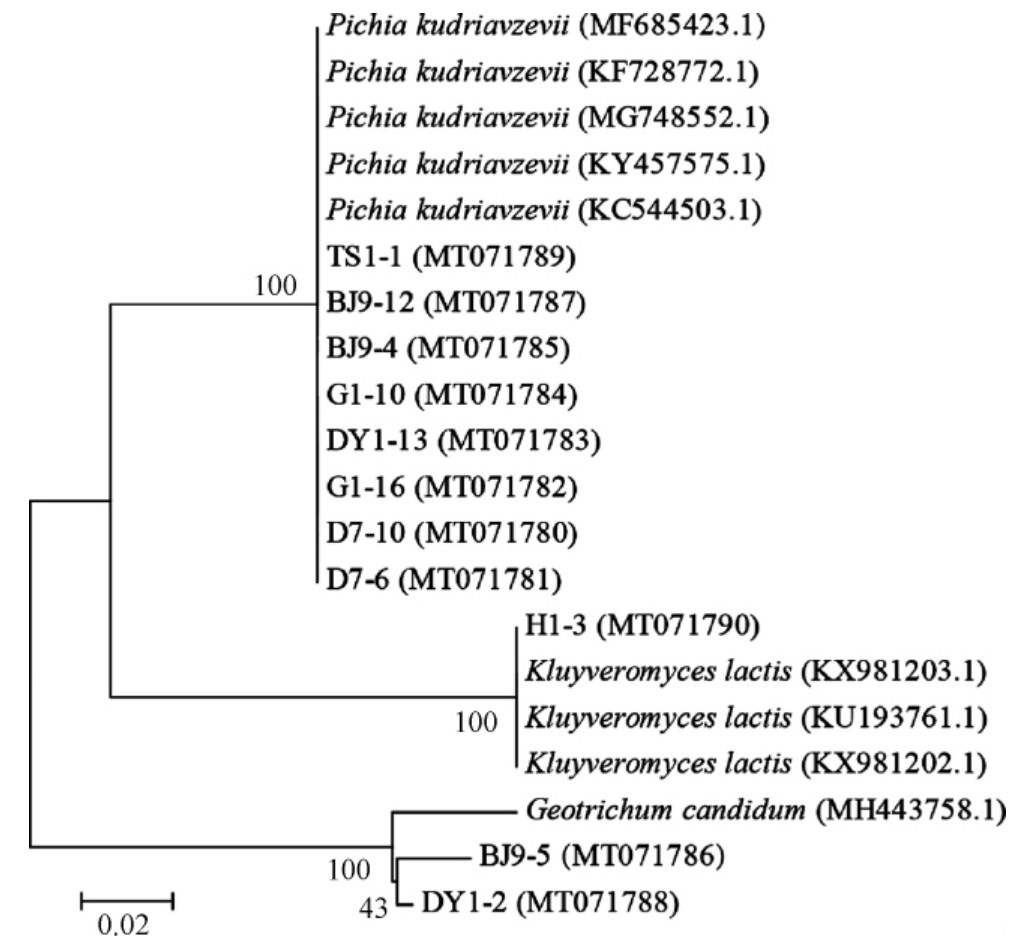
图3 基于5.8S rDNA ITS1/ITS2区域序列11株菌株的系统发育树
Fig.3 Phylogenetic tree of 11 strains based on 5.8S rDNA ITS1/ITS2 regional sequences
由图3可知,菌株D7-10、D7-6、G1-16、DY1-13、G1-10、BJ9-4、BJ9-12和TS1-1均与库德毕赤酵母(Pichia kudriavzevii)聚于一支,亲缘关系最近;菌株BJ9-5和DY1-2均与白地霉(Geotrichum candidum)聚于一支,亲缘关系最近;菌株H1-3与乳酸克鲁维酵母(Kluyveromyces lactis)聚于一支,亲缘关系最近。结合形态观察及生理生化试验结果,鉴定菌株D7-10、D7-6、G1-16、DY1-13、G1-10、BJ9-4、BJ9-12、TS1-1均为库德毕赤酵母(Pichia kudriavzevii),菌株BJ9-5、DY1-2均为白地霉(Geotrichum candidum),菌株H1-3为乳酸克鲁维酵母(Kluyveromyces lactis)。乳酸克鲁维酵母(Kluyveromyces lactis)在我国《可用于保健食品的真菌菌种名单》中。库德毕赤酵母(Pichia kudriavzevii)也称为东方伊萨酵母(Issatchenkia orientalis),可用于发酵面团、酒和醋等[15-16];白地霉(Geotrichum candidum)在制作霉菌成熟干酪时可作为次级发酵剂分解酯类和酪蛋白形成独特风味[17],美国食品药品监督管理(food and drug administration,FDA)规定这些酵母为一般认为安全(generally recognized as safe,GRAS)[18]。
2.4 分解植酸盐菌株耐酸耐胆盐能力测定
随发酵食品入肠道后,酵母存活、分解植酸盐,需要耐受胃(极酸)和/或肠(高胆盐)环境。11株分解植酸盐酵母菌株的耐酸存活率与耐胆盐存活率见表2。
表2 11株酵母菌株的存活率
Table 2 Survival rates of 11 strains of yeast
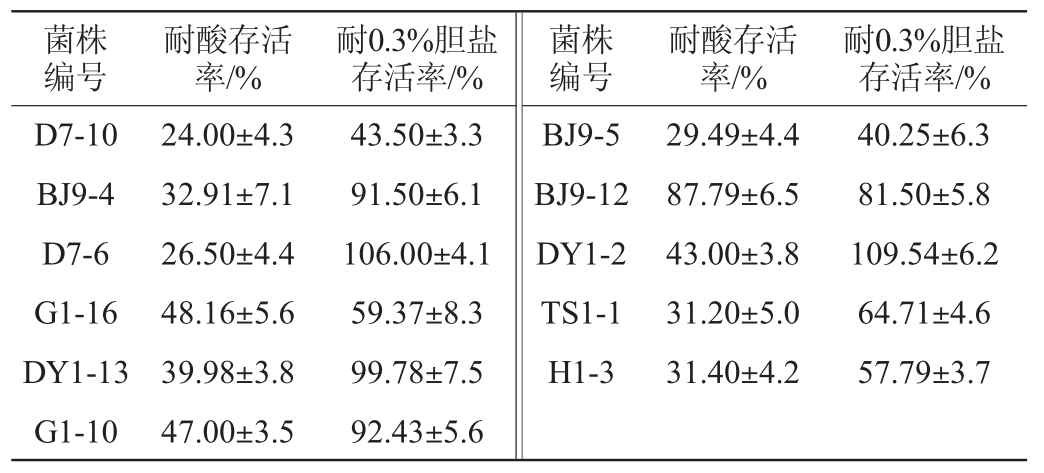
由表2可知,11株菌株对模拟胃肠道的极端环境都具有耐受性,耐酸存活率为24.00%~87.89%,耐0.3%胆盐存活率为40.25%~109.54%。其中菌株BJ9-12在酸和0.3%胆盐胁迫下存活率分别达到87.79%和81.50%,具有良好的耐酸耐胆盐能力;菌株D7-6和DY1-2在胆盐胁迫下正常生长,具有很强的胆盐耐受性。
迪娜热尔·迪力达西等[7]从新疆传统发酵乳制品乳酪乳清中分离出的东方伊萨酵母(Issatchenkia orientalis)在模拟人工胃液中存活率达到132.22%,乙醇假丝酵母(Candida ethanolica)在模拟肠液中存活率达到101.27%。肖新云等[19]研究发现,汉逊德巴利酵母菌(Debaryomyces hansenii)在pH 1.5和0.4%胆盐下仍然能够存活,并且在模拟人工胃肠液下,该菌并没有被抑制反而能够适应性生长繁殖;而一株伯顿毕赤酵母菌(Pichia burtonii)在人工胃液环境(pH 1.5)培养4 h后存活率达到42.78%[20]。在本研究中8株毕赤库德酵母菌只有菌株BJ9-12在耐酸耐胆盐能力较为突出可见。可见不同种的酵母菌或者同种不同株的酵母菌耐受胃肠环境胁迫能力呈株特异性。
3 结论
利用植酸二钾培养基和植酸盐透明圈筛选出11株可分解植酸盐的酵母菌,经形态观察、生理生化试验及分子生物学鉴定8株为库德毕赤酵母(Pichia kudriavzevii),2株为白地霉(Geotrichum candidum),1株为乳酸克鲁维酵母(Kluyveromyces lactis)。其中,库德毕赤酵母BJ9-12在模拟胃液和肠液中的存活率分别为87.79%和81.50%,培养48 h时,分解植酸盐的透明圈直径为3.45 cm,在发酵食品中具有良好的应用潜力。
[1]陈磊.毕赤酵母异源表达来自于Yersinia rohdei 植酸酶及其酶学特性的分析[D].上海:上海海洋大学,2016.
[2]龙跃.毕赤酵母工程菌产植酸酶的发酵优化及其耐热稳定性研究[D].广州:华南理工大学,2011.
[3]单安山,王安,徐奇友,等.植酸酶的特性及其在家禽饲粮中应用的研究1.微生物植酸酶、植物植酸酶特性的测定与影响因素的研究[J].东北农业大学学报,2001(4):345-351.
[4]QVIRIST L A,DE FILIPPO C,FRANCESCO S,et al.Isolation,identification and characterization of yeasts from fermented goat milk of the Yaghnob Valley in Tajikistan[J].Front Microbiol,2016,7:1690.
[5]MENEZES A G T,RAMOS C L,CENZI G,et al.Probiotic potential,antioxidant activity,and phytase production of indigenous yeasts isolated from indigenous fermented foods[J].Prob Antimicrob Proteins,2019:12:280-288.
[6]GREPPI A,KRYCH L,COSTANTINI A,et al.Phytase-producing capacity of yeasts isolated from traditional African fermented food products and PHYPk gene expression of Pichia kudriavzevii strains[J]. Int J Food Microbiol,2015,205:81-89.
[7]迪娜热尔·迪力达西,刘璐,加勒哈斯别克·塞力克,等.新疆传统发酵乳品中乳酸菌与酵母菌的益生特性[J].中国微生态学杂志,2018,30(1):5-9,13.
[8]陈历水.乳源潜在益生酵母菌的筛选鉴定及其对类Camembert 干酪特性影响[D].哈尔滨:哈尔滨工业大学,2010.
[9]张熙,李国辉,周胜虎,等.酿酒酵母异源合成己二酸[J].食品与发酵工业,2020,https://doi.org/10.13995/j.cnki.11-1802/ts.023231.
[10]NUOBARIENE L,HANSEN A S,JESPERSEN L,et al.Phytase-active yeasts from grain-based food and beer[J].J Appl Microbiol,2011,110(6):1370-1380.
[11]BANITE J A.酵母菌的特征与鉴定手册[M].胡瑞卿译.青岛:中国海洋大学出版社,1991:24-25.
[12]乔传丽,蒋彩虹,金丹,等.新疆传统发酵酸奶中酵母菌的分离鉴定及系统发育分析[J].中国酿造,2017,36(4):67-71.
[13]李王强,刘月,孟祥栓,等.新疆塔城地区乳源酵母菌的分离、鉴定及其抗胁迫特性[J].食品工业科技,2018,39(22):99-106.
[14]孙禹.高吸附Pb2+酵母菌的益生特性、吸附特性及吸附机理的研究[D].呼和浩特:内蒙古农业大学,2019.
[15]张文文,翁佩芳,吴祖芳.东方伊萨酵母和酿酒酵母混合发酵杨梅酒的发酵效率及风味特征分析[J].食品科学,2019,40(18):144-151.
[16]郑苗,邓泽元,任志青,等.东方伊萨酵母高密度培养的研究[J].中国食品学报,2016,16(4):96-103.
[17]POTTIER I,STEPHANIE G,VERNOUX J P,et al.Safety assessment of dairy microorganisms:Geotrichum candidum[J].Int J Food Microbiol,2008,126(3):327-332.
[18]BOURDICHON F,CASAREGOLA S,FARROKH C,et al.Food fermentations:microorganisms with technological beneficial use[J]. Int J Food Microbiol,2012,154(3):87-97.
[19]肖新云,刘又嘉,邓艳玲,等.汉逊德巴利酵母菌在胃酸、肠胆盐环境的耐受性研究[J].湖南农业科学,2016(6):6-8.
[20]谭周进,肖刘邓.伯顿毕赤酵母菌在酸性及胆盐环境的抗逆性研究[J].中国微生态学杂志,2016,28(6):655-658.