云南地处祖国西南边陲,境内崇山峻岭、水系纵横,低纬高原、南北落差显著,造就了一山分四季,十里不同天的独特立体气候和丰富多彩的民族文化传统[1-2],历来享有动植物王国、微生物资源宝库的美誉。云南各地均有腌制(渍)保存食物的传统,以民间小规模生产和家庭作坊生产为主,多属自然发酵食品[3-5],传统腌制食品地域、食材、气候类型、制作工艺的多样性,为研究资源微生物带来了诸多的可能性[6]。本研究选取云南多个地州传统腌制食品6个品种共11份样品进行可培养乳酸菌的分离鉴定及其发酵特性研究,以期从中获得乳酸发酵优势菌株,为资源微生物开发及食品工业发酵提供线索与参考。
1 材料与方法
1.1 材料与试剂
6个品种11个样品,采集自昭通、昆明、玉溪、西双版纳、楚雄、保山、德宏等7个地州用传统工艺腌制的酸味浓郁、发酵成熟的农家自制品[7-8],见表1。
葡萄糖、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)(均为分析纯):国药集团化学试剂有限公司;蛋白胨、牛肉膏(生化试剂):北京奥博星生物技术有限责任公司;酵母浸出汁(生化试剂):上海天鹅啤酒有限公司;吐温-80(化学纯)、柠檬酸三铵、乙酸钠、硫酸锰、硫酸镁、磷酸二氢钾、碳酸钙(均为分析纯):天津市风船化学试剂科技有限公司。
表1 样品的信息
Table 1 Information of samples

MRS液体培养基:葡萄糖20 g,蛋白胨10 g,牛肉膏10 g,酵母浸出汁5 g,吐温-80 1 mL,柠檬酸三铵2 g,乙酸钠1 g,硫酸锰0.25g,硫酸镁0.58g,磷酸二氢钾2g,蒸馏水1000mL,pH自然。
产酸菌株筛选平板:MRS液体培养基添加2%琼脂、2%碳酸钙、0.04%溴甲酚紫。
1.2 仪器与设备
ZHWY-2102恒温培养振荡器:上海智城分析仪器制造有限公司;XSP-10C双目显微镜:上海光学仪器厂;TGL-15B高速冷冻离心机:上海安亭科学仪器厂;Eppendorf 5331聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;GENE GENIUS凝胶成像系统:上海天能科技有限公司。
1.3 方法
1.3.1 菌株分离和鉴定
无菌条件下,称取10 g腌制样品加入90 mL无菌生理盐水中,匀浆后进行10倍梯度稀释,选取适宜的浓度梯度,用涂布法接种于MRS培养基进行微生物分离[9]。32 ℃条件下培养48~72 h[10],随机挑取菌落,多次平板划线获得纯培养,挑取单菌落接种于产酸菌株筛选平板中央,于32 ℃恒温培养,筛选出产生黄色透明水解圈的菌株[11]。
1.3.2 菌株细胞形态观察
将分离获得的菌株进行革兰氏染色并显微观察细胞形态,采集细胞图像[12]。
1.3.3 菌株生理生化试验
将分离获得的菌株进行明胶液化试验、产H2S试验、吲哚试验、过氧化氢酶试验、葡萄糖发酵产气、七叶苷水解、淀粉水解等生理生化试验[13-15]。
1.3.4 菌株分子生物学鉴定
将分离获得的菌株用MRS平板纯化培养3次,接种于30 mL MRS液体培养基,32 ℃培养24 h,取5 mL培养物于12 000 r/min离心10 min,收集菌体,用液氮冻融-十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)法提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)。采用通用引物27f:5'-AGAGTTTGATCCTGGCTCAG-3'、1495r:5'-CTACGGCTACCTTGTTACGA-3',以基因组DNA为模板进行16S rDNA扩增。PCR扩增体系:Taq MIX 12 μL,引物各1 μL,模板2 μL,加无酶水补足20 μL。PCR扩增程序:95 ℃预热5 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸2 min,经30个循环后72 ℃末端延伸10 min,4 ℃保存。PCR产物经琼脂糖凝胶电泳检测后送至北京梓熙生物科技有限公司进行纯化、测序,序列在美国国家生物技术信息中心(national center for biotechnology information,NCBI)基因库中进行同源性比对,用MEGA软件进行系统发育分析。
1.3.5 菌株发酵特性研究
将10株乳酸菌活化后,分别接种于装有200 mL MRS培养基的250 mL锥形瓶,每个菌株做3个平行,置32 ℃、160 r/min条件下振荡培养[16-18]。于12 h、24 h、48 h、72 h、96 h定时取样测定发酵液中的乳酸、残糖,作出产酸曲线、降糖曲线,对菌株发酵特性进行初步表征[19-20]。
1.3.6 乳酸的测定
用EDTA络合滴定法[9]对发酵液中乳酸钙进行滴定,按照以下公式进行乳酸换算:
式中:W乳酸表示乳酸的质量浓度,g/L;M乳酸表示乳酸的摩尔质量,90.08 g/mol;CEDTA表示EDTA标准溶液的物质的量浓度,mol/L;VEDTA表示滴定消耗EDTA标准溶液的体积,mL;V样表示量取发酵液样品的体积,mL。
2 结果与分析
2.1 菌株分离结果
用梯度稀释-平板培养法对自然发酵成熟的11个样品分别进行菌株分离,尽可能多的挑取菌落形态不同的细菌获得纯培养,进而用产酸菌株筛选培养基对纯培养菌株进行复筛,以平板上变色-溶钙圈出现的时间、大小为指标,获得优势产酸菌株10株。
2.2 菌株鉴定结果
经革兰氏染色等试验,10株产酸菌株菌落形态特征描述见表2。
表2 10株菌株的菌落形态
Table 2 Colony morphology of 10 strains
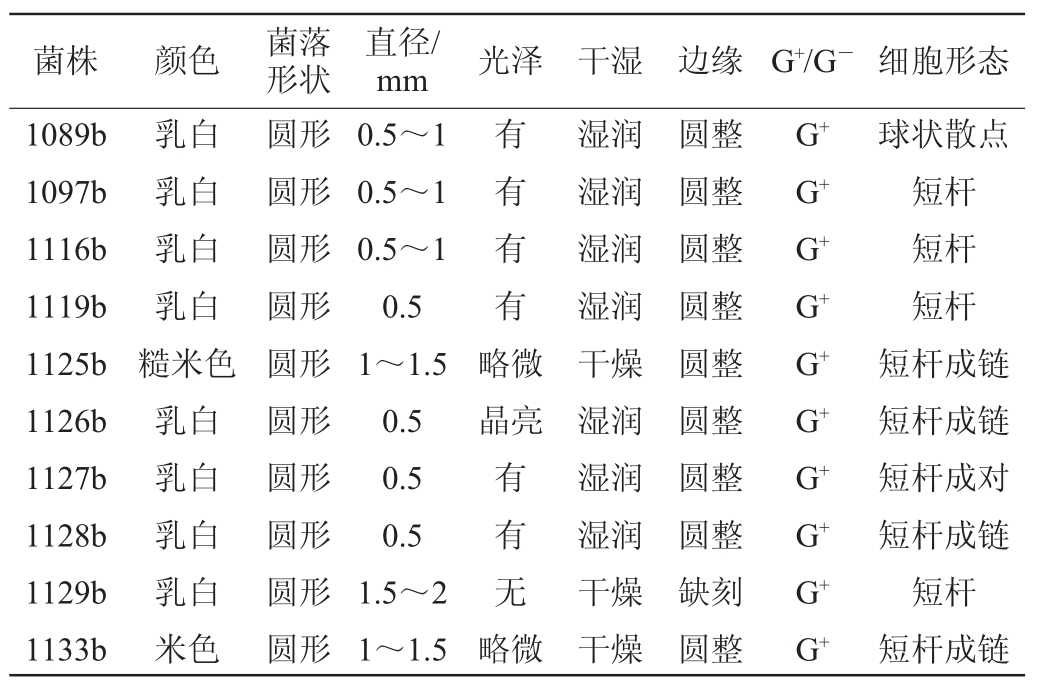
对分离菌株菌落形态特征与细胞形态观察,结合生理生化试验,参照《伯杰细菌鉴定手册》、《乳酸细菌分类鉴定及实验方法》,初步判断10株产酸菌均为乳酸菌,其中杆菌9株、球菌1株。生理生化试验结果见表3。
表3 10株菌株的生理生化特性
Table 3 Physiological and biochemical characteristics of 10 strains

注:“+”表示试验结果呈阳性;“-”表示试验结果呈阴性。
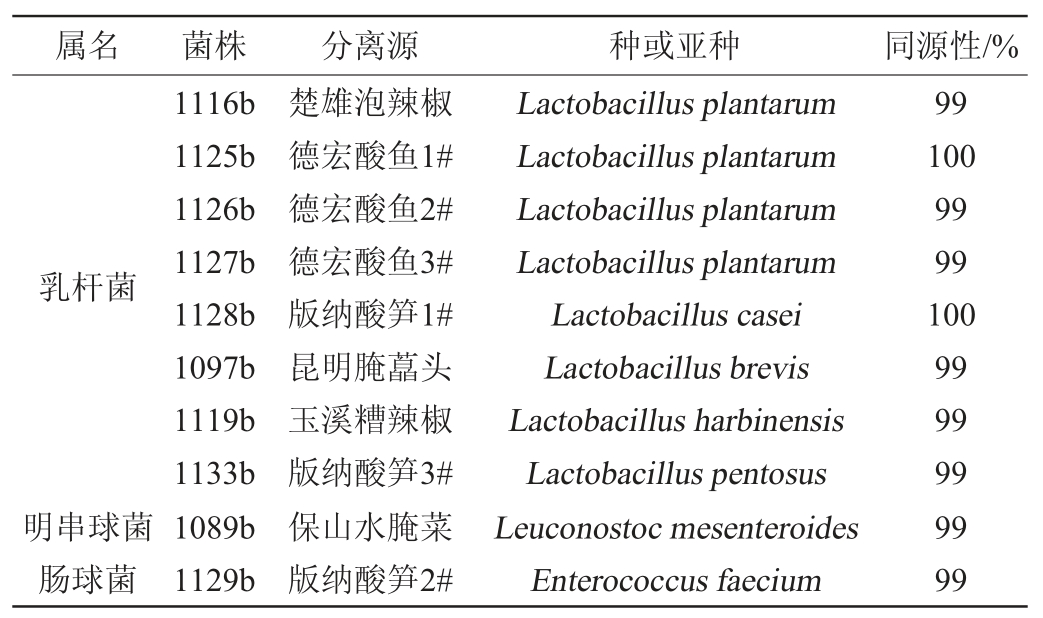
菌株16S rDNA序列PCR扩增产物经1%琼脂糖凝胶电泳检测,凝胶成像见图1。扩增产物送至北京梓熙生物科技有限公司进行测序,序列在NCBI GenBank库中进行同源性比对,用MEGA软件进行系统发育分析,见图2。将10株产酸菌株进行鉴定,结果见表4。由表4可知,10株菌分别属乳杆菌属(Lactobacillus)、明串球菌属(Leuconostoc)、肠球菌属(Enterococcus),其中4株为戊糖乳杆菌(Lactobacillus pentosus)。
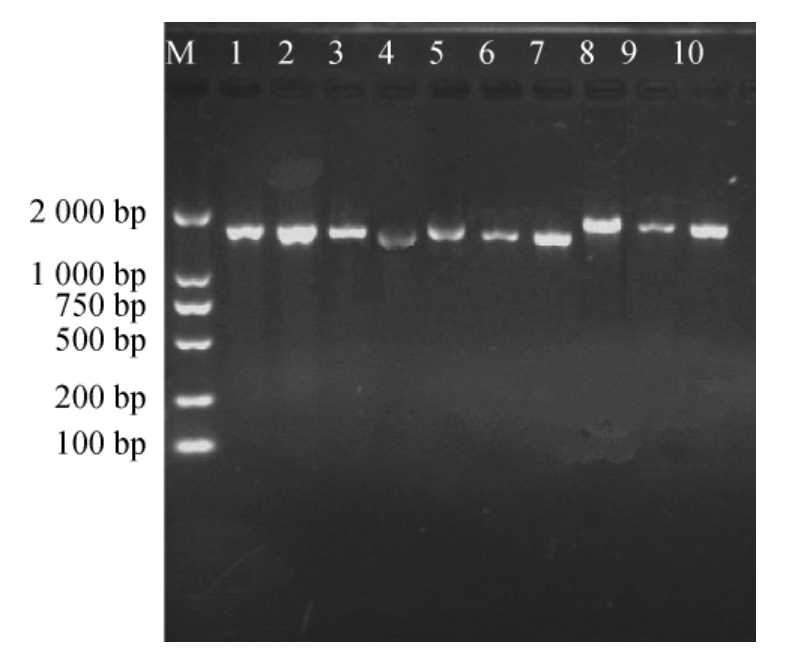
图1 16S rDNA PCR扩增产物检测结果
Fig.1 Detection results of 16S rDNA PCR product
1~10分别为菌株1089b、1097b、1116b、1119b、1125b、1126b、1127b、1128b、1129b、1133b的PCR扩增产物。
经鉴定,菌株1116b、1125b、1126b、1127b被鉴定为植物乳杆菌(Lactobacillus plantarum),菌株1128b被鉴定为干酪乳杆菌(Lactobacillus casei),菌株1097b被鉴定为短乳杆菌(Lactobacillus brevis),菌株1119b被鉴定为哈尔滨乳杆菌(Lactobacillus harbinensis),菌株1133b被鉴定为戊糖乳杆菌(Lactobacillus pentosus),菌株1089b被鉴定为肠系膜明串球菌(Leuconostoc mesenteroides),菌株1129b被鉴定为粪肠球菌(Enterococcus faecium)。
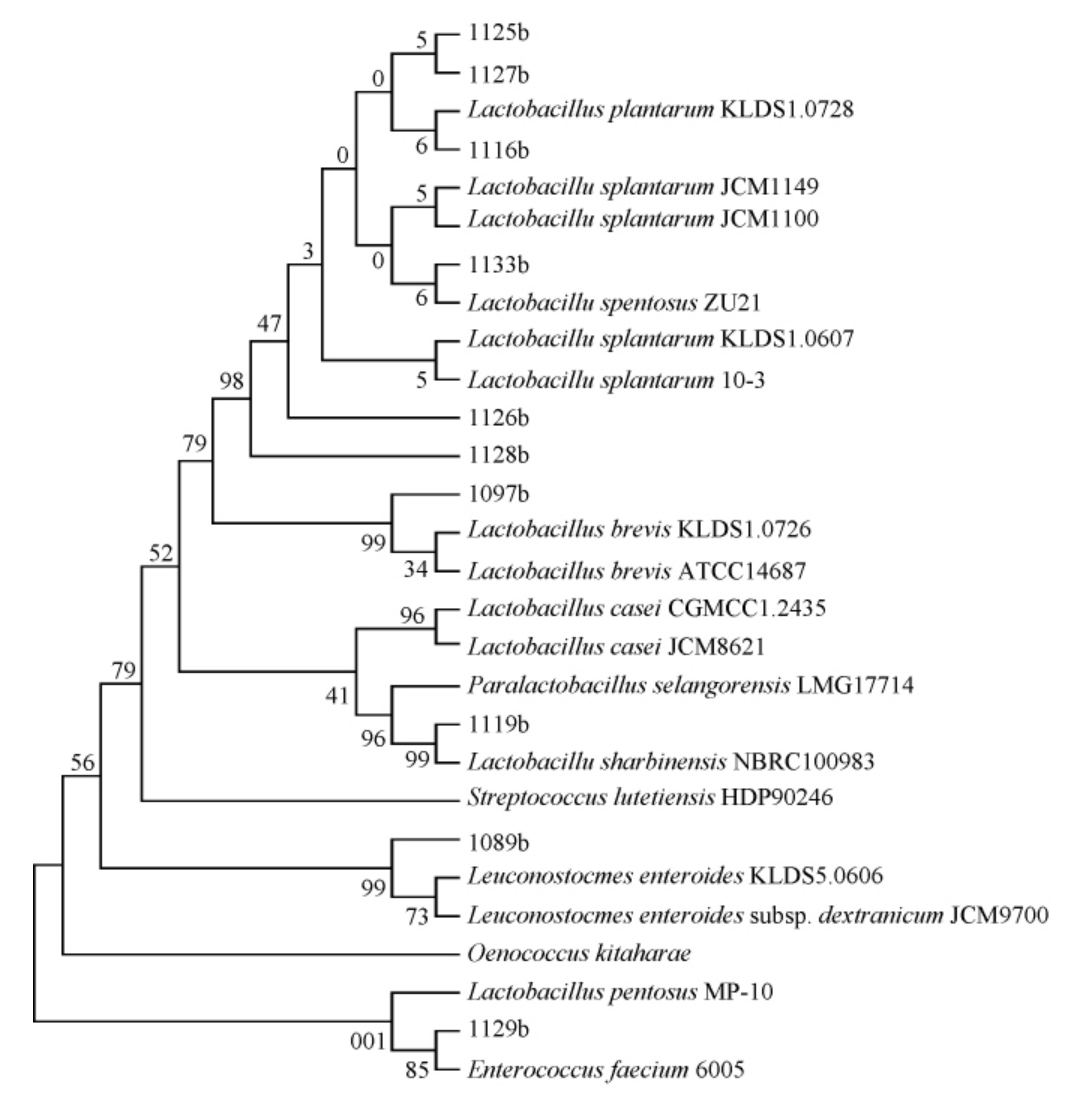
图2 基于16S rDNA序列10株菌株的系统发育树
Fig.2 Phylogenetic tree of 10 strains based on 16S rDNA sequences
表4 10株菌株的鉴定结果
Table 4 Identification results of 10 strains
2.3 菌株发酵特性研究
对纯培养的10株乳酸菌进行初步发酵实验,作出产酸曲线见图3、降糖曲线见图4。

图3 10株菌株发酵产乳酸曲线
Fig.3 Curve of lactic acid production by 10 strains
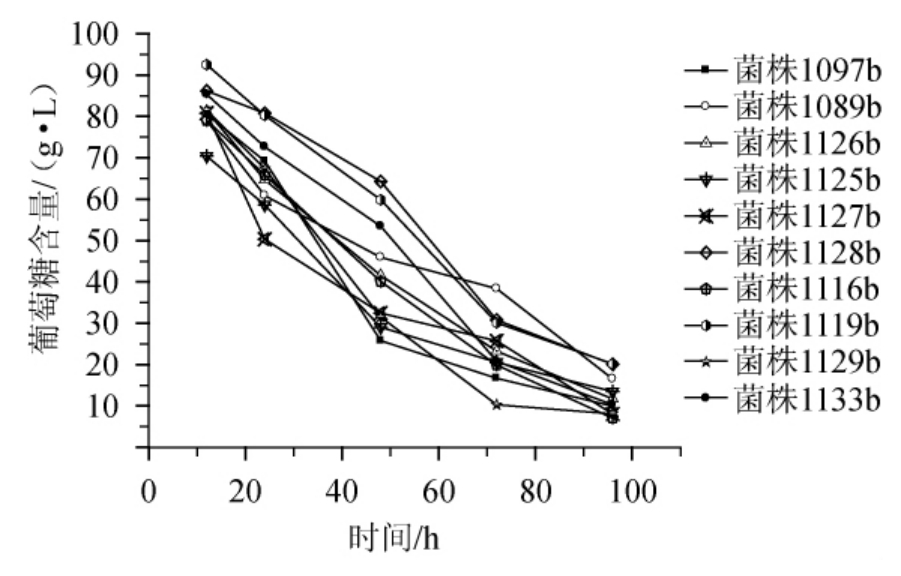
图4 10株菌株发酵降糖曲线
Fig.4 Curve of glucose consumption by 10 strains
由图3、图4可知,各菌株发酵特性差异较显著:菌株1119b发酵过程中产酸量一路平稳上升,但发酵终点乳酸产量较低、残糖量较高;菌株1126b在发酵开始至24 h时即出现产酸速率的最大值,随后增长趋势减缓,发酵终点乳酸产量较高、残糖量较低;菌株1097b、1129b发酵前期增长迅速,后期则表现出明显的减缓趋势,发酵终点乳酸产量处于中间水平;菌株1127b具有最高的发酵终点乳酸浓度及较低的残糖量,其发酵过程具有最高的转化率。
总体来看,10株菌均有较强的产酸能力,乳酸产量为40.84~71.82 g/L,残糖含量在7.04~20.04 g/L,乳酸转化率为40.84%~71.82%,其中8株表现出同型或混合型乳酸发酵,其余2株表现出异型或混合型乳酸发酵。
3 结论
本研究通过对云南传统腌制食品进行菌株分离、定向筛选,结合形态观察、生理生化实验、分子生物学鉴定等实验,分离得到3个属10个种乳酸菌,说明云南传统发酵食品中可培养乳酸菌多样性丰富,是潜在的乳酸菌来源。通过进一步的乳酸发酵实验,表明所分离菌株代谢类型多样,且以具有优良产酸性能的同型发酵为主,部分菌株表现出潜在的乳酸发酵应用价值,为资源微生物的开发利用提供了新的线索。
[1]张海燕.云南传统发酵食品中细菌群落结构、元转录组及腐败菌研究[D].昆明:昆明理工大学,2016.
[2]曹佳璐.传统四川泡菜盐水乳酸菌多样性的研究[D].北京:中国农业大学,2017.
[3]杜刚,刘赟,詹梦涛,等.乳酸菌发酵甘蔗糖蜜产乳酸的培养条件优化[J].化工进展,2018,37(10):4006-4011.
[4]张蓓蓓,王柱,王宪斌,等.四川地区泡菜微生物的多样性分析[J].食品与发酵科技,2016,52(1):1-10.
[5]凌代文,冬秀珠.乳酸细菌分类鉴定及试验方法[M].北京:中国轻工业出版社,1999:43-46.
[6]YIN P,NISHINA N,KOSAKAI Y,et al.Enhanced production of L(+)-lactic acid from corn starch in a culture of Rhizopus oryzae using an air-lift Bioreactor[J].J Ferment Bioeng,1997,84(3):249-253.
[7]MOBLEY D P.Plastics from Microbes[M].New York:Hanser Gardner Publications Inc,1994.
[8]张刚.乳酸细菌——基础、技术和应用[M].北京:化学工业出版社,2006:12-17.
[9]金超.蔗糖发酵生产L-乳酸的研究[D].南宁:广西大学,2006.
[10]叶陵,李勇,王蓉蓉,等.我国传统发酵蔬菜中乳酸菌多样性的研究进展[J].食品科学,2018,39(15):296-301.
[11]白琴琴,程雅韵,金清.发酵肉制品中乳酸菌多样性分析[J].食品工业,2014,35(6):186-188.
[12]包秋华,王俊国,刘文俊,等.传统发酵乳制品曲拉中乳酸菌多样性分析[J].中国乳品工业,2016,44(7):12-14.
[13]王昱敬,李伟叶,张潇俊,等.传统乳扇中乳酸菌的多样性研究[J].食品科技,2017,42(1):12-17.
[14]樊哲新,李宝坤,李开雄,等.传统分离培养结合DGGE 技术研究新疆传统发酵酸驼乳中乳酸菌的多样性[J].中国食品学报,2015,15(4):208-215.
[15]尚雪娇,折米娜,邓长阳,等.恩施市3 种泡辣椒样品中细菌多样性研究[J].中国酿造,2019,38(2):53-57.
[16]韩俊燕,赵国忠,赵建新,等.发酵辣椒细菌多样性的16S rRNA 测序分析[J].中国食品学报,2018,18(5):246-251.
[17]谷静思,侯娟,何国庆.高通量测序分析臭豆腐中的细菌菌种多样性[J].中国食品学报,2019,19(3):250-254.
[18]张哲,刘小鸣,串陈卫.内蒙古传统发酵驼乳中乳酸菌和酵母菌的分离鉴定及其生物多样性分析[J].中国食品学报,2018,18(7):230-237.
[19]赵飞燕,刘亚华,李枝,等.锡林郭勒地区鲜马奶中细菌多样性分析[J].微生物学通报,2019,46(12):3295-3304.
[20]刘文俊,多拉娜,刘亚华,等.基于纯培养方法和PacBio 三代测序技术研究蒙古国传统酸马奶中乳酸菌多样性[J].中国食品学报,2019,19(4):27-35.