全世界约有50%的人感染幽门螺杆菌(Helicobacter pylori),我国感染率达40%~90%[1]。幽门螺杆菌已被确定与慢性胃炎、消化性溃疡、胃癌及黏膜相关淋巴样组织淋巴瘤等疾病的发生密切相关[2]。目前临床上治疗幽门螺杆菌感染常用的方法主要包括“三联”、“四联”疗法,但用药量较多,导致患者体内细菌耐药性增加[3]。并且不合理应用抗生素可引起各种胃肠功能紊乱及胃肠道菌群失调等不良反应[4]。因此临床要选择一种更加安全有效的根除幽门螺杆菌的方法。
世界卫生组织(world health organization,WHO)与联合国粮食及农业组织(food and agriculture organization of the united nations,FAO)指出,含益生菌的制剂对健康有益,近年来益生菌制剂已作为重要的辅助治疗药物或主要治疗药物应用于清除幽门螺杆菌感染[5]。大多数可行的临床研究显示,益生菌对于特殊的病症有明显作用,如急性胃炎的治疗,过敏性肠炎以及幽门螺杆菌等[6]。SAHAGUNFLORES J E等[7]将感染幽门螺杆菌的患者分为实验组和对照组进行实验,对照组采用克拉霉素、阿莫西林、奥美拉唑三联疗法,实验组采用干酪乳杆菌(Lactobacillus casei)加三联疗法。通过8周的呼吸试验,确定实验组幽门螺杆菌的根除率达94%,而对照组的幽门螺杆菌根除率仅达到76%。CATS A等[8]研究表明,服用干酪乳杆菌乳制品的幽门螺杆菌阳性患者体内幽门螺杆菌数量减少,说明干酪乳杆菌可以抑制幽门螺杆菌感染。因此探索利用乳酸菌治疗幽门螺杆菌感染具有重要的意义。
在实验室分离得到的耐酸、耐胆盐的干酪乳杆菌基础上,进一步探究干酪乳杆菌对幽门螺杆菌的抑制作用及体外抑菌机制,为后续动物模型的研究和抗胃癌的益生菌制剂的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
干酪乳杆菌(Lactobacillus casei)(美国国家生物信息中心(national center for biotechnology information,NCBI)登录号MN400655):从新鲜玉米秸秆中分离得到,保存于中国科学院近代物理研究所微生物实验室,其中菌株JY300-8、JY160-15以及JY300-10是经12C6+辐照诱变筛选所得;菌株JY是未经辐照的原始菌株;幽门螺杆菌(Helicobecter pylori)SS1:兰州大学第二附属医院馈赠。
MRS培养基:蛋白胨10 g、牛肉膏10 g、酵母浸膏5 g、葡萄糖20 g、K2HPO4 2 g、柠檬酸钠2 g、MgSO4·7H2O 0.2 g、乙酸钠5.0 g、MnSO4·4H2O 0.2 g,吐温80 1mL,1 000 mL蒸馏水。121 ℃灭菌20 min。
改良MRS培养基:胰蛋白胨10 g、牛肉膏10 g、酵母浸膏5 g、葡萄糖20 g、K2HPO42 g、柠檬酸钠2 g、MgSO4·7H2O 0.2 g、MnSO4·4H2O 0.2 g,1 000 mL蒸馏水。121 ℃灭菌20 min[9]。
磷酸缓冲盐溶液(phosphate buffer saline,PBS)、哥伦比亚血平板、脑心浸液(brain heart infusion,BHI)培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
2.5 L微需氧产气包、2.5 L圆底立式厌氧培养袋:青岛高科技工业园海博生物技术有限公司;Epoch微孔板分光光度计:时代联想生物科技有限公司;DHP-9082恒温培养箱:上海一恒科技有限公司。
1.3 方法
1.3.1 干酪乳杆菌自凝聚性能测定
干酪乳杆菌于MRS液体培养基中37 ℃培养24 h,发酵液8 000 r/min离心5 min收集菌体沉淀,磷酸缓冲盐溶液(phosphate buffer saline,PBS)调整OD600nm至0.50±0.05左右。37 ℃静置培养,分别测定第0 h、6 h、12 h、18 h、24 h上层溶液在波长600 nm处的吸光度值,并记录。按照下式计算细菌的自凝聚率[10-11]:
式中:A0为0 h的吸光度值;At为t h的吸光度值。
1.3.2 干酪乳杆菌疏水性能测定
干酪乳杆菌于MRS液体培养基中37 ℃培养24 h,发酵液8 000 r/min离心5 min收集菌体沉淀,PBS洗涤两次,用PBS调整菌液浓度至108 CFU/mL。取2 mL调好浓度的菌悬液与2 mL二甲苯混匀,静置30 min。取下层水相,在波长600 nm处测定吸光度值,并记录。按下式计算菌株疏水性[12]:
式中:A0为与二甲苯混匀前水相在波长600 nm处的吸光度值;At为与二甲苯混匀静置30 min后水相在波长600 nm处的吸光度值。
1.3.3 MRS培养液和改良MRS培养液培养的干酪乳杆菌对幽门螺杆菌的抑制
调整幽门螺杆菌浓度为108 CFU/mL,每板200 μL。观察无水迹后放入牛津杯,每板3个。为确定干酪乳杆菌发酵过程中不同成分对幽门螺杆菌生长的抑制情况,分别将干酪乳杆菌发酵液、发酵上清液、干酪乳杆菌菌悬液、PBS、MRS培养液、调节到发酵液pH的MRS培养液(改良MRS培养液)、甲硝唑、二甲基亚砜(dimethyl sulfoxide,DMSO)依次加入牛津杯,每杯200 μL。其中,甲硝唑为阳性对照,MRS培养液(改良MRS培养液)为阴性对照,PBS和DMSO为空白对照。在37 ℃、微氧条件下培养72 h取出并记录抑菌圈直径[13-14]。
1.3.4 干酪乳杆菌与幽门螺杆菌的交互凝聚能力测定
分别吸取2 mL干酪乳杆菌菌悬液与幽门螺杆菌菌悬液于试管中,涡旋振荡混匀,分别在0 h、6 h、12 h、18 h、24 h测定其在波长600 nm处的吸光度值,按照下式计算细菌的共凝聚率[15]:
式中:A0为0 h混合液的吸光度值,Amix为混合液各个时间点的吸光度值。
1.3.5 干酪乳杆菌抑制幽门螺杆菌尿素酶活性测定
幽门螺杆菌在CAB平板37 ℃微氧培养72 h,加入PBS冲洗菌体,8 000 r/min离心5 min,收集菌体沉淀,用BHI调节幽门螺杆菌浓度至108 CFU/mL。干酪乳杆菌于改良MRS液体培养基中培养所得发酵液在8 000 r/min,5 min条件下离心收集菌体沉淀,PBS缓冲液洗两次,用改良MRS培养基调节其浓度至108 CFU/mL。在96孔板中,取40 μL上述制备好的幽门螺杆菌和10 μL上述制备好的干酪乳杆菌菌悬液混匀,放入微需氧环境中共培养48 h。然后取出加入150 μL尿素-酚红溶液,振荡后于波长550 nm处测其吸光度值。对照是BHI代替上清液测定[14]。
1.3.6 数据处理
实验数据采用SPSS 21.0进行统计分析,并用Origin 8.0进行图表处理,结果用平均值±标准误差表示,以P<0.05表示差异显著。
2 结果与分析
2.1 菌株自凝聚性能
研究表明,具有较高自凝聚能力的菌株的粘附性也很高,而且自凝聚作用可以使益生菌形成空间位阻阻碍病原菌在肠道上的定植[14]。4株干酪乳杆菌自凝聚性能的实验结果如图1所示。4株干酪乳杆菌的自凝聚都随时间的延长而增大,其中菌株JY300-8的自凝聚在24 h时达到71.7%,比菌株JY、JY160-15、JY300-10分别高19.7%、28.8%、29.6%(P<0.05)。细菌自凝聚能力可分为低(16%~35%)、中(35%~50%)、高等(50%以上)[11]。由此可知,菌株JY300-8和JY的自凝聚能力处于较高水平。
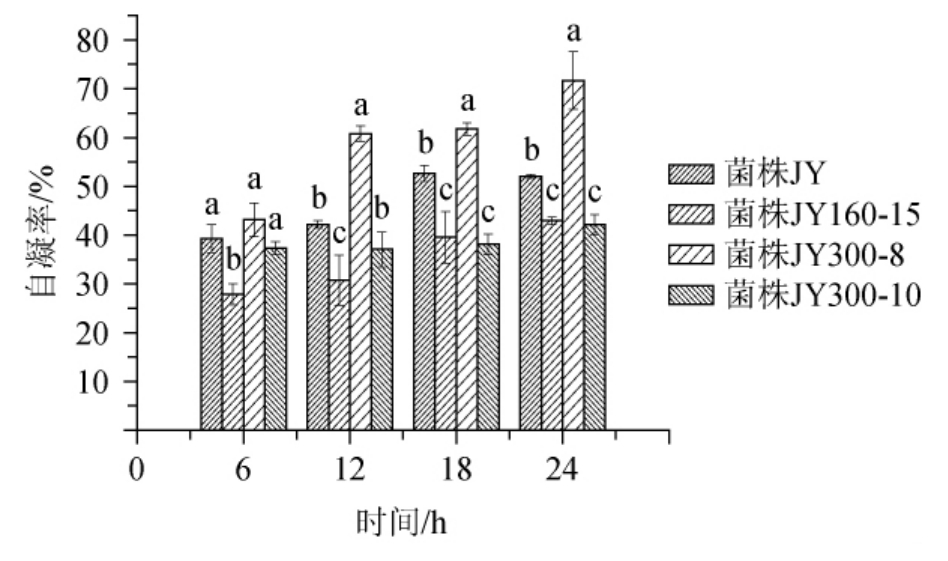
图1 4株干酪乳杆菌菌株自凝聚情况
Fig.1 Self-agglutination of four strains of Lactobacillus casei
不同字母表示结果差异显著(P<0.05)。下同。
2.2 菌株疏水性能
疏水性较高的乳酸菌在肠道中也呈现较高的粘附性,即菌体表面疏水性与其对肠道上皮细胞的粘附力成正比[10],40%的疏水性是对益生菌菌株基本要求的最小值[12]。4株干酪乳杆菌的表面疏水性如表1所示。经统计分析,菌株JY300-8的疏水性达到72.3%,分别比JY、JY160-15、JY300-10高4.1%、8.0%、7.5%(P<0.05)。
表1 4株干酪乳杆菌菌株的疏水性情况
Table 1 Hydrophobicity of four strains of Lactobacillus casei

2.3 MRS培养液培养的干酪乳杆菌各成分对幽门螺杆菌生长抑制的测定
益生菌粘附能力的强弱是其发挥益生作用的前提条件,因此确定细菌粘附力的初筛指标,对于益生菌的研究意义重大[16]。粘附定植是乳酸菌在肠道中发挥生理功能的前提和基础[17],乳酸菌的非特异性粘附过程跟复杂的物理化学作用密切相关,大量研究表明,乳酸菌的表面性质对乳酸菌的粘附具有重要作用。尤其是与其表面电荷、疏水作用、自聚合能力等具有密切联系[18]。
通过干酪乳杆菌自凝聚和疏水性实验,可知菌株JY300-8和JY的自凝聚率和疏水性较大,说明这两株菌的粘附性较大,可以更好地用于后续实验发挥作用,因此选用这两株菌进行抑制幽门螺杆菌的实验。
利用牛津杯法进行抑菌实验,测定抑菌圈直径,初步探究菌株JY300-8和JY对幽门螺杆菌的抑制作用。两株干酪乳杆菌对幽门螺杆菌的抑菌作用如表2所示。
表2 MRS培养基培养的干酪乳杆菌抑制幽门螺杆菌效果
Table 2 Inhibitory effect of Lactobacillus casei cultured by MRS medium on Helicobacter pylori
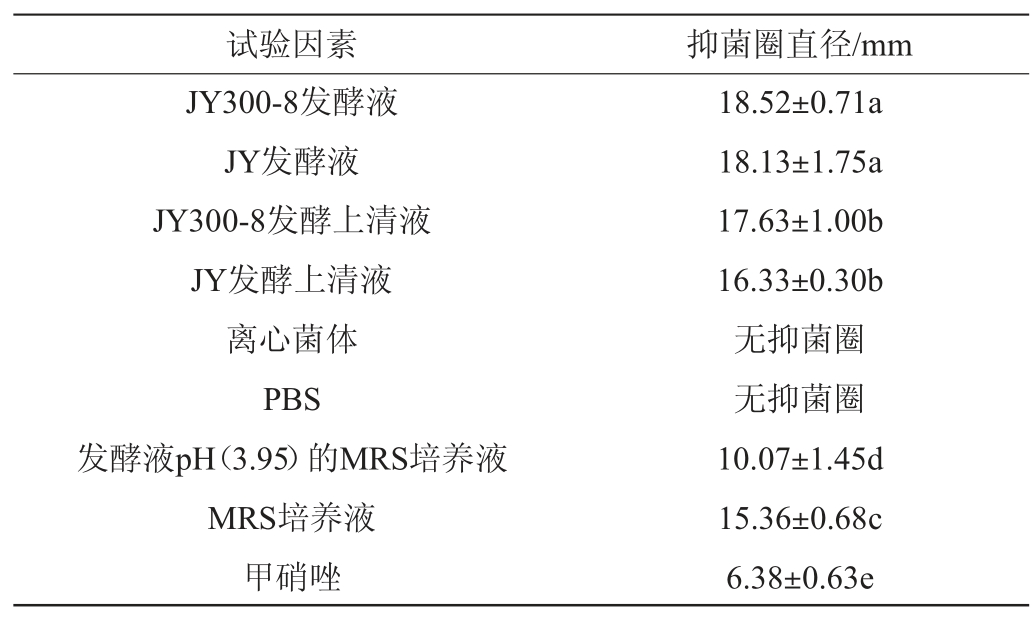
由表2可知,干酪乳杆菌JY300-8发酵液的抑菌圈直径最大,说明其抑菌作用最强;新鲜MRS培养基也可以抑制幽门螺杆菌生长,说明培养基自身对幽门螺杆菌有很强的抑制作用,这可能会使实验结果出现假阳性。因此,在保证干酪乳杆菌能够良好生长的前提下,要对培养基进行改良,然后进行抑菌实验以进一步证明干酪乳杆菌有拮抗幽门螺杆菌生长的作用。
2.4 改良MRS培养基培养的干酪乳杆菌对幽门螺杆菌生长的抑制
通过牛津杯法抑菌实验,初步探究菌株JY300-8和JY对幽门螺杆菌的抑制作用,结果见表3。
表3 改良MRS培养基培养的干酪乳杆菌抑制幽门螺杆菌效果
Table 3 Inhibitory effect of Lactobacillus casei cultured by modified MRS medium on Helicobacter pylori
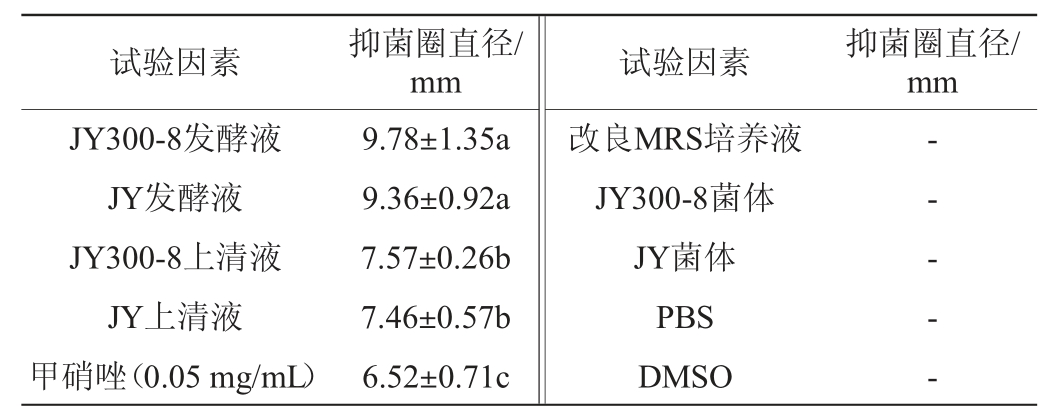
注:“-”表示无抑菌圈。
从表3可以看出,菌株JY300-8的发酵液及上清液抑菌直径分别为(9.78±1.35)mm、(7.57±0.26)mm;菌株JY的发酵液及上清液的抑菌直径分别为(9.36±0.92)mm、(7.46±0.57)mm;培养干酪乳杆菌的改良MRS培养液不产生抑菌圈,进一步说明了两株干酪乳杆菌对幽门螺杆菌的生长都有抑制作用。甲硝唑(0.05mg/mL)的抑菌圈直径为6.52 mm,因此干酪乳杆菌的抑菌能力要稍大于0.05 mg/mL甲硝唑的抑菌能力。该抑菌实验表明两种干酪乳杆菌菌体没有抑菌作用,但是二者发酵液与上清液的抑菌圈直径有显著性差异(P<0.05),说明发酵液比上清液表现出更强的抑制作用,这可能与菌体的生长代谢有关。
2.5 干酪乳杆菌与幽门螺杆菌共凝集性能
乳杆菌可以通过与致病菌的共凝集作用,减少致病菌在肠道中的数量,改变肠道中的菌群结构,改善肠道微环境[19]。干酪乳杆菌和幽门螺杆菌的交互凝集能力如图2所示。由图2可知,它们的交互凝集率随着时间的延长而增加,在24 h时菌株JY300-8的共凝集率最高,为64.4%,比菌株JY共凝集率高出5.3%。
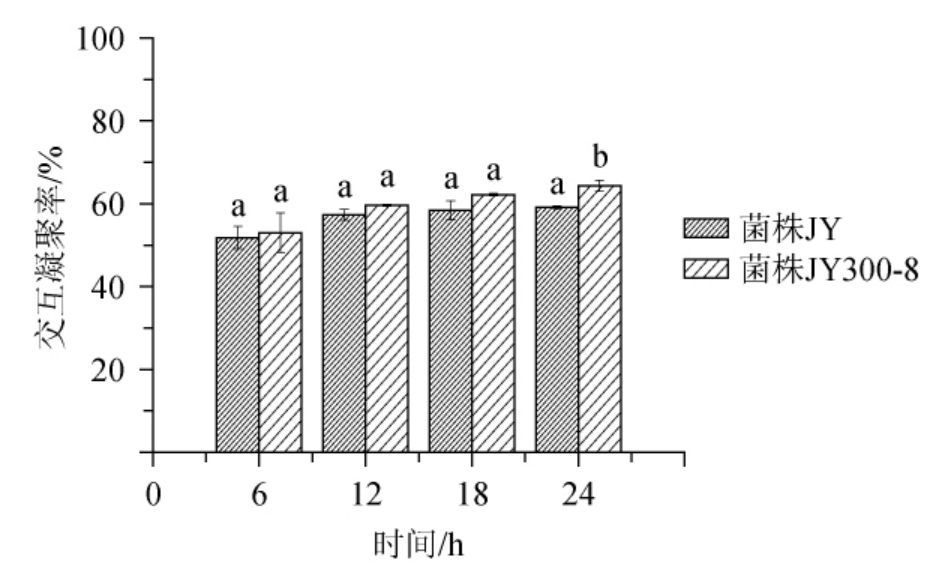
图2 干酪乳杆菌菌株共凝集情况
Fig.2 Co-aggregation of Lactobacillus casei strains
2.6 干酪乳杆菌抑制尿素酶活性测定
幽门螺杆菌菌体表面有尿素酶,能分解宿主体内尿素产生氨,中和胃酸,保护菌体菌体免受伤害。益生菌通过有机酸来抑制幽门螺杆菌的尿素酶活性来抑制幽门螺杆菌[20]。
尿素酶能够分解尿素提高溶液pH,使指示溶液变色,其活性可以由测定溶液在波长550 nm 处的吸光度值(OD550nm)值来反映[13]。干酪乳杆菌抑制尿素酶活性测定结果如表4所示。由表4可知,经过菌株JY和JY300-8处理后的幽门螺杆菌的OD550nm值分别为0.42±0.039、0.41±0.051,均显著低于对照组值1.08±0.439,说明这两株菌均可有效抑制幽门螺杆菌的尿素酶活性,而培养基没有此作用。菌株JY和JY300-8对幽门螺杆菌的尿素酶活性的抑制率达到61.1%,62.3%说明这两株菌株均可抑制尿素酶酶活性。
表4 干酪乳杆菌抑制幽门螺杆菌的尿素酶活性情况
Table 4 Inhibitory effect of Lactobacillus casei on urease activity of Helicobacter pylori
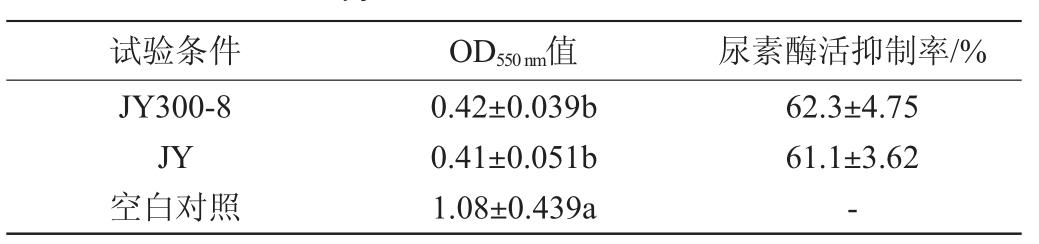
注:同列数据不同字母表示差异显著(P<0.05)。“-”表示无抑制尿素酶活性。
3 结论
本研究利用干酪乳杆菌的自凝集性、疏水性、对幽门螺杆菌的抑制性实验,从4株耐酸耐胆盐的干酪乳杆菌中筛选出具有潜在拮抗幽门螺杆菌作用的菌株JY300-8。实验结果表明,菌株JY具有抑制幽门螺杆菌SS1和降低尿素酶活性的能力,菌株JY300-8除了上述作用外,还有较强的疏水性、自凝集性和共凝集性。综上所述,菌株JY300-8具有优良的益生潜能,对胃癌的生物致病菌具有良好的抑制效果,可用于后续动物模型的研究和抗胃癌的益生菌制剂的开发。
[1]郑晓文,李强,王玉平,等.幽门螺杆菌治疗的新进展[J].医学综述,2016,22(1):1316-1318,1322.
[2]刘慧.益生菌对根除幽门螺杆菌临床疗效的研究进展[J].今日药学,2015,25(1):66-69.
[3]刘秋芳,陈作波,洪可仲.益生菌联合四联疗法治疗难治性幽门螺杆菌感染的临床效果[J].中国当代医药,2019,26(18):87-89.
[4]陈云华,汪春莲,谢云.幽门螺杆菌致病机制及益生菌防治作用的研究进展[J].世界华人消化杂志,2007(25):2690-2697.
[5]龚芳红,贺松,张德纯,等.国内益生菌制剂清除幽门螺杆菌感染临床疗效的Meta 分析[J].中国微生态学杂志,2009,21(9):817-821.
[6]刘齐,孙美玲,王鲁峰,等.益生菌的功能活性及其分子机理探究的研究进展[J].中国酿造,2014,33(1):14-19.
[7]![]() J E,LOPEZ-PENA L S,CRUZ-RAMIREZ J J,et al.Eradication of Helicobacter pylori:triple treatment scheme plus Lactobacillus vs.triple treatment alone[J].Cirugia Y Cirujanos,2007,75(5):333-663.
J E,LOPEZ-PENA L S,CRUZ-RAMIREZ J J,et al.Eradication of Helicobacter pylori:triple treatment scheme plus Lactobacillus vs.triple treatment alone[J].Cirugia Y Cirujanos,2007,75(5):333-663.
[8]CATS A,KUIPERS E J,BOSSCHAERT M A R,et al.Effect of frequent consumption of a Lactobacillus casei-containing milk drink in Helicobacter pylori-colonized subjects[J].Aliment Pharm Therap,2003,17(3):429-435.
[9]苗君莅,辛羚,吴正钧,等.改良MRS 对消除培养基自身抑制幽门螺杆菌生长的研究[J].乳业科学与技术,2005(4):154-156.
[10]靳彩娟.高粘附性乳酸菌的筛选、鉴定及其表面疏水特性研究[D].扬州:扬州大学,2013.
[11]熊世进,高文功,杨菲菲,等.六株人源益生菌的表面性质与黏附性能研究[J].食品工业科技,2019,40(9):126-132.
[12]赵雪婷,彭珍,胡敏,等.三株人源干酪乳杆菌的益生特性[J].食品与发酵工业,2019,45(12):15-19,34.
[13]郭怡麟.两株潜在益生菌拮抗幽门螺杆菌的作用机制研究及其乳品工艺初探[D].南昌:南昌大学,2018.
[14]陈晓华.拮抗幽门螺杆菌益生菌的筛选及其干预机制的研究[D].无锡:江南大学,2011.
[15]刘勇.植物乳杆菌益生特性及产共轭亚油酸能力研究[D].呼和浩特:内蒙古农业大学,2010.
[16]龚虹,王海霞,马征途,等.乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J].中国微生态学杂志,2016,28(9):1026-1028,1033.
[17]张明辉,王光强,夏永军,等.植物乳杆菌粘附性与其表面特征关系的探究[J].工业微生物,2017,47(1):37-42.
[18]佘银,罗芳,高婉茹,等.乳酸菌粘附特性的研究新进展[J].食品研究与开发,2018,39(4):218-224.
[19]COLLADO M C,MERILUOTO J,SALMINEN S.Adhesion and aggregation properties of probiotic and pathogen strains[J].Eur Food Res Technol,2008,226(5):1065-1073.
[20]喻钢.益生菌拮抗幽门螺杆菌的研究[D].南昌:南昌大学,2007.