饮酒的传统古来有之,有报告称全世界最早的酒精饮品诞生于中国[1],研究表明少量饮酒能降低死亡率[2],但是饮酒过度会损害健康[3]。中国的酒精性肝疾病患者正在增多[4],健康饮酒的基础教育成为当务之急。饮酒导致肝损伤的背景是氧化应激上升,其中长期酗酒和过量狂饮都存在有害性,为此人们正在进行多方面的研究[5-7]。研究结果显示酒精在通过肝脏代谢的过程中会产生活性氧类(reactive oxygen species,ROS)[8],过度的活性氧会使肝脏中的抗氧化物质枯竭,导致氧化应激并由此导致细胞损伤。酒精性肝损伤在人体上的症状有:肝脏脂肪蓄积、肝脏纤维化、肝硬化,甚至肝癌。酒精在人体内主要通过乙醇脱氢酶(alcohol dehydrogenase,ADH)和乙醛脱氢酶(aldehyde dehydrogenase,ALDH)来分解,有报告称ADH和ALDH可减轻氧化应激[9],已有研究表明,通过摄取醋酸菌可以减轻摄取乙醇对肝脏造成的损伤[9]。
醋是自古以来餐桌上常用的调味料,除了具有调味的功能之外,其还具有抑制血压升高和促进钙吸收等保健功能,还有报告称一部分的醋具有醒酒[10]和减轻酒精性肝损伤的功能[11-12]。醋是通过对酒精进行醋酸发酵制得的,其代谢是通过ADH和ALDH途径进行的。醋的制造工艺与人体酒精代谢的类似性,或许在醋的制造过程中产生的具有ADH和ALDH活性的组分,能够促进酒精分解,减轻酒精性肝损伤。前期研究已经证明摄入醋酸菌可减轻因使用乙醇诱发的血清谷草转氨酶、谷丙转氨酶升高和脂肪在小鼠肝脏中的蓄积[13]。本研究以“醋酸菌粉末”(acetic acid bacterial powder)为研究对象,建立动物实验模型,评估其对急性摄入酒精引起的肝脂质蓄积和氧化损伤的影响,为开发新型减缓酒精性肝损伤的营养辅助食品提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品信息
醋酸菌粉末:由丘比株式会社提供,-20 ℃冷冻保存。
1.1.2 实验动物与饲料
选用北京维通利华实验动物技术有限公司(SCXK(京)2016-0006)提供的无特定病体(specific pathogen free,SPF)级雄性美国癌症研究所(institule of cancer research,ICR)小鼠,共25只,体质量28~30 g,适应环境5 d后,进行实验。按体质量进行随机分组,每组5只。所有动物实验均以实验动物饲养和储存以及疼痛缓解标准为基础,经CAIQtest动物研究委员会审核批准。
饲养条件:温度:20~26 ℃;相对湿度:40%~70%;亮暗循环:明暗交替时间12 h/12 h,早8点到晚8点。
饲料:斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2015-0015)。
1.1.3 试剂
铁氰化钾(纯度>99.0%)、乙醇(纯度>99.5%)、柠檬酸(纯度>99.0%)、磷酸氢二钠(纯度>99.0%)、硫酸铁(III)n水合物(60.0%~80.0%)、磷酸:日本关东化学株式会社;十二烷基硫酸钠(纯度>95.0%):日本FUJIFILM公司;麦基尔文缓冲液(pH=5)由柠檬酸和磷酸氢二钠制备;Dupanol溶液由硫酸铁(III)n水合物、十二烷基硫酸钠和磷酸配制。
丙二醛(malondialdehyde,MDA)测定试剂盒、还原型谷胱甘肽(glutathione,GSH)测定试剂盒:南京建成科技有限公司;甘油三酸酯(triglyceride,TG)测定试剂盒:中生北控生物科技股份有限公司。
1.2 仪器与设备
SynergyHIM多功能酶标仪:美国伯腾仪器有限公司(BioTek)、TBA120FR全自动生化分析仪:日本东芝有限公司;S10型手提式高速分散器:宁波新芝生物科技股份有限公司)、CM1850冰冻切片机:德国Leica有限公司。
1.3 方法
1.3.1 动物实验方法
根据现有报道[14]改良了乙醇的给予方法。连续5 d的适应期结束后,试验前1d,动物称质量,实施预饲养后将其分为对照组,乙醇组,样品7.5 mg/kg组,15.0 mg/kg组,45.0 mg/kg组,共计5组。阴性对照组灌胃给予植物油(0.01mL/10 g);乙醇组灌胃给予植物油(0.01 mL/10 g)和体积分数50%乙醇(0.12 mL/10 g);乙醇+醋酸菌粉末组灌胃给予体积分数50%乙醇(0.12 mL/10 g)和三种不同剂量的受试样品。禁食不禁水16 h,称质量后处死动物,称体质量。
1.3.2 生化学分析
取0.5 g肝脏制成10%肝匀浆,取0.1 mL肝匀浆液参照试剂盒说明书测定MDA含量,10%肝匀浆液,3 000 r/min离心10 min,取上清液0.5 mL,参照试剂盒说明书测定GSH的含量,取上清液0.5 mL使用全自动生化仪测定TG含量。
1.3.3 组织学分析
从肝左叶中部做横切面取材,冰冻切片,油红O染色[15],从肝脏的一端视野开始记录细胞的病理变化,用40倍物镜连续观察整个组织切片。
1.3.4 乙醇脱氢酶(ADH)、乙醛脱氢酶(ALDH)酶活性测定
根据现有报道[16]改良了酶活性测定方法。用微量吸管快速添加100 μL 醋酸菌粉末溶液,将空白样换成纯水100 μL。用触摸式磁力搅拌器轻轻搅拌,放在微量恒温器中(35 ℃)。5 min后,用微量吸管快速加入100 μL 0.1 mol/L铁氰化钾溶液。用触摸式磁力搅拌器轻轻搅拌,放回微量恒温器(35 ℃)。按一定间隔(10~20 s左右)进行添加。20 min后,用微量吸管快速加500 μL Dupanol溶液。用触摸式磁力搅拌器轻轻搅拌,放在常温下。所有样品添加Dupanol溶液后,用微量吸管吸取反应液400μL,添加在准备好的1 000μL纯水中。用触摸式磁力搅拌器轻轻搅拌,放在常温下待测定。添加Dupanol 20 min后,用分光光度计测定波长660 nm下的吸光度值。以铁氰化钾含量(x)为横坐标,OD660nm值(y)为纵坐标绘制铁氰化钾标准曲线。
1.3.5 酶活性值计算
在37 ℃条件下,在1 min内将1 μmol乙醇氧化所需要的酶量为1 U。将0.1 mL 1 mg/mL的醋酸菌粉末溶液稀释D倍,反应20 min后进行活性测定,醋酸菌粉末底物为乙醛时,比酶活计算公式如下:
比酶活(U/mg干细胞)=A/d×D/20
式中:A为波长660 nm处的吸光度值,d为铁氰化钾标准曲线斜率,D为稀释倍数。
底物为乙醇时,会通过ADH分节生成乙醛,因此同时会检出ALDH活性。这里假设活性值的1/2是ADH活性。如果只关注醋酸菌粉末量,比酶活计算公式如下:
比酶活(U/mg干细胞)=A/d×0.1×1/T×1/E
式中:T为反应时间,min;E为醋酸菌粉末质量,mg。
1.3.6 统计学分析
使用IBM SPSS Statistics 19.0统计分析软件进行统计学分析。数据采用方差分析,计算F值,F值<F0.05,则各组均数间无显著性差异;F值≥F0.05,P≤0.05,则各组均数间存在显著性差异。用多个实验组和一个对照组均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
2 结果与分析
2.1 小鼠体质量水平
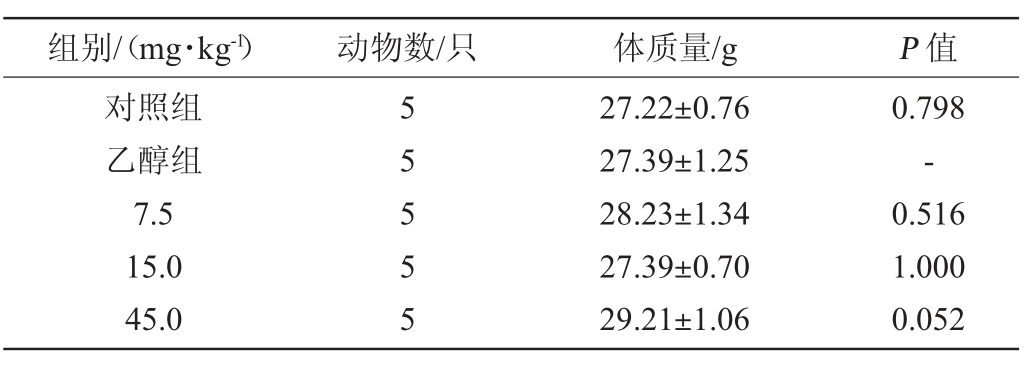
通过对实验小鼠体质量的测定,并对其进行显著性差异分析,结果见表1。经统计学分析,其体质量在各剂量组与乙醇组间比较,均无显著性差异(P>0.05)。这说明实验过程中使用的小鼠体质量差异对后续实验结果无显著性影响。
表1 小鼠体质量测定结果
Table 1 Determination results of body mass of mice
2.2 肝脏TG水平及油红O染色
甘油三酯(TG)是人体脂质的主要组成成分,血清中TG含量是诱发心血管疾病的危险因素,TG含量越高诱发心血管疾病的可能性越大[7,17]。小鼠肝匀浆TG含量的测定结果见图1。

图1 不同处理组对小鼠肝脏甘油三酸脂的影响
Fig.1 Effects of different treatment groups on triglycerides in mice liver
“**”与乙醇组比较差异显著(P<0.01)。
由图1可见,经统计学分析,乙醇组与对照组比较,肝脏TG浓度显著升高(P<0.01),可判定造模成功。1次灌胃给予受试物后,醋酸菌粉末给予组的TG水平低于乙醇给予组,差异具有显著性(P<0.01),且45.0 mg/kg组小鼠的TG水平几乎与空白对照组持平。
取不同处理组的小鼠肝脏,经冰冻切片油红O染色结果见图2。
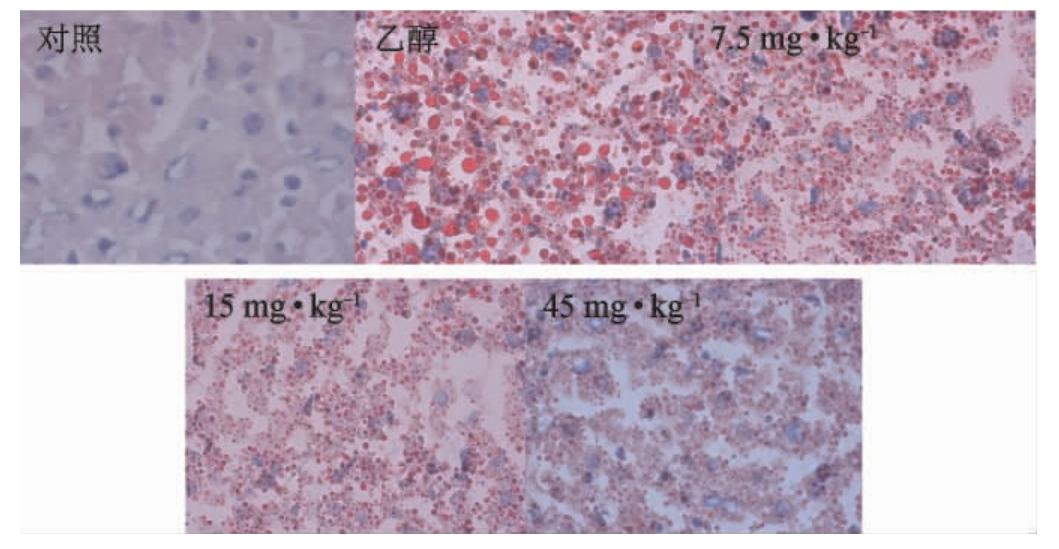
图2 不同处理组小鼠的油红染色结果(×40)
Fig.2 Oil red staining results in different treatment groups of mice
由图2可知,对照组小鼠肝脏脂滴形成较少,细胞呈散在分布;乙醇组小鼠肝脏内弥漫性脂肪变性,大部分肝细胞内充满大小不等、分布不均的脂滴空泡,部分融合呈片状并分布于肝细胞内,脂滴在肝脏中的分布、范围均高于对照组;45.0 mg/kg组脂肪变性情况有所减轻,脂滴空泡较小,但仍呈弥漫性分布。通过组织学分析,乙醇组小鼠肝脏中存在脂质蓄积的现象,与乙醇组相比,45.0 mg/kg组小鼠肝脏中脂质蓄积程度较轻,说明醋酸菌粉末对酒精引起的脂质蓄积具有缓解作用。
本研究使用的急性模型是用单次喂食0.12 mL/10 g的体积分数50%乙醇来模拟过量狂饮。急性过度摄入乙醇导致的肝脏脂肪蓄积是短暂可逆的[17]。结果表明,醋酸菌粉末具有减轻因过量狂饮导致的肝脏脂肪蓄积和氧化应激的可能性。因此摄入醋酸菌粉末会有效减轻日常摄入酒精饮料导致的肝脏脂肪蓄积。
2.3 肝脏MDA及GSH水平
已有研究阐明,为了应对乙醇代谢过程中产生的氧化应激,抗氧化物质GSH会减少[17]。不同处理组的小鼠肝脏MDA以及GSH水平见表2。
表2 各组小鼠中肝脏丙二醛、谷胱甘肽水平
Table 2 Levels of malonaldehyde andglutathione in mice liver of each groups
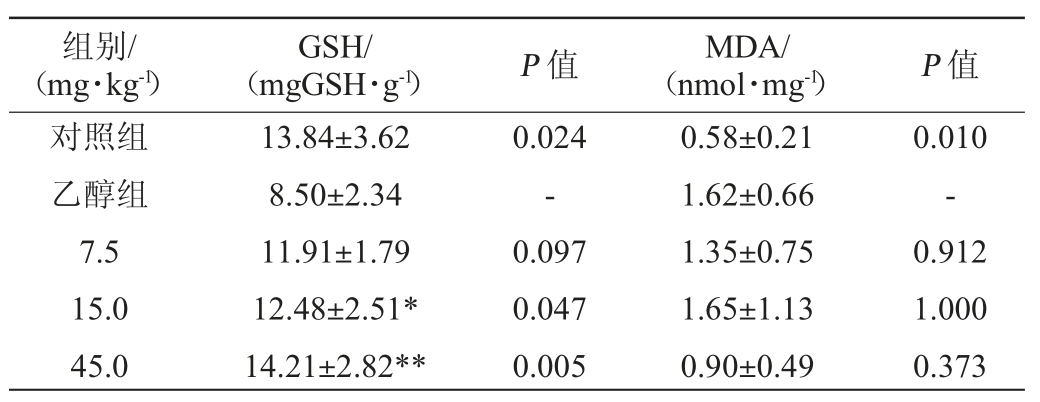
注:“*”表示与乙醇组比较差异显著(P<0.05);“**”表示与乙醇组比较差异极显著(P<0.01)。
由表2可见,经统计学分析,乙醇组与对照组比较,肝脏MDA浓度显著升高(P<0.05),GSH浓度显著降低(P<0.05),可判定造模成功。1次灌胃给予受试物后,15.0 mg/kg组以及45.0 mg/kg组的GSH水平高于乙醇组,差异均具有极显著性(P<0.01);其MDA水平在各剂量组与乙醇组间比较,差异均无显著性(P>0.05)。
在本研究中,醋酸菌粉末对抗氧化物质GSH的减少有抑制作用,却不影响氧化生成物MDA。这是因为对氧化应激的防御反应途径有多种,GSH与MDA并非一一对应关系[18],具体的代谢机理还有待进一步阐明。
2.4 醋酸菌粉末酶活性测定以及作用效果
铁氰化钾的标准曲线见图3。由图3可知,标准曲线的回归方程为y=0.194 7x-0.002 7,二者线性良好(R2=0.999 4)。本研究中测定的醋酸菌粉末的ADH和ALDH活性分别是0.48 U/mg和1.38 U/mg。
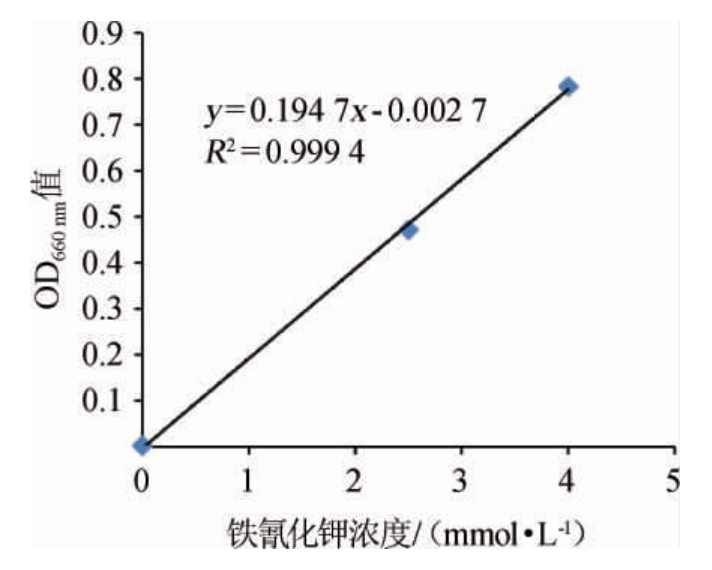
图3 铁氰化钾的标准曲线
Fig.3 Standard curve of potassium ferricyanide
此次试验中使用的小鼠体质量约30 g,胃排泄时间约180 min[19]。根据此次喂食的乙醇量与酶活性进行换算,推测醋酸菌粉末中的酶分解了喂食的180 mg乙醇中的约0.9~5.5 mg(占喂食量的0.5%~3.0%)。将这一结果与醋酸菌粉末的作用强度(减轻肝脏TG蓄积30%~55%)进行对比,可以推测醋酸菌粉末依靠ADH和ALDH对乙醇的分解作用,以及ADH和ALDH对细胞氧化应激的减轻作用[9,20],有助于减轻肝脏TG蓄积。结果表明,在单次喂食乙醇的同时喂食醋酸菌粉末,可减轻因乙醇导致的肝脏脂肪蓄积。
3 结论
本研究通过模拟急性酒精摄入,构建动物模型评估了醋酸菌粉末对急性摄入酒精引起的肝脂质蓄积和氧化损伤的影响。结果表明,与对照组相比,乙醇组肝脏中TG、MDA浓度显著升高(P<0.05),GSH浓度显著降低(P<0.05),小鼠肝脏脂肪变性严重;(乙醇+45.0 mg/kg醋酸菌粉末)组的TG浓度显著低于乙醇组(P<0.01),GSH浓度极显著高于乙醇组(P<0.01);脂肪变性情况有所减轻;各剂量组的MDA浓度与乙醇组比较,差异均无显著性(P>0.05)。醋酸菌粉末的ADH和ALDH酶活性分别为0.48 U/mg和1.38 U/mg。摄入醋酸菌粉末可以减轻急性摄入酒精引起的肝脂质蓄积和氧化损伤。
研究报告称有数种能够减轻酒精性肝损伤的天然成分,它们的作用大都是凭借抗氧化能力发挥的。而醋酸菌粉末与其他成分相比,其独到之处是能够降低呼气和血液中的酒精浓度。将醋酸菌粉末与具有抗氧化作用的天然成分相结合,有望发挥加乘效果。进一步减轻因过量狂饮导致的肝脏脂肪蓄积和氧化应激现象。
[1]MCGOVERN P E,ZHANG J,TANG J,et al.Fermented beverages of preand proto-historic China[J].P Natl Acad Sci USA,2004,101(51):17593-17598.
[2]SAITO E,INOUE M,SAWADA N,et al.Impact of alcohol intake and drinking patterns on mortality from all causes and major causes of death in a Japanese population[J].J Epidemiol,2018,28(3):140-148.
[3]World Health Organisation.Global status report on alcohol and health 2014[R].Geneva:WHO:2014.
[4]HUANG A,CHANG B,SUN Y,et al.Disease spectrum of alcoholic liver disease in Beijing 302 Hospital from 2002 to 2013[J].Medicine,2017,96(7):e6163.
[5]ENOMOTO N,YAMASHINA S,KONO H,et al.Development of a new,simple rat model of early alcohol-induced liver injury based on sensitization of kupffer cells[J].Hepatology,1999,29(6):1680-1689.
[6]BERTOLA A,MATHEWS S,KI S H,et al.Mouse model of chronic and binge ethanol feeding(the NIAAA model)[J]. Nat Protocol,2013,8(3):627-637.
[7]GUO F,ZHENG K,BENEDÉ-UBIETO R,et al.The lieber-decarli diet-a flagship model for experimental alcoholic liver disease[J]. Clin Exp Res,2018,42(10):1828-1840.
[8]ABDELMEGEED M A,BANERJEE A,JANG S,et al.CYP2E1 potentiates binge alcohol-induced gut leakiness,steatohepatitis,and apoptosis[J].Free Rad Biol Med,2013,65:1238-1245.
[9]SINGH S,BROCKER C,KOPPAKA V,et al.Aldehyde dehydrogenases in cellular responses to oxidative/electrophilic stress[J].Free Rad Biol Med,2013,56:89-101.
[10]徐庆,韦玉先,唐祖年,等.冰糖醋醒酒作用的实验研究[J].中国中药杂志,2002,6:446-448.
[11]XIA T,ZHANG J,YAO J,et al.Shanxi aged vinegar protects against alcohol-induced liver injury via activating[J].Nutrients,2018,10:805.
[12]MOON Y J,CHA Y S.Effects of persimmon-vinegar on lipid metabolism and alcohol clearance in chronic alcohol-fed rats[J]. J Med Food,2008,11(1):38-45.
[13]清野慧至,栗原仁,松岗亮辅,等.醋酸菌对C57BL/6J 小鼠的酒精性肝损伤的影响研究[J].中国酿造,2019,37(8):27-31.
[14]CARSON E J,PRUETT S B.Development and characterization of a binge drinking model in mice for evaluation of the immunological effects of ethanol[J].Clin Exp Res,1996,20(1):132-138.
[15]MEHLEM A,HAGBERG C E,MUHL L,et al.Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J].Nat Protocol,2013,8(6):1149-1154.
[16]ADACHI O,YOSHIHARA N,TANASUPAWAT S,et al.Purification and characterization of membrane-bound quinoprotein quinate dehydrogenase[J].Biosci Biotechn Bioche,2003,67(10):2115-2123.
[17]朱诗雅,翟齐啸,赵星,等.不同乳杆菌缓解慢性酒精性肝损伤的作用比较[J].食品发酵与工业,2019,45(22):20-26.
[18]LIEBER C S.Alcoholic fatty liver:its pathogenesis and mechanism of progression to inflammation and fibrosis[J].Alcohol,2004,34(1):9-19.
[19]SCHWARZ R,KASPAR A,SEELIG J,et al.Gastrointestinal transit times in mice and humans measured with 27Al and 19F nuclear magnetic resonance[J].Mag Reson Med,2002,48(2):255-261.
[20]LIU G,ZHANG Y,LIU C,et al.Luteolin alleviates alcoholic liver disease induced by chronic and binge ethanol feeding in mice[J]. J Nutr,2014,144(7):1009-1015.