壳寡糖是一类由氨基葡萄糖(glucosamine,GLcN)和N-乙酰-氨基葡萄糖(N-acetyl glucosamine,GLcNAc)通过β-1,4-糖苷键连接的低聚糖(聚合度为2~10),通常是由甲壳素和壳聚糖经过化学法、物理法和酶法等水解得到的[1]。壳寡糖具有分子质量低,易被人体吸收,水溶性好和吸湿保湿等[2-3]优于壳聚糖的特性,因此可用于制备饲料[4]和保鲜材料[5-7]等生物制品。壳寡糖具有增强机体免疫调节能力[8-9]、抗氧化[10-12]、抗肿瘤[13-14]、螯合重金属[11]以及促进植物抗逆和促进生长[15]等都强于壳聚糖的生物活性。
因此,壳寡糖的制备已经成为国内外学者研究的重点。目前,制备壳寡糖的方法有化学法、物理法和酶解法。化学法制备壳寡糖存在后期分离纯化降解产物难度大,消耗试剂多和处理复杂等缺点[16]。物理法存在底物利用率低和降解产物得率低等缺点[17]。酶解法因其壳寡糖产量高和酶特异性好等优点被广泛关注,但也存在试验成本高、反应条件严格和实用性差等缺点[18]。
本研究利用蜡状芽孢杆菌(Bacillus cereus)产壳聚糖酶,在单因素试验的基础上,通过响应面法对酶解法制备壳寡糖的工艺进行优化,从而提高壳寡糖的产量,以便进一步为壳寡糖的功能研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
蜡状芽孢杆菌(Bacillus cereus):由天津科技大学微生物菌株保藏中心保藏,保藏编号为TCCC 150018。
1.1.2 化学试剂
3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(分析纯)、壳聚糖(脱乙酰度80%~95%):国药集团化学试剂有限公司;氨基葡萄糖盐酸盐(分析纯):北京博奥拓达科技有限公司。
1.1.3 培养基
种子培养基:蛋白胨10 g/L,酵母浸粉5 g/L,氯化钠5g/L,葡萄糖10 g/L,调pH值为6.0~6.4,121 ℃灭菌20 min。
发酵培养基:酵母浸粉16 g/L,葡萄糖11.5 g/L,K2HPO41.4 g/L,KH2PO40.6 g/L,MgSO4·7H2O 1.2 g/L,吐温-80 1.2 g/L,NaCl 5.0 g/L,调pH值为6.0~6.4,121 ℃灭菌20 min。
1.2 仪器与设备
DHP-9272电热恒温培养箱:上海一恒科技有限公司;UV-2550紫外分光光度计:日本岛津公司;H1850高速离心机:湘仪离心机仪器有限公司。
1.3 试验方法
1.3.1 壳聚糖酶制备
每50 mL种子培养基接入一环蜡状芽孢杆菌(Bacillus cereus),在30 ℃、160 r/min的条件下培养24 h,得到种子液。以4%的接种量接入发酵培养基中,在30 ℃、160 r/min的条件下发酵48 h,得到发酵液。
发酵液8 000 r/min离心5 min除去菌体,在上清液中加入(NH4)2SO4,不断搅拌使发酵液中的(NH4)2SO4饱和度达到60%,静置2 h后,4 ℃、10 000 r/min离心15 min除去杂蛋白,再取上清液,加入(NH4)2SO4使其饱和度达到80%,4 ℃、10 000 r/min离心15 min,倒掉上清液,收集沉淀,得到壳聚糖酶,用蒸馏水定容至20 mL,4 ℃储藏。
1.3.2 氨基葡萄糖标准曲线的绘制
参考李燕等[19]的氨基葡萄糖标准曲线的制作方法,绘制氨基葡萄糖标准曲线。
1.3.3 壳寡糖含量的测定
1%胶体壳聚糖溶液:称取1 g壳聚糖(脱乙酰度80%~95%)于烧杯中,量取20 mL蒸馏水搅拌溶胀2 min,加入30 mL浓度为0.2 mol/L的醋酸溶液,摇匀,待溶液透明,用0.2 mol/L的醋酸钠调pH至5.5,蒸馏水定容至100 mL。
壳寡糖含量测定采用DNS法。每个比色管加入0.8 mL乙酸-乙酸钠缓冲液,另取壳聚糖酶粗酶液0.1 mL于比色管中,空白对照加入0.1 mL灭活酶液,再向各试管中加入1 mL 1%的胶体壳聚糖溶液,在35 ℃水浴锅中反应30 min,然后实验组沸水浴10 min,定容比色管中溶液至2 mL,再加入2 mL DNS试剂,沸水浴5 min,冷却后定容至25 mL,以空白组为对照,在波长520 nm处测定各试管的吸光度值。按照氨基葡萄糖标准曲线回归方程计算酶解液中壳寡糖含量。
1.3.4 壳聚糖酶的添加量
按照1.3.3的方法,分别加入0.05 mL、0.10 mL、0.15 mL、0.20 mL和0.25 mL的壳聚糖酶粗酶液,计算酶解液中壳寡糖含量,确定最佳壳聚糖酶添加量。
1.3.5 单因素试验优化酶解条件
壳寡糖的产量受到酶解pH、温度、时间和壳聚糖的浓度等条件的影响,本研究以最终壳寡糖的产量(Y)为考察指标,分别以酶解pH值(3.6、4.0、4.4、4.8、5.2、5.6),酶解温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃),壳聚糖质量分数(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)和酶解时间(30 min、60 min、90 min、120 min、150 min、180 min)为影响因素,进行单因素试验,考察单因素对壳寡糖的产量的影响。
1.3.6 响应面法优化壳聚糖酶解条件
通过单因素试验初步考察最佳酶解pH值(X1)、酶解温度(X2)、底物浓度(X3)以及酶解时间(X4)对壳寡糖产量(Y)的影响。然后利用Box-Behnken进行试验优化设计,试验因素与水平见表1。
表1 Box-Behnken试验的因素与水平
Table 1 Factors and levels for Box-Behnken experiments

2 结果与分析
2.1 氨基葡萄糖标准曲线
以波长520 nm处的吸光度值(x)为横坐标,氨基葡萄糖的浓度(y)为纵坐标,绘制氨基葡萄糖标准曲线,如图1所示。由图1可知,标准回归方程y=12.719 0x+0.607 6,相关系数R2=0.9997,二者线性关系良好,可用于测定壳寡糖的含量。
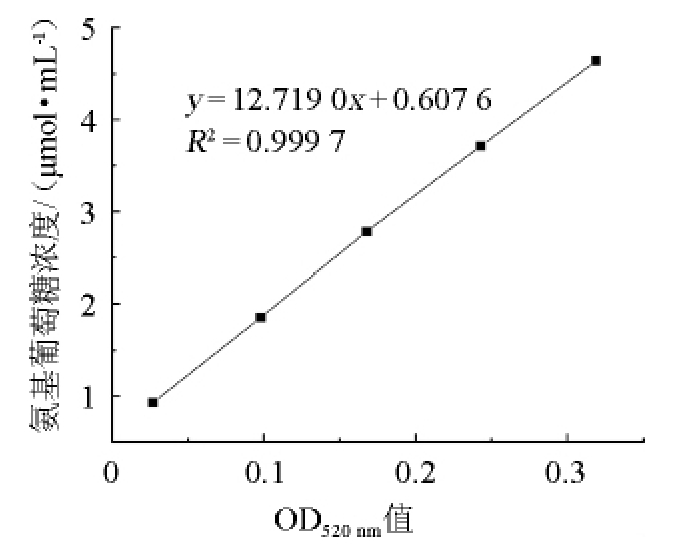
图1 氨基葡萄糖标准曲线
Fig.1 Standard curve of glucosamine
2.2 壳聚糖酶的最佳添加量
考察最佳壳聚糖酶的添加量对壳寡糖产量的影响,如图2所示。由图2可知,在壳聚糖酶的添加量为0.5~2.0 mL时,随着壳聚糖酶添加量的增加,壳寡糖产量随之增多;当酶液添加量为2.0 mL时,壳寡糖产量最大,但是当酶液添加量>2.0 mL后,随着添加量的增多,壳寡糖的产量几乎不再变化。因此,壳聚糖酶最佳的添加量为2.0 mL。
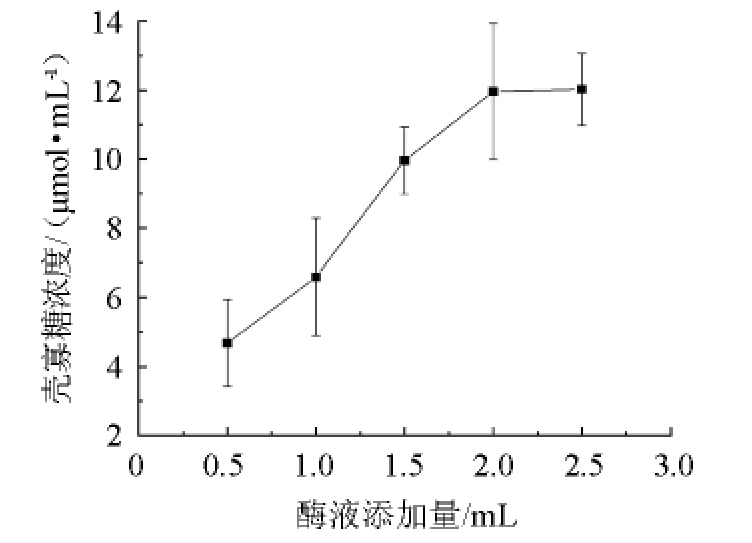
图2 壳聚糖酶添加量对壳寡糖产量的影响
Fig.2 Effect of chitosanase addition on chitosan oligosaccharide yield
2.3 壳聚糖酶酶解条件优化
2.3.1 酶解pH值对壳寡糖产量的影响
酶的活性受pH的影响主要是pH会使酶的活性中心发生结构变化,会解离酶的中心结构基团,限制酶与底物的结合,pH还决定氨基在反应体系中形成R-NH2或R-NH3+[20]。考察壳聚糖酶在pH为3.6~5.6的酶解效率,结果见图3。
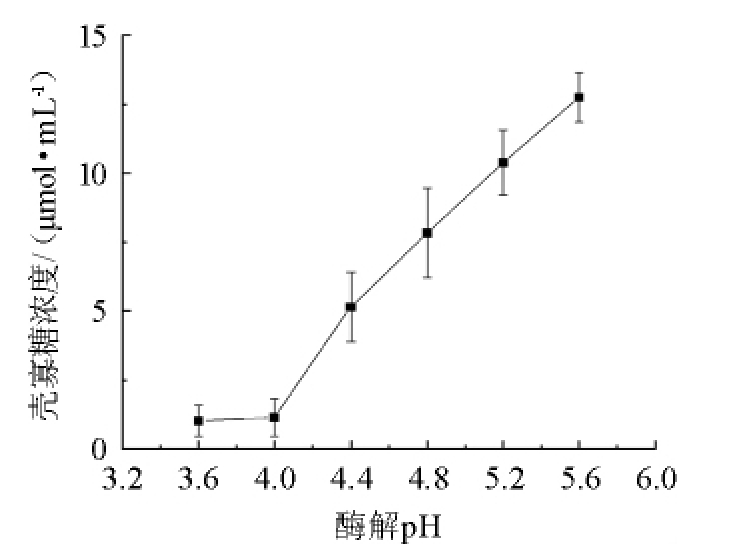
图3 酶解pH值对壳寡糖产量的影响
Fig.3 Effect of enzymolysis hydrolysis pH on chitosan oligosaccharide yield
由图3可知,酶解pH为3.6~4.0时,壳聚糖酶受pH影响较大,几乎不降解壳聚糖;当酶解pH值为4.0~5.6,随着pH值的增大,壳寡糖的产量也随之增大;当pH达到5.6时,降解效果达到最佳;当酶解pH值>5.6时,溶液中会出现白色絮状不溶物质,又会影响酶解效率。因此,酶解pH值为5.6为宜。
2.3.2 酶解温度对壳寡糖产量的影响
酶解温度对酶的影响在于酶解温度过低会降低酶的活性,影响酶解反应的进行。酶解温度适合,酶会达到最佳酶解效果。当温度再持续升高,一定程度会导致酶的结构发生变化而失活,一般温度对酶活性的影响呈现出钟罩形[21]。不同酶解温度对壳聚糖酶降解能力影响结果如图4所示。
由图4可知,当酶解温度为30~50 ℃时,壳寡糖的含量随着酶解温度的升高而升高;当酶解温度为50 ℃时,壳寡糖含量最高,为16.603 μmol/mL;当酶解温度高于50 ℃之后,壳寡糖含量随着酶解温度升高而降低。因此,壳聚糖酶降解的最佳温度为50 ℃。
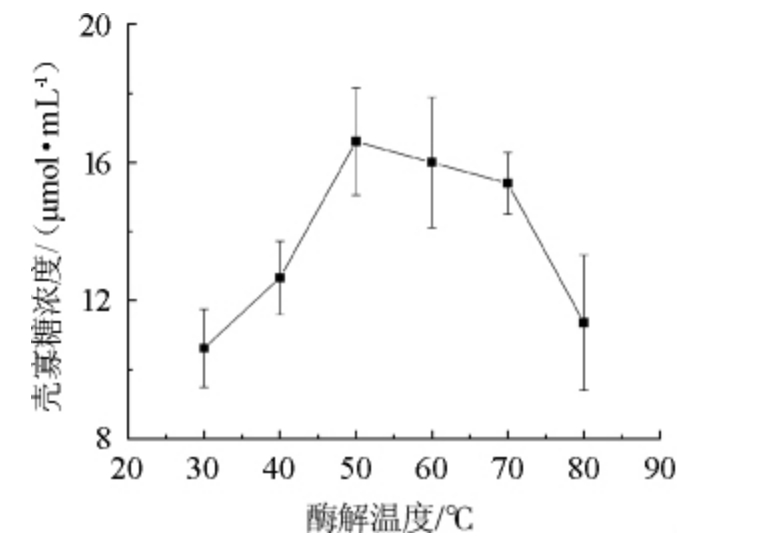
图4 酶解温度对壳寡糖产量的影响
Fig.4 Effect of enzymolysis hydrolysis temperature on chitosan oligosaccharide yield
2.3.3 底物浓度对壳寡糖产量的影响
不同壳聚糖质量分数下壳聚糖酶降解能力结果如图5所示。由图5可知,当壳聚糖质量分数为0.5%~2.0%时,随着壳聚糖质量分数的升高,壳寡糖产量也增多;当壳聚糖质量分数为2.0%时,壳寡糖产量最高;当壳聚糖质量分数>2.0%之后,壳寡糖产量随之下降。因此,最佳的壳聚糖质量分数为2.0%。
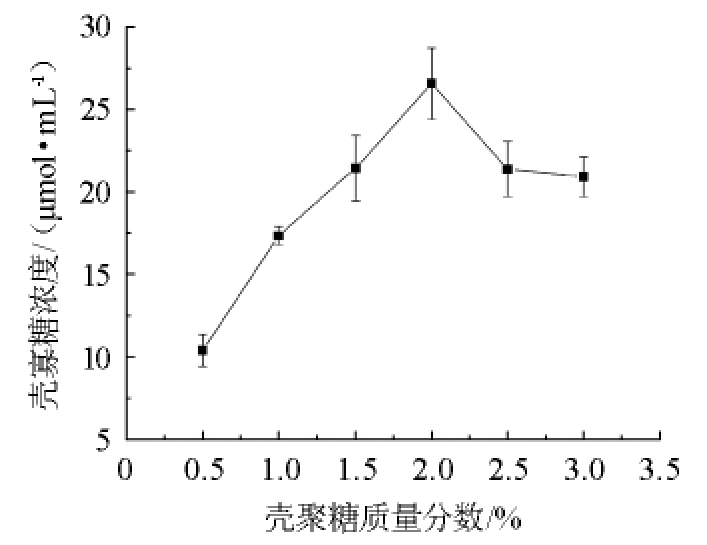
图5 壳聚糖质量分数对壳寡糖产量的影响
Fig.5 Effect of chitosan mass fraction on chitosan oligosaccharide yield
2.3.4 酶解时间对壳寡糖产量的影响
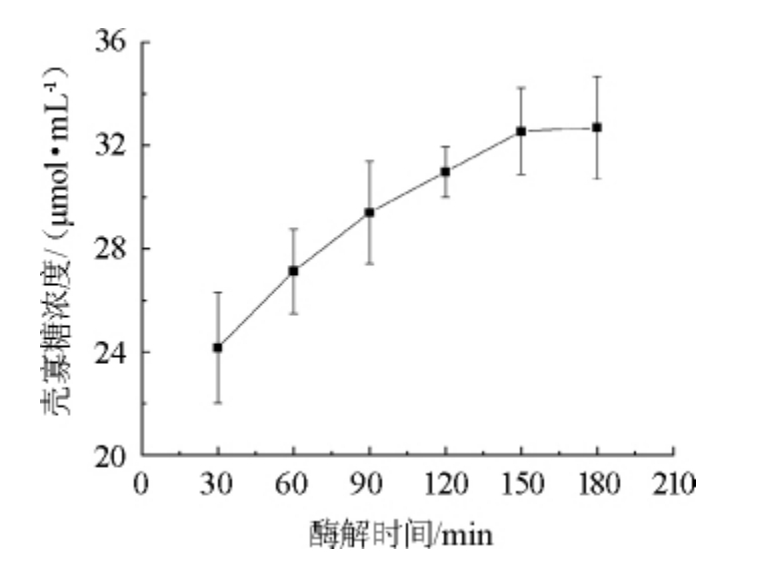
图6 酶解时间对壳寡糖产量的影响
Fig.6 Effect of enzymolysis hydrolysis time on chitosan oligosaccharide yield
不同酶解时间对壳寡糖产量的影响结果如图6所示。由图6可知,在酶解时间为30~150 min时,随着酶解时间的延长,壳寡糖产量随着时间的延长而增多;当酶解时间为150 min时,壳寡糖产量最大,但是当酶解时间>150 min后,随着时间延长,壳寡糖的产量几乎不再变化。因此,壳聚糖酶降解壳聚糖的最佳酶解时间为150 min。
2.3.5 响应面法优化壳聚糖酶酶解条件
在单因素试验基础上,利用Design Expert 10.0 进行响应面试验,考察最佳酶解pH值(X1)、酶解温度(X2)、底物浓度(X3)以及酶解时间(X4)对壳寡糖产量(Y)的影响,对其结果进行优化和响应面分析,所得试验结果与分析见表2,方差分析见表3。
表2 响应面试验结果与分析
Table 2 Results and analysis of Box-Behnken experiments
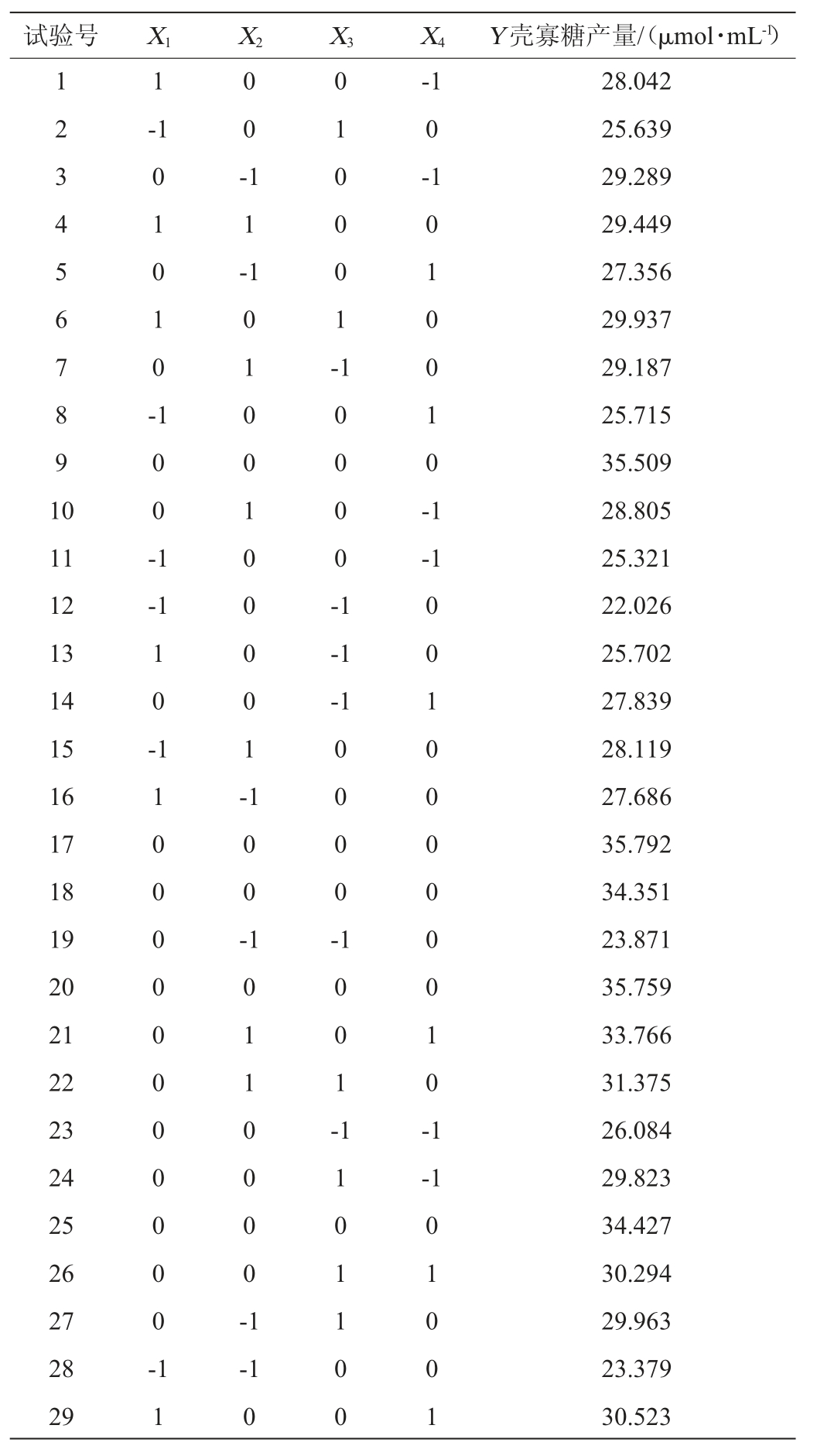
通过Design Expert V10.0软件对表2数据进行回归分析,得到的多元二次回归方程为:
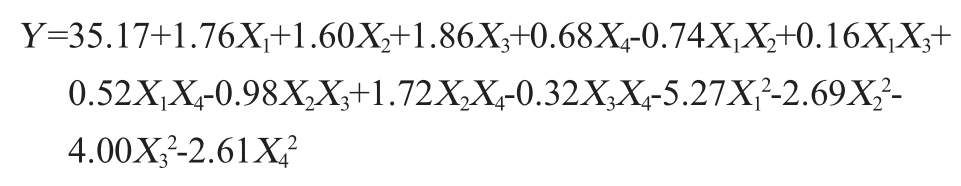
表3 回归方程方差分析
Table 3 Variance analysis of regression equation
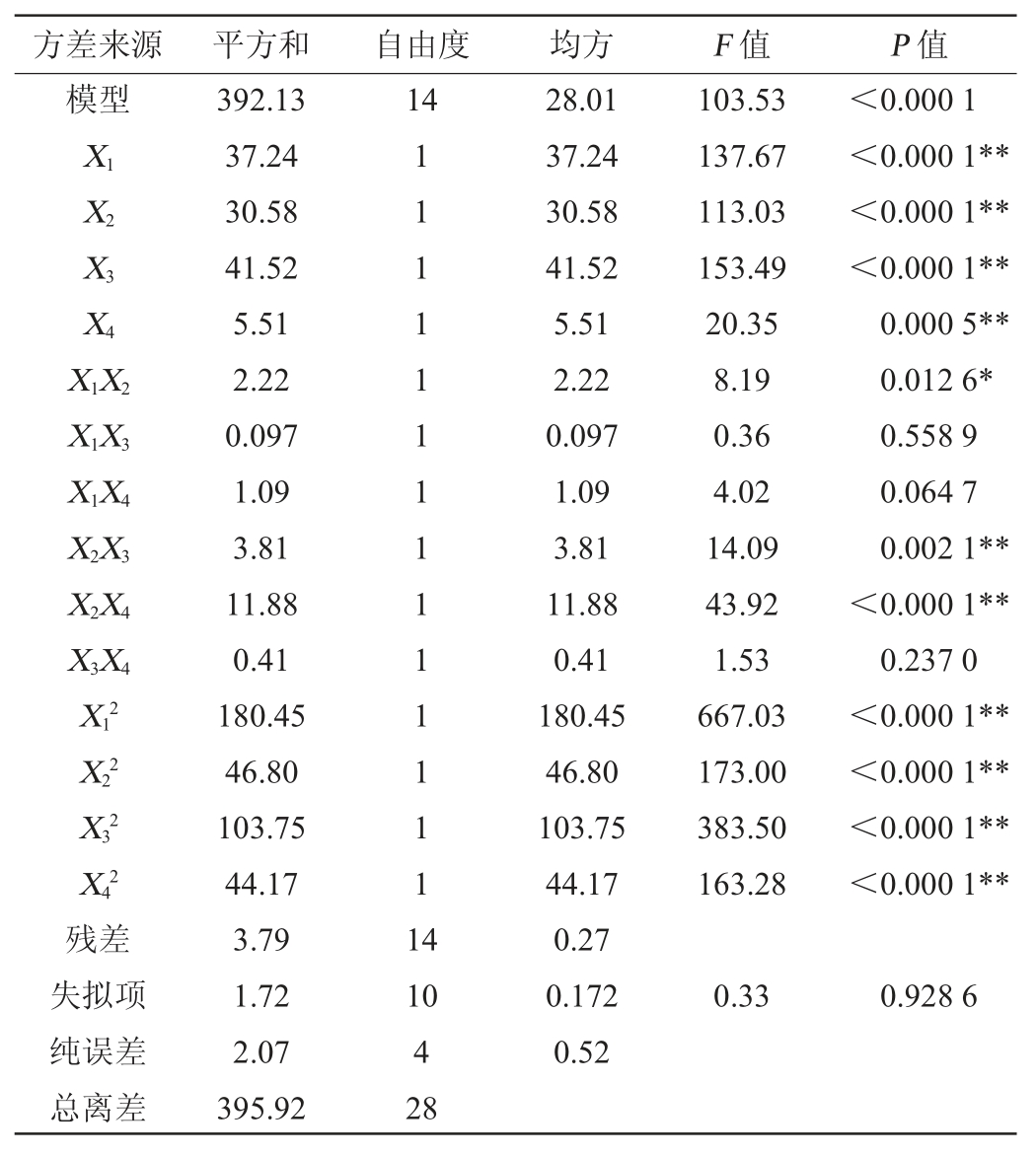
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
由表3可知,该模型P值<0.000 1,极显著(P<0.01),失拟项P=0.928 6>0.05,表明失拟项不显著,即模型和试验拟合较好。模型决定系数R2为0.990 4,校正后模型的决定系数![]() 为0.980 9,变异系数(coefficient of variation,CV)为1.785 0%,表明该模型只有1.785 0%的变异不能由该模型解释,信噪比为34.056 9,说明试验操作与模型可信。在该模型中一次项X1、X2、X3、X4、二次项
为0.980 9,变异系数(coefficient of variation,CV)为1.785 0%,表明该模型只有1.785 0%的变异不能由该模型解释,信噪比为34.056 9,说明试验操作与模型可信。在该模型中一次项X1、X2、X3、X4、二次项![]() 及交互项X2X3、X2X4对壳寡糖产量影响极显著(P<0.01);交互项X1X2对壳寡糖产量影响显著(P<0.05);交互项X1X3、X1X4、X3X4对壳寡糖产量影响不显著(P>0.05)。
及交互项X2X3、X2X4对壳寡糖产量影响极显著(P<0.01);交互项X1X2对壳寡糖产量影响显著(P<0.05);交互项X1X3、X1X4、X3X4对壳寡糖产量影响不显著(P>0.05)。
2.3.6 响应面分析
综上所述,该模型可用于解释试验结果并进行预测,由回归分析和回归方程拟合可以绘制出各因素相互作用的响应面及等高线,结果见图7。
由图7可知,壳聚糖最佳酶解条件为酶解pH值5.66、酶解温度53 ℃、壳聚糖质量分数2.09%、酶解时间157 min,该条件下壳寡糖产量理论值可达35.81 μmol/mL。为了检验响应面分析的可靠性,考虑到壳聚糖溶解度的问题,将pH值调至5.6,并在此条件下进行验证试验,反应终止后壳寡糖浓度可达35.73μmol/mL,与模型预测值35.48μmol/mL接近。

图7 各因素交互作用对壳寡糖产量影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effects of interaction between each factors on chitosan oligosaccharide production
3 结论
在单因素试验基础上,利用响应面法对壳聚糖酶的酶解条件进行优化,最终确定最优酶解条件:酶解pH值为5.6,酶解温度为53℃,壳聚糖质量分数为2.09%,酶解时间为157 min。在此优化条件下,壳寡糖的产量为35.73 μmol/mL,与预测值接近,说明所建模型可以很好的预测壳寡糖的产量。
[1]LODHI G,KIM Y S,HWANG J W,et al.Chitooligosaccharide and its derivatives:preparation and biological applications[J].Biomed Res Int,2014,2014:654913.
[2]DANG Y,LI S,WANG W,et al.The effects of chitosan oligosaccharide on the activation of murine spleen CD11c+dendritic cells via Toll-like receptor 4[J].Carbohyd Polym,2011,83(3):1075-1081.
[3]MUANPRASAT C,CHATSTUDTHIPONG V.Chitosan oligosaccharide:Biological activities and potential therapeutic applications[J].Pharmacol Ther,2016:170:80-97.
[4]张成喜.饲料中添加壳寡糖对动物机体的影响[J].当代畜禽养殖业,2014(12):43-43.
[5]聂青玉,刘丹,王燕飞,等.壳寡糖处理对草莓贮藏品质的影响[J].农产品加工(创新版),2010(7):31-33.
[6]邓丽莉,黄艳,周玉翔,等.壳寡糖处理对柑桔果实贮藏品质的影响[J].食品工业科技,2009(7):287-290.
[7]聂青玉,侯大军.壳寡糖处理对红橘果实贮藏品质和生理的影响[J].西南大学学报(自然科学版),2010,32(10):37-41.
[8]ZOU P,YANG X,WANG J,et al.Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J].Food Chem,2016,190(6):1174-1181.
[9]LI K,XING R,LIU S,et al.Advances in preparation,analysis and biological activities of single chitooligosaccharides[J].Carbohyd Polym,2016,139(12):178-190.
[10]ZHAO D,WANG J,TAN L,et al.Synthesis of N-furoyl chitosan and chitooligosaccharides and evaluation of their antioxidant activity in vitro[J].Int J Biol Macromol,2013,59(4):391-395.
[11]何昇鸿,王一安,曾令智,等.营养强化剂壳寡糖铜、锰螯合物的合成与表征及抗氧化活性[J].中国食品添加剂,2018,170(4):118-123.
[12]XU W,JIANG C,KONG X,et al.Chitooligosaccharides and N-acetyl-D-glucosamine stimulate peripheral blood mononuclear cell-mediated antitumor immune response[J].Mol Med Rep,2012,6(2):385-390.
[13]JE J Y,KIM S K.Chapter 21-Chitooligosaccharides as potential nutraceuticals:Production and bioactivities[J].Adv Food Nutr Res,2012,65(12):321-336.
[14]ALEXANDER W,JOSE D N,INMACULADA A,et al.Short-chain chitin oligomers:promoters of plant growth[J].Mar Drugs,2017,15(2):E40.
[15]GARRY K.The potential of chitosan and its derivatives in prevention and treatment of age-related diseases[J].Mar Drugs,2015,13(4):2158-2182.
[16]梁慧培,覃小丽,钟金锋.壳寡糖制备和生理活性的研究进展[J].食品工业科技,2016,37(3):384-388.
[17]陈巍,罗志刚,李忠彦,等.物理方法在壳聚糖降解中的应用[J].酿酒,2006,33(2):57-60.
[18]YUAN X,ZHENG J,JIAO S,et al.A review on the preparation of chitosan oligosaccharides and application to human health,animal husbandry and agricultural production[J].Carbohyd Poly,2019,220(9):60-70.
[19]李燕,赵华,李佳,等.组成型壳聚糖酶制备壳寡糖酶解条件的优化[J].中国食品添加剂,2017(12):131-135.
[20]孙金凤,唐秋锋,董祥毅.壳聚糖的酶法降解产物分析[J].淮阴工学院学报,2008,17(1):64-67.
[21]赵希荣.壳聚糖与葡萄糖发生美拉德反应的条件及产物的抗氧化性能[J].食品科学,2004,25(6):61-63.