速冻面制品主要是以馒头、花卷、面条、水饺等为主,其生产过程主要是基于冷冻面团的原理[1]。冷冻面团技术起源于1950年,是指利用速冻技术加工包子、面条、水饺等食品,使其预先冷藏一段时间后再取出解冻进行后续加工,直到得到成品为止[2]。冷冻面团技术可将面团分为冷冻和加工两个环节,既节约了人力资源和时间,又降低了制作成本[3]。传统的“现做现卖”的面制品生产和消费形式,在方便性、卫生性、流通性等方面都不能完全满足消费者的需求[4],而速冻面制品中的酵母菌耐冷冻能力较差,抗冻性较弱,速冻面制品感官和风味较差,所以筛选性能优良的耐冻藏酵母菌,实现速冻面制品主食的工业化生产已成为当今食品产业的重要课题。
酵母是制作冷冻面团的重要原料。由于酵母和面团需要同时进行冷冻和冷藏,因此存活率也是一个重要因素[5]。无论是在基础研究还是在发展研究中,关于酵母在面食中的耐受机制的研究一直是酵母研究人员的重要课题之一[6],并且耐冻藏酵母是冷冻生胚加工的关键。耐冻藏酵母必须在经过冷冻、解冻后仍然保持活力,以保证焙烤(或蒸制)产品的大小、形状和口感等产品质量[7]。近年来,国内外许多研究者在利用自然筛选、诱变筛选、杂交等手段,驯化出了更多的抗冻性良好的酵母菌株[8],但是将其应用到冷冻面制品中的研究还较少。
本研究以冷冻老面为原料,通过对老面中酵母菌的分离、鉴定及性能研究,以期筛选出一株性能优良的耐冻藏酵母菌,改善冷冻面制品的风味,提高冷冻面制品的品质,为耐冻藏的冷冻面制品工业化生产提供一定的理论依据,促进冷冻面制品的工业化发展。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
冷冻老面:-18 ℃冰箱中冷冻60 d的老面。
1.1.2 化学试剂
麦芽浸粉、酵母膏、蛋白胨、琼脂、糖发酵基础液(均为生化试剂):苏州瑞测技术有限公司;葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、棉籽糖、D-果糖、海藻糖等(均为分析纯):苏州泰安生化有限公司。
1.1.3 培养基
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:1%酵母膏,2%蛋白胨,2%葡萄糖,2%琼脂粉,pH 5.0,121 ℃灭菌20 min。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA):2%葡萄糖,2%琼脂粉,0.6%马铃薯浸粉,pH 5.6,115 ℃灭菌20 min。
麦芽汁培养基:麦芽浸粉13%,氯霉素0.01%,pH 5.6,121 ℃灭菌20 min。
无碳基础培养基:1%蛋白胨,0.5%NaCl,pH 7.6,121 ℃灭菌20 min。
无氮合成培养基:酵母膏0.1 g/L,MgSO4·7H2O 0.5 g/L,KH2PO41 g/L,(NH4)2SO45 g,pH 7.0,121 ℃灭菌20 min。
1.2 仪器与设备
SCH-103电热恒温干燥箱、UJGT-70电热恒温培养箱、ESJI80-4电子天平、TYH2电热恒温水浴锅:哈尔滨顺城不锈钢设备有限公司;SG-400高压灭菌锅、WS-600R振荡培养箱、TG16-WS高速离心机:上海巴玖实业有限公司;UV-5200紫外分光光度仪:上海元析仪器有限公司;PHS-300酸度计:江苏盛奥华环保科技有限公司;ProFlex聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:上海山富科学仪器有限公司;
1.3 方法
1.3.1 耐冻藏酵母菌的筛选
将-18 ℃冰箱中冷冻60 d的老面,放在30 ℃的恒温箱中发酵约1 h,用电子天平准确称取1 g(精确至0.01 g)老面,加入9 mL无菌水中充分混匀,梯度稀释(取10-4~10-7 CFU/mL)至合适浓度后涂布于YPD培养基上,参照滕超等[9]的方法进行试验。
1.3.2 耐冻藏酵母菌的鉴定
(1)菌落形态鉴定
菌落形态观察[10]:观察固体培养基中单菌落的菌落形态、颜色、大小等,并做好记录。
(2)生理生化鉴定
碳源同化试验:将活化1~2 d的酵母菌分别接种到蜜二糖、葡萄糖、纤维二糖等18种碳源的微量生理生化管中,30℃下培养1~2d,根据颜色的变化判断哪种碳源可以同化。
氮源同化试验[11]:将活化的酵母在无氮液体培养基中分别培养3 d后,将无氮培养基中的菌在不同氮源的固体培养基上30 ℃培养,看是否长出菌。
糖发酵试验[12]:选取葡萄糖、乳糖、海藻糖等8种糖,分别用无菌水配成质量分数12%的母液。按照每管4 mL无碳基础培养液,1 mL母液,1 mL菌悬液的添加量,30 ℃恒温培养7 d,期间每天观察杜氏小管内产气量以及大试管内产酸情况。
1.3.3 耐冻藏酵母菌的性能测定
参照郭勇等[13-14]的方法进行产气性能测试、耐酒精能力测试和耐酸能力测试;参照国标GB/T 20886—2007《食品加工用酵母》中的方法[15]进行酵母菌的发酵能力测试;参照李春慧[16]的方法并略作修改进行耐冻藏能力测定:酵母菌AY003、AY005、AY007和AY026的菌液在-18 ℃的冰箱中保存60 d,每10 d取一次样,并对活酵母菌计数,挑选30~300个之间的菌落数,然后计算单位活菌数(CFU/mL),以存活率表示酵母的耐冻藏能力。
1.3.4 菌种的分子生物学鉴定
按照肖新云等[17-18]的方法进行基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取,使用18S rDNA通用引物(NS1:GTAGTCATATGCTTGTCTC;NS8:TCCGCAGGTTCACCTACGGA)进行PCR扩增。扩增产物经电泳检测,PCR产物经过纯化后,送交测序公司进行测序。
将菌株的测序结果与美国生物技术信息中心(national center for biotechnology information,NCBI)中的GenBank数据库进行基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)相似性分析,选择近源菌种的18S rDNA序列进行比对,最后采用MEGA5.2软件构建系统发育树,分析鉴定菌株与已知菌株的同源性[19]。
1.3.5 生长曲线的测定
参照耿瑞玲[20]的方法并稍作更改。挑选分离的单个菌落接种于装液量为300 mL/1 000 mL的马铃薯葡萄糖培养基中,30 ℃、150 r/min摇床培养,每2 h取5 mL发酵液,用无菌蒸馏水稀释3倍,于波长600 nm条件下以初始发酵液作为空白对照测定吸光度值(OD600nm值),绘制酵母菌的生长曲线。
2 结果与分析
2.1 耐冻藏酵母菌的筛选
表1 酵母菌的菌落及细胞形态特征
Table 1 Colony and cell morphological characteristics of yeasts

根据酵母菌的个体形态、出芽方式和其他形态特征,参考滕超等[9]的方法从冰箱的冷冻面团中分离出酵母菌AY003、AY005、AY007、AY022、AY026、QY003,其菌落及细胞形态特征见表1。由表1可知,6株酵母菌的菌落均为乳白色,有光泽,不透明,边缘形状规则,菌落大小为1~6 mm之间,细胞形态特征为卵圆形或椭圆形,菌株AY005、AY007表面干燥,为周边出芽,其余菌株表面湿润,为单端出芽。
2.2 酵母菌的生理生化鉴定结果
2.2.1 碳源同化结果
碳源物质可以提供酵母菌生长所需的能量,也是组成其酵母菌结构的物质。不同的酵母菌对碳源的利用能力不同,将在30 ℃恒温培养箱中培养好的菌株AY003、AY005、AY007、AY022、AY026、QY003种子液分别接入碳源发酵微量生理生化管内,30 ℃培养48 h,测试菌株对不同碳源同化能力,结果见表2。
表2 酵母菌的碳源同化试验结果
Table 2 Results of carbon source assimilation tests of yeasts
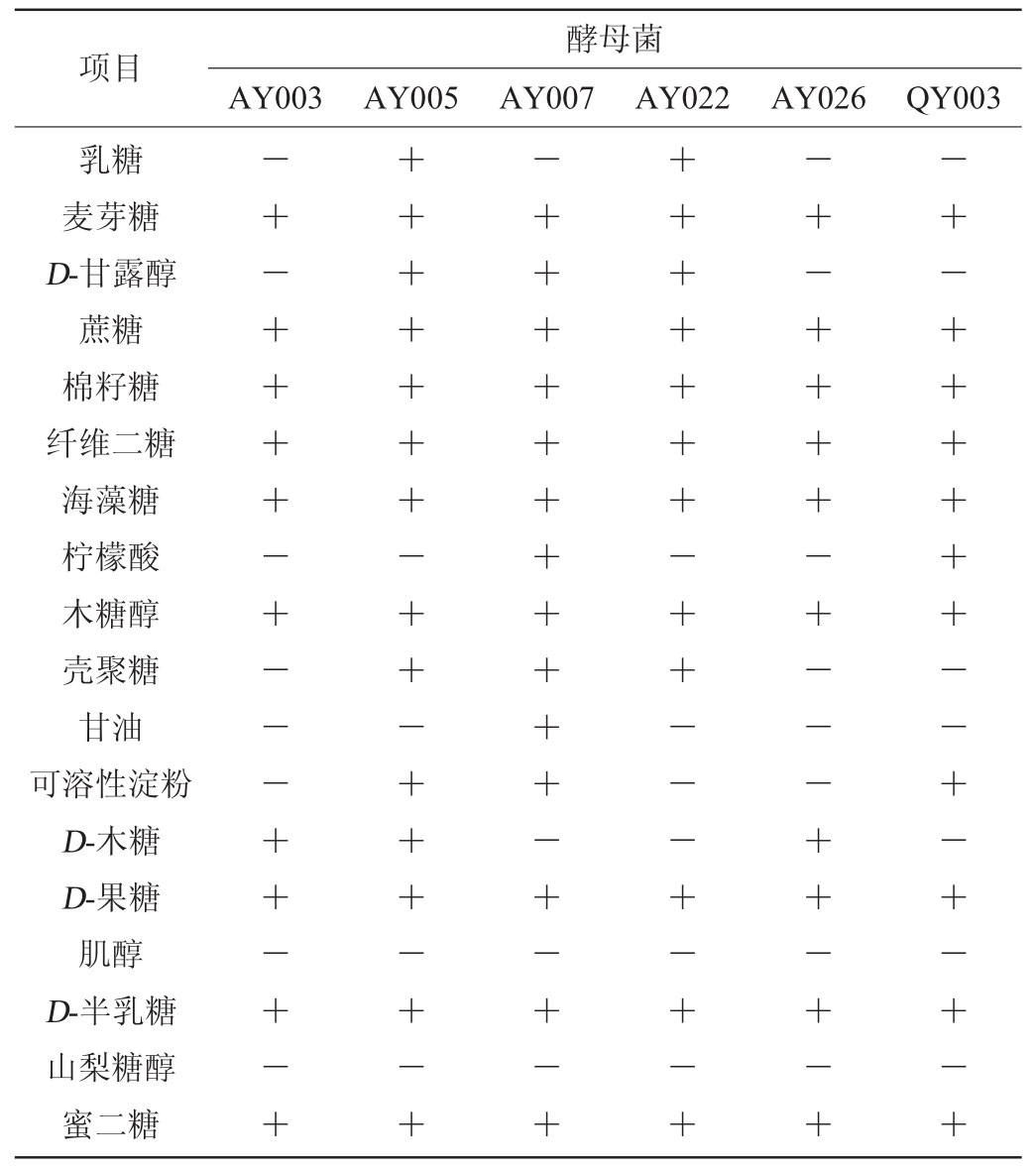
注:“+”表示阳性反应;“-”表示阴性反应。下同。
由表2可知,酵母AY005、AY007对碳源具有良好的同化能力,菌株AY005不能同化柠檬酸、甘油、肌醇、山梨糖醇;菌株AY007不能同化乳糖、D-木糖、肌醇、山梨糖醇;对碳源同化效果次之的是菌株AY022,剩下的酵母菌株AY003、AY026、QY003碳源同化能力较差。
2.2.2 氮源同化结果
酵母菌只能利用一些简单的蛋白质的含氮化合物。将活化的酵母接种在无氮液体培养基上培养3 d后,将无氮培养3 d的菌株分别于含有不同氮源硝酸钾、硫酸铵和亚硝酸钠的固体培养基培养,放在30 ℃恒温培养箱里培养,结果见表3。
表3 酵母菌的氮源同化试验结果
Table 3 Results of nitrogen source assimilation tests of yeasts
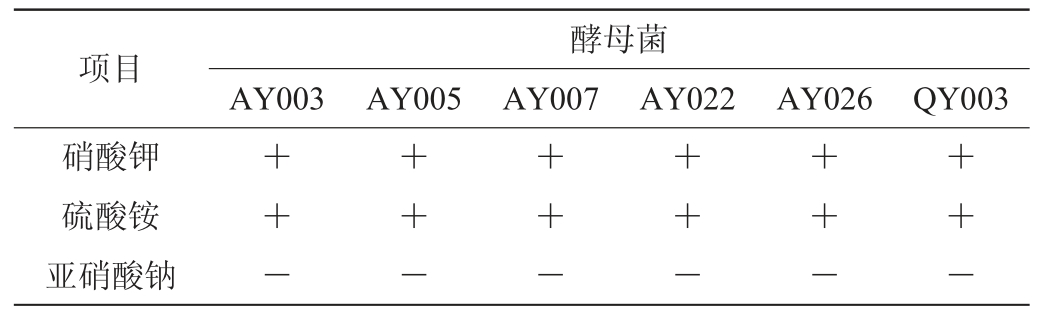
由表3可知,酵母菌AY003、AY005、AY007、AY022、AY026、QY003对氮源的同化能力比较相近,都可以利用硝酸钾和硫酸铵这两种氮源,不能利用亚硝酸钾这种氮源。
2.2.3 糖发酵试验结果
不同酵母菌会对糖类的利用有所差异,这可以用来鉴别酵母菌的一个方法。根据《酵母菌特征与鉴定手册》[12]进行糖发酵试验(D-果糖、乳糖、D-半乳糖、海藻糖、蔗糖、棉籽糖等),结果见表4。
表4 酵母菌糖发酵试验结果
Table 4 Results of sugar fermentation tests of yeasts
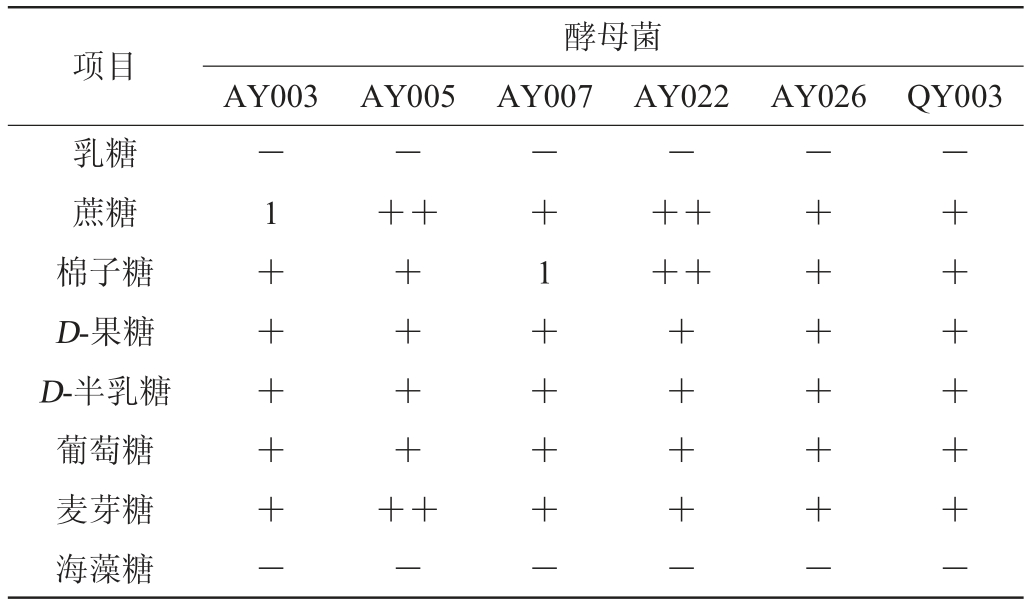
注:“1”为产酸,“+”为产酸产气,“-”为不产气;“+”越多代表产气量越多。
由表4可知,所有菌株对海藻糖和乳糖没有作用;当菌株AY005使用蔗糖或麦芽糖作为碳源时,比其他碳源产气产酸效果更好;菌株AY022以蔗糖、棉籽糖为碳源时,产气产酸较强,相比于其他碳源发酵效果较好;菌株AY026、QY003对蔗糖、棉籽糖、葡萄糖和麦芽糖的发酵效果一般;菌株AY003对蔗糖无产气现象;菌株AY007对棉子糖无产气现象。
2.3 耐冻藏酵母菌性能测试结果
2.3.1 产气性能测试结果
对分离到的6株菌株进行产气性能测试,结果见表5。
表5 杜氏小管的产气性能测试结果
Table 5 Results of gas production performance tests of Duchenne tubules

注:“+”代表稍微产气现象;“++”代表有一半产气量;“+++”代表整管产气量。
由表5可知,有4株酵母菌株能产气达到满体积,说明AY003、AY005、AY007、AY026这4株菌的起酵能力比较强,产气能力好,具有很高的发酵程度。选择产气效果较好的AY003、AY005、AY007、AY026菌株进行以下实验。
2.3.2 耐酒精能力测试结果
对酵母菌株AY003、AY005、AY007、AY026进行为期7 d的耐酒精能力测试,“+”代表培养基菌落较少,“++”代表培养基有1/2菌落,“+++”代表培养基有2/3菌落,“-”代表培养基无菌落,耐酒精能力结果见表6。
表6 酵母菌耐酒精能力测试结果
Table 6 Results of alcohol tolerance tests of yeasts
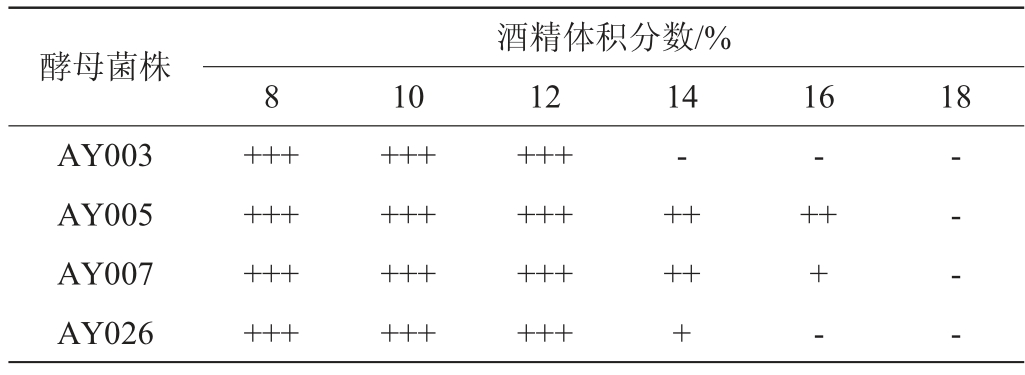
由表6可知,在酒精体积分数为8%、10%、12%的培养基中,AY003、AY005、AY007、AY026酵母菌均可以旺盛生长。然而,可以清楚地看出,当酒精体积分数增加至14%时,菌株AY003的耐受性差,停止生长。当酒精体积分数达到16%时,菌株AY005仍然维持正常生长,说明菌株AY005有较好的酒精耐受性,而菌株AY007的酒精耐受能力相比于菌株AY005来说略差。菌株AY026在酒精体积分数16%时停止生长。当酒精体积分数为18%时,4株菌株都停止生长。因此对于酒精的耐受性菌株AY005最好,菌株AY003最差。与陈胜等[21]高产耐酒精酵母的研究结果一致。
2.3.3 耐酸能力测试结果
在醒发面团的过程中,由于各种细菌(如醋酸菌和乳酸菌)的联合作用通常伴随着乳酸菌发酵、丁酸发酵等过程,所以面团的酸度会随时间的增长不断上升,pH值不断下降,会直接抑制酵母菌的逐步生长[22],使其发酵力降低。四株酵母AY003、AY005、AY007和AY026的耐酸能力测试结果见图1。
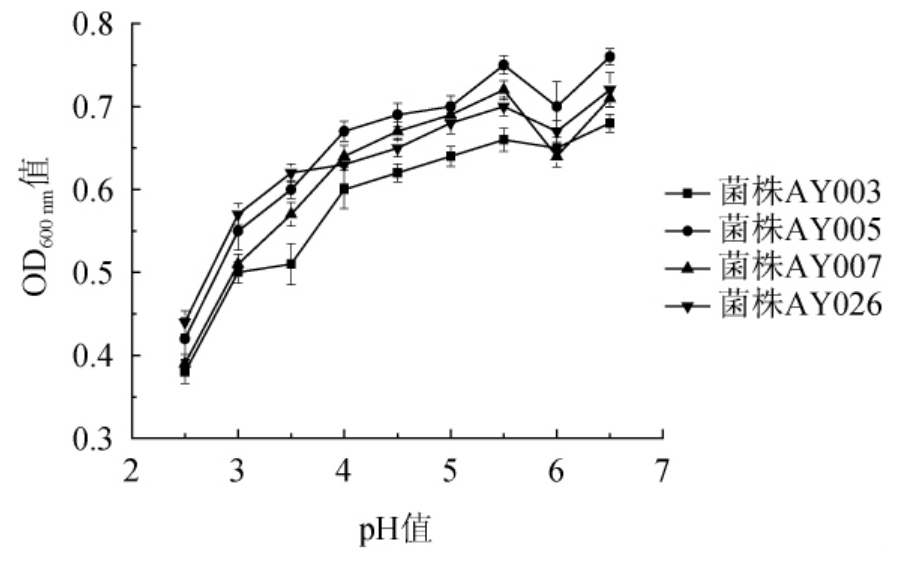
图1 酵母菌耐酸能力测试结果
Fig.1 Results of acid tolerance tests of yeasts
由图1可知,菌株AY003、AY005、AY007、AY026在pH 4.0~6.5的范围内均能保持较好的生长趋势(与接种于正常YPD培养基上的菌株的OD600nm值做比较),因此,这四株酵母菌在酸性环境中良好繁殖。当pH值降至2.5时,这四株菌株的生长繁殖受到显著抑制,且AY003和AY007对pH值的变化较敏感。然而当pH为3.0时,四株菌株测定的OD600nm值仍>0.5,推测这四株酵母可以更有利于面制品的醒发。
2.3.4 发酵力测试结果
酵母菌可以利用水解后的糖进行发酵,并产生大量的CO2、乙醛以及乙醇,使面制品产生独特风味,大量的CO2可使面团膨胀,膨胀速率和产气量通常被用作为酵母菌发酵能力的指标[23]。通过国标GB/T 20886—2007《食品加工用酵母》方法,测定菌株AY003、AY005、AY007和AY026的发酵力,结果见图2。
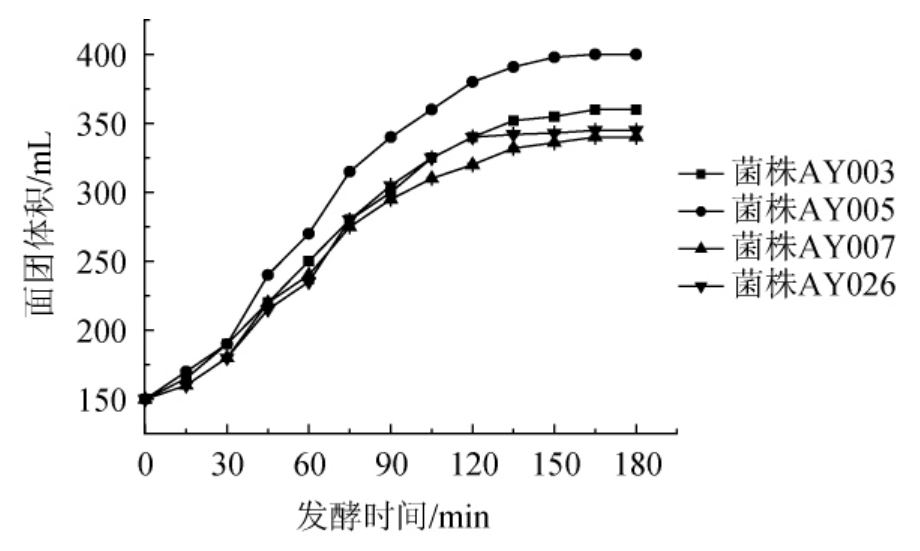
图2 不同酵母菌对发酵面团体积的影响
Fig.2 Effect of different yeasts on fermented dough volume
由图2可知,在发酵前30 min,酵母菌AY003、AY005、AY007和AY026的发酵面团体积膨胀程度较小,之后,曲线的斜率逐渐变大,体积增长速率相对稳定,并且在发酵过程中体积相对平稳地增加,这个结果与胡丽花等[23]的研究结果一致。因此,通过判断认为筛选获得的四株酵母菌株均具有良好的稳定性。但是,菌株AY005的发酵力相比于其他3株菌株的发酵力较好,面团膨胀体积最大可至250 mL,发酵性能最优。
2.3.5 耐冻藏能力测试结果
酵母菌AY003、AY005、AY007和AY026分别在-18 ℃保存10 d、20 d、30 d、40 d、50 d、60 d的活酵母菌数结果见图3。
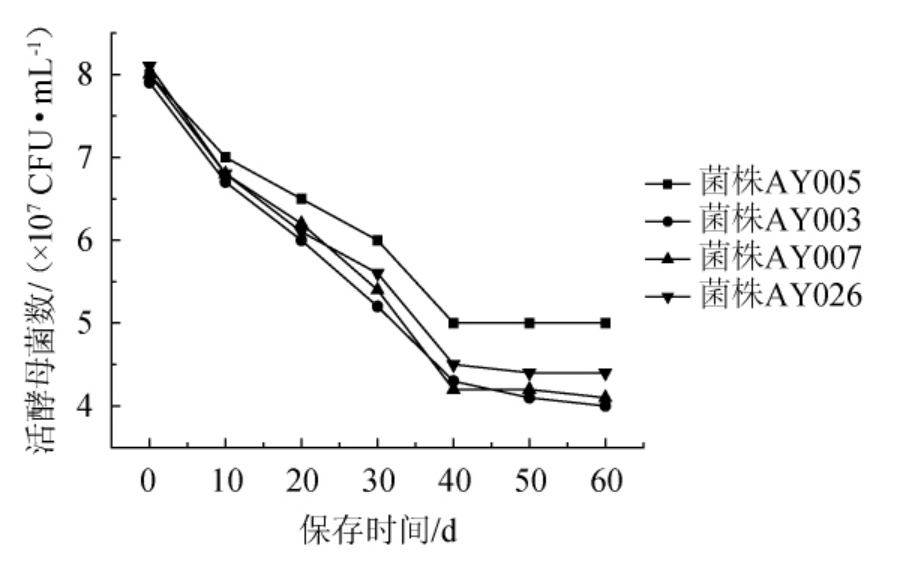
图3 -18 ℃下保存时间对酵母菌生长的影响
Fig.3 Effect of storage time on yeasts growth at -18 ℃
由图3可知,4株菌的活酵母菌数随贮藏时间的延长逐渐减少。0~40 d期间,4株菌的活酵母菌数都随着时间的增加逐渐下降,40 d后活酵母菌数变化较少。菌株AY003的存活率由100%下降到50.6%;菌株AY007的存活率下降到51.3%;菌株AY026存活率下降到54.3%;菌株AY005的存活率由100%下降到62.5%,随后酵母菌活力不变,活酵母菌数维持在5.03×107CFU/mL不再下降。相关研究表明,酵母通常不会在0 ℃以下或47 ℃以上增殖[15]。说明,菌株AY005相比其他3株菌株,在-18 ℃环境下储存60 d,酵母菌存活率高,具有比较不错的发酵活力,耐冷冻能力较高。因此,选择菌株AY005为目标菌株。
2.4 分子生物学鉴定
通过双向测序确定菌株AY005的18S rDNA D1/D2区域的序列。用Sequencher软件拼接测得的DNA序列,将所获得的序列通过BLAST在GenBank核酸序列数据库中进行同源序列的搜索及相关信息的检索,结果见图4。
用MEGA5.2 Tree软件构建18S rDNA的系统发育树,结果见图4。

图4 菌株AY005基于18S rDNA序列的系统发育树
Fig.4 Phylogenetic tree of strain AY005 based on 18S rDNA sequences
由图4可知,菌株AY005与Saccharomyces cerevisiae JCABSC23菌株为一支,同源性最近,结合两者D1/D2序列一致性为100%,结合形态学观察及生理生化试验,菌株AY005被鉴定为酿酒酵母(Saccharomyces cerevisiae)。
2.5 酵母菌生长曲线的绘制
多数酵母菌的生长包含四个阶段:滞后期,对数生长期,稳定生长期和衰变期。然而,每个阶段的时间和酵母菌的种类有关。酿酒酵母AY005在30 ℃、150 r/min下振荡培养,每2 h取5 mL菌液,用无菌蒸馏水稀释3倍后,测量OD600nm值[24]。酵母菌AY005的生长曲线见图5。
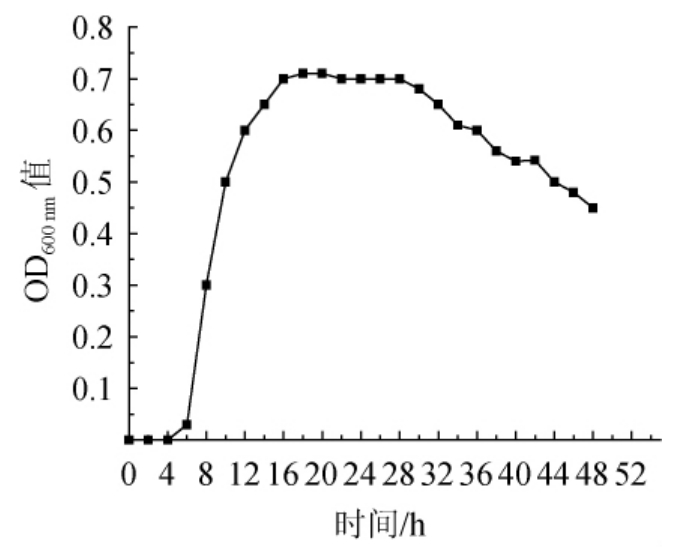
图5 酵母AY005的生长曲线
Fig.5 Growth curve of yeast AY005
由图5可知,前4 h是酿酒酵母AY005的延滞期,是因为酵母处于新的生长环境中并且需要一些酶,辅酶和一些中间代谢物,为了适应新环境,为细胞分裂做准备[25]。在对滞后期进行短暂调整后,培养时间为4~16 h酵母进入快速分裂和繁殖阶段的对数生长期,可将处于对数生长期的酵母做成干酵母应用于工业生产,具有一定的工业应用前景。培养时间为16~28 h是酿酒酵母AY005的稳定期,新传代的酵母几乎与酵母菌死亡达到动态平衡。随之,死亡酵母菌的数量逐渐超过新生酵母的数量,并且种群中的活细菌数量减少,并且曲线下降,培养时间为28~48 h是酿酒酵母AY005的衰亡期[19]。
3 结论
本实验从冷冻的老面中筛选得到一株耐冻藏酵母菌AY005,产气效果好,发酵力佳,面团膨大体积最大达到250 mL,在-18 ℃环境下储存60 d存活率为62.5%,表现出较好的耐冻藏能力,经形态学、生理生化和18S rDNA序列分析被鉴定为酿酒酵母(Saccharomyces cerevisiae),发现4~16 h为其对数生长期,可将处于对数生长期的酵母做成干酵母应用于工业生产,具有一定的工业应用前景。本实验对耐冻藏酵母菌AY005在冷冻面制品的应用提供了一定的理论基础,其抗冻机理还有待进一步研究。
[1]张云焕,赵文华,马军涛,等.速冻面制食品品质改良剂的研究进展[J].食品与发酵工业,2017,43(4):295-302.
[2]段人钰.速冻发酵面制品技术研究[D].天津:天津商业大学,2014.
[3]INOUE Y,BUSHUK W.Studies on frozen dough II.Flour quality requirements for bread production from frozen dough[J].Cereal Chem,1992,69(4):423-428.
[4]樊少飞,吴卫国,廖卢艳,等.南方馒头冷冻面团生产技术研究[J].中国酿造,2019,38(2):148-152.
[5]SELOMULYO V O,ZHOU W.Frozen bread dough:effects of freezing storage and dough improvers[J].J Cereal Sci,2007,45(1):1-17.
[6]程玉来,赵爽.传统面食发酵中的酵母菌的发酵性能分析[J].食品工业,2011(3):77-80.
[7]陈君,缪冶炼,尤业兵,等.抗冻酵母AFY-1 的菌种同源性及发酵能力[J].中国食品学报,2016,16(10):59-65.
[8]陈叶福,刘青,肖冬光.耐冷冻高糖面包酵母菌株的选育[C]//全国发酵工程学术研讨会,2006:105-108.
[9]滕超,曲玲玉,师雨梦,等.传统面食发酵剂中酵母菌的筛选及性能研究[J].中国食品学报,2017,17(11):74-81.
[10]范秀容,沈萍.微生物学实验[M].北京:北京人民教育出版社,1989:130-131.
[11]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,2011:87-89.
[12]巴尼特J A.酵母菌的特征与鉴定手册[M].胡瑞卿译.青岛:青岛海洋大学出版社,1990:364-367.
[13]郭勇.酶工程[M].北京:中国轻工业出版社,2004:49-60.
[14]周洪禄,李梦琴,冯蕾.不同酵母对冷冻面团发酵特性及馒头品质的影响[J].食品与发酵工业,2011,37(11):56-59.
[15]中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.国标GB/T 20886—2007 食品加工用酵母方法[S].北京:中国标准出版社,2007.
[16]李春慧,蒲万霞,吴润.酵母菌制剂保存的稳定性研究[J].湖北农业科学,2015,54(7):1661-1664.
[17]肖新云,刘又嘉,邓艳玲,等.1 株小鼠肠道酵母菌的分离与鉴定[J].湖南农业大学学报,2016,42(4):419-423.
[18]李绍兰,周斌,杨丽源,等.真菌DNA 提取方法的改良[J].云南大学学报,2002,24(6):471-472.
[19]丁娟芳,杨嘉,朱淑云,等.扬州酱菜中降解亚硝酸盐乳酸菌的筛选、鉴定及性能研究[J].中国酿造,2018,37(12):87-91.
[20]耿瑞玲.酵母抗冻性研究及其在冷冻面团中的应用[D].郑州:河南农业大学,2011.
[21]MA M,LIU Z L.Mechanisms of ethanol tolerance in Saccharomyces cerevisiae[J].Appl Microbiol Biot,2010,87(3):829-845.
[22]BHATTACHARYA M,LANGSTAFF T M,BERZONSKY W A.Effect of frozen storage and freeze-thaw cycles on the rheological and baking properties of frozen doughs[J].Food Res Int,2003,36(4):365-372.
[23]胡丽花.传统主食馒头发酵剂微生物的筛选及对馒头品质的影响[D].郑州:河南工业大学,2010.
[24]杨小冲,陈忠军,赵洁,等.耐高酒精野生酵母菌株的筛选及其特性研究[J].中国酿造,2017,36(8):67-71.
[25]陈玮,董秀芹.微生物学及实验实训技术[M].北京:化学工业出版社,2007:91.