葡萄酒品质受葡萄品种和发酵过程中微生物种群的影响,而香气物质是决定葡萄酒品质的重要因素之一。葡萄酒香气由多种挥发性化合物构成,包括醇类、酯类、酸类、萜烯类等物质,主要来源于葡萄品种、发酵过程和后期陈酿[1]。这些挥发性化合物因其极性、挥发性和浓度的不同,从而使葡萄酒具有不同的风味独特性[2]。香格里拉产区赤霞珠冰酒是在自然温度降到-8℃以下时(有的产酒规规定-7℃),对冰葡萄进行采摘,以冰冻状态进行压榨酿制而成。所酿酒通常具有蜂蜜、成熟的蜜瓜、菠萝、玫瑰以及葡萄干等风味,其风味的形成与产区气候环境、发酵工艺条件关系密切。
酿酒酵母(Saccharomyces cerevisiae)在发酵过程中产生的香气物质对葡萄酒风味有重要影响,是葡萄酒挥发性化合物的重要组分[3]。由酵母发酵过程中产生的挥发性化合物主要包括高级醇、中链和长链脂肪酸、脂肪酸乙酯、乙基酯、醛类等物质[4]。酵母产香能力不仅受菌种影响,而且与产糖苷酶性能强的菌株存在一定联系[5]。不同酵母发酵同一葡萄酒所产生的风味物质差异明显[6],主要由于酵母释放葡萄品种风味前体和从头合成的能力不同[7]。相关研究发现,本土酵母能增加葡萄酒的口感复杂性和圆润度,更好的适应当地气候和发酵环境,保证葡萄酒发酵的顺利进行[8]。因此,筛选合适的本土酵母对葡萄酒生产至关重要。
本研究采用4株香格里拉本土酵母(CZ10、CZ11、BZL10、BZL12)与商业酵母DV10发酵赤霞珠冰酒,通过顶空-固相微萃取(head space-solid phase microextraction,HP-SPME)和气相色谱质谱联用(gas chromatography-mass spectrometry,GC-MS)技术检测分析冰酒的挥发性香气物质,并利用感官评定比较其感官品质优劣,旨在探究香格里拉本土酵母和进口商业干酵母发酵赤霞珠冰酒的香气物质和感官差异性,为香格里拉产区特色冰酒的挖掘和适宜冰酒酿造的酵母菌株选育提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和原料
酿酒酵母(Saccharomyces cerevisiae)菌株CZ10、CZ11、BZL10、BZL12:均筛选于香格里拉葡萄酒产区梅里冰酒庄葡萄园(泰山学院微生物菌种保藏中心);商业酵母菌株DV10:法国拉曼公司。
赤霞珠葡萄:选自云南香格里拉太阳魂酒庄产业有限公司梅里冰酒庄。
1.1.2 化学试剂
乙酸乙酯、乙酸异丁酯、乙酸异戊酯、乙酸-2-苯乙酯、2-甲基丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯、十二酸乙酯、正丙醇、异丁醇、异戊醇、2-苯乙醇、乙酸、3-甲基丁酸、2-甲基丙酸、己酸、辛酸和癸酸(纯度均>98%):美国Sigma公司;内标物4-甲基-2-戊醇(纯度>98%):美国Aldrich公司;氯化钠(分析纯):国药化学试剂有限公司;果胶酶(酶活4 150 U/g):法国拉曼公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:酵母提取物1%,蛋白胨2%,葡萄糖2%,pH自然,在121℃条件下灭菌15 min。固体YPD培养基添加2%琼脂粉。
1.2 仪器与设备
QP2010Plus气质联用仪:日本岛津公司;5417C型离心机:德国Eppendorf公司;MP220K pH计:瑞士METTLER TOLEDO公司;手动SPME进样器、50/30 μm DVB/CAR/PDMS固相微萃取萃取头:美国Supelco公司。
1.3 方法
1.3.1 赤霞珠冰酒工艺流程及操作要点
成熟葡萄→除梗破碎→低温浸渍→酒精发酵→皮渣分离→自然澄清→陈酿→过滤→灌装→包装
操作要点:葡萄原料含糖量达到350 g/L时进行采摘,除梗破碎,添加总二氧化硫达到30 mg/L;如桶浸渍,浸渍温度5℃,浸渍时间120 h;果胶酶添加量30 mg/L;接种酵母(取试管斜面酵母于三角瓶中37℃活化30 min,转接到发酵醪中),接种量1×107个/mL;进行发酵(发酵温度12℃);酒精发酵期间每12 h取样检测酒精度,每次3个重复;酒精度达到13%vol时,分离皮渣,生葡萄酒转入新罐,添加总二氧化硫60 mg/L;低温2℃冷冻处理15 d;分离酒脚,澄清酒转入新罐,检测游离二氧化硫,保证其含量20 mg/L;葡萄酒密封陈酿(温度13℃),利用惰性气体(氮气)封罐,持续到来年10月发酵季节;过滤灌装得冰酒。
1.3.2 理化指标测定
酒样的pH、总酸、挥发酸、总糖和酒精度测定参照GB 15038—2006《葡萄酒、果酒通用分析方法》中的pH计法、酒精计法、总糖直接滴定法、总酸测定指示剂法、挥发酸测定方法。
1.3.3挥发性香气物质的测定[9-10]
冰酒香气物质测定采用HS-SPME-GC-MS法。挥发性香气物质的提取:萃取头放入进样口280℃老化30 min。在20 mL顶空瓶中,加入8 mL葡萄酒,2 g NaCl和20 μL内标物(4-甲基-2-戊醇,质量浓度为2 g/L)。放置于45℃的可加热磁力搅拌器上,预热10 min。将老化好的萃取针插入顶空瓶,45℃进行萃取,萃取50 min后插入GC-MS进样口,250℃解吸10 min。
气相色谱条件:DB-WAX色谱柱(30m×0.25mm×0.25μm);进样口温度250℃;升温程序:40℃下保持2 min,然后以1℃/min的速度升到45℃,保持2 min,3℃/min的速度升到84℃,保持2 min,5℃/min的速度升到230℃,保持5 min,载气为氦气(He)。平均线速度为25 cm/s;不分流进样。
质谱条件:电子电离(electronic ionization,EI)源;电子能量70 eV;离子源温度230℃;检测器温度250℃;质量扫描范围30~400 m/z。
定性定量分析:分析结果美国国家标准技术研究(national institute of standards and technology,NIST)08和WILEY7谱库进行初步检索及资料分析,再结合文献进行人工谱图解析,确认香气物质的各个化学成分。采用内标法进行定量。
1.3.4 感官评价
不同酵母发酵的酒样放在通风良好、无任何气味的房间内,分别由专业人员采用定量描述分析法(quantitative descriptive analysis,QDA)进行酒样感官的定性和定量评价[11],整体评价满分为100分,具体评价标准见表1。
表1 冰酒感官评价标准
Table 1 Sensory evaluation standard of ice wine

项目 分值外观透明度(5分)挂杯(5分)色泽(5分)
续表

注:总分>86分为极好;81~85分为好;71~80分为较好;50~70分为一般;<50分为差。
项目 分值香气味觉香气纯净度(14分)芳香度(16分)甜度(5分)酸度(5分)浓度(8分)酒质(8分)留香(8分)酒体(10分)绵延度(6分)滑度(5分)
1.3.5 统计分析
数据采用SPSS 19.0软件进行分析。实验重复3次。
2 结果与分析
2.1 赤霞珠葡萄冰酒理化指标分析
对酿酒酵母菌株CZ10、CZ11、BZL10、BZL12及商业酵母DV10发酵赤霞珠冰酒样品进行理化指标测定,结果见表2。由表2可知,各酵母发酵酒样的基本理化指标差别不大,均符合相关国标要求。本土酵母所发酵酒样较商业酵母DV10具有较低的挥发酸和总酸含量,其中本土酵母BZL10挥发酸含量最低,为0.54 g/L;CZ10的总酸含量最低,为6.3 g/L。总糖测定结果发现,本土酵母发酵酒样的总糖含量整体较高,其中CZ10总糖含量为126.7 g/L,BZL12为121.82g/L,均高于商业酵母DV10发酵酒样总糖含量110g/L。
表2 不同酵母发酵冰酒理化指标测定结果
Table 2 Determination results of physicochemical indexes of ice wines fermented by different yeasts

注:同列小写字母不同表示差异显著(P<0.05)。
酵母 酒精度/%vol总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1) pH值DV10 CZ10 CZ11 BZL10 BZL12 13.0±0.20a 13.0±0.23a 13.1±0.05a 13.1±0.15a 13.0±0.09a 110.60±2.73c 126.70±2.34a 117.25±1.98b 107.00±1.87a 121.82±3.21c 6.65±0.11c 6.30±0.09a 6.45±0.05c 6.48±0.10c 6.54±0.07b 0.59±0.01a 0.55±0.01a 0.56±0.01a 0.54±0.01a 0.57±0.01a 3.20±0.06c 3.39±0.03ab 3.33±0.02a 3.25±0.09a 3.24±0.12a
2.2 赤霞珠葡萄冰酒发酵动力学分析
发酵醪接种酵母后进行糖度的测定,结果见图1。由图1可知,本土酵母BZL12接种2 d后糖度开始下降,起酵迅速;商业酵母DV10在接种4 d后起酵;酵母BZL10在第5天起酵;酵母CZ10、CZ11在第6天起酵。当酒精度接近13%vol的终止发酵,此时酵母BZL12糖度为7.8°Be,发酵周期最短,共35 d;其次是菌株BZL10糖度为7.1°Be,发酵周期共37 d;酵母CZ10和CZ11糖度分别为8 °Be和7.5 °Be,发酵周期分别为45 d和41 d;酵母DV10发酵周期最长,为47 d,糖度为7.2°Be。因此,本土酿酒酵母发酵周期都较短,可能与本土酵母更加适应当地的发酵环境有关系,其中酿酒酵母BZL12表现最佳(发酵周期35 d)。
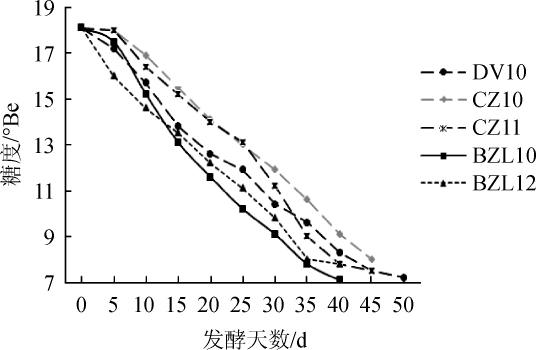
图1 五株酵母的发酵动力学曲线
Fig.1 Fermentation kinetics curves of five yeasts
2.3 赤霞珠葡萄冰酒挥发性化合物分析
试验对五株酵母发酵冰酒样进行香气物质的定性定量分析,检测结果见表3。由表3可知,五种酿酒酵母发酵赤霞珠葡萄冰酒共检测到67种挥发性化合物,主要包括醇类、酯类、酸类、酮类、萜烯类。其中酵母BZL12检测到62种香气物质,种类最多,含量最高(490.02 mg/L);酵母BZL10次之,检测到60种香气物质,含量474.06 mg/L;酵母CZ11检测到59种香气物质,含量434.80 mg/L;酵母DV10和CZ10种类较少,分别检测到56和54种香气物质,含量分别为469.05 mg/L、410.67 mg/L。
酵母BZL12酯类物质含量最高,为145.31 mg/L,酵母CZ10、CZ11及BZL10酯类物质含量分别为78.24 mg/L、96.58 mg/L及130.22 mg/L,均比酵母DV10酯类物质含量(125.14 mg/L)低。酯对葡萄酒香气中的花香和果香贡献非常大[12-13]。其中,乙酸乙酯能产生愉悦的、甜的水果香,己酸乙酯产生果香或苹果香,辛酸乙酯产生菠萝、梨的果香,癸酸乙酯产生花香,月桂酸乙酯与果香有关,乙酸异戊酯则产生香蕉味,这些酯类是酵母发酵酒中的主要酯类[14]。
酵母BZL12、CZ10、CZ11及BZL10醇类物质含量在323.80~337.66 mg/L之间,均与酵母DV10醇类物质含量(335.22 mg/L)差别不大。正丙醇、异丁醇、异戊醇和2-苯乙醇是酵母合成的主要高级醇[15],其中,异戊醇是主要的高级醇,5株酵母异戊醇含量229.68~236.85 mg/L,差异不大。
酵母BZL12、CZ10、CZ11及BZL10萜烯类物质含量在0.11~0.18mg/L之间,均与酵母DV10醇类物质含量(0.16mg/L)差别不大。
酵母CZ10酮类物质含量最高,为2.75mg/L,酵母CZ11、BZL10及BZL12酮类物质含量分别为1.82 mg/L、1.64 mg/L及1.73 mg/L,均比酵母DV10酮类物质含量(2.28 mg/L)低。
表3 不同酵母菌株发酵冰酒挥发性香气化合物
Table 3 Volatile aroma compounds of ice wine fermented by different yeast strains mg/L

香气化合物 DV10 CZ10 CZ11 BZL10 BZL12酯类乙酸乙酯丁酸乙酯乙酸异戊酯戊酸乙酯己酸甲酯丙酸戊酯己酸乙酯乙酸己酯庚酸乙酯2-己烯酸乙酯己酸异丁酯乙酸庚酯辛酸甲酯辛酸乙酯己酸异戊酯7-辛烯酸乙酯辛酸丙酯壬酸乙酯辛酸异丁酯癸酸甲酯癸酸乙酯辛酸-3-甲基丁酯乙基-9-壬烯变酸酯癸酸正丙酯十一酸乙酯癸酸异丁酯苯乙酸乙酯月桂酸甲酯乙酸-2-苯乙酯月桂酸乙酯癸酸-3-甲基丁酯己酸-4-辛基乙酯肉豆蔻酸乙酯棕榈酸乙酯小计醇类正丙醇异丁醇正丁醇异戊醇正戊醇23.85±1.24 0.59±0.78 3.31±0.53 0.02±0.00 0.06±0.02 n.d.9.41±1.94 0.21±0.01 0.57±0.01 0.22±0.00 0.01±0.00 0.05±0.01 0.26±0.02 57.63±4.89 0.12±0.01 n.d.0.13±0.01 0.08±0.00 n.d.1.52±0.01 36.24±6.39 0.37±0.01 1.42±0.04 n.d.0.11±0.02 n.d.n.d.0.05±0.01 1.91±0.01 6.48±1.20 0.13±0.01 n.d.0.27±0.00 0.12±0.00 125.14 43.73±2.51 0.37±0.74 1.98±1.83 0.01±0.04 0.06±0.00 n.d.8.48±1.56 0.19±0.03 0.41±0.02 0.21±0.00 n.d.0.03±0.01 0.27±0.01 31.64±8.33 0.14±0.01 n.d.n.d.0.08±0.00 1.29±0.01 1.99±0.02 19.77±1.28 0.34±0.06 0.95±0.02 n.d.0.20±0.04 n.d.n.d.0.05±0.00 0.80±0.00 4.68±1.43 0.14±0.32 n.d.0.29±0.00 0.14±0.01 78.24 44.04±1.57 0.48±0.18 2.46±0.73 0.02±0.00 0.05±0.01 0.02±0.00 10.34±1.23 0.15±0.04 0.49±0.02 0.26±0.00 n.d.0.04±0.02 0.32±0.03 40.55±5.98 0.18±0.00 n.d.0.13±0.00 0.08±0.01 n.d.1.19±0.03 26.65±2.98 0.47±0.01 0.74±0.00 n.d.0.16±0.00 n.d.0.04±0.01 0.44±0.01 0.75±0.02 5.79±2.66 0.20±0.00 n.d.0.35±0.00 0.19±0.02 96.58 33.97±5.39 0.53±0.92 2.77±0.85 0.03±0.08 0.05±0.01 18.35±1.07 9.34±1.66 0.14±0.02 0.42±0.03 0.40±0.01 n.d.0.04±0.01 0.27±0.01 42.99±2.19 0.23±0.01 0.27±0.01 0.13±0.01 0.16±0.01 0.16±0.03 1.10±0.01 38.27±8.73 0.89±0.01 3.23±0.04 0.14±0.00 0.12±0.01 n.d.n.d.0.03±0.00 0.94±0.01 4.58±1.84 0.26±0.01 n.d.0.24±0.01 0.17±0.00 130.22 53.56±1.68 0.58±0.79 3.43±0.99 0.02±0.00 0.06±0.01 n.d.11.07±1.74 0.21±0.04 0.45±0.01 0.33±0.00 n.d.0.07±0.01 0.42±0.01 68.66±2.57 0.28±0.01 0.33±0.01 0.14±0.01 0.22±0.00 0.31±0.02 1.31±0.05 35.08±2.09 1.86±0.01 5.22±1.03 0.06±0.00 0.18±0.03 0.07±0.00 n.d.0.06±0.01 1.26±0.03 8.52±2.87 0.59±0.01 0.17±0.01 0.58±0.00 0.21±0.00 145.31 10.89±3.29 72.05±6.37 0.13±0.00 234.32±3.94 0.02±0.00 10.76±4.19 71.22±8.92 0.14±0.00 229.68±9.62 0.03±0.00 10.88±2.74 71.52±4.73 0.15±0.00 233.03±8.45 0.02±0.00 10.95±4.83 71.97±9.36 0.16±0.01 236.85±8.11 0.03±0.00 10.66±1.02 71.72±4.58 0.13±0.01 236.31±6.72 0.02±0.00
续表
注:“n.d.”表示低于检测限,未检出。
香气化合物 DV10 CZ10 CZ11 BZL10 BZL12 4-甲基-1-戊醇正己醇3-乙氧基丙醇庚醇2,3-丁二醇3-甲基-2-丁醇正辛醇丙二醇壬醇3-甲硫基丙醇1-癸醇苯甲醇2-苯乙醇丙三醇小计萜烯类松油醇香茅醇小计酮类二异丁基酮3-羟基-2-丁酮2-壬酮小计酸类异丁酸异戊酸己酸庚酸反式-2-己烯酸糠酸辛酸癸酸月桂酸小计总计0.03±0.00 0.24±0.02 0.25±0.00 0.27±0.02 3.88±0.00 n.d.0.07±0.00 0.19±0.01 n.d.n.d.n.d.0.05±0.01 12.33±1.09 0.50±0.00 335.22 0.04±0.00 0.21±0.01 0.33±0.00 0.28±0.00 1.66±0.03 0.02±0.00 0.09±0.00 0.14±0.00 n.d.n.d.n.d.0.08±0.01 8.65±1.02 0.47±0.00 323.80 0.03±0.00 0.27±0.01 0.36±0.01 0.33±0.00 3.68±0.01 0.11±0.00 0.08±0.00 0.17±0.01 0.14±0.01 0.14±0.01 n.d.0.07±0.00 9.10±1.11 0.45±0.01 330.53 0.02±0.00 0.26±0.00 0.34±0.01 0.28±0.01 4.48±0.02 n.d.n.d.0.25±0.00 0.05±0.01 0.04±0.00 n.d.0.07±0.00 11.15±2.01 0.76±0.00 337.66 0.02±0.00 0.23±0.01 0.38±0.00 0.41±0.02 3.91±0.00 n.d.0.10±0.00 0.26±0.00 0.07±0.00 0.04±0.00 0.15±0.01 0.08±0.00 11.78±1.04 0.59±0.00 336.86 0.05±0.00 0.11±0.01 0.16 0.05±0.00 0.11±0.00 0.16 0.04±0.00 0.07±0.00 0.11 0.05±0.00 0.13±0.00 0.18 0.05±0.00 0.08±0.00 0.13 2.15±0.01 0.08±0.00 0.05±0.00 2.28 2.68±0.07 0.04±0.00 0.03±0.00 2.75 1.71±0.06 0.07±0.00 0.04±0.00 1.82 1.58±0.09 0.04±0.00 0.02±0.00 1.64 1.64±0.00 0.05±0.00 0.04±0.00 1.73 0.12±0.00 0.51±0.00 1.47±0.07 0.03±0.00 0.07±0.00 n.d.2.88±0.01 1.13±0.01 0.04±0.00 6.25 469.05 n.d.0.22±0.00 1.42±0.02 0.01±0.00 0.07±0.00 n.d.3.04±0.02 0.96±0.01 n.d.5.72 410.67 0.05±0.00 0.97±0.00 1.26±0.05 n.d.0.04±0.00 n.d.2.55±0.01 0.86±0.01 0.03±0.00 5.76 434.80 0.70±0.00 0.30±0.00 0.92±0.04 n.d.0.03±0.00 0.05±0.00 1.59±0.00 0.74±0.01 0.03±0.00 4.36 474.06 0.04±0.00 0.20±0.00 1.23±0.00 n.d.0.05±0.00 n.d.2.86±0.00 1.50±0.02 0.11±0.00 5.99 490.02
酵母BZL12酸类物质含量最高,为490.02 mg/L,其次是酵母BZL10(474.06 mg/L),酵母CZ10、CZ11酸类物质含量分别为410.67 mg/L、434.80 mg/L,均比酵母DV10酸类物质含量(469.05 mg/L)低。
综上所述,酵母BZL12发酵冰酒挥发性香气化合物检测到香气物质种类最多,含量最高,适合作为冰酒制备的优良菌株。
2.4 赤霞珠葡萄冰酒的感官分析
对5种酵母发酵的赤霞珠葡萄冰酒样品进行感官评定,结果见图2。由图2可知,各酵母在相同的感官特性上所表达的每种特性的强度不同。整体感官评价得分由高到低依次为:BZL12(95分)、CZ11(90分)、BZL10(80分)、CZ10(74分)、DV10(56分);酵母BZL12发酵的酒样花香、黑色浆果香、蜂蜜香比较明显,具有较低的生青味,可能与酵母合成大量的酯类有关[16];CZ11发酵的酒样坚果香、奶油香比较明显;CZ10和DV10菌株发酵酒样的生青味较大;而菌株BZL10具有较突出的奶油香。酵母菌株影响葡萄酒的香气[17-20]。不同酵母发酵赤霞珠葡萄酒香气物质存在差异性[18]。
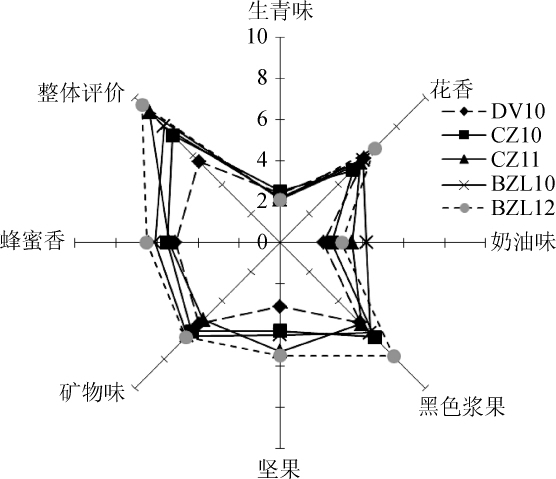
图2 各酵母菌株的二次判别分析数据蜘蛛网形图
Fig.2 Spider web chart of quadratic discriminant analysis data of yeast strains
3 结论
本土酵母BZL12发酵冰酒生成的香气物质种类最为丰富,香气物质含量最高,酯类和醇类总量均高于商业酵母DV10。感官分析结果表明,酵母BZL12发酵葡萄酒的整体评价最高,理化指标满足相关国标要求。在香格里拉产区冰葡萄酒酿造中,可以利用本土酵母BZL12替代商业酵母DV10增加冰酒香气的复杂性。此外,不同本土酵母具有生产不同风味特征葡萄酒的应用潜力,可以根据酵母的发酵性能、产香特性等酿造特定类型的葡萄酒。还可以用不同类型酵母按一定比例混合发酵,根据市场需求生产不同风味葡萄酒。
[1]SWIEGERS J H,BARTOWKSY E J,HENSCHKE P A,et al.Yeast and bacterial modulation of wine aroma and flavour[J].Aust J Grape Wine Res,2005,11(2):139-173.
[2]MAURIELLO G,CAPECE A,DĬAURIA M,et al.SPME-GC method as a tool to differentiate VOC profiles in Saccharomyces cerevisiae wine yeasts[J].Food Microbiol,2009,26(3):246-252.
[3]KING E S,SWIEGERS J H,TRAVIS B,et al.Coinoculated fermentations using Saccharomyces yeasts affect the volatile composition and sensory properties of Vitis viniferaL.cv.Sauvignon Blanc wines[J].J Agr Food Chem,2008,56(22):10829-10837.
[4]LAMBRECHTS M G,PRETORIUS I S.Yeast and its importance to wine aroma-A review[J].South Afr J Enol Viticult,2000,21(1):97-129.
[5]TORRENS J,URPI P,RIU-AUMATELL M,et al.Different commercial yeast strains affecting the volatile and sensory profile of cava base wine[J].Int J Food Microbiol,2008,124(1):48-57.
[6]WONDRA M,BOVERIC M.Analyses of aroma components of Chardonnay wine fermented by different yeast strains[J].Food Technol Biot,2001,39(2):141-148.
[7]UGLIANO M,BARTOWSKY EJ,MCCARTHY J,et al.Hydrolysis and transformation of grape glycosidically bound volatile compounds during fermentation with three Saccharomyces yeast strains[J].J Agr Food Chem,2006,54(17):6322-6331.
[8]CALLEJON R M,CLAVIJO A,ORTIGUEIRA P,et al.Volatile and sensory profile of organic red wines produced by different selected autochthonous and commercial Saccharomyces cerevisiaes trains[J].Anal Chim Acta,2010,660(1):68-75.
[9]BARBOSA C,FALCO V,MENDES-FAIA A,et al.Nitrogen addition influences formation of aroma compounds,volatile acidity and ethanol in nitrogen deficient media fermented by Saccharomyces cerevisiae wine strains[J].J Biosci Bioeng,2009,108(2):99-104.
[10]MENDES-FERREIRA A B C,FALCO V,LECDO C,et al.The production of hydrogen sulphide and other aroma compounds by wine strains of Saccharomyces cerevisiaein synthetic media with different nitrogen concentrations[J].J Ind Microbiol Biot,2009,36(4):571-583.
[11]李志江,牛广财,李兴革,等.定量描述分析(QDA)在葡萄酒感官评定中的应用研究[J].中国酿造,2009,28(6):158-160.
[12]TAO Y S,LI H,WANG H,et al.Volatile compounds of young Cabernet Sauvignon red wine from Changli County(China)[J].J Food Compos Anal,2008,21(8):689-694.
[13]KAFKAS E,CABAROGLU T,SELLI S,et al.Identification of volatile aroma compounds of strawberry wine using solid-phase microextraction techniques coupled with gaschro matography-masss pectro metry[J].Flavour Fragr J,2006,21(1):68-71.
[14]CAMELEYRE M,LYTRA G,TEMPERE S,et al.2-Methylbutyl acetate in wines:Enantiomeric distribution and sensory impact on red wine fruity aroma[J].Food Chem,2017,237(15):364-371.
[15]DE-LA-FUENTE-BLANCO A,SÁENZ-NAVAJAS M P,FERREIRA V.Onthe effect so fhigher alcoholson red wine aroma[J].Food Chem,2016,210(1):107-114.
[16]MOLINA AM,GUADALUPE V,VARELA C,et al.Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J].Food Chem,2009,117(2):189-195.
[17]WANG X J,TAO Y S,WU Y,et al.Aroma compounds and characteristics of noble-rot wines of Chardonnay grapes artificially botrytized in the vineyard[J].Food Chem,2017,226(1):41-50.
[18]李景明,于静,吴继红,等.不同酵母发酵的赤霞珠干红葡萄酒香气成分研究[J].食品科学,2009,30(2):185-189.
[19]ESCRIBANO-VIANA R,GONZÁLEZ-ARENZANA L,PORTU J,et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomycesyeasts[J].Food Res Int,2018,112:17-24.
[20]王倩倩,覃杰,马得草,等.优选发酵毕赤酵母与酿酒酵母混合发酵增香酿造爱格丽干白葡萄酒[J].中国农业科学,2018,51(11):2178-2192.