我国农业生产中登记的农药达1 000多种。蔬菜种植过程中农药使用不合理、禁限用农药滥用等现象时有发生,导致农药残留问题日益突出,给人们健康带来极大的危害[1]。因此,农药多残留的分析监测对于指导农药的科学合理使用,保障食品安全具有重要意义。
目前,蔬菜农药多残留的分析方法主要有气相色谱法(gas chromatography,GC)[2-4]、高效液相色谱法(high performance liquid chromatography,HPLC)[5-7]、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)[8-10]和液相色谱-串联质谱联用法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[11-13]等。LC-MS/MS法因其具有选择性高、灵敏度高、适用范围广等特性而被广泛应用于农药多残留检测领域。在前处理技术方面,传统的前处理方法较为繁琐复杂,难以满足现代分析检测的要求。QuEChERS(quick,easy,cheap,effective,rugged,safe)技术将提取和净化同步进行的最新前处理技术,吸附剂选择是QuEChERS技术的关键环节之一,针对不同的样品,QuEChERS方法中不同的吸附剂能够产生不同的净化效果,不同的吸附剂组合也会带来不同的结果,由于其具有操作简单、便捷高效、溶剂用量小等特点,已被广泛应用于食品中农药残留的分析检测[14-18]。乙二胺-N-丙基硅烷(primary secondary amine,PSA)、十八烷基硅烷键合硅胶(C18)、石墨化炭黑(graphitized carbon black,GCB)等是QuEChERS前处理技术的常用吸附剂,可有效去除基质中的有机酸、糖类和色素等多种组分。GCB具有较好的除色素效果,但对多菌灵、噻菌灵等平面结构农药具有较强的吸附性,因此本实验不选用该吸附剂。
该研究采用QuEChERS前处理技术,结合高效液相色谱-串联质谱(HPLC-MS/MS)的高选择性、高灵敏度和强抗干扰能力等特点[19],建立了QuEChERS-HPLC-MS/MS快速测定蔬菜中29种农药残留的分析方法。该方法操作简便、灵敏度高、重现性好、分析速度快,适用于蔬菜中农药多残留的同时检测,为蔬菜中农药残留的风险监测提供了技术参考。
1 材料与方法
1.1 材料与试剂
29种农药标准品(纯度91.5%~99.7%):Dr.Ehrenstorfer GmbH公司;甲醇、乙腈、乙酸铵(均为色谱纯):德国Merck公司;甲酸(色谱纯):美国Sigma-Aldrich公司;十八烷基硅烷键合硅胶(C18)、N-丙基乙二胺(PSA):上海安谱科学仪器公司;氯化钠(分析纯):国药集团化学试剂有限公司。
菠菜、小白菜、黄瓜和韭菜等10种蔬菜样品从市场上随机抽取。
1.2 仪器与设备
SCIEX4500QTRAP串联质谱仪(配有可用于电喷雾电离的TurboV离子源)):美国ABSCIEX公司;LC30A液相色谱仪:日本岛津公司;AllegraX-15RCentrifuge离心机:美国贝克曼库尔特公司;Vortex-Genie2涡旋振荡器:美国Scientific Industries公司;PM5-2000TL超声波清洗器:普律玛仪器公司;Milli-Q超纯水系统:美国Millipore公司;ME204/02电子天平:梅特勒-托利多仪器有限公司。
1.3 方法
1.3.1标准溶液配制
分别准确称取适量的农药标准品,用甲醇溶解,配制质量浓度为10μg/mL的标准储备液,于-18℃保存。临用时,移取适量的标准储备液用空白样品基质提取液配制系列浓度的基质匹配标准工作溶液,现用现配。
1.3.2样品前处理
准确称取匀浆的样品5.0g,置于50mL聚丙烯离心管中,加入10 mL乙睛和3 g NaCl,涡旋混匀,超声提取30 min,以4750r/min转速离心5min,取上清液待净化。取2mL上清液置于含有25 mg C18+50 mg PSA吸附剂的离心管中,涡旋30 s,静置后取上清液过0.22 μm滤膜后,供HPLC-MS/MS测定。
1.3.3 仪器条件
(1)色谱条件
色谱柱:Waters XBridge C18(150 mm×2.1 mm,5 μm);柱温:40℃;进样量:2μL;流动相:A--5mmol/L乙酸铵-0.1%甲酸水;B--5mmol/L乙酸铵-甲醇;梯度洗脱程序:0~1.0min,5.0%B;1.0~3.5 min,5.0%~30.0%B;3.5~6.5 min,30.0%~90.0%B;6.5~9.5 min,90.0%B;9.5~9.6 min,90.0%~5.0%B;9.6~12 min,5.0%B。
(2)质谱条件
电离源:电喷雾电离(electrospray ionization,ESI)正离子模式;扫描方式:多反应监测模式;电喷雾电压:4500V;雾化气:50.0 psi;气帘气压力:30 psi;碰撞气体:Medium;辅助气流速:50psi;离子源温度:450℃。
1.3.4 条件优化
(1)色谱条件的优化
选择Waters XBridgeC18色谱柱(150mm×2.1mm,5μm)对29种农药进行分离分析,并比较了29种农药在乙腈-水与甲醇-水流动相体系中的色谱分离效果,进一步考察不同含量的流动相对分离效果的影响。
(2)质谱条件的优化
利用针泵进样将29种目标化合物注入质谱仪中优化质谱参数。首先选择全扫描模式确定29种化合物的母离子。结果表明29种化合物在正离子(ESI+)扫描模式下的质谱响应较高。对29种化合物进行二级碎片离子扫描,选择响应较高、干扰小的两个碎片离子用于定性定量分析,其中响应最高的碎片离子用于定量分析。最后优化各目标化合物的去簇电压、碰撞能量等质谱参数。
(3)提取溶剂的优化
该实验以标准添加样品对提取溶剂的种类进行了考察,比较了甲醇、0.5%甲酸甲醇、1.0%甲酸甲醇、乙腈、0.5%甲酸乙腈、1%甲酸乙腈6种溶剂的提取效果。
(4)净化方法的选择
蔬菜基质较为复杂,含色素、有机酸、维生素、蛋白质等多种成分[20],在提取过程中这些物质可能会和目标物一起被提取出来,这些共提物不仅干扰目标物的检测,而且可能会损害色谱柱,污染离子源,因此有必要进行净化处理。以菠菜样品基质为例,各净化方法对回收率的影响。该实验考察了25mgC18+25mgPSA、50mgC18+25mg PSA、100 mg C18+25 mg PSA、25 mg C18+50 mg PSA、50mgC18+50mgPSA、100mgC18+50mgPSA、25mgC18+100mg PSA、50 mg C18+100 mg PSA、100 mg C18+100 mg PSA这九种不同含量的净化剂组合对29种农药回收率的影响。
2 结果与分析
2.1 条件优化结果
2.1.1 色谱条件优化结果
结果表明目标化合物在5 mmol/L乙酸铵-0.1%甲酸水和5 mmol/L乙酸铵-甲醇组成的流动相中分离效率高、保留较好且质谱响应高。因此,该实验采用5 mmol/L乙酸铵-0.1%甲酸水和5 mmol/L乙酸铵-甲醇作为流动相。29种农药在MRM模式下的离子色谱图见图1。结果表明,29种目标化合物在11 min内可实现良好分离,峰形对称。
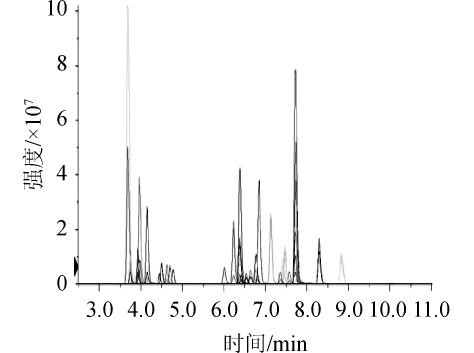
图1 29种农药在多反应监测模式下的离子色谱图
Fig.1 Ion chromatographs of 29 pesticides residues with multiple reaction monitoring mode
2.1.2 质谱条件的优化结果
29种农药的母离子、子离子、去簇电压、碰撞能量等重要质谱参数如表1所示,均为29种农药的最佳质谱参数。
表1 29种农药的母离子、子离子等重要质谱参数
Table 1 Precursor ions,products ions,and other important MS parameters of 29 pesticides residues
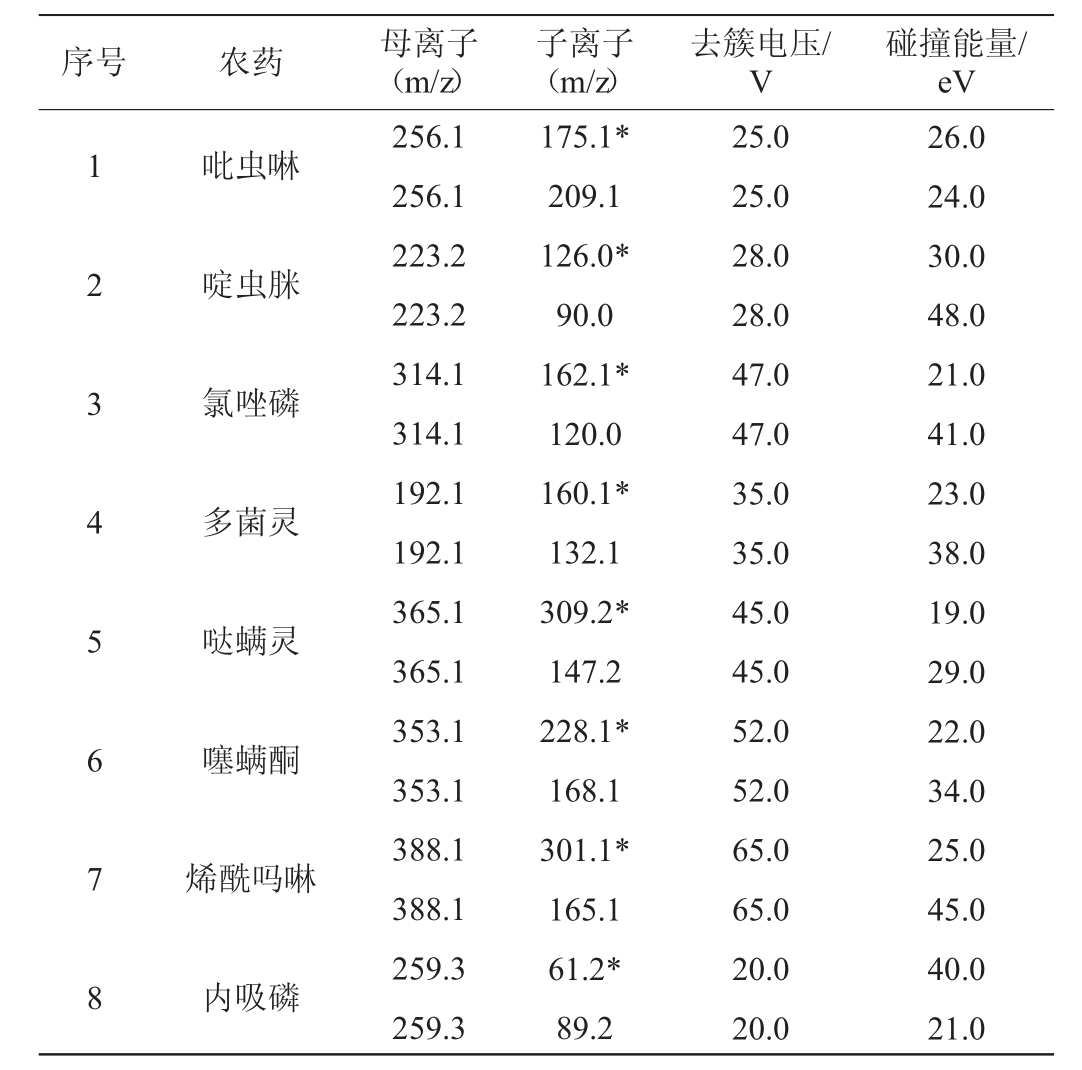
序号 农药 母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV 1 2 3 4 5 6 7 8吡虫啉啶虫脒氯唑磷多菌灵哒螨灵噻螨酮烯酰吗啉内吸磷256.1 256.1 223.2 223.2 314.1 314.1 192.1 192.1 365.1 365.1 353.1 353.1 388.1 388.1 259.3 259.3 175.1*209.1 126.0*90.0 162.1*120.0 160.1*132.1 309.2*147.2 228.1*168.1 301.1*165.1 61.2*89.2 25.0 25.0 28.0 28.0 47.0 47.0 35.0 35.0 45.0 45.0 52.0 52.0 65.0 65.0 20.0 20.0 26.0 24.0 30.0 48.0 21.0 41.0 23.0 38.0 19.0 29.0 22.0 34.0 25.0 45.0 40.0 21.0
续表
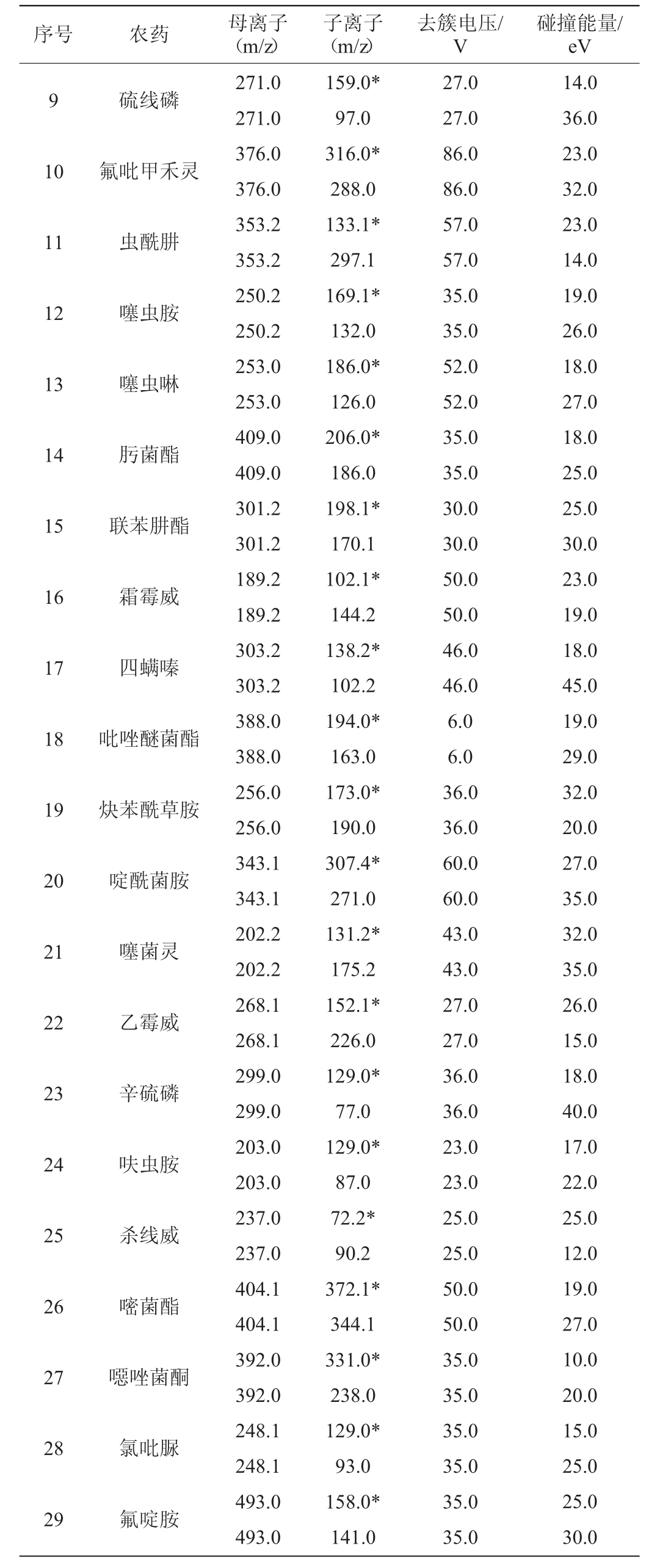
注:“*”表示定量离子。
序号 农药 母离子(m/z)子离子(m/z)去簇电压/V碰撞能量/eV 9硫线磷10氟吡甲禾灵11虫酰肼12噻虫胺13噻虫啉14肟菌酯15联苯肼酯16霜霉威17四螨嗪18吡唑醚菌酯19炔苯酰草胺20啶酰菌胺21噻菌灵22乙霉威23辛硫磷24呋虫胺25杀线威26嘧菌酯27噁唑菌酮28氯吡脲29氟啶胺271.0 271.0 376.0 376.0 353.2 353.2 250.2 250.2 253.0 253.0 409.0 409.0 301.2 301.2 189.2 189.2 303.2 303.2 388.0 388.0 256.0 256.0 343.1 343.1 202.2 202.2 268.1 268.1 299.0 299.0 203.0 203.0 237.0 237.0 404.1 404.1 392.0 392.0 248.1 248.1 493.0 493.0 159.0*97.0 316.0*288.0 133.1*297.1 169.1*132.0 186.0*126.0 206.0*186.0 198.1*170.1 102.1*144.2 138.2*102.2 194.0*163.0 173.0*190.0 307.4*271.0 131.2*175.2 152.1*226.0 129.0*77.0 129.0*87.0 72.2*90.2 372.1*344.1 331.0*238.0 129.0*93.0 158.0*141.0 27.0 27.0 86.0 86.0 57.0 57.0 35.0 35.0 52.0 52.0 35.0 35.0 30.0 30.0 50.0 50.0 46.0 46.0 6.0 6.0 36.0 36.0 60.0 60.0 43.0 43.0 27.0 27.0 36.0 36.0 23.0 23.0 25.0 25.0 50.0 50.0 35.0 35.0 35.0 35.0 35.0 35.0 14.0 36.0 23.0 32.0 23.0 14.0 19.0 26.0 18.0 27.0 18.0 25.0 25.0 30.0 23.0 19.0 18.0 45.0 19.0 29.0 32.0 20.0 27.0 35.0 32.0 35.0 26.0 15.0 18.0 40.0 17.0 22.0 25.0 12.0 19.0 27.0 10.0 20.0 15.0 25.0 25.0 30.0
2.1.3 提取溶剂的优化结果
不同提取溶剂中29种农药的提取回收率如图2所示。由图2可知,6种提取溶剂的平均回收率分别为55.93%、55.30%、56.06%、86.91%、77.98%和77.28%,这表明采用纯乙腈的提取效果优于其他5种提取试剂,且满足实验要求。
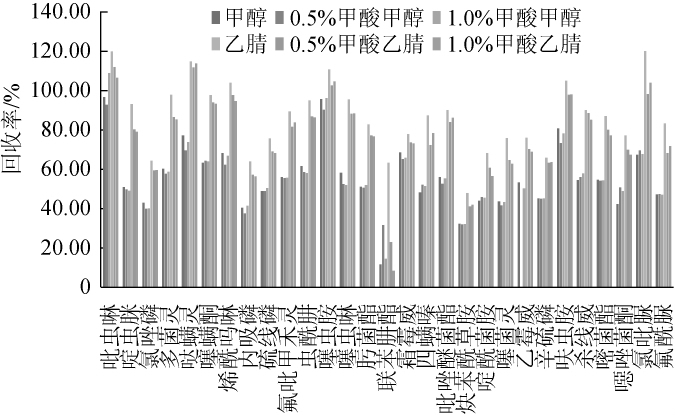
图2 不同提取溶剂对蔬菜中29种农药的提取效率
Fig.2 Extraction efficiencies of different extraction solvents for 29 pesticides residues in vegetables
2.1.4 净化方法的优化结果
不同净化剂对蔬菜中农药回收率的影响结果见图3。结果表明,25 mg C18+50 mg PSA净化效果最佳,对29种农药的平均回收率为90.76%,而其它8种吸附剂对29种农药的平均回收率均低于90%,且在霜霉威的回收率方面,25mg C18+50 mg PSA为72.07%,而50 mg C18+25 mg PSA、50 mg C18+50mgPSA、100mgC18+50mgPSA、25mgC18+100mg PSA、50 mg C18+100 mg PSA、100 mg C18+100 mg PSA均低于70%;啶酰菌胺的回收率方面25 mg C18+50 mg PSA为72.07%,而25 mg C18+25 mg PSA、50 mg C18+25 mg PSA、100 mg C18+25 mg PSA、50 mg C18+50 mg PSA也均低于68%。故选用25 mg C18+50 mg PSA吸附剂组合作为最优净化方案。
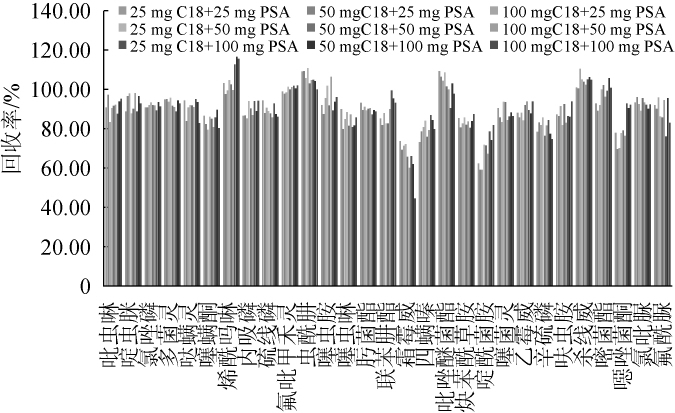
图3 不同净化剂对蔬菜中29种农药回收率的影响
Fig.3 Effect of different purificants on the recoveries of 29 pesticides residues in vegetables
2.2 基质效应
基质效应(matrix effect,ME)指目标分析物以外的其他组分对分析信号引起的增强或抑制现象,通常以基质标准曲线斜率与溶剂标准曲线斜率的比值来进行评价。若ME在0.80~1.20之间,基质效应可以忽略。反之,基质效应不可忽略[21]。本实验用菠菜、小白菜黄瓜和韭菜等10种蔬菜的空白基质提取液与纯溶剂分别配制系列浓度的混合标准工作溶液,通过比较标准曲线的斜率来评价基质效应。结果表明:以菠菜为例,除了氟吡甲禾灵存在一定的基质增强效应(ME>1.20),啶酰菌胺存在一定基质抑制效应(ME<0.80)外,其他农药的基质效应均在0.80~1.20之间。具体结果如表2所示。因此,该实验采用基质匹配标准工作溶液作校准曲线来降低基质效应对测定结果的影响。
表2 29种农药的基质效应
Table 2 Matrix effect of 29 pesticides

农药 ME 农药 ME吡虫啉啶虫脒氯唑磷多菌灵哒螨灵噻螨酮烯酰吗啉内吸磷硫线磷氟吡甲禾灵虫酰肼噻虫胺噻虫啉肟菌酯联苯肼酯0.91 1.02 0.98 0.87 1.02 0.92 0.99 0.96 1.01 1.45 1.09 0.97 0.95 0.96 1.07霜霉威四螨嗪吡唑醚菌酯炔苯酰草胺啶酰菌胺噻菌灵乙霉威辛硫磷呋虫胺杀线威嘧菌酯噁唑菌酮氯吡脲氟啶胺1.00 0.88 1.08 0.87 0.68 0.87 0.91 0.86 0.90 1.11 0.97 0.95 0.93 1.06
2.3 线性关系与定量限
用空白基质提取液配制系列浓度的29种农药混合标准工作溶液,以峰面积(y)为纵坐标,质量浓度(x)为横坐标绘制基质标准工作曲线。结果表明:在质量浓度范围内,霜霉威的响应值与其质量浓度线性关系较好,相关系数(R)为0.995 8,其他28种农药的响应值与其质量浓度均呈现良好的线性关系,相关系数(R)均大于0.999 0。以10倍信噪比(S/N)计算定量限(limit of quantitation,LOQ),该方法29种农药的定量限在0.40~8.00 μg/kg之间。选取阴性样品添加三个浓度水平(LOQ、4LOQ、20LOQ)的混合标准溶液,每个水平做6次平行实验,计算回收率和精密度,结果见表3。由表3可知,29种农药的加标回收率在64.62%~123.55%之间,相对标准偏差(rlative sandard deviation,RSD)在0.7%~14.3%之间,表明方法回收率高、精密度高,能够满足蔬菜中农药残留监测的要求。
表3 29种农药的线性范围、线性方程、定量限、加标回收率及相对标准偏差
Table 3 Linear ranges,linear equations,limits of quantification,recoveries and relative standard deviation of 29 pesticides

农药 线性范围/(ng·mL-1)线性方程R定量限/(μg·kg-1)低水平回收率/%RSD/% RSD/%4.2 3.0 1.7 2.4 3.1 3.1 3.6 2.5 1.6 1.6 2.0 1.8 2.6 4.2 2.2 3.3 2.5 1.4 2.0 5.7 0.9 2.5 2.6 2.1 3.8 11.1 3.0 2.3 2.5中水平回收率/%高水平回收率/% RSD/%吡虫啉啶虫脒氯唑磷多菌灵哒螨灵噻螨酮烯酰吗啉内吸磷硫线磷氟吡甲禾灵虫酰肼噻虫胺噻虫啉肟菌酯联苯肼酯霜霉威四螨嗪吡唑醚菌酯炔苯酰草胺啶酰菌胺噻菌灵乙霉威辛硫磷呋虫胺杀线威嘧菌酯噁唑菌酮氯吡脲氟啶胺1.00-100 0.25-50.0 0.20-40.0 0.50-50.0 0.25-50.0 0.40-80.0 0.50-50.0 0.25-50.0 0.50-50.0 0.25-50.0 0.40-80.0 1.00-100 0.25-50.0 0.25-50.0 0.50-50.0 0.50-50.0 0.50-50.0 0.25-50.0 0.50-50.0 1.50-150 0.50-50.0 0.50-50.0 0.50-50.0 4.00-200 0.50-50.0 0.20-40.0 1.00-100 0.50-50.0 1.00-100 y=1.07×104x+550 y=3.92×104x-510 y=1.09×105x+120 y=1.13×105x+400 y=1.31×105x+750 y=4.33×104x+1 760 y=3.24×104x+2 600 y=7.36×104x-3 100 y=1.20×105x+0.103 y=1.68×105x+700 y=1.39×105x+3 000 y=1.01×104x+0.031 y=4.27×104x-1 230 y=1.09×105x+1 860 y=2.74×104x+2 220 y=1.67×105x+1.7 y=3.00×104x-180 y=1.04×105x+1 600 y=3.80×104x+880 y=1.08×104x+1 240 y=6.93×104x+1 200 y=9.91×104x-1 100 y=4.59×104x+1 900 y=1.21×104x+1 600 y=5.21×104x+2 700 y=2.05×105x+4 900 y=1.69×104x-4 760 y=3.71×104x+4 440 y=1.87×104x-1 710 1.000 0 0.999 9 1.000 0 0.999 9 1.000 0 0.999 9 1.000 0 0.999 9 0.999 9 1.000 0 1.000 0 0.999 8 1.000 0 1.000 0 0.999 9 0.995 8 0.999 9 0.999 8 1.000 0 0.999 9 1.000 0 0.999 3 0.999 8 1.000 0 0.999 9 1.000 0 0.999 9 1.000 0 0.999 8 2.00 0.50 0.40 1.00 0.50 0.80 1.00 0.50 1.00 0.50 0.80 2.00 0.50 0.50 1.00 1.00 1.00 0.50 1.00 3.00 1.00 1.00 1.00 8.00 1.00 0.40 2.00 1.00 2.00 104.27 85.87 93.86 96.61 87.39 82.68 123.55 106.45 87.96 110.34 114.56 105.94 91.00 85.28 76.25 66.61 95.92 92.52 90.49 73.04 77.29 111.01 95.94 92.33 86.58 113.54 82.81 112.71 109.55 95.73 87.16 84.40 99.36 86.38 80.99 94.80 94.80 84.89 99.64 101.78 92.70 81.26 84.34 72.85 64.62 79.43 98.85 88.41 70.07 91.24 94.09 72.90 91.92 89.05 102.08 84.33 94.40 95.87 5.0 2.7 1.9 1.2 1.0 1.2 0.9 1.6 1.6 1.7 0.8 1.0 0.9 2.3 1.0 1.7 1.3 1.3 1.3 2.4 1.5 2.2 0.7 1.8 1.3 5.2 1.2 1.2 2.1 89.04 88.73 88.60 92.24 87.37 81.88 88.64 88.64 90.43 100.15 101.25 85.09 83.80 90.15 85.04 66.35 79.80 97.84 84.44 76.78 87.66 92.56 87.44 89.33 94.26 97.01 79.16 95.28 104.13 5.3 2.8 3.5 2.5 2.0 2.1 1.8 3.2 1.6 6.7 6.2 2.2 2.5 2.8 2.2 2.1 2.3 3.2 2.8 2.5 2.3 3.4 2.1 1.8 1.5 14.3 2.8 3.3 3.3
2.4 实际样品测定
利用该实验建立的方法对市场上购买的50份蔬菜样品进行检测,共检出20份阳性样品,小白菜、黄瓜、韭菜等样品中农药残留的检出率较高,检出频率较高的农药为多菌灵、啶虫脒、哒螨灵、烯酰吗啉、辛硫磷等杀菌剂和杀虫剂。该方法与国标方法的部分测定结果见表4。
表4 部分阳性样品农残检测结果
Table 4 Determination results of pesticides residues of practical positive samples

样品 农药小白菜韭菜含量/(mg·kg-1)本方法 GB/T 20769—2008啶虫脒多菌灵2.04 2.25 1.98 2.19
由表4可知,小白菜中的啶虫脒含量为2.04mg/kg,韭菜中的多菌灵含量为2.25 mg/kg,均超过了GB 2763—2016《食品安全国家标准食品中农药最大残留限量》规定的最大残留限量。该实验同时采用GB/T 20769—2008《水果和蔬菜中450种农药及相关化学品残留量的测定》标准方法对上述阳性样品进行测定来验证方法的准确性,其结果与本方法测得值相吻合。
3 结论
该实验以蔬菜为研究对象,建立了QuEChERS-HPLCMS/MS快速测定29种农药的分析方法。分别对样品前处理方法、色谱条件、质谱条件进行了优化,采用多反应监测模式检测,基质匹配标准溶液外标法定量,能够同时完成蔬菜中29种农药的定性和定量分析。该方法简单快速、灵敏可靠,为农药多残留的测定节约了分析时间,可广泛应用于蔬菜中29种农药的测定。
[1]仲维科,郝晋.我国食品的农药污染问题[J].农药,2000,9(7):1-4.
[2]洪泽淳,熊含鸿,刘莹莹,等.气相色谱法同时测定韭菜中16种有机磷农药残留[J].食品研究与开发,2018,335(10):137-141.
[3]吴巍,刘丹,孙静,等.气相色谱法测定人参提取物中3种农药残留[J].食品研究与开发,2017,38(8):115-117.
[4]党富民,向晓黎,罗瑞峰,等.气相色谱法快速测定有机磷农残方法的研究[J].食品工业,2017,38(10):301-304.
[5]侯如燕,蔡荟梅,张正竹,等.水果蔬菜中吡虫啉农药残留的液相色谱检测方法[J].世界农药,2010,32(1):53-53.
[6]何强,赵洁,孔祥红,等.HPLC法同时测定苹果及浓缩苹果汁中吡虫清等 4 种农药的残留量[J].分析实验室,2008,27(6):64-66.
[7]SANNINO A,BOLZONI L,BANDINI M J.Application of liquid chromatography with electrospray tandem mass spectrometry to the determination of a new generation of pesticides in processed fruits and vegetables[J].J Chromatogr A,2004,1036(2):161-169.
[8]程志,张蓉,刘韦华,等.气相色谱-串联质谱法快速筛查测定中药材中144 种农药残留[J].色谱,2014,32(1):57-68.
[9]王东,侯传金,赵尔成,等.分散液液微萃取/气相色谱-质谱法测定蜂蜜中六六六和滴滴涕类农药残留[J].色谱,2015,33(1):40-45.
[10]SURMA M K,SADOWSKA-ROCIEK A B,CIES′LIK E J.Evaluation of the QuEChERS method with GC-MS detection for the determination of organochlorine pesticides in food of animal origin[J].Food Anal Method,2014,7(2):366-376.
[11]吴岩,姜冰,徐义刚,等.QuEChERS-液相色谱-串联质谱法同时测定果蔬中 16 种农药残留[J].色谱,2015,33(3):228-234.
[12]王连珠,周昱,陈泳,等.QuEChERS样品前处理-液相色谱-串联质谱法测定蔬菜中66种有机磷农药残留量方法评估[J].色谱,2012,30(2):146-153.
[13]KANRAR B,MANDAL S,BHATTACHARYYA A.Validation and uncertainty analysis of a multiresidue method for 42 pesticides in made tea,tea infusion and spent leaves using ethyl acetate extraction and liquid chromatography-tandem mass spectrometry[J].J Chromatogr,2010,1217(12):1926-1933.
[14]OZGUR G,BULENT K.Evaluation of QuEChERS sample preparation and liquid chromatography-triple-quadrupole mass spectrometry method for the determination of 109 pesticide residues in tomatoes[J].Food Chem,2015,176:319-332.
[15]王连珠,周笠,黄小燕,等.基于QuEChERS提取方法优化的液相色谱-串联质谱法测定蔬菜中51种氨基甲酸脂类农药残留[J].色谱,2013,31(12):1136-1175.
[16]CIESLIK E,SADOWSKA-ROCIEK A,RUIZ J,et al.Evaluation of QuEChERS method for the determination of organochlorine pesticide residues in selected groups of fruits[J].Food Chem,2011,125:773-778.
[17]SACK C,SMOKER M,CHAMKASEM N,et al.Collaborative validation of the QuEChERS procedure for the determination of pesticides in food by LC-MS/MS[J].J Agr Food Chem,2011,59(12):6383-6411.
[18]PAREJA L,CESIO V,HEINZEN H,et al.Evaluation of various QuECh-ERS based methods for the analysis of herbicides and other commonly used pesticides in polished rice by LC-MS/MS[J].Talanta,2011,83(5):1613-1622.
[19]陈树兵,单正军,胡秋辉.食品中农药残留检测的样品前处理技术[J].食品科学,2004,25(12):152-155.
[20]WANG Z,CAO Y,GE N,et al.Wide-scope screening of pesticides in fruits and vegetables using information-dependent acquisition employing UHPLC-QTOF-MS and automated MS/MS library searching[J].Anal Bioanalyt Chem,2016,408(27):7795-7810.
[21]YOU X W,PENG W,LIU F M,et al.Simultaneous determination of five strobilurin fungicides and the metabolite BF-500-3 in cereals,fruits and vegetables[J].Int J Environ Anall Chem,2015,95(11):989-1000.