白酒酿造过程实质上是多种微生物繁殖和代谢的过程,中国传统的浓香型白酒以固态发酵为特征,糖化、酒化、酯化等多种生化反应均在窖池中完成。窖泥是微生物的载体,其复杂的微生物菌群不断进行自然选择与淘汰,最终形成特有的微生态环境。窖泥微生物产生的广谱代谢产物,对浓香型白酒复合香气的形成起着至关重要的作用,窖泥微生物种类和数量,在一定程度上决定了浓香型白酒的质量[1]。窖泥微生物群落结构及其变化规律的研究,能够为实现从白酒酿造“源头”—微生物菌群改造来提高白酒品质提供理论和技术支撑。
传统研究窖泥微生物常采用菌种分离培养技术,该方法仅能对极少数可培养微生物进行分析,难以客观揭示窖泥微生物的多样性。磷酸脂肪酸(phosphor lipid fatty acid,PLFA)生物标记、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gel gradient electrophoresis,PCR-DGGE)、TA克隆文库、单链构象多态性(single-strand conformation polymorphism,SSCP)、荧光原位杂交(fluorescence in situ hybridization,FISH)等现代分子生物学免培养技术一定程度上克服了传统纯培养技术的弊端,但仍存在工作量大、成本高,仅对群落中主要成分比较敏感等缺陷[2-4]。与上述方法相比,高通量测序(high-throughput sequencing,HTS)技术对微生物群落结构的研究有着明显的先进性和优势,具有成本低、通量高、覆盖广泛、耗时短等特点。其结合生物信息学分析,能更加科学、准确地表征或预测微生物的群落结构,样本间差异性比较更具说服力[5]。
目前,利用高通量测序技术已经对五粮液、泸州老窖、古井贡酒、中周羌稞养生酒以及古襄阳酒等酒业窖池中窖泥的微生物群落进行了不同程度的解析[2,6-9]。河南是中华酒的发源地,豫酒在经历了10年漫长的低谷期后,2017年,省委省政府将豫酒振兴列为全省产业转型升级攻坚工作之一。振兴豫酒品质先行,白酒品质是发展根基,窖泥是浓香型白酒生产的关键,但是针对河南省浓香型白酒窖泥的研究非常薄弱。宋河酒业是浓香型豫酒代表,但目前对其窖泥微生物的研究还限于传统纯培养技术以及局部窖泥的微生物变化规律探讨[10-11]。因此,本研究以宋河浓香型白酒不同窖龄窖泥为研究对象,采用高通量测序技术对不同窖龄的窖泥、同一窖池不同部位窖泥细菌群落结构进行全面分析,同时对窖泥细菌群落结构与窖泥理化指标的相关性进行典范对应分析(canonical correspondence analysis,CCA),探讨影响其群落结构的环境因素,为最终实现微生物菌群改造提升白酒品质提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
6年窖龄的窖壁泥(W1)和窖底泥(W2)、16年窖龄的窖壁泥(Y1)和窖底泥(Y2)样品均采自河南宋河酒业股份有限责任公司白酒生产窖池。采用五点取样法采集窖底泥(四角及窖底中心),距窖口约50 cm处采集窖壁泥(四壁中心),样品充分混匀后迅速装入无菌采样袋,低温带回实验室,-20℃保存备用。
1.1.2 主要试剂
E.Z.N.A.Soil脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;TaqDNA聚合酶(5U/μL):宝生物工程(大连)有限公司;琼脂糖(生化试剂):西班牙Biowest Agarose公司;MagicPure磁珠核酸纯化试剂盒:北京全式金生物技术有限公司;引物341F和805R:生工生物工程(上海)股份有限公司;Qubit3.0 DNA检测试剂盒:美国Life公司。
1.2 仪器与设备
HQd水质分析仪:美国HACH公司;IlluminaMiseqPE250高通量测序仪:美国Illumina公司;T100 Thermal Cycler聚合酶链式反应(polymerase chain reaction,PCR)仪:美国BIORAD公司;Qubit3.0荧光定量仪:美国Thermo Fisher公司;GelDoc-ItTS3凝胶成像系统:美国UVP公司;FE28/S210K pH计:瑞士Mettler Toledo公司。
1.3 方法
1.3.1 窖泥理化特性分析
对窖泥样品的理化指标(水分、有机物含量、有效磷含量、pH值以及氨基酸态氮含量)进行测定。水分的测定:新鲜窖泥于105℃烘干2 h,测定烘干前后质量差,计算得到样本水分。有机物含量的测定:采用重铬酸钾容量法[12]。有效磷含量的测定:采用碳酸氢钠浸提-钼锑抗分光光度法[13]进行测定。pH值的测定:采用电位法进行测定[14]。氨基酸态氮含量的测定:取1.0 g窖泥样品于50 mL 0.1 mol/L KCl中,振荡浸提30 min,过滤,采用靛酚兰比色法测定[15]。
1.3.2 窖泥总DNA的提取
采用E.Z.N.A.Soil DNA提取试剂盒提取窖泥样品中微生物的基因组DNA,于-20℃保存。
1.3.3 PCR扩增及Illumina MiSeq测序
以基因组DNA为模板,采用引物341F和805R对细菌16S rDNA的V3~V4区进行PCR扩增。PCR扩增体系:2×Taq master Mix 15 μL,DNA模板10 ng,10 μmol/L正反向引物各1 μL,双蒸水(ddH2O)补充至30 μL。PCR扩增条件:95℃预变性3 min;95℃变性30 s,45℃退火30 s,72℃延伸30 s,共5个循环;然后95℃变性30 s,55℃退火30 s,72℃延伸30 s,共20个循环;最后72℃延伸5 min。
PCR扩增产物经1%琼脂糖电泳检测后,采用MagicPure磁珠核酸纯化试剂盒对PCR扩增产物进行纯化、回收,利用Qubit3.0DNA检测试剂盒对回收的DNA精确定量,所有DNA样本等量混合后,依托生工生物工程(上海)股份有限公司进行Illumina MiSeq高通量测序。
1.3.4 高通量测序数据分析
采用Usearch软件剔除测序结果中的嵌合序列,以97%序列相似性标准划分操作分类单元(operational taxonomic unit,OTU),调用Mothur软件,计算各个样品覆盖率(Coverage)和辛普森(Simpson)指数、香农(Shannon)指数等多样性指数及ACE、Chao1丰富度指数。
1.3.5 典范对应分析
利用Canoco Windows 4.5软件对窖泥细菌群落特性与环境因子的相关性进行典范对应分析。WCanoImp软件将OTUs与环境因子数据转换为Canoco识别格式,经Canoco Windows 4.5软件运算后利用Canodraw for Windows作图。
2 结果与分析
2.1 窖泥理化指标分析
窖泥的理化指标检测结果见表1。由表1可知,随着窖龄的增加,窖泥的pH值、水分、氨基酸态氮、有效磷以及有机物含量均呈现增长的趋势。窖泥养分的组成是窖泥质量的重要标志,也是微生物生长繁殖的重要基质,其在不同程度上影响窖泥微生物群落的组成、分布及菌群演变。
表1 窖泥样品的理化指标
Table 1 Physicochemical indexes of pit mud samples
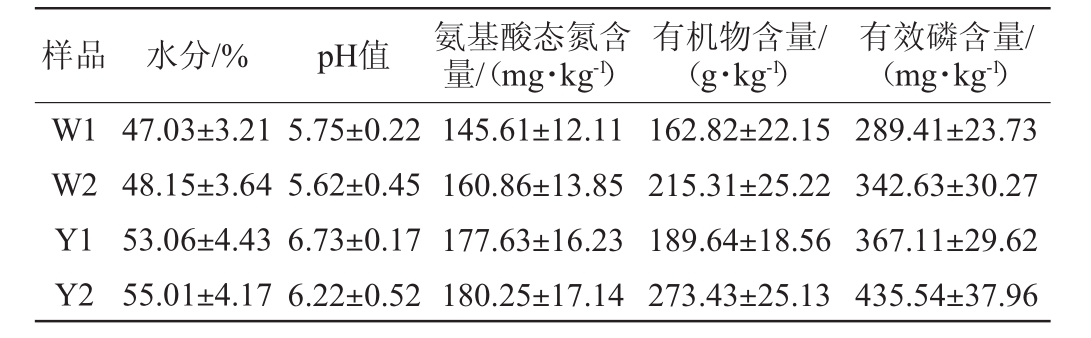
样品 水分/% pH值 氨基酸态氮含量/(mg·kg-1)有机物含量/(g·kg-1)有效磷含量/(mg·kg-1)W1 W2 Y1 Y2 47.03±3.21 48.15±3.64 53.06±4.43 55.01±4.17 5.75±0.22 5.62±0.45 6.73±0.17 6.22±0.52 145.61±12.11 160.86±13.85 177.63±16.23 180.25±17.14 162.82±22.15 215.31±25.22 189.64±18.56 273.43±25.13 289.41±23.73 342.63±30.27 367.11±29.62 435.54±37.96
2.2高通量测序结果及Alpha多样性分析
利用Illumina Miseq测序平台得到窖泥样品W1、W2、Y1、Y2的原始序列数分别为44 842条、48 003条、48 750条和55 762条。使用Usearch剔除嵌合序列,并与silva数据库代表性序列进行Blast比对,覆盖率低于60%,相似度低于70%的序列被认为是靶区域外序列,剔除该部分序列后最终得到的有效序列数分别为40930条、43757条、38595条和50037条,其平均长度分别为427.59 bp、425.68 bp、407.99 bp和417.81 bp。
在97%序列相似性水平上划分OTU,4个窖泥样品共得到4 561个OTUs,对其进行Alpha多样性分析,结果见表2。由表2可知,4个窖泥样品的覆盖率均>98%,表明试验的取样合理,测序结果能真实反映样本的实际情况。窖泥样品Y2的香农指数(3.51)最高,辛普森指数(0.09)最低,说明其细菌群落的多样性最高;窖泥样品W2的ACE指数(2 876.21)及Chao1指数(2 293.38)最高,说明其细菌群落物种的丰富度最大,同时发现无论多样性还是丰富度,窖泥样品Y2高于Y1,W2高于W1。由此可见,窖龄越长的窖泥微生物多样性越高,相同窖龄的窖底泥微生物多样性及丰富度高于窖壁泥。这与DING X F等[16-17]的研究结果相一致。
表2 窖泥样品细菌的序列数、OTU数及Alpha多样性指数
Table 2 Sequence number,operational taxonomic unit number and Alpha diversity index of bacteria in pit mud samples
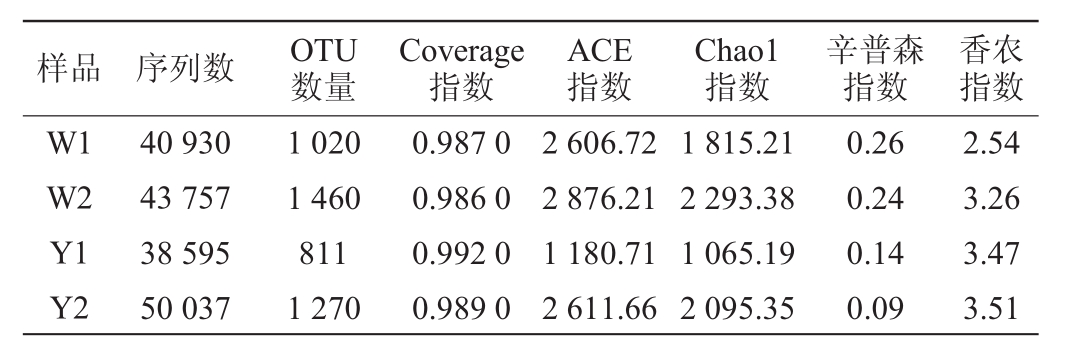
样品 序列数 OTU数量Coverage指数ACE指数Chao1指数辛普森指数香农指数W1 W2 Y1 Y2 40 930 43 757 38 595 50 037 1 020 1 460 811 1 270 0.987 0 0.986 0 0.992 0 0.989 0 2 606.72 2 876.21 1 180.71 2 611.66 1 815.21 2 293.38 1 065.19 2 095.35 0.26 0.24 0.14 0.09 2.54 3.26 3.47 3.51
基于窖泥样品中细菌的香农指数绘制稀释性曲线,结果见图1。由图1可知,4个窖泥样品的稀释性曲线趋向平坦,进一步说明本次测序数据量合理[17]。
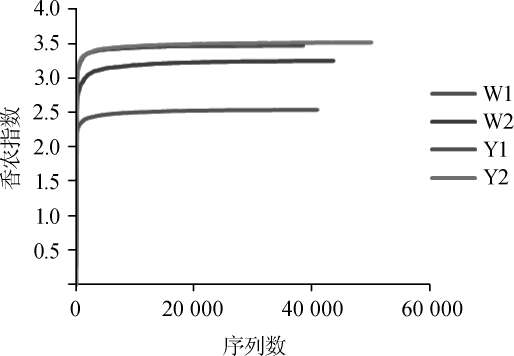
图1 基于香农指数不同窖泥样品的稀释曲线
Fig.1 Rarefaction curves of different pit mud samples based on Shannon index
2.3 基于属水平窖泥细菌群落结构分析
依据高通量测序获得的序列信息,在属水平上分析窖泥细菌的种类和相对丰度。根据相对丰度将样本中的菌属分为优势菌属(相对丰度≥1.0%)和次要菌属(相对丰度<1.0%),且将次要菌属归类于其他(others),结果见图2。
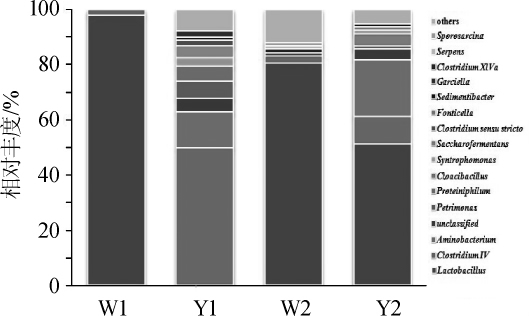
图2 基于属水平窖泥中细菌群落结构分析
Fig.2 Analysis of bacterial community structure of pit mud based on genus level
由图2可知,6年窖池窖泥细菌群落多样性较低,窖底泥与窖壁泥中细菌群落结构差异性不大,均以厚壁菌门(Firmicutes)的乳酸菌属(Lactobacillus)为绝对优势细菌属,相对丰度分别为96.09%和78.35%。16年窖池窖泥细菌群落多样性愈加丰富,细菌主要归属于厚壁菌门(Firmicutes)、互养菌门(Synergistetes)和拟杆菌门(Bacteroidetes)3个门类。16年窖壁泥与窖底泥细菌群落结构在属水平上差异显著,窖壁泥与窖底泥共有的绝对优势细菌属主要为梭菌属(Clostridium)、氨基酸杆菌(Aminobacterium)、理研菌属(Petrimonas)、互营单胞菌属(Syntrophomonas)和消化链球菌属(Sedimentibacter)。两者特有绝对优势细菌属共7种,其中乳酸菌属的变化最明显,16年窖底泥中其相对丰度高达50.66%,为绝对优势细菌属,而在窖壁泥中其相对丰度仅为0.35%,为次要细菌属。与6年窖池窖泥细菌群落结构相比,16年窖池窖泥乳酸菌属相对丰度显著降低,梭菌属和氨基酸杆菌增长迅速,其相对丰度在窖壁泥、窖底泥中分别为49.01%、9.98%和12.84%、20.05%。HUX等[18]应用Illumina Miseq技术对江苏汤沟浓香型白酒优质、普通和退化窖泥中细菌多样性进行了分析,研究发现随着窖泥质量的提升,乳酸菌属含量显著减少,而梭菌属、氨基酸杆菌等核心属的含量明显增加;罗雯等[19]借助高通量测序技术探讨了四川某知名浓香型白酒生产厂不同性状窖泥的微生物群落结构组成,研究同样发现趋老熟、老熟窖泥中梭菌属优势较为明显。结果表明,本研究中的16年窖池已经成为趋于老熟化的优质窖池,利用微生物群落组成预测窖泥质量具有一定可行性。
2.4 典范对应分析
采用Canoco for Windows 4.5软件对4种窖泥细菌群落结构与理化指标的相关性进行典范对应分析,结果见图3。由图3可知,窖泥样品W1、W2均位于第三象限,说明6年窖底泥、窖壁泥细菌群落结构具有较高相似度。胡晓龙[20]研究发现,优质窖泥处于较高pH值、氨基酸态氮及有效磷环境中,本实验同样发现,16年优质窖泥与上述3个理化指标呈现正相关性。且5个理化指标中,pH值与有机物含量分别是影响窖泥样品Y1、Y2的主要理化指标。因此,根据典范对应分析结果推测,窖池窖泥的pH值和有机物含量可能是导致16年窖池窖泥细菌群落结构发生较大变化的外因。
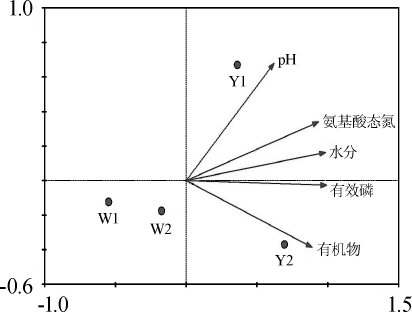
图3 窖泥细菌群落与理化指标的典范对应分析
Fig.3 Canonical correspondence analysis of bacterial community and physicochemical indexes of pit mud
3 结论
本研究运用Illumina MiSeq高通量测序技术较为全面的分析了河南宋河浓香型白酒不同窖龄窖泥、同一窖池不同部位窖泥的细菌群落结构特征及其影响因素。结果表明,窖龄越长窖泥细菌群落多样性越高,且相同窖龄、同一窖池的窖壁泥的细菌多样性小于窖底泥。6年窖壁泥与窖底泥的细菌群落结构相似,绝对优势细菌属均为Lactobacillus。16年窖壁泥与窖底泥的细菌群落结构差异较大,共有的绝对优势细菌属为Clostridium、Aminobacterium、Petrimonas、Syntrophomonas和Sedimentibacter。特有细菌属中Lactobacillus相对丰度的降低以及Clostridium和Aminobacterium相对丰度的迅速增长,均表明16年窖池已成为趋于老熟化的优质窖池。CCA分析结果推测,pH值和有机物含量可能是影响16年窖壁泥与窖底泥细菌群落结构不同的主要环境因子。
[1]蔡雪梅,蒋英丽,吴联海,等.不同区域酱香型白酒人工窖底泥细菌多样性及其影响因子[J].食品科学,2017,38(10):87-91.
[2]张会敏.古井贡酒微生物群落结构及其与主要风味物质的关联研究[D].哈尔滨:哈尔滨工业大学,2017.
[3]叶光斌,罗惠波,杨晓东,等.基于免培养法研究泸州地区浓香型白酒窖泥原核微生物群落结构[J].食品科学,2013,34(17):176-181.
[4]李永博,邓波,刘燕梅,等.基于PLFA分析不同窖龄窖泥微生物群落结构[J].中国酿造,2017,36(9):74-77.
[5]KLINDWORTH A,PRUESSE E,SCHWEER T,et al.Evaluation of genera 16S ribosomal RNA gene PCR primers for classical and next-generation sequencing-based diversity studies[J].Nucl Acid Res,2013,41(1):1-11.
[6]熊亚.泸州老窖不同窖龄窖泥中细菌及古菌种群多样性和系统发育研究[D].成都:四川农业大学,2014.
[7]赵东,郑佳,彭志云,等.高通量测序技术解析五粮液窖泥原核微生物群落结构[J].食品与发酵工业,2017,43(9):1-8.
[8]覃荣周,王琪林,任朝琴,等.Illumina高通量测序技术分析中周羌稞养生酒窖泥细菌多样性[J].中国酿造,2017,36(1):138-141.
[9]杨小丽,尚雪娇,余海忠,等.基于Miseq高通量测序技术的古襄阳酒窖泥细菌多样性评价[J].中国酿造,2018,37(7):26-30.
[10]李芳莉.浓香型白酒窖泥微生物群落结构分析及其对原酒风味物质的影响[D].郑州:郑州轻工业学院,2017.
[11]李绍亮,曹振华,李学思,等.宋河酒业不同窖龄窖泥中微生物变化规律研究[J].酿酒,2017,44(3):16-19.
[12]夏清华,黄永东,黄永川,等.土壤有机质重铬酸钾容量法最佳测定条件的探索[J].南方农业,2014,8(16):35-37.
[13]沈志群,张琪,刘琳娟,等.碳酸氢钠浸提-钼锑抗分光光度法测定土壤中的有效磷[J].环境监控与预警,2011,3(5):12-15.
[14]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:615-626.
[15]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000:308-312.
[16]DING X F,WU C D,ZHANG L Q,et al.Characterization of eubacterial and archaeal community diversity in the pit mud of Chinese Luzhou-flavor liquor by nested PCR-DGGE[J].World J Microb Biot,2014,30(2):605-612.
[17]邓杰,黄治国,卫春会,等.基于高通量测序的浓香型白酒窖池细菌群落结构分析[J].现代食品科技,2015,31(7):50-55.
[18]HU X,DU H,REN C,et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Appl Environ Microb,2016,82(8):2506-2515.
[19]罗雯,张倩颖,廖作敏,等.基于高通量测序技术的不同性状窖泥微生物组成研究[J].食品与发酵工业,2017,43(9):9-14.
[20]胡晓龙.浓香型白酒窖泥中梭菌群落多样性与窖泥质量关联性研究[D].无锡:江南大学,2015.