食用植物酵素[1]是以一种或多种新鲜蔬菜、水果和谷豆类、海藻类、食药两用本草类等食材为原料,加(或不加)糖类物质,经多种有益菌通过较长时间发酵而生产的功能性微生物发酵产品,拥有丰富的次生代谢产物、植物本身营养成分和益生菌等功能性成分,特别是富含小分子功能成分,研究表明该类产品具有抗衰老、抗菌消炎、净化血液、增强机体免疫能力及解毒抗癌等多种保健功能[2-4]。由于酵素的发酵过程属于复杂的间歇性过程,其发酵周期的控制需要结合期间多种微生物的基质代谢与产物生成情况综合考虑[5-6]。研究发酵过程中代谢产物及其活性的变化规律,不仅有利于酵素产品的质量控制,还可为其发酵终点的确定提供理论支撑。
紫苏叶为唇形科植物紫苏(Perilla frutescens L.Britt.)的干燥叶(或带嫩枝)。具有解表散寒、行气和胃之功效,用于风寒感冒,咳嗽呕恶,妊娠呕吐,鱼蟹中毒[7]。紫苏叶中富含多种营养成分以及多酚、黄酮等多种生物活性物质[8],具有良好的抗氧化、抗癌、抗炎、抗菌、抗过敏、保肝、降血脂、调节血糖等药理作用[9-12]。目前,以紫苏叶为原料加工制成的保健食品较少,仅有紫苏茶[13]与紫苏果酒[14]等。通过微生物发酵制备紫苏叶酵素,可以在保留紫苏叶本身药用活性成分的基础上,进一步增强其营养价值及保健功效,对丰富紫苏叶的加工形式,实现其高值化利用具有重大意义。
目前尚未有关于紫苏叶酵素的相关研究报道,故本试验以紫苏叶为原料,探究紫苏叶酵素发酵过程中有机酸、总糖、总酚、乙醇等代谢产物的变化以及1,1-二苯基-2-苦苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、羟基自由基清除率等抗氧化活性的变化,以期为紫苏叶综合开发提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
紫苏叶:采自浙江省农副产品加工重点实验室植物园;酵液、糖浆:由浙江省农副产品加工重点实验室提供。
1.1.2 试剂
DPPH:梯希爱(上海)化成工业发展有限公司;福林酚、蒽酮、三羟甲基氨基甲烷(Tris(hydroxymethyl)methyl aminomethane,Tris)、水杨酸钠、FeSO4、H2O2(均为分析纯):国药集团化学试剂有限公司。L-乳酸(纯度≥98%)、醋酸(纯度≥99.9%)、无水乙醇(优级纯)、叔丁醇(纯度≥99.5%):上海阿拉丁化学试剂有限公司。
1.2 仪器与设备
20 L不锈钢(型号:316L)发酵罐:浙江省农产品化学与生物加工技术重点实验室提供;PTX-FA210型电子天平:福州华志科学仪器有限公司;Allegra X-12R离心机:贝克曼库尔特有限公司;PHS-3C型精密酸度计:杭州齐威仪器有限公司;KQ-300E型超声波清洗器:昆山市超声仪器有限公司;UV-5500PC型紫外分光光度计:上海市元析仪器有限公司;XMTD-204数显式电热恒温水浴锅:常州诺基仪器有限公司;Waters e2695高效液相色谱(配备Waters 2998二极管阵列紫外检测器):美国沃特世公司;GC-2010气相色谱:日本岛津公司;HSS86.50型顶空进样器:意大利DANI公司;SpectraMax iD5多功能酶标仪:美国美谷分子仪器有限公司。
1.3 实验方法
1.3.1 紫苏叶酵素的制备
用无菌水冲洗新鲜摘取的紫苏叶,置于阴暗处晾干,粗粉碎,将紫苏叶和糖浆按质量比3∶4加入高压蒸汽灭菌过的20 L不锈钢发酵罐中,加入10%体积分数的酵液(菌体浓度:1×105CFU/mL)。于室温(20±5)℃条件下发酵,定期取样,将样品于6 000 r/min条件下离心10 min,取上清液保存于-80℃超低温冰箱中,待测。
1.3.2 总酚含量测定
采用福林酚法[15]测定紫苏叶酵素中总酚含量。取5 μL酵素离心液,加纯水至0.5mL,加入体积分数为10%的福林酚溶液2.5mL,常温避光静置反应3min后加入75g/LNa2CO3溶液2 mL,混匀。于25℃反应1 h,以0.5 mL水按上述方法进行空白调零,在波长765 nm处测定吸光度值。
1.3.3 pH值测定
参照GB 10468—1989《水果和蔬菜产品pH值的测定方法》[16],使用精密pH计直接测定酵素样品pH值。
1.3.4 可滴定酸含量测定
可滴定酸含量的测定方法参照GB/T 12456—2008《食品中总酸的测定方法》[17],并加以调整:取酵素样品1 mL,用去离子水定容至50 mL,取10 mL稀释液于锥形瓶中,以0.1g/L酚酞试剂为指示剂,记录消耗0.002mol/L的氢氧化钠溶液滴定体积,测定结果以苹果酸质量浓度(g/100mL)计。
1.3.5 有机酸含量测定[18]
样品配制:取离心后的紫苏叶酵素上清液200 μL,使用0.01 mol/L磷酸二氢钾缓冲液(pH 2.7)稀释5倍,经过0.22 μm微孔滤膜过滤,待测。
标品配制:配制乳酸和醋酸的混合标准溶液,其质量浓度均为1 mg/mL,经过0.22 μm微孔滤膜过滤。
检测条件:色谱柱为AgilentTCC18柱(250mm×4.6mm,5 μm);流动相为甲醇∶磷酸二氢钾缓冲液(pH 2.7)=2∶98;流速1.0mL/min;柱温25℃;进样体积10μL;检测波长210nm。检测器为二极管阵列检测器。
1.3.6 总糖含量测定
采用蒽酮-硫酸法[19]测定紫苏叶酵素中总糖含量。将样品液用纯水稀释5 000倍,取稀释液200 μL,置于冰浴中,加入800 μL 2 mg/mL的蒽酮-硫酸溶液,混合均匀后置于沸水浴中反应10 min,冰浴中冷却至室温后,使用酶标仪在波长620 nm处测定其吸光度值。并配制质量浓度梯度为20 μg/mL、40 μg/mL、60 μg/mL、80 μg/mL、120 μg/mL、160 μg/mL的葡萄糖溶液,按照上述步骤绘制标准曲线。
1.3.7 乙醇含量测定[20]
样品配制:取离心后紫苏叶酵素上清液990 μL,加入10 μL叔丁醇作为内标,待测。
标准曲线的绘制:分别配制体积分数为0.1%、0.2%、0.5%、1.0%、2.0%、4.0%、5.0%的乙醇溶液,上述溶液中均含有体积分数1%的叔丁醇作为内标,待测。
自动顶空条件:炉温85℃,平衡时间40 min;进样阀温度105℃;传输线温度110℃。
气相色谱条件:RTX-5毛细管柱(30m×0.25mm×0.25μm);柱温40℃,平衡时间3.0 min,10℃/min升温至180℃,保温5 min;进样口/气化室温度200 ℃;分流比30∶1;检测器温度250℃。
1.3.8 DPPH自由基清除能力测定[21]
取5 μL离心后紫苏叶酵素上清液,加水稀释至2 mL,加入0.1 mmol/L DPPH-甲醇溶液4 mL,再加入50 mmol/L Tris-HCl缓冲液(pH7.4)450 μL,25℃恒温水浴反应30 min,以纯水为参比溶液,于波长517 nm处测定吸光度值。
式中:A0为空白对照吸光度值;A1为样品吸光度值;A2为样品本底管吸光度值。
1.3.9 羟自由基清除能力测定[22]
取250μL离心后紫苏叶酵素上清液,加水稀释至2mL,加入6mmol/LH2O2溶液1.4mL,再加入20mmol/L水杨酸钠0.6 mL和1.5 mmol/L FeSO42 mL,混匀,37℃恒温水浴反应1 h。以纯水为参比溶液,于波长510 nm处测定吸光度值。
式中:A0为空白对照吸光度值;A1为样品吸光度值;A2为样品本底管吸光度值。
1.3.10 综合评价指标分析
通过主成分分析法进行多指标综合评价,以各主成分所对应的特征值除以所提取主成分的特征值之和,再线性加权求和得到综合评价指标(composite evaluation index,CEI)。
式中:λ1为主成分1的特征值;λ2为主成分2的特征值;F1为主成分1的因子得分;F2为主成分2的因子得分。
2 结果与分析
2.1 发酵过程中总酚含量的变化
紫苏叶中的酚类物质具有较强的抗氧化活性[23],紫苏叶酵素发酵过程中总酚含量变化如图1所示。
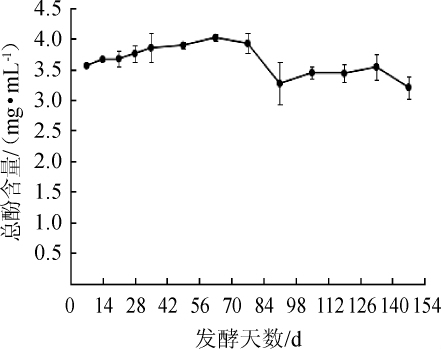
图1 紫苏叶酵素发酵过程中总酚含量的变化
Fig.1 Changes of total phenolic content during the Perilla leaves jiaosu fermentation
由图1可知,随着发酵时间的延长,总酚含量呈现先波动上升后下降的趋势,于发酵63d时达到最大值3.96mg/mL。研究表明,苹果酵素、葡萄酵素的总酚含量分别为259.4mg/L、2.31 mg/mL[3,6],本实验紫苏叶酵素总酚含量较高,可能是由于物料本身及其自身菌种的差异导致的。GAO K等[24]研究发现,微生物发酵可将类黄酮物质转化为酚酸产物,致使总酚含量上升。过量的多酚类物质会抑制益生菌的生长,同时体系自身的微生物也会影响多酚类物质的生物功能,故而紫苏叶酵素中的优势菌种可能降解部分酚类物质,从而维持酚类物质含量平衡,导致酵素中总酚含量下降[25]。
2.2 发酵过程中pH值与可滴定酸含量的变化
pH值是酵素发酵程度的一个代表性的重要指标,总酸是反映酵素发酵过程状况的理化指标,同时也在一定程度上反映了微生物代谢情况。紫苏叶酵素在发酵过程中pH值和可滴定酸的变化如图2所示。
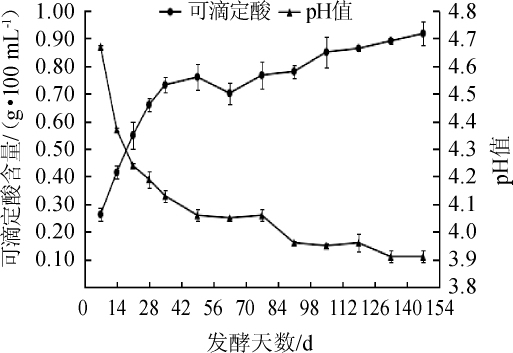
图2 紫苏叶酵素发酵过程中pH值与可滴定酸含量的变化
Fig.2 Changes of pH value,total titratable acidity during the Perilla leaves jiaosu fermentation
由图2可知,随着发酵时间的延长,发酵pH值由4.67持续下降至3.91。可滴定酸总体呈现上升趋势。前49 d上升速率较快,后期趋于平缓,最终达到0.918 g/100 mL(以苹果酸计)。发酵过程中紫苏叶中的有机酸的溶出及醋酸菌等大量微生物代谢使得乙醇转化为乳酸、醋酸等有机酸[26],导致酵素中可滴定酸含量的快速上升。为更好地解释发酵过程中pH值与可滴定酸含量的变化趋势,本实验对乳酸、醋酸的含量变化进行了跟踪检测。
2.3 发酵过程中乳酸、醋酸含量的变化
酵素中存在的最常见的3种菌种为酵母菌、醋酸菌和乳酸菌[1]。其代谢产物乳酸、醋酸等有机酸的含量变化为酵素品质的重要指标之一[27]。乳酸、醋酸标品的标准曲线见表1。由表1可知,乳酸、醋酸标准曲线方程具有良好线性相关性,相关系数R2均>0.999 9。
表1 有机酸标准曲线
Table1 Standard curves of organic acids

顺序 有机酸 标准曲线方程 相关系数(R2)12乳酸醋酸y=432 168x-16 197 y=310 906x-11 851>0.999 9>0.999 9
紫苏叶酵素在发酵过程中乳酸、醋酸含量变化如图3所示。由图3可知,随发酵时间的延长,乳酸、醋酸含量均呈现先上升后下降的趋势,分别于发酵49 d、105 d到达最大值(4.82 mg/mL、0.90 mg/mL)。发酵前28 d,醋酸菌等微生物利用葡萄糖、果糖代谢生成醋酸等物质,使得乳酸、醋酸含量快速增加[28];91 d后乳酸、醋酸含量缓慢下降可能是因为酵母菌等菌种在发酵后期会降解部分有机酸,导致乳酸、醋酸含量有所下降[29]。结合图2,醋酸、乳酸含量在前28 d的上升导致了可滴定酸的同期上升以及pH值的快速下降。
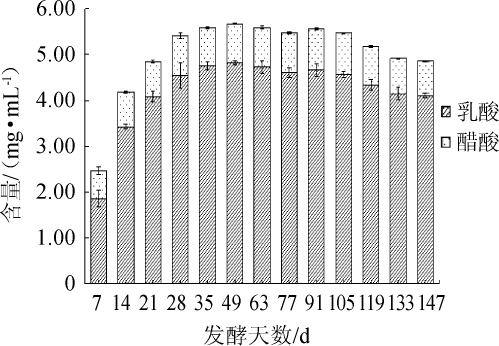
图3 紫苏叶酵素发酵过程中乳酸、醋酸含量的变化
Fig.3 Changes of lactic acid,acetic acid production during the Perilla leaves jiaosu fermentation
2.4 发酵过程中总糖含量的变化
糖作为酵素发酵过程中微生物利用的主要碳源,其含量变化是研究紫苏叶酵素发酵过程中微生物代谢的核心指标之一。紫苏叶酵素发酵过程中,总糖含量随发酵时间变化结果如图4所示。由图4可知,随着发酵时间的延长,发酵液中总糖含量先快速下降,而后逐渐升高直至平缓,且在发酵21 d时达到最低值636.33 mg/mL。前期的变化趋势可能是由于发酵过程中总糖被水解成葡萄糖和果糖并被乳酸菌等微生物利用消耗[30],结合图3可知,前期消耗的总糖有可能被转化为乳酸,导致总糖含量下降以及乳酸含量的上升。发酵21d后,总糖含量的波动可能是由于发酵过程中乳酸菌等菌种逐渐利用糖类物质导致的。
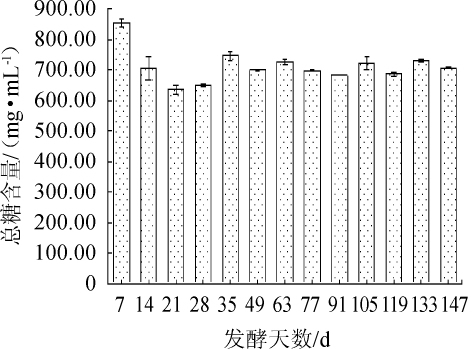
图4 紫苏叶酵素发酵过程中总糖含量的变化
Fig.4 Changes of total sugar concentration during the Perilla leaves jiaosu fermentation
2.5 发酵过程中乙醇含量的变化
乙醇是一种典型的初级代谢产物,其含量变化与酵母菌紧密相关,故而将其作为研究紫苏叶酵素发酵过程中微生物代谢的核心指标之一[31]。紫苏叶酵素在发酵过程中乙醇含量的变化如图5所示。由图5可知,紫苏叶酵素在发酵过程中乙醇含量的变化呈先增长后下降趋势,并于发酵105 d达到最高值1.66%vol。D'AMORE T等[32]研究表明,高糖渗透压条件会导致酵母菌细胞内乙醇浓度的增加,从而抑制其生长和发酵速率,导致紫苏叶酵素前21天乙醇含量增长速率缓慢。发酵21天总糖含量降至最低,酵母菌发酵进入旺盛期,酵母菌代谢生成乙醇含量速率与前期降糖速率具有一致性。发酵28 d后乙醇含量的增长速率减缓可能是由于部分乙醇被醋酸菌利用转化为乙酸,但由于乙醇生成速率仍大于其消耗速率,故乙醇含量仍呈现上升趋势。发酵105 d后乙醇含量降低可能是因为酿酒酵母与非酿酒酵母混合发酵引起了较好的降醇效果[33-34]。通过对乳酸、醋酸和乙醇含量变化的研究,可据此推断紫苏叶酵素中乳酸菌、酵母菌等微生物的生长、代谢情况,但具体微生物种类与菌落总数的变化有待进一步研究。

图5 紫苏叶酵素发酵过程中乙醇含量的变化
Fig.5 Changes of ethanol content during the Perilla leaves jiaosu fermentation
2.6 发酵过程中DPPH自由基消除率的变化
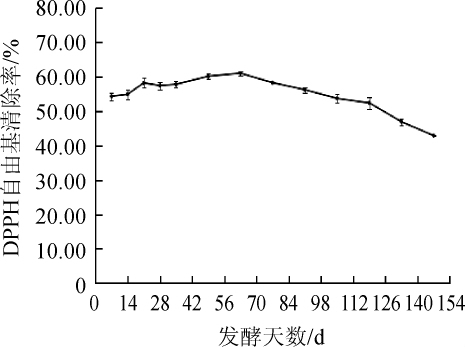
图6 紫苏叶酵素发酵过程中DPPH自由基清除能力的变化
Fig.6 Changes of DPPH free radical scavenging ability during the Perilla leaves jiaosu fermentation
不同发酵时间的紫苏叶酵素DPPH自由基消除率变化如图6所示。由图6可知,发酵前63 d紫苏叶酵素DPPH自由基消除率呈缓慢上升的趋势,清除率达到最大值61.03%,随后缓慢下降。郭晓青等[35]报道紫苏叶提取物的DPPH自由基清除率明显低于同浓度维生素C(vitamin C,VC),分析比较可得同等稀释倍数下紫苏叶酵素DPPH自由基清除能力远大于紫苏叶提取物,说明适当发酵可提高紫苏叶的DPPH自由基清除能力。韦仕静等[36]通过酵母菌、乳酸菌和醋酸杆菌复合发酵西兰花酵素,并研究发现随着发酵时间延长其DPPH自由基清除率快速上升后缓慢下降,这与紫苏叶酵素趋势相近。
2.7 发酵过程中羟基自由基消除率的变化
羟基自由基是一种较活泼的自由基,同时也是一种毒性最强的活性氧自由基[37]。会引起间充质干细胞以及脱氧核糖核酸(deoxyribonucleic acid,DNA)的氧化损伤,故其清除率是体现酵素抗氧化能力的重要指标之一[38]。不同发酵时间的紫苏叶酵素羟基自由基消除率变化如图7所示。由图7可知,随着发酵时间的延长,紫苏叶酵素的羟基自由基清除率逐渐上升,于第91天达到最大值83.49%,相较发酵7 d的清除率增长了92.64%。发酵91 d后清除率变化趋于稳定。可见适当延长发酵时间同样有利于提升紫苏叶酵素羟基自由基的消除能力。肖翔等[39]研究发现,紫苏叶提取物可提高发酵液的抗氧化活性,紫苏叶自身活性成分可与微生物代谢产物相互作用,使得紫苏叶酵素羟基自由基清除率呈现上升趋势。GU L等[40]通过薄层色谱法(thin-layer chromatography,TLC)自显影等技术鉴定得出紫苏中的迷迭香酸与木犀草素等多酚类物质发挥了主要的清除羟基自由基作用。
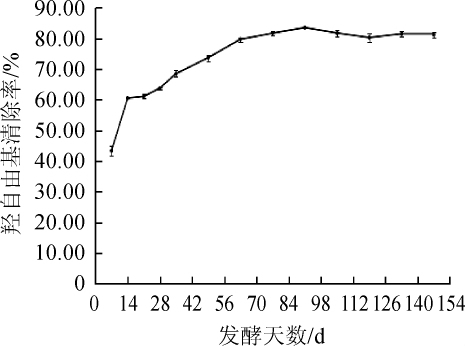
图7 紫苏叶酵素发酵过程中羟自由基清除能力的变化
Fig.7 Changes of hydroxyl free radical scavenging ability during the Perilla leaves jiaosu fermentation
2.8 相关性分析
紫苏叶酵素的总酚、pH值、可滴定酸、乳酸、醋酸、乙醇、总糖、DPPH自由基消除率、羟基自由基消除率进行相关性分析后的结果见表2。由表2可知,总酚与DPPH自由基消除率具有显著的正相关性(P<0.01),pH值、可滴定酸、乳酸、醋酸与羟基自由基消除率有显著的正相关性(P<0.01),可见紫苏叶酵素中的多酚类物质与有机酸均具有一定的抗氧化活性[4]。乙醇与乳酸、醋酸呈现良好的相关性(P<0.05),与可滴定酸、pH呈现显著的相关性(P<0.01),这与发酵过程中微生物利用乙醇代谢成有机酸有关。
表2 紫苏叶酵素发酵过程中各参数相关性
Table 2 Correlation of various parameters during the Perilla leaves jiaosu fermentation
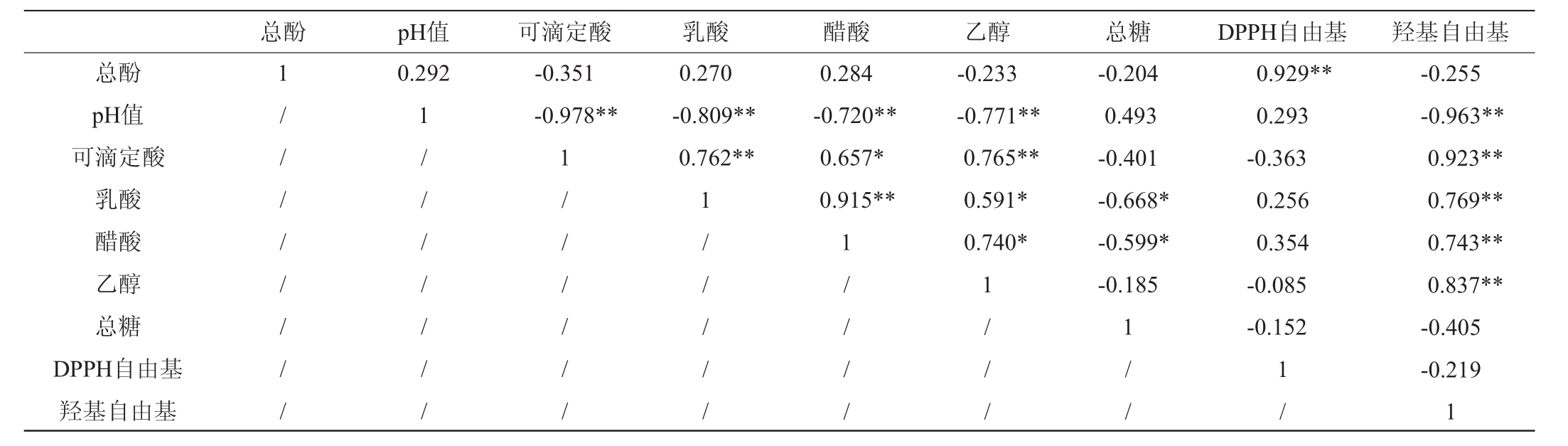
注:“*”表示差异显著,P<0.05,“**”表示差异极显著,P<0.01。
总酚 pH值 可滴定酸 乳酸 醋酸 乙醇 总糖 DPPH自由基 羟基自由基总酚pH值可滴定酸乳酸醋酸乙醇总糖DPPH自由基羟基自由基1 / / / / / / / /0.292 1 / / / / / / /-0.351-0.978**1 / / / / / /0.270-0.809**0.762**1 / / / / /0.284-0.720**0.657*0.915**1 / / / /-0.233-0.771**0.765**0.591*0.740*1 / / /-0.204 0.493-0.401-0.668*-0.599*-0.185 1 / /0.929**0.293-0.363 0.256 0.354-0.085-0.152 1 /-0.255-0.963**0.923**0.769**0.743**0.837**-0.405-0.219 1
2.9 主成分分析
由相关性分析可知,紫苏叶酵素各指标变量间存在信息冗余,为了更好地研究紫苏叶酵素发酵过程中代谢产物与抗氧化活性等综合指标信息,对上述参数进行降维处理,即主成分分析。
紫苏叶酵素主成分的初始特征值及指标变化对主成分的累积贡献率见表3。由表3可知,以特征值1.0为纳入标准,从影响紫苏叶酵素的9种变量指标中提取出2个主成分。紫苏叶酵素的第1主成分(principal component 1,PC1)的方差贡献率为58.903%,第2主成分的方差贡献率为27.509%,前2个主成分的累积方差贡献率高达86.413%,说明前2个主成分能够反映原始变量86.413%的信息,符合主成分分析的要求。因子载荷旋转成分矩阵见表4。由表4可知,PC1反映了pH值、可滴定酸、乳酸、醋酸、乙醇和羟基自由基清除率的变异信息,PC2反映了总酚以及DPPH自由基清除率的变异信息。故通过降维获得F1、F2来代替原先的9种变量指标,为后续综合评价指标的计算奠定基础。
表3 主成分的初始特征值及指标变量对主成分的累积贡献率
Table 3 Initial eigenvalues of the principal components and cumulative contribution rate of indicator variables to principal components
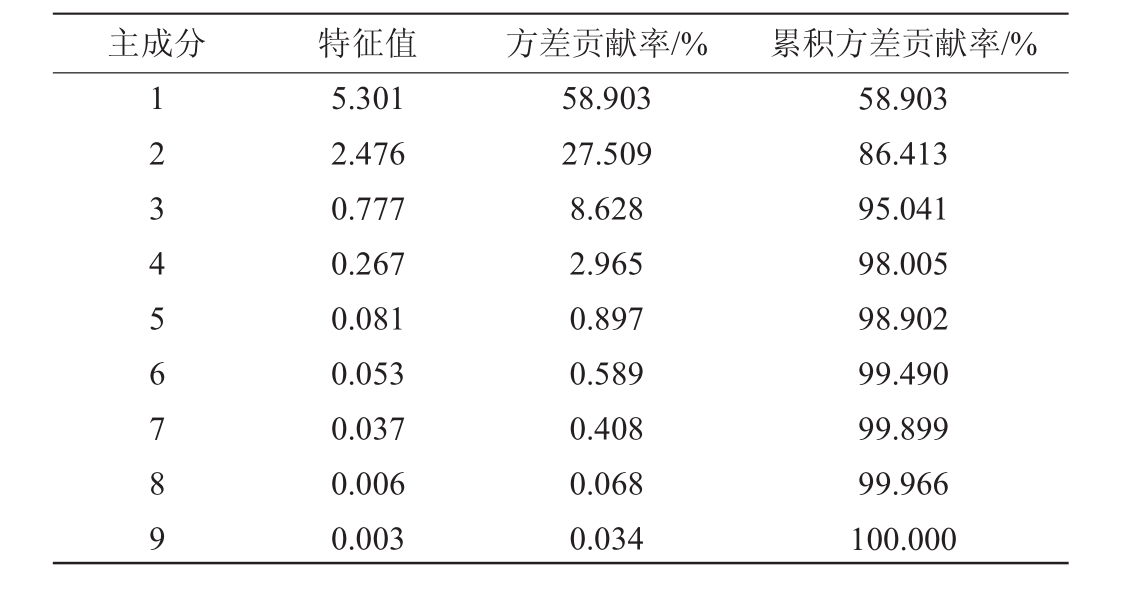
主成分 特征值 方差贡献率/% 累积方差贡献率/%123456789 5.301 2.476 0.777 0.267 0.081 0.053 0.037 0.006 0.003 58.903 27.509 8.628 2.965 0.897 0.589 0.408 0.068 0.034 58.903 86.413 95.041 98.005 98.902 99.490 99.899 99.966 100.000
表4 因子载荷旋转成分矩阵
Table 4 Factor load rotation component matrix
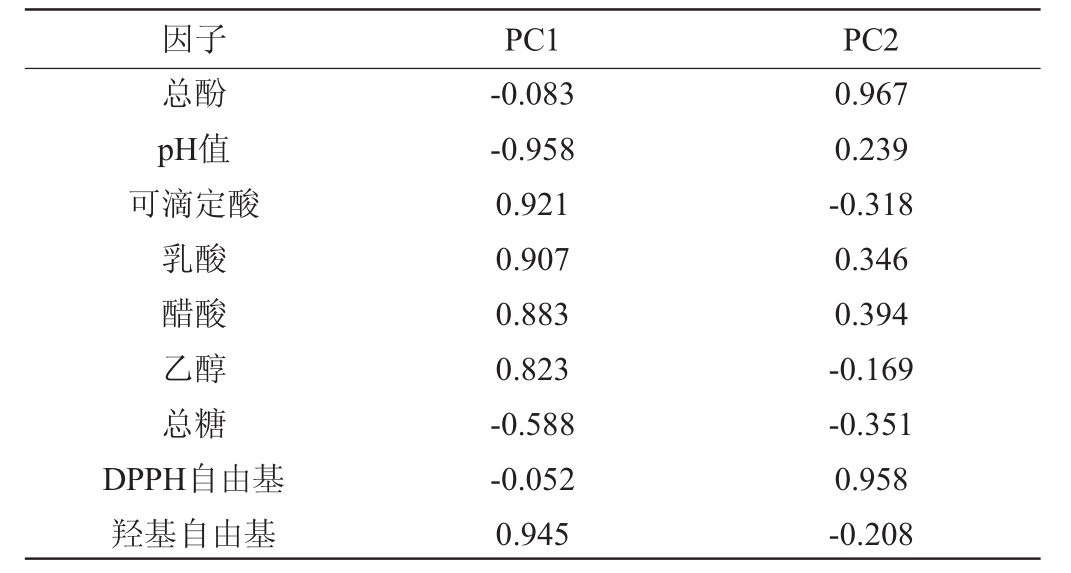
因子 PC1 PC2总酚pH值可滴定酸乳酸醋酸乙醇总糖DPPH自由基羟基自由基-0.083-0.958 0.921 0.907 0.883 0.823-0.588-0.052 0.945 0.967 0.239-0.318 0.346 0.394-0.169-0.351 0.958-0.208
不同发酵时间紫苏叶酵素的CEI值见图8。由图8可知,发酵第63天CEI值最高为0.627,发酵第7天CEI值最低为-2.078。发酵前28 d,CEI值快速上升;在28~91 d时CEI值较为稳定,稍有波动;发酵91 d之后,CEI值逐渐下降。因此可判断适当延长发酵时间有利于紫苏叶酵素的综合评价指标的上升。
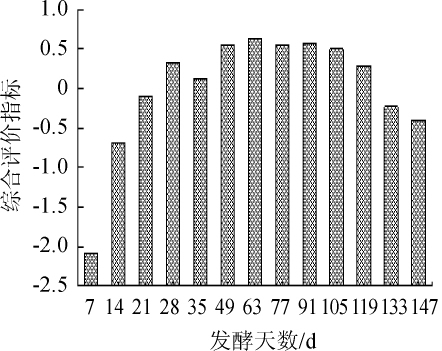
图8 发酵过程中紫苏叶酵素综合评价的变化
Fig.8 Charges of comprehensive evaluation indexes of Perilla leaves jiaosu during fermentation process
3 结论
根据综合评价指标结果,本研究将发酵过程分为三个阶段:发酵前期(0~28 d)、发酵中期(28~91 d)、发酵末期(91~147 d)。发酵前期,紫苏叶酵素发酵过程中总酚含量、可滴定酸含量、乳酸含量、醋酸含量、乙醇含量、DPPH自由基清除率和羟自由基清除率呈上升趋势;发酵中期,总糖与乳酸、醋酸含量趋于稳定,乙醇含量、可滴定酸、羟自由基清除率、总酚含量和DPPH自由基清除率缓慢上升且后两者已于发酵63 d出现下降趋势;发酵末期,紫苏叶酵素中总酚、乳酸、醋酸等生物活性物质含量开始下降,抗氧化活性呈现轻微减弱趋势。综合考虑时间成本与CEI值,发酵至63d时CEI值达到最大,且发酵末期CEI值逐渐下降,故基本确定紫苏叶酵素的发酵终点为63 d。
[1]毛建卫,吴元锋,方晟.微生物酵素研究进展[J].发酵科技通讯,2010,39(3):42-44.
[2]蒋增良,毛建卫,黄俊,等.蓝莓酵素在天然发酵过程中抗氧化性能的变化[J].食品工业科技,2013,34(2):194-197.
[3]蒋增良,毛建卫,黄俊,等.葡萄酵素在天然发酵过程中体外抗氧化性能的变化[J].中国食品学报,2014,14(10):29-34.
[4]程勇杰,陈小伟,王珍珍,等.树莓酵素与蓝莓酵素有机酸分析及其体外抗氧化性能[J].食品工业科技,2017,38(20):141-145.
[5]赵芳芳,莫雅雯,蒋增良,等.功能性微生物酵素产品的研究进展[J].食品与发酵工业,2016,42(7):283-287.
[6]杨小幸,周家春,陈启明,等.苹果酵素天然发酵过程中代谢产物的变化规律[J].食品科学,2017,38(24):15-19.
[7]于占洋,苏中武.紫苏属植物的研究及其新进展[J].国外医学:药学分册,1986,3(13):173-177.
[8]张洪,黄建韶,赵东海.紫苏营养成分的研究[J].食品与机械,2006,22(2):41-43.
[9]吕晓玲,朱惠丽,姜平平,等.紫苏提取物抗氧化活性体外实验研究[J].中国食品添加剂,2003,7(5):22-25.
[10]张燕平,戴志远,陈肖毅.紫苏提取物体外清除自由基能力的研究[J].食品工业科技,2003,24(10):67-70.
[11]郭群群,杜桂彩,李荣贵,等.紫苏抗菌活性成分的研究[J].高等学校化学学报,2006,27(7):1292-1294.
[12]郎玉英,张琦.紫苏总黄酮的抗炎作用研究[J].中草药,2010,41(5):791-794.
[13]彭光前,粟本文,史端甫,等.紫苏茶工艺技术研究[J].茶叶通讯,2001(1):8-11.
[14]赵贵红.营养紫苏果酒的研制[J].酿酒科技,2008(10):86-88.
[15]沙如意,王珍珍,陈小伟,等.火龙果酵素在发酵过程中功能成分变化规律及其与抗氧化相关性[J].生物资源,2018,40(3):208-217.
[16]GB 10468—1989水果和蔬菜产品pH值的测定方法[S].北京:全国信息与文献标准化技术委员会,1989.
[17]GB/T 12456—2008食品中总酸的测定方法[S].北京:全国信息与文献标准化技术委员会,1989.
[18]秦红英,周光明,彭贵龙,等.高效液相色谱法测定紫苏中5种有机酸和黄酮的含量[J].食品科学,2014,35(14):102-105.
[19]郭晓蕾,朱思潮,翟旭峰,等.硫酸蒽酮法与硫酸苯酚法测定灵芝多糖含量比较[J].中华中医药学刊,2010,28(9):2000-2002.
[20]周枝凤,陈凌云,沈梅,等.自动顶空-气相色谱-质谱法测定血液中乙醇含量[J].理化检验(化学分册),2010,46(1):22-24.
[21]FLOEGEL A,KIM D O,CHUNG S J,et al.Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods[J].J Food Compos Anal,2011,24(7):1043-1048.
[22]陈乃东,周守标,王春景,等.春花胡枝子黄酮类化合物的提取及清除羟自由基作用的研究[J].食品科学,2007,28(1):86-91.
[23]RICEEVANS C,MILLER N,PAGANGA G.Antioxidant properties of phenolic compounds[J].Trends Plant Sci,1997,2(4):152-159.
[24]GAO K,XU A,KRUL C,et al.Of the major phenolic acids formed during human microbial fermentation of tea,citrus,and soy flavonoid supplements,only 3,4-dihydroxyphenylacetic acid has antiproliferative activity[J].J Nutr,2006,136(1):52-57.
[25]王丽,许奇,徐顺,等.茶多酚对微生物生长影响的研究进展[J].现代食品科技,2013,29(7):1737-1741.
[26]许伟,张晓君,许泓瑜,等.镇江香醋醋酸发酵过程中细菌群落组成分析[J].微生物学通报,2007,34(4):646-649.
[27]孙付保,赵长新,任洪艳,等.啤酒酵母发酵产有机酸的初步研究[J].食品与生物技术学报,2005,24(5):51-54.
[28]张爱民.酵母固定化与醋酸菌发酵生产苹果醋工艺的研究[J].中国酿造,2008,2008(11):92-94.
[29]赵玉平,王春霞,杜连祥,等.酵母菌发酵降低山楂汁有机酸含量的研究[J].食品工业科技,2003,24(10):71-73.
[30]XIONG T,LI X,GUAN Q,et al.Starter culture fermentation of Chinese sauerkraut:Growth,acidification and metabolic analyses[J].Food Control,2014,41(2):122-127.
[31]BAI F W,ANDERSON W A,MOOYOUNG M.Ethanol fermentation technologies from sugar and starch feedstocks[J].Biotechnol Adv,2008,26(1):89-105.
[32]D'AMORE T,PANCHAL C J,RUSSEIL I,et al.Osmotic pressure effects and intracellular accumulation of ethanol in yeast during fermentation[J].J Ind Microbiol,1988,2(6):365-372.
[33]尤雅,段长青,燕国梁.扁平云假丝酵母Candidahumilis与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J].食品科学,2018,39(20):157-165.
[34]CONTRERAS A,HIDALGO C,SCHMIDT S,et al.The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].Int J Food Microbiol,2015,205(16):7-15.
[35]郭晓青,陈晓靓,杨春梅,等.紫苏叶活性成分及抗氧化性研究[J].食品与机械,2014,30(4):179-181.
[36]韦仕静,刘涛,葛亚中,等.西兰花酵素在发酵过程中生化指标变化及其抗氧化活性研究[J].现代食品科技,2017,33(8):123-129.
[37]柳红,张静.不同南瓜多糖体外清除羟基自由基作用的研究[J].植物科学学报,2007,25(4):356-359.
[38]LI X,HAN L,LI Y,et al.Protective effect of sinapine against hydroxyl radical-induced damage to mesenchymal stem cells and possible mechanisms[J].Chem Pharm Bull,2016,64(4):319-325.
[39]肖翔,周立平,马新.红曲菌发酵中添加紫苏叶提取物对其抗氧化活性的影响[J].中国酿造,2011,30(7):50-53.
[40]GU L,WU T,WANG Z.TLC bioautography-guided isolation of antioxidants from fruit of Perilla frutescens var.acuta[J].LWT-Food Sci Technol,2009,42(1):131-136.