商业酵母为了便于储存、运输和方面操作使用,在酵母生产过程中会对酵母细胞进行脱水干燥处理,最终制成含水量多数为4.0%~8.0%的活性干酵母,而自然状态的正常酵母细胞含水量多在70.0%左右[1]。在酵母生产的干燥脱水环节,会采用多种物理和生物工程技术,使酵母细胞失去所有的自由水和大部分的结合水,水分的缺失导致细胞膜水化层的丧失,进而失去正常的代谢功能及生长能力[2]。因此活性干酵母在进行接种发酵或者繁殖代谢前,首先必须吸收大量水分使酵母细胞恢复至原来自然状态的含水量,此即为复水,或称之为再水化。复水后的酵母细胞,再经过一定时间的适应性培养,恢复至自然状态酵母细胞本该具有的正常生理代谢功能,此即为活化[1]。由于酵母细胞膜水化层的丧失,导致酵母细胞膜磷脂双分子层的紊乱,细胞膜的渗透性也会增加,失去选择透过性,因此在活性干酵母复水活化的过程中会伴随着胞内无机化合物、氨基酸、核苷酸、酯类等生物活性物质的大量渗透流失,特别是在低温或高渗透压的环境中这种细胞内含物的流失会更加严重,这将直接影响到酵母细胞的活性。因此在传统酿酒工艺中,通常将活性干酵母经过复水活化后再添加到发酵醪中启动酒精发酵[3-5],这种操作可以使活性干酵母细胞从干缩休眠状态恢复到正常细胞形态,另外也可以避免活性干酵母直接接触低温、高渗透压的不利环境,减轻不利或胁迫因子对酵母细胞的损伤,有利于酵母快速启动酒精发酵,保障酒精发酵过程的顺利启动、彻底完成,此工序已成为酿酒行业公认的基本操作流程。但近年来,为了节省工厂操作工序、减轻车间工作量,使酿造简便化,也有少部分葡萄酒生产者在尝试对活性干酵母不进行活化,直接投到发酵醪中启动酒精发酵。
甘油即丙三醇,是酿酒酵母酒精发酵过程中主要的代谢产物之一,仅次于乙醇和二氧化碳。甘油对于酿酒酵母具有重要的生理调节作用,当酵母细胞处于高渗透压的不利环境时,甘油会在细胞内快速的合成和积累以维持细胞内外的渗透压平衡[6]。另外甘油合成是酵母在厌氧或微氧条件下调节酵母细胞内氧化还原电势平衡的重要途径之一[7-8]。甘油在酵母酒精发酵过程中产生,通常含量在1~15 g/L,被灰霉菌侵染的葡萄酿造的葡萄酒中,甘油含量会更高,如贵腐葡萄酒中甘油含量可达25 g/L[9]。甘油的生成会消耗一部分碳源,有研究表明,每生产100 g乙醇会产生5g甘油。所以在工业酒精的生产中会想方设法降低酒精发酵过程中甘油的产量[10-12],但在葡萄酒生产过程中甘油会给葡萄酒带来更加圆润、饱满的酒体,提高葡萄酒的综合感官品质[13-14],并且在全球变暖的大环境下,全球多个产区的酿酒葡萄成熟期的糖度越来越高,随之带来葡萄酒酒度增高[15-16],过高的酒精度会给葡萄酒带来苛性感或不平衡性,如果葡萄酒酵母在酒精发酵过程中能适当增加甘油的生成量,降低酒精生成率,反而会使葡萄酒更加的圆润、舒适、易饮。
为了研究葡萄酒酵母活化工艺与直投工艺对酒精发酵及甘油代谢的影响,本项目选取国内外多个品牌的不同品种的葡萄酒活性干酵母进行酿酒试验,验证其在常规发酵醪中、不同温度发酵条件下的差异性,为葡萄酒活性干酵母的合理使用提供一定的科学理论和应用参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与菌株
赤霞珠葡萄汁:总糖231.5 g/L,pH 3.5,总酸(以酒石酸计)5.3 g/L,市售;葡萄酒活性干酵母CECA、MST(酿酒酵母(Saccharomyces cerevisiae)):安琪酵母股份有限公司;葡萄酒活性干酵母F1、F2(酿酒酵母(Saccharomyces cere visiae)):法国某公司;葡萄酒活性干酵母A1、A2(酿酒酵母(Saccharomyces cerevisiae)):加拿大某公司。所选6种葡萄酒活性干酵母均为单一纯种。
1.1.2化学试剂
L-酒石酸(分析纯):上海源叶生物科技有限公司;甘油(分析纯):美国Sigma公司;无水乙醇(色谱纯)、硫酸(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
LRH-系列生化培养箱:上海一恒科技有限公司;BSA2202S电子天平:赛多利斯科学仪器(北京)有限公司;LKTC-B1-T恒温水浴锅:金坛市城东新瑞仪器厂;PHS-3C酸度计:上海仪电科学仪器股份有限公司;ZORBAX碳水化合物分析柱(4.6 mm×250 mm,5 μm)、HP1100高效液相色谱仪(具有示差折光检测器和自动进样器):美国安捷伦公司;SHZ曲型循环水真空泉:郑州长城科工贸有限公司;KQ100DB型超声波清洗器:昆山市超声仪器有限公司。
1.3 方法
1.3.1 酵母活化液制备
所有酵母采用200 mg/L的接种量,将称量好的活性干酵母提前放入10 mL的试管中,然后按照常规活化工艺规程,加入10倍酵母质量的38℃去离子水,使葡萄酒活性干酵母溶解完全,将带有复水活化液的试管放入38℃的恒温水浴锅中活化20 min,再逐步加入少量的葡萄汁,待酵母活化液的温度降至与葡萄汁温差在10℃以内时,将酵母活化液接种到装有葡萄汁的500 mL三角瓶中,每瓶装300 mL葡萄汁,每个样品两个重复。
1.3.2 酒精发酵
传统的葡萄酒发酵生产中最常见的酒精发酵温度多在13~18℃或23~29℃两个温度区间进行,所以本实验的酒精发酵温度设置为15℃和25℃。将接种好的葡萄汁处理样分别在15℃和25℃条件下恒温静置发酵,活化处理与直投处理25℃培养分别用“H-”和“G-”标示;活化处理与直投处理15℃培养分别用“H15-”和“G15-”标示。每隔24 h在同一时间点测定一次发酵处理样的质量,发酵前后的质量差代表CO2的生成量,并根据每天的CO2生成量绘制发酵曲线。当24 h间隔CO2的生成量<1.0 g时,可以判定酒精发酵基本结束。每个处理样设置2个重复,为了保证15℃的发酵模拟环境接近生产实际,确保数据准备可信,要求接种时的葡萄汁发酵液的温度也低于15℃。
1.3.3 酒样常规理化指标测定
酒精、残糖、总酸、挥发酸:参照GB/T 15038—2006《葡萄酒、果酒通用分析法》[17]。
1.3.4 甘油含量的测定
发酵样品的处理:将发酵样品在取样容器中混匀,取混匀后的适量样品4 000 r/min离心10 min,精密称取一定质量离心后的上清液至容量瓶中,用纯水定容并稀释合适的倍数,使其浓度在曲线范围内,将稀释后溶液经0.45 μm滤膜过滤后上机测试。
高效液相色谱条件:用0.005 mol/L H2SO4溶液作为流动相,流速为0.6 mL/min,柱温65℃,平衡流动相待仪器基线走平稳后进样,进样量为20 μL。
1.3.5 数据分析
运用SPSS 22.0进行方差分析。
2 结果与分析
2.1 发酵曲线结果与分析
3个品牌6个品种的葡萄酒活性干酵母的发酵曲线如图1。
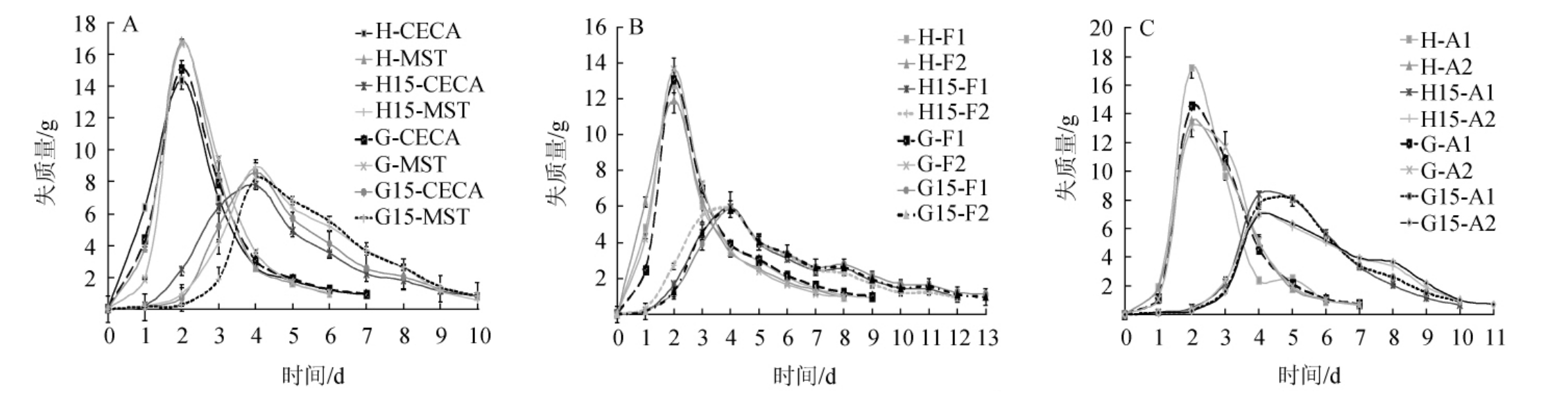
图1 不同条件下安琪葡萄酒酵母(A)、法国葡萄酒酵母(B)、加拿大葡萄酒酵母(C)发酵曲线
Fig.1 Fermentation curve of Angel wine yeast(A),French wine yeast(B)and Canada wine yeast(C)under different fermentation conditions
从图1可以看出,在25℃发酵条件下,6种葡萄酒酵母在发酵的第1天活化接种的酵母发酵速度比直投接种快31.5%~50.9%;在发酵的第2天发酵速度达到最快,此时直投酵母的发酵速度开始快于活化处理。加拿大A酵母在发酵的第1天活化接种的发酵速度要快于直投工艺39.6%~43.1%;在发酵的第2天发酵速度达到最大,此时活化处理的葡萄酒酵母发酵速度仍快于直投处理,活化接种和直投工艺均在同一天完成了酒精发酵。在15℃发酵条件下,6种酵母无论是活化接种还是直投接种在接种的第1天单日质量损失均<0.5 g,且差异不大、发酵速度极慢,在接种后的第2天安琪葡萄酒酵母和法国葡萄酒酵母的单日质量损失开始快速增加,其中所选2种安琪葡萄酒酵母活化接种要比直投接种单日质量损失高71%,F1和F2酵母接种第2天单日质量损失活化接种比直投接种分别高24%和53%。加拿大2种葡萄酒酵母在接种后第2天单日质量损失仍然<0.5 g,活化接种比直投接种单日质量损失高30%左右。除直投处理的A1酵母外,单日最大质量损失均在接种后第4天,此时活化与直投的发酵速度差距明显缩小,单日质量损失相差不大。在低温15℃发酵条件下,6种酵母起酵速度均比较慢,尤其直投的酵母起酵速度更慢。
从发酵曲线可以看到,无论是在25℃还是在15℃发酵条件下,相比活化工艺,直投工艺都会明显的引起起酵速度缓慢、滞后。研究表明,将活性干酵母置于35~43℃复水有助于细胞膜转变回液晶状态并使内含物泄漏最小化[18],因此通常在葡萄酒酵母接种前酿酒师会选用35~38℃条件复水,然后再补充适当葡萄汁活化,或者直接用4%~5%的糖水溶液复水活化。如果复水温度低于30℃,酵母细胞的活性损失将会很大,特别是对没添加保护剂的活性干酵母损害会更大。而没有经过科学的复水活化的活性干酵母在直接投入到发酵液后面对低温、高渗透压等不利环境,酵母细胞内含物的流失会更加的严重[19],随之带来更大的酵母活性损失,这也是葡萄酒活性干酵母经活化后接种比直投接种起酵快的原因之一。
由于葡萄酒发酵多在5 d以上,所以起酵速度一般不影响中、后期的酒精发酵,因此从图1可以看出,安琪酵母和法国酵母无论是在15℃还是在25℃发酵条件下,当发酵速度达到峰值时,直投工艺的发酵速度开始超过活化处理的样品,并且在中期也是如此,直到发酵末期直投酵母和活化酵母发酵速度趋于一致。在25℃发酵条件下所有的酵母无论是活化接种还是直投接种均在同一天结束发酵。在15℃条件下,安琪酵母活化接种与直投接种均在同一天结束发酵;但是所选的法国酵母在15℃培养条件下直投工艺均比活化晚1~2 d结束酒精发酵;加拿大葡萄酒酵母在发酵速度达到峰值时仍是活化酵母的发酵速度高于直投工艺,在酒精发酵中后期才表现出直投酵母发酵速度高于活化酵母,在发酵末期两种接种工艺的发酵速度趋于一致,但在15℃培养条件下A2酵母的直投工艺要比活化工艺晚1 d结束发酵,由此可见直投接种会导致部分商业葡萄酒酵母发酵时间延长、拖后。
2.2 常规理化指标结果与分析
对6种葡萄酒酵母不同接种方法、不同发酵温度条件下的酒样进行常规理化分析。从表1可知,在15℃发酵条件下,除F1和F2酵母直投接种最终酒样残糖低于活化接种酒样,其他酵母均表现出活化接种的最终残糖低于直投接种,总酸(酒石酸计)、酒精度、挥发酸含量差异不大,均符合国标要求。在15℃条件下只有H-MST和G15-F1酒样最终残糖含量<4 g/L,其他均未发酵彻底,另外从图1可以看到,在15℃发酵条件下,安琪酵母MST活化接种和直投接种均在同一天结束发酵,而F1酵母活化接种要比直投接种晚1天结束发酵,可能F1酵母在CO2单日产量<1 g后酵母还在缓慢的进行发酵,所以活化接种的残糖反而大于直投接种。由此可见,在15℃发酵条件下,不同的葡萄酒酵母采用不同的接种工艺会影响到最终能否发酵完全彻底。从表2可知,在25℃酒精发酵条件下,6种酵母无论采用活化接种工艺还是直投工艺,均能彻底完成酒精发酵,残糖含量均<4 g/L,总酸(酒石酸计)、酒精度、挥发酸含量差异不大,均符合国标要求。
表1 15℃发酵结束后酒样常规理化指标
Table 1 Conventional physical and chemical indexes of wine samples after fermentation under 15℃
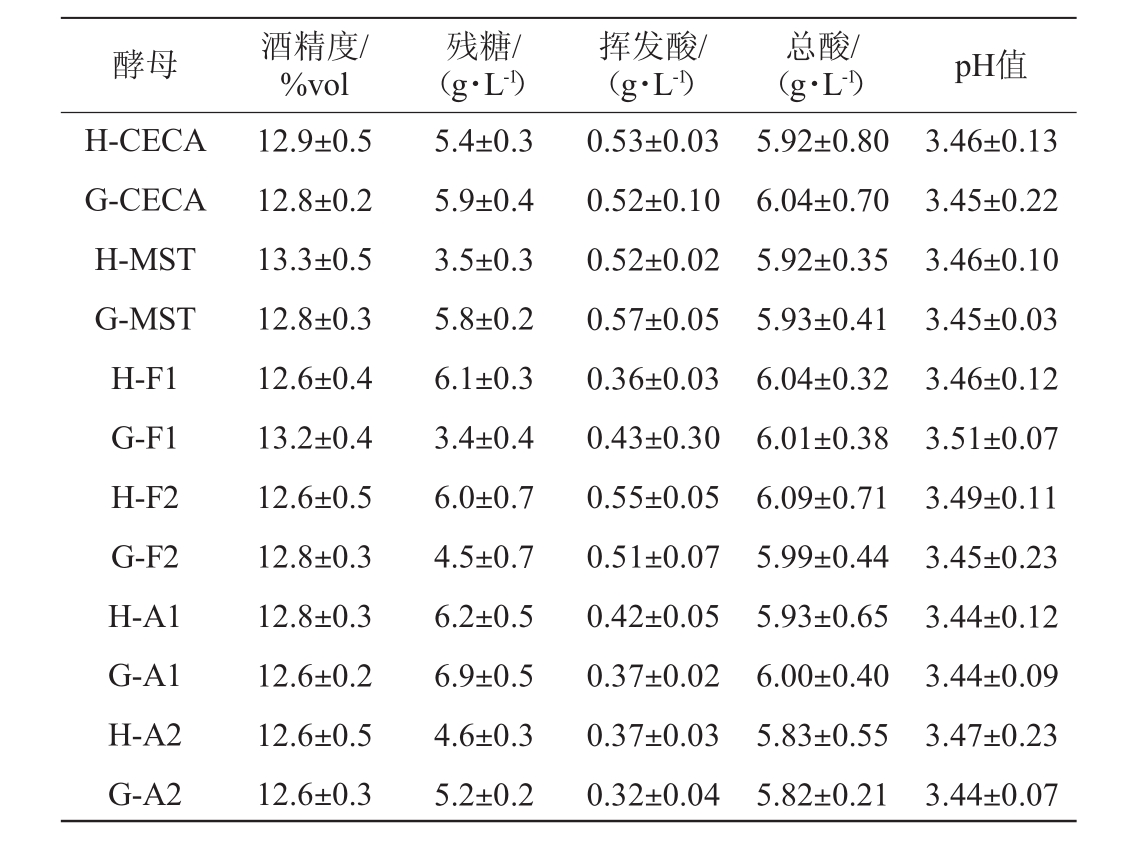
酵母 酒精度/%vol残糖/(g·L-1)挥发酸/(g·L-1)总酸/(g·L-1) pH值H-CECA G-CECA H-MST G-MST H-F1 G-F1 H-F2 G-F2 H-A1 G-A1 H-A2 G-A2 12.9±0.5 12.8±0.2 13.3±0.5 12.8±0.3 12.6±0.4 13.2±0.4 12.6±0.5 12.8±0.3 12.8±0.3 12.6±0.2 12.6±0.5 12.6±0.3 5.4±0.3 5.9±0.4 3.5±0.3 5.8±0.2 6.1±0.3 3.4±0.4 6.0±0.7 4.5±0.7 6.2±0.5 6.9±0.5 4.6±0.3 5.2±0.2 0.53±0.03 0.52±0.10 0.52±0.02 0.57±0.05 0.36±0.03 0.43±0.30 0.55±0.05 0.51±0.07 0.42±0.05 0.37±0.02 0.37±0.03 0.32±0.04 5.92±0.80 6.04±0.70 5.92±0.35 5.93±0.41 6.04±0.32 6.01±0.38 6.09±0.71 5.99±0.44 5.93±0.65 6.00±0.40 5.83±0.55 5.82±0.21 3.46±0.13 3.45±0.22 3.46±0.10 3.45±0.03 3.46±0.12 3.51±0.07 3.49±0.11 3.45±0.23 3.44±0.12 3.44±0.09 3.47±0.23 3.44±0.07
表2 25℃发酵结束后酒样常规理化指标
Table 2 Conventional physical and chemical indexes of wine samples after fermentation under 25℃
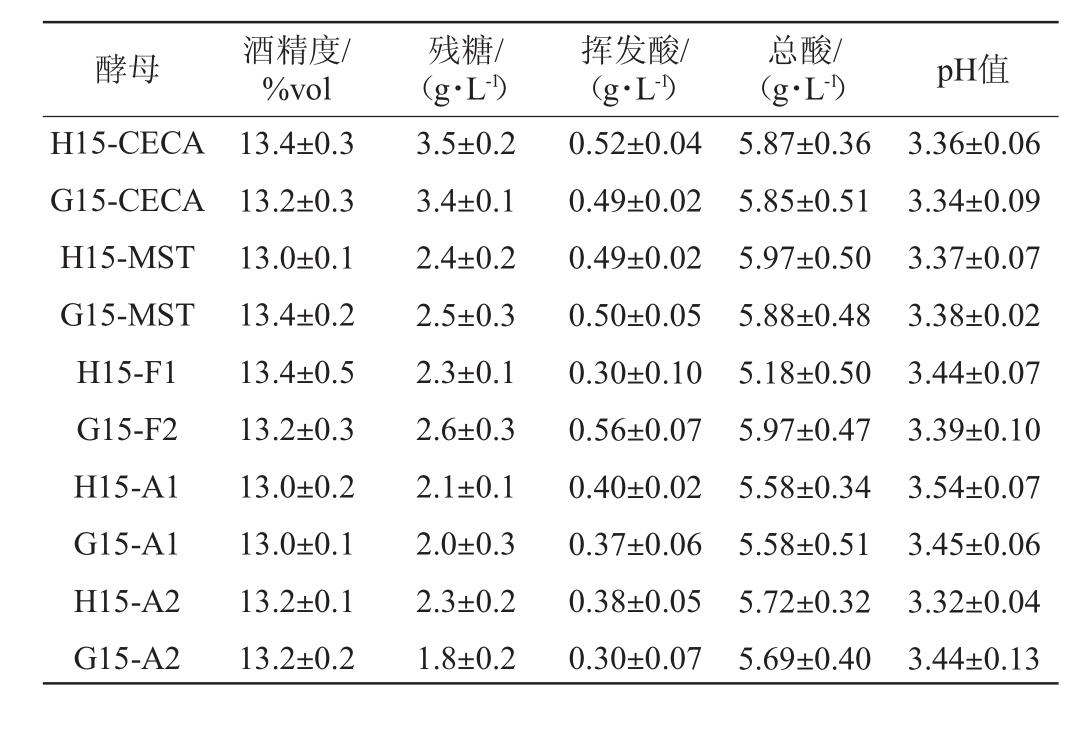
酵母 酒精度/%vol残糖/(g·L-1)挥发酸/(g·L-1)总酸/(g·L-1) pH值H15-CECA G15-CECA H15-MST G15-MST H15-F1 G15-F2 H15-A1 G15-A1 H15-A2 G15-A2 13.4±0.3 13.2±0.3 13.0±0.1 13.4±0.2 13.4±0.5 13.2±0.3 13.0±0.2 13.0±0.1 13.2±0.1 13.2±0.2 3.5±0.2 3.4±0.1 2.4±0.2 2.5±0.3 2.3±0.1 2.6±0.3 2.1±0.1 2.0±0.3 2.3±0.2 1.8±0.2 0.52±0.04 0.49±0.02 0.49±0.02 0.50±0.05 0.30±0.10 0.56±0.07 0.40±0.02 0.37±0.06 0.38±0.05 0.30±0.07 5.87±0.36 5.85±0.51 5.97±0.50 5.88±0.48 5.18±0.50 5.97±0.47 5.58±0.34 5.58±0.51 5.72±0.32 5.69±0.40 3.36±0.06 3.34±0.09 3.37±0.07 3.38±0.02 3.44±0.07 3.39±0.10 3.54±0.07 3.45±0.06 3.32±0.04 3.44±0.13
2.3 甘油产量结果与分析
从图2可知,在15℃发酵条件下,除F1酵母外,其他5种酵母采用活化接种的样品最终甘油产量均显著高于直投接种的样品(P<0.05),其中以F2酵母最为明显,其活化接种比直投接种的甘油产量高出8%。从图2可知,在25℃培养条件下除F1和A2酵母外,其他4种酵母经活化接种的甘油产量均显著的高于直投接种的样品,其中A1酵母活化接种比直投接种的甘油高出10.5%。F1酵母无论是在15℃还是在25℃酒精发酵条件下采用活化与直投接种工艺酵母产生的甘油产量均无显著差异。而A2酵母在15℃发酵条件下活化接种发酵酒产生的甘油高于直投接种,但在25℃发酵条件下,活化接种的发酵酒甘油产量反而低于直投接种。有相关报道,酵母在酒精发酵过程中甘油的产量受温度、pH、葡萄原料、酵母菌种等多种因素的影响[20]。本实验中采用相同的葡萄汁、同一发酵温度进行酒精发酵,甘油的产量一方面因不同的酵母菌株而异,另一方面活化处理的甘油产量高于直投工艺,有可能是活性干酵母经过活化后能够相对快速的恢复到正常的生理状态并开始正常的甘油代谢有关。
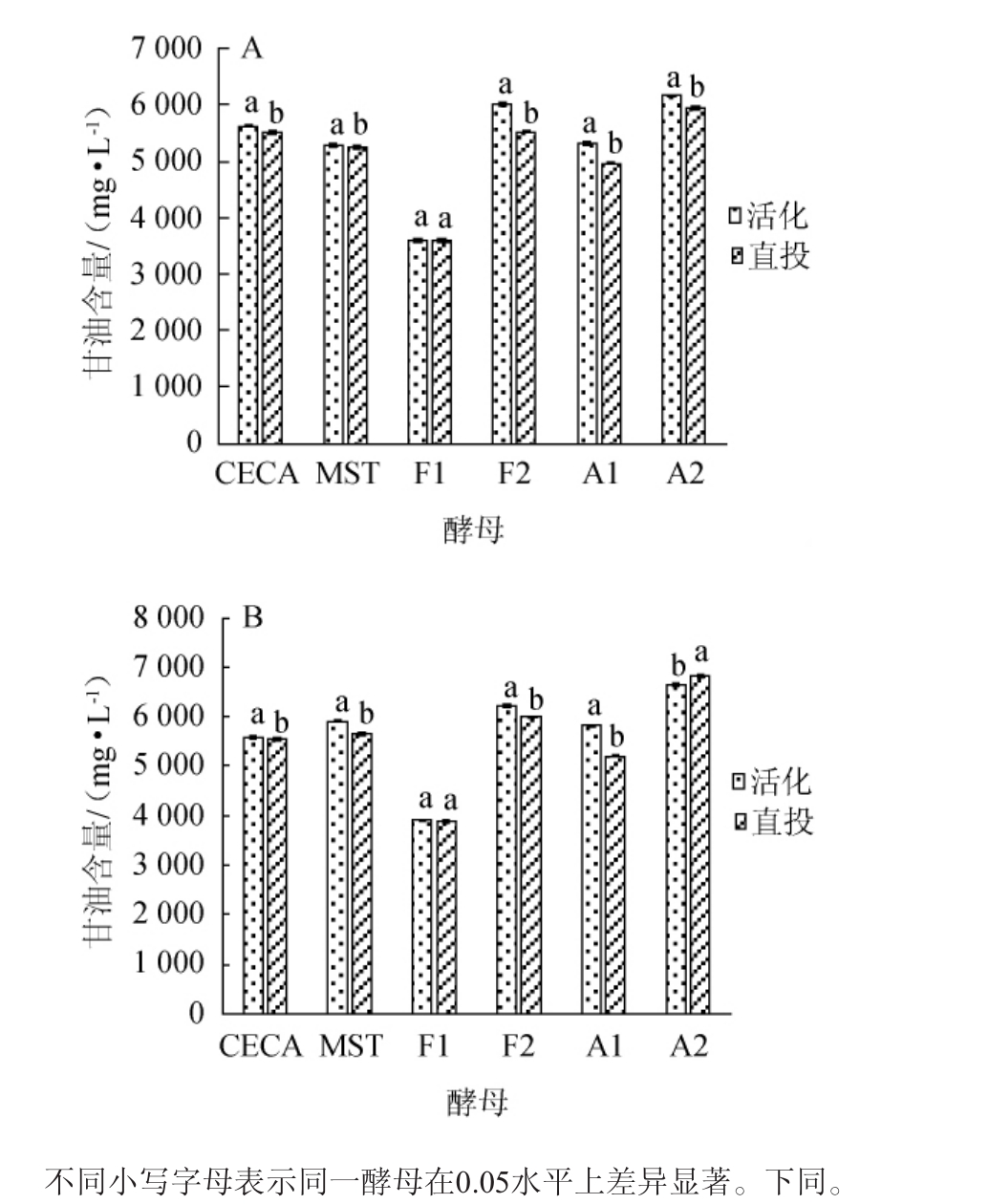
图2 6种酵母15℃(A)和25℃(B)条件下不同接种工艺甘油产量
Fig.2 Yield of glycerol in different inoculation processes of 6 yeasts at 15 °C(A)and 25 °C(B)
3 结论
本实验中,采用活化处理接种的葡萄酒活性干酵母起酵速度要明显的快于直投工艺。在15℃发酵条件下,部分活性干酵母直投接种比活化接种晚一天结束发酵;F1酵母活化与直投处理间甘油产量没有显著差异(P>0.05),其他5种酵母活化工艺发酵的葡萄酒甘油产量显著高于直投工艺(P<0.05);在25℃发酵条件下,活化接种和直投接种均在同一天完成酒精发酵,最终残糖含量均<4 g/L;F1酵母活化与直投接种之间的甘油产量没有显著的差异,A2酵母活化接种后葡萄酒的甘油产量显著低于直投工艺,其他4种葡萄酒活性干酵母活化后的甘油产量明显高于直投工艺。因此综合考虑,与活化后接种相比,直投接种可能延长发酵时间,降低甘油产量。
[1]于景芝.酵母生产与应用手册[M].北京:中国轻工业出版社,2005:233-234.
[2]窦冰然,郭会明,骆海燕,等.活性干酵母及其在食品工业中的应用[J].中国酿造,2016,35(8):1-4.
[3]都振江,徐金辉,曹明秀.论酒精发酵中酵母菌的有效活化与营养管理[J].中外葡萄与葡萄酒,2017(4):110-113.
[4]刘嘉璐,孙玉梅,黄超,等.活性干酵母活化时间与级数对葡萄酒发酵的影响[J].中国酿造,2018,37(7):101-106.
[5]赵芳.安琪牌葡萄酒活性干酵母在草莓酒酿造中的应用[J].中国酿造,2008,27(13):70-72.
[6]陈献忠,王正祥,诸葛健.酵母细胞甘油代谢与生理功能研究进展[J].中国生物工程杂志,2010,30(5):140-148.
[7]陈献忠,王正祥,诸葛健.酵母细胞甘油代谢与生理功能研究进展[J].中国生物工程杂志,2010,30(5):140-148.
[8]朱济义,杜金华,王秀菊,等.葡萄酒中甘油的生成及其影响因素[J].酿酒,2010,37(2):23-27.
[9]王秀菊,杜金华,朱济义,等.影响果酒酵母甘油产量主要因素的研究[J].食品与发酵工业,2010(2):80-84.
[10]孔庆学.酿酒酵母遗传操作降低甘油合成提高乙醇产量的研究[D].天津:天津大学,2007.
[11]王寒,张梁,石贵阳.过表达NADH激酶基因对酿酒酵母乙醇发酵的影响[J].生物工程学报,2014,30(9):1381-1389.
[12]吴婷婷,吴雪昌.高乙醇转化率酿酒酵母工程菌株构建研究进展[J].食品与发酵工业,2006,32(8):88-92.
[13]朱济义,杜金华,王秀菊,等.葡萄酒中甘油的生成及其影响因素[J].酿酒,2010,37(2):23-27.
[14]薛军侠,徐艳文,裴颖芳,等.葡萄酒中酵母菌高产甘油的研究进展[J].微生物学杂志,2008,28(5):77-82.
[15]张陆阳.气候变化带来葡萄酒酿造新理念[J].中外葡萄与葡萄酒,2015(4):41.
[16]刘敏,闵卓,鞠延仑,等.全球气候变暖对葡萄和葡萄酒品质的影响[J].北方园艺,2017(4):177-182.
[17]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[18]LESLIE S B,TETER S A,CROWE L M,et al.Trehalose lowers membrane phase transitions in dry yeast cells[J].Biochim Biophys Acta,1994,1192(1):7-13.
[19]卢佩颜.干酵母活化方式对酒精发酵影响的研究[J].轻工科技,2014(4):10.
[20]YANNIOTIS S,KOTSERIDIS G,ORFANIDOU A,et al.Effect of ethanol,dry extract and glycerol on the viscosity of wine[J].J Food Eng,2007,81(2):399-403.