小曲酒是以小曲为糖化发酵剂进行酿造的中国传统白酒,因其使用的酒曲以及发酵方式的不同而有别于大曲酒,在酒行业中占据着一定的市场。传统小曲的制备是以自然接种的方式,在观音土、米糠、薯渣、米粉、麸皮等制曲原料上培养得来,相关微生物主要有根霉、曲霉、毛霉等霉菌以及酵母菌等,培养过程中也会有细菌生长,整个制曲工艺中对有益微生物和有害微生物的生长难以把控[1-2]。随着纯种培养技术的发展,小曲的制作逐渐改进为纯种接种根霉培养种曲,与酵母菌混合制曲,出酒率大大得以提高,如厦门白曲,邛崃米曲等小曲,其中根霉是小曲制作中的主要糖化菌,含有丰富的糖化型淀粉酶,能从酿酒原料中淀粉的非还原端切断α-1,4和α-1,6糖苷键,使其转化成为可发酵性还原糖,供后续发酵微生物利用[3],在整个酿造过程中起着至关重要的作用,同时成品曲的糖化性能是检验酒曲质量的重要指标,也是影响白酒酿造出酒率的关键因素之一。
纯种根霉曲的生产包括一级试管种培养,二级三角瓶种曲制作,然后再扩大培养到三级浅盘种曲,后续大批投入培养成生产曲[4-5],目前关于纯种根霉米粉曲的研究主要集中在生产曲生产过程中的酶学性质研究及工艺优化[6-7],机械化制曲的工艺摸索[8],以及菌种的改造选育与表达分析[9-11]。未有针对一级试管菌种与种曲质量的相关性研究,其培养多凭靠经验判断,难以稳定,但实际上一级试管菌种的状态会直接影响到二级种曲制作的质量,与后续生产曲的发酵特性密切相关,是整个制曲过程中的关键环节。培养时间过短会使得糖化性能变差,发酵不能正常进行;若培养时间过长,过多的孢子会导致成品酒出现不好的风味。而酒曲作为酿酒的糖化发酵剂,其质量好坏很大程度上决定了酿造过程能否正常发酵,没有针对性的工艺研究,常常会导致不必要的人力物力损失,因此很有必要对米粉种曲制作工艺进行探究与优化。
种曲的糖化性能好坏决定了后续生产曲的优劣,针对该指标展开研究,对实际生产具有很大的指导作用。采用纯种根霉接种制备种曲,通过控制一级试管菌种的培养时间、种曲培养温度以及米粉的水分含量,研究三者对种曲试饭糖分值与糖化酶活力的影响,并利用Box-Behnken响应面设计进一步对种曲制作工艺进行优化,以期为根霉制曲自动化,智能化的发展建设提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
WJ02-G根霉:桂林湘山酒业有限公司;国家一级籼米:湖南省金健米业股份有限公司。
1.1.2 化学试剂
苯酚、酒石酸甲钠、3,5-二硝基水杨酸(3,5-dinitrosali cylic acid,DNS)、琼脂粉:生工生物工程(上海)股份有限公司;氢氧化钠、亚硫酸氢钠、冰醋酸、醋酸钠(均为分析纯):国药集团化学试剂有限公司。试验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
米曲汁琼脂培养基:参照毛宜祥等[12]的方法制备,再以纯水调节其糖度至12°Bx,以氢氧化钠溶液调节pH至6.5,琼脂添加量为2%,115℃条件下高压灭菌20 min,斜面摆至试管长度1/3,放置10 d待试管内壁无水珠后备用。
1.2 仪器与设备
60目标准筛:新乡市同心机械有限责任公司;SF130高速中药粉碎机:长沙市岳麓区中南制药机械厂;LMQ电热立式自动高压灭菌锅:山东新华医疗器械股份有限公司;SW-SJ-1FD超净工作台:苏州安泰空气技术有限公司;MJP-250霉菌培养箱:北京中兴伟业仪器有限公司;DZ-260C真空包装机:温州市凯驰包装机械有限公司;HH-M2恒温水浴锅:金坛市城西春兰试验仪器厂;UV-1800紫外可见光分光光度计:岛津企业管理有限公司。
1.3 方法
1.3.1 纯种根霉米粉种曲制作工艺流程及操作要点

操作要点:将籼米粉碎后过60目标准筛,以每瓶40 g的装载量将米粉分装在500 mL三角瓶中,于121℃条件下15 min后取出趁热用无菌药刮搅散待冷却至室温,同时在无菌水中加入1 mL试管根霉菌悬液,混匀后将混合液倒入冷却刮散的米粉中翻拌均匀,然后旋转搭窝,置于32℃霉菌培养箱培养24h后扣瓶,继续培养至48h后将米粉饼取出放入无菌牛皮纸袋内,于39℃电热鼓风干燥箱中干燥48 h后真空包装,待测种曲的糖化酶活力及试饭糖分。
1.3.2 不同培养时间试管菌种的菌悬液制备
无菌操作勾取WJ02-G纯种根霉菌丝体接种于米曲汁琼脂培养基斜面中间,于32℃霉菌培养箱中培养一定时间,培养结束后将试管中根霉整块挑出置于无菌研钵中,加入3 mL无菌水研磨2 min,制得不同培养时间试管菌种的菌悬液。
1.3.3 酒曲糖化酶活力的测定方法
糖化酶活力定义[13]:1 g酒曲(以绝干计)在40℃、pH 4.6条件下,1h分解可溶性淀粉生成1 mg葡萄糖,即为1个酶活力单位,以U/g表示。
测定方法:参照马歌丽等[14]的方法利用3,5-二硝基水杨酸比色法测定种曲中的糖化酶活力。
1.3.4 酒曲试饭糖分的测定方法
试饭方法:参照王晓慧等[15]的方法,糖分:参照马歌丽等[14]的方法利用DNS法进行定量。
1.3.5 单因素试验
设置各因素的固定水平分别为试管菌种培养时间72h、种曲培养温度32℃、米粉水分含量25%。改变待考察因素的水平分别为试管菌种培养时间36 h、48 h、60 h、72 h、84 h、96 h;种曲培养温度26℃、28℃、30℃、32℃、34℃、36℃;米粉水分含量15%、20%、25%、30%、35%、40%。培养完毕后分别测定种曲的试饭糖分与糖化酶活力。
1.3.6 Box-Behnken响应面试验设计
在单因素试验的基础上,以试管菌种培养时间(A)、种曲培养温度(B)、种曲水分含量(C)为考察因素,以试饭糖分(Y)为响应值,利用Box-Behnken响应面设计试验,试验因素与水平如表1所示。
表1 种曲制作工艺优化Box-Behnken响应面设计试验因素与水平
Table 1 Factors and levels of Box-Behnken response surface design for optimization of rice flour fermentation process
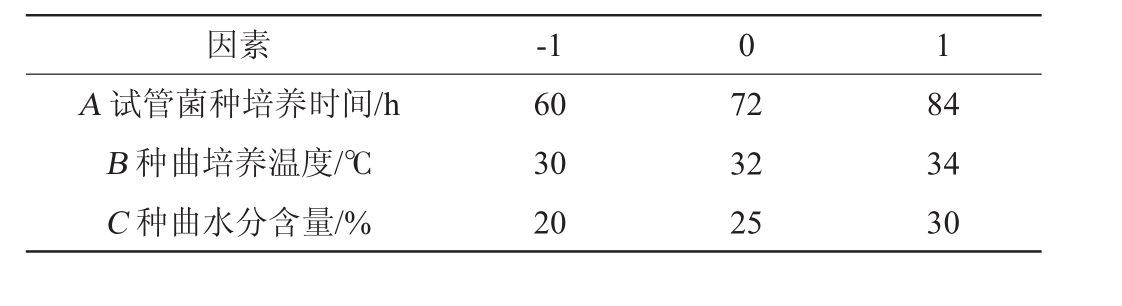
因素-1 0 1 A试管菌种培养时间/h B种曲培养温度/℃C种曲水分含量/%60 30 20 72 32 25 84 34 30
2 结果与分析
2.1 单因素试验
2.1.1不同培养时间的一级试管菌种对种曲的影响
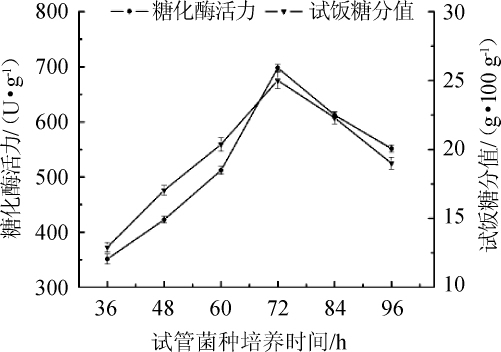
图1 培养时间对种曲的影响
Fig.1 Effect of culture time on the seed starter
由图1可知,当培养温度为32℃、米粉水分含量为25%时,不同的试管菌种培养时间对种曲的糖化酶活力与试饭糖分值均有显著影响。在36~72h时,随着培养时间的延长,糖化酶活力与试饭糖分值呈现递增趋势,在72 h均达到了峰值,分别为698.13 U/g和25.02 g/100 g;延长时间继续培养,72 h之后两者均逐渐降低。
这一现象很有可能与根霉菌丝生长与孢子产生直接相关,根霉菌丝是根霉营养体的基本单位,随着顶端的细胞不断生长而蔓延开来逐渐成熟,是由孢子在合适的生长条件下萌发得来,但成熟的根霉菌丝同样具有繁殖能力与糖化能力[16],往往孢子较少而菌丝较多的根霉曲,接种后有利于根霉孢子的萌发和菌丝体的前期生长。随着试管菌种中菌丝体逐渐成熟到最终老化,以及孢子数量不断增多,接种后种曲的糖化酶活力与试饭糖分值均呈现出先升后降的趋势。因此,选择72 h为最适宜的试管菌种培养时间。
2.1.2 不同的培养温度对种曲的影响
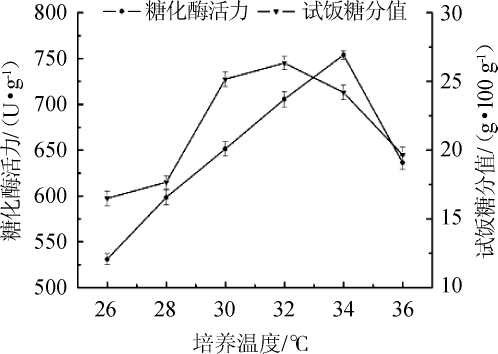
图2 培养温度对种曲的影响
Fig.2 Effect of culture temperature on the seed starter
由图2可知,在试管菌种培养时间为72 h、米粉水分含量为25%的条件下,不同的培养温度对于种曲的糖化酶活力与试饭糖分同样影响显著。在26~34℃范围内,糖化酶活力随种曲培养温度的升高持续增高,在34℃达到峰值753.80 U/g,之后随温度升高而出现急剧下降;26~32℃范围内,试饭糖分随温度升高,在32℃达到峰值26.33 g/100 g,超过32℃后逐渐下降。两者总体趋势均呈现为先升后降,但糖化酶活力34℃时最优,试饭糖分在32℃最优,同时两者下降的幅度是前者大于后者。
大部分根霉的最适生长温度为30~33℃,而产酶温度则比生长温度稍高,最适产酶温度在30~35℃[17],根霉在适宜温度条件下快速生长,然后在合适的产酶温度下开始产酶;IKASARI L等[18]研究发现,温度上升会导致根霉在生长过程中主动延长的菌丝尖端数量减少,而且将温度降低之后,根霉也并不会立即恢复。超出最佳生长温度范围之外后,根霉的生长会被抑制,孢子的萌发和菌丝体的生长也会随之受限。因此根霉产酶会受到很大的影响,酶活急剧下降。相对而言,温度对试饭糖分的影响比糖化酶活力小一些,针对试饭糖分开展研究。因此,选择32℃为最适宜的种曲培养温度。
2.1.3 不同的水分含量对种曲的影响
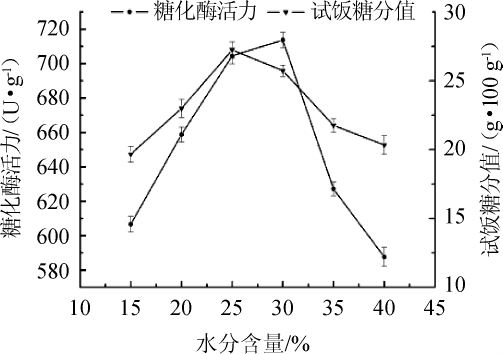
图3 米粉水分含量对种曲的影响
Fig.3 Effect of moisture content of rice flour on the seed starter
由图3可知,在试管菌种培养时间为72 h,种曲培养温度32℃条件下,米粉中不同的水分含量对种曲糖化酶活力及试饭糖分都影响显著。在15%~25%加水量范围内,试饭糖分值随水分含量的增大而逐渐升高,在25%处达到峰值27.23 g/100 g,在25%~40%范围内,试饭糖分值随水分含量的增加而持续降低;糖化酶活力与试饭糖分值趋势相同,但峰值点出现在30%处,为713.67 U/g,在15%~30%范围递增,30%~40%范围递减,且下降幅度较大。
水分和氧气是影响根霉生长代谢的重要因素,米粉中的水分一方面为根霉生长提供了必须的条件,另一方面也影响着根霉生长环境的氧含量,从而调控着其生长。SPARRINGA R A等[19]在对寡孢根霉菌进行生长条件优化时发现其生长需要一定的水分,刘宪春[20]在研究根霉Q303生长特性时也发现,水分与温度是影响根霉质量的关键因素,而且根霉在培养过程中也需供给一定量的氧分,以提高培菌糖化率和出酒率[21]。水分含量适宜时,根霉可以从生长环境中获取足够的水与氧气,但当水分过多时,物料疏松程度不够,米粉过多粘结成块,氧浓度不足的同时,也阻碍了根霉菌丝的攀附延伸,对其生长不利。从试饭糖分的结果来看,选择25%作为最适宜的加水量较为合理。
2.2 Box-Behnken响应面试验结果分析
2.2.1 响应面设计及结果
小曲酒的酿造工艺决定了小曲的添加量远远小于大曲,后续的发酵主要依靠菌体边生长边糖化发酵,酒曲的糖化酶活力并不是决定糖化好坏的关键因素,试饭糖分值更能准确地反映出实际发酵过程中酒曲的糖化性能。在单因素试验的基础上,以试管菌种培养时间(A)、种曲培养温度(B)、米粉水分含量(C)为试验因素,试饭糖分值(Y)为响应值,利用Design Expert 8.06响应面软件的Box-Behnken设计3因素3水平试验,试验设计与结果见表2。对试验结果进行多元回归拟合分析,得到试饭糖分Y对自变量A、B、C的回归方程为:
表2 种曲制作工艺优化响应面试验结果与分析
Table 2 Analysis and results of Box-Behnken response surface design for optimization of rice flour fermentation process by pure Rhizopus seed starter
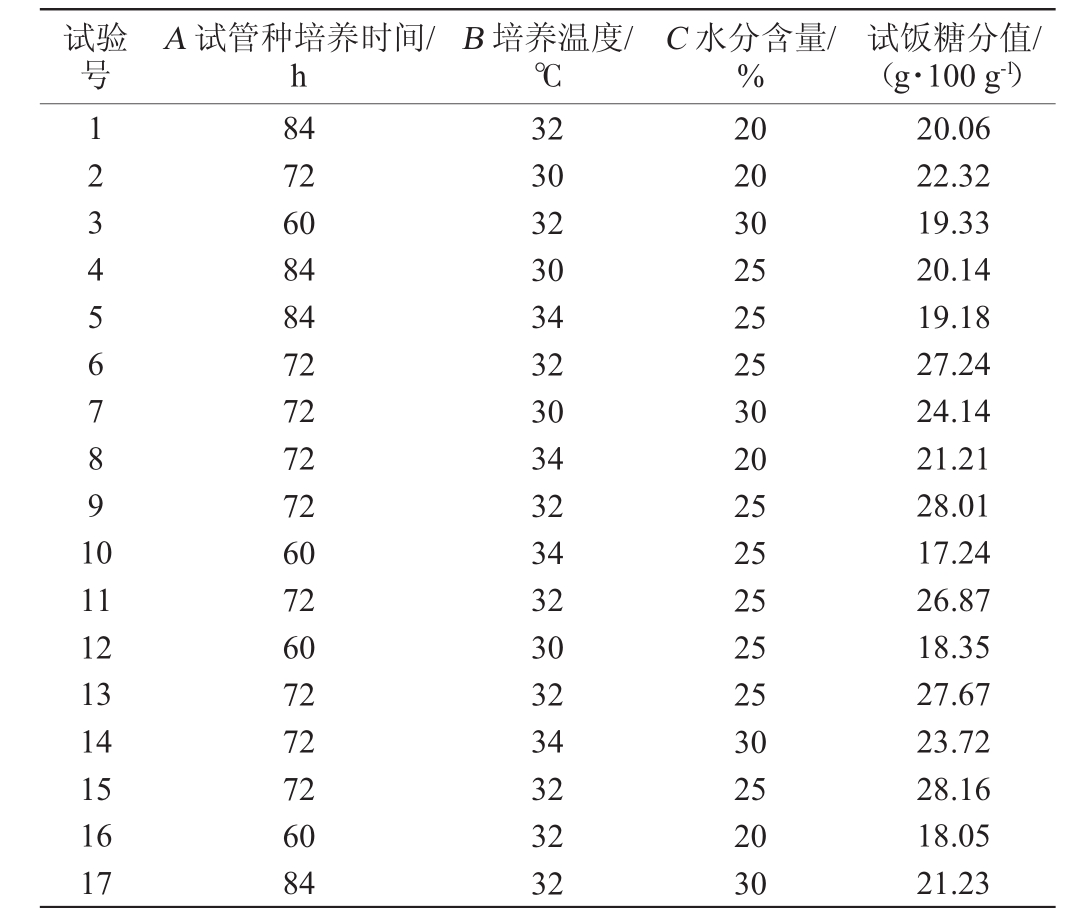
试验号A试管种培养时间/h B培养温度/℃C水分含量/%试饭糖分值/(g·100 g-1)1234567891 0 11 12 13 14 15 16 17 84 72 60 84 84 72 72 72 72 60 72 60 72 72 72 60 84 32 30 32 30 34 32 30 34 32 34 32 30 32 34 32 32 32 20 20 30 25 25 25 30 20 25 25 25 25 25 30 25 20 30 20.06 22.32 19.33 20.14 19.18 27.24 24.14 21.21 28.01 17.24 26.87 18.35 27.67 23.72 28.16 18.05 21.23
2.2.2方差及可信度分析
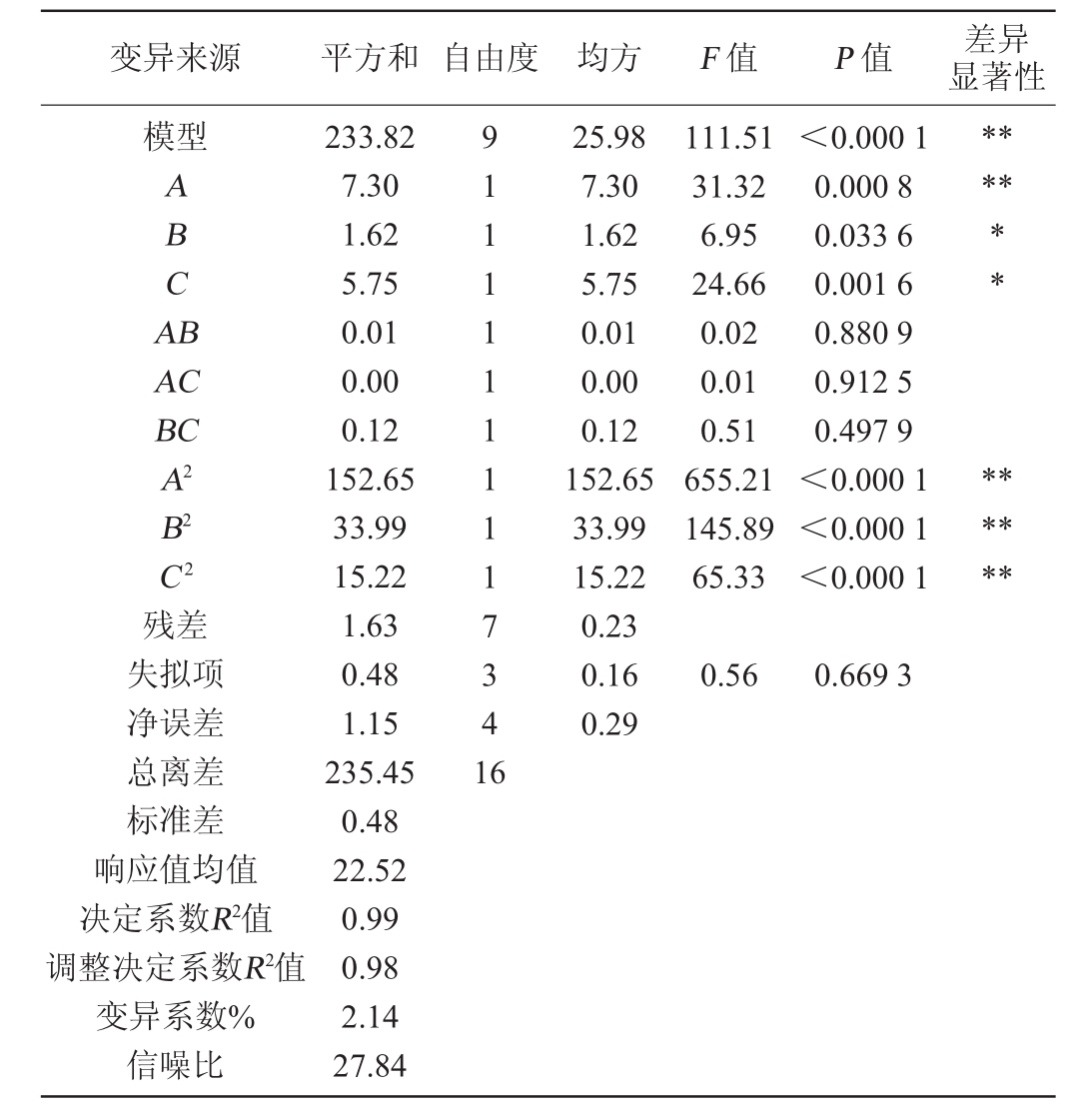
响应面的二次模型方差分析结果见表3,由表3可知,模型的P值<0.001,差异极显著,具有统计学意义;失拟项P值>0.05,差异不显著,说明所选模型与试验的拟合度较好,可用该回归方程对试验结果进行分析。一次项中A(菌种时间)、B(培养温度)、C(水分含量)的P值分别为PA<0.001,0.001<PB<0.05,PC<0.05,三者P值均<0.05,表明3个因素均对响应指标试饭糖分具有显著影响,其中A影响极显著,B、C影响显著。F值越大,则试验因素对响应指标的影响程度越大,三者F值分别为31.32、6.95、24.66,表明3个因素对试饭糖分的影响程度大小为A>C>B。二次项A2、B2、C2对试饭糖分均有极显著影响(P<0.01)。
表3 响应面二次模型的方差分析结果
Table 3 ANOVA results of response surface quadratic model
注:“*”表示影响显著(P<0.05);“**”表示影响极显著(P<0.01)。
变异来源 平方和 自由度 均方 F值 P值 差异显著性模型ABCA B****AC BC A2 B2** **C2 111.51 31.32 6.95 24.66 0.02 0.01 0.51 655.21 145.89 65.33<0.000 1 0.000 8 0.033 6 0.001 6 0.880 9 0.912 5 0.497 9<0.000 1<0.000 1<0.000 1****残差失拟项净误差总离差标准差响应值均值决定系数R2值调整决定系数R2值变异系数%信噪比233.82 7.30 1.62 5.75 0.01 0.00 0.12 152.65 33.99 15.22 1.63 0.48 1.15 235.45 0.48 22.52 0.99 0.98 2.14 27.84 91111111117341 6 25.98 7.30 1.62 5.75 0.01 0.00 0.12 152.65 33.99 15.22 0.23 0.16 0.29 0.560.669 3
方差分析结果中,决定系数R2值为0.99,表明模型可以解释99%的响应值,回归方程的拟合程度较好;调整决定系数R2值为0.98,说明试验可进行优化,调整之后有98%的变化来源于试验所考察变量。变异系数为2.14%,在试验范围内变异较小,数据的离散程度在可接受范围内。
综上,回归模型与实际值的拟合程度较好,可用来预测和优化纯种根霉米粉种曲制备的工艺。
2.2.3 各因素交互作用的响应面分析
各因素交互作用对种曲试饭糖分值的影响如图4所示。等高线的形状可反映出交互作用的显著性,等高线呈椭圆形表示两因素交互作用显著,等高线呈圆形表示交互作用不显著;若响应面坡度相对平缓,表明处理条件的变化对响应值的影响不大,相反,如果一个响应面坡度陡峭,表明响应值对于处理条件的改变非常敏感[22]。由图4可知,随着3个因素的水平逐渐增高,种曲试饭糖分值呈现出先增后降的趋势,交互作用的3个响应面均出现极大值。图4的陡峭程度显示:A(菌种时间)、B(培养温度)、C(水分含量)均对响应指标试饭糖分值有显著影响,其中BC(水分含量与培养温度)的交互作用相对较强,对试饭糖分值的影响相对较大。以上结果与响应面二次模型方差分析结果一致。

图4 各因素交互作用对种曲试饭糖分值影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between each factors on the trial sugar content of rice testing
2.3 最佳工艺验证试验
针对Box-Behnken响应面优化过后得出的最佳工艺开展验证试验:一级试管菌种培养时间为73 h,种曲培养温度为32℃,水分含量为26%,重复3次,实际试饭糖分平均值为27.18 g/100 g,与模型预测的理论优值27.74 g/100 g基本一致,模型拟合成功,优化工艺能为根霉种曲的生产提供依据。
3 结论
本试验以试管菌种培养时间、种曲培养温度、米粉水分含量为试验因素,以种曲的试饭糖分值为响应指标,利用响应面法建立了纯种根霉种曲制作工艺的二次项回归模型,通过方差分析,验证了该模型的预测优值与实际值的拟合程度较高。在此基础上,针对试饭糖分值做了最大值优化,得出优化工艺为一级试管菌种培养时间为73 h,种曲培养温度为32℃,水分含量为26%,在此条件下的重复验证试验显示,试饭糖分值为27.18 g/100 g,与模型预测的理论优值27.74g/100g基本一致。该模型优化工艺能为根霉种曲的生产提供参考。
[1]傅其旭,车经纬,张怀山,等.小曲酿酒的研究进展[J].轻工科技,2018,34(5):6-7,21.
[2]产锦,方尚玲,蒋威,等.降低小曲酒中杂醇油含量的研究进展[J].酿酒,2012,39(6):32-35.
[3]徐成勇,刘泉勇,周东阳,等.酿酒根霉高糖化力菌株的筛选[J].酿酒科技,2002(5):26-28.
[4]凌生才.根霉曲一、二级菌种接种方法[J].酿酒科技,2001(1):29-29.
[5]李晓楼.生料制作根霉曲工艺控制措施分析[J].湖南工业职业技术学院学报,2013(2):19-20.
[6]马跃,任光达,杨建刚,等.米曲制备过程中酶活性的变化及制备工艺研究初报[J].酿酒科技,2006(11):39-41.
[7]罗惠波,谢军,黄治国,等.纯种根霉麸曲制曲工艺优化研究[J].四川理工学院学报(自然科学版),2015,28(5):7-11.
[8]王喆,贺友安,汪陈平,等.圆盘制曲机在根霉曲生产上的应用研究[J].酿酒科技,2016(2):77-79.
[9]王建荣,刘丹妮,李鹏,等.雪白根霉脂肪酶基因在毕赤酵母中的高效表达及其酶学性质研究[J].食品与发酵工业,2014,40(2):83-88.
[10]汤斌,张莹莹,杨亚平.匍枝根霉TP—02内切葡聚糖酶基因eg2的克隆表达及功能分析[J].食品与发酵工业,2013,39(7):13-17.
[11]田方源,汤斌,李松,等.米根霉α-淀粉酶高麦芽糖生成能力相关氨基酸的初步分析[J].食品与发酵工业,2017,43(8):31-36.
[12]毛宜祥,郑翠萍.怎样制好米曲汁培养基[J].上海调味品,1990(1):31-31.
[13]林艳,马莹莹,张宿义,等.米曲糖化酶活力测定方法的比较研究[J].酿酒科技,2015(6):23-27.
[14]马歌丽,魏泉增,张志刚.分光光度法测定大曲糖化酶活力探讨[J].中国酿造,2008,27(17):69-71.
[15]王晓慧,董大伟,马伟,等.根霉酒曲试饭糖分检测方法及标准的研究[J].酿酒科技,2018(6):76-79,84.
[16]肖冬光,邹海晏.根霉曲试饭糖化力检测方法的研究[J].酿酒科技,1998(5):60-63.
[17]龙可,赵中开,马莹莹,等.酿酒根霉菌研究进展[J].现代食品科技,2013(2):443-447.
[18]IKASARI L,MITCHELL D A,STUART D M.Response of Rhizopus oligosporus to temporal temperature profiles in a model solid-state fermentation system[J].Biotechnol Bioeng,2015,64(6):722-728.
[19]SPARRINGA R A,KENDALL M,WESTBY A,et al.Effects of temperature,pH,water activity and CO2concentration on growth of Rhizopus oligosporus NRRL 2710[J].J Appl Microbiol,2010,92(2):329-337.
[20]刘宪春.水分与温度对根霉Q303生长繁殖的影响[J].酿酒科技,2007(6):59-60.
[21]侯红萍,肖冬光.小曲酒生产中根霉曲培菌糖化过程动力学的研究[J].酿酒科技,1999(1):26-28.
[22]吕小京,操德群,徐年军.响应面试验优化酶解法制备海洋微藻微拟球藻抗氧化肽工艺[J].食品科学,2018,39(6):183-188.