红色酵母菌是一类重要的资源微生物,其细胞内可积累类胡萝卜素[1-3]和油脂[4-5]等多种生物活性物质[6-7]。目前,已从环境中分离出多株红色酵母菌[8-9]。作为一种红色酵母菌,锁掷孢酵母(Sporidiobolus)的多个菌株能高产油脂,是微生物油脂开发的理想研究对象[10],而且锁掷孢酵母油脂中富含油酸,可作为功能性油脂的一种来源[11]。此外,锁掷孢酵母合成类胡萝卜素[12-14]的特性也引起研究人员的极大兴趣。因此,锁掷孢酵母在食品加工[15]、腐败菌防治[16]和医药研发[12]等领域的应用日趋增多,利用锁掷孢酵母细胞积累油脂、色素、酶类等有益代谢产物的特性受到研究者的重视[17-18]。
烟草废水中含有大量可溶性糖类物质,且其pH值为弱酸性,适合真菌类微生物生长[19-20]。近年来,有关烟叶内生真菌的研究较多[21-24],而对烟草废水中微生物类群的研究甚少。本研究采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基从烟草废水中分离一株红色酵母菌,通过形态观察、生理生化试验及分子生物学技术对其进行鉴定,并初步探讨其发酵马铃薯葡萄糖水(potato dextrose water,PDW)产油脂和色素的潜力,旨在为红色酵母菌天然产物的开发和有机酿造废水的资源化利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
烟草废水:河南卷烟工业烟草薄片有限公司污水处理站。
1.1.2 试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)Ladder Mix Marker:生工生物工程(上海)股份有限公司;盐酸(分析纯):洛阳昊华化学试剂有限公司;丙酮(分析纯):河南省金硕化学试剂有限公司;乙醇(分析纯):新乡市三伟消毒制剂有限公司;氯仿(分析纯):天津市科密欧化学试剂开发中心;甲醇(分析纯):天津市风船化学试剂科技有限公司。
1.1.3 培养基
马铃薯葡萄糖水(PDW):青岛海博生物技术有限公司;马铃薯葡萄糖琼脂(PDA)培养基:北京陆桥技术股份有限责任公司。
1.2 仪器与设备
JJ300精密电子天平:常熟双杰测试仪器厂;SW-CJ-2F型双人双面净化工作台:苏州净化设备有限公司;YXQ-LS-30SII高压蒸汽灭菌器:上海博迅实业有限公司;Avanti J-25低温高速离心机:美国贝克曼库尔特有限公司;GHP-9160恒温振荡培养箱:太仓市实验设备厂;Microstation自动微生物鉴定仪:美国Biolog公司;GHP-9160隔水式恒温培养箱:上海一恒科技有限公司;WH861漩涡混合器:上海康华生化仪器制造公司;UV1700紫外分光光度计:日本岛津公司;3730XL测序仪:美国应用生物系统公司。
1.3 方法
1.3.1 菌株分离
将采集的烟草废水用无菌生理盐水进行10倍梯度稀释(10-1~10-5),然后将梯度稀释液分别涂布于PDA培养基,30℃条件下培养至出现红色菌落,采用PDA培养基划线纯化,获得单菌落,4℃保藏于PDA培养基斜面,备用。
1.3.2 分离菌株的鉴定
形态观察[25]:将分离菌株划线于PDA培养基,30℃培养48 h,观察菌落特征,在显微镜下观察细胞形态。
生理生化试验[26]:采用Microstation自动微生物鉴定仪对分离菌株的碳源利用情况进行检测。
分子生物学鉴定:分离菌株ITS序列的扩增及测序由生工生物工程(上海)股份有限公司进行,序列同源性分析及系统发育树的构建参考文献[25]进行。
1.3.3 分离菌株的培养
挑取一环分离菌株接种于含20 mL PDW的100 mL三角瓶中,30℃、150r/min条件下培养18h制备种子液。取5mL种子液接种于含45 mL PDW的250 mL三角瓶中,30℃、150 r/min条件下培养4 d,测定生物量、胞内油脂及色素。
1.3.4分析方法
生物量的测定[27]:取20mL发酵液,8000r/min离心5min,弃上清,收集菌体,称质量并计算菌体湿质量,105℃烘至恒质量后,称质量并计算菌体干质量。
菌体胞内油脂的提取和含量测定[28]:采用酸热法提取菌体胞内油脂。1 g湿菌体加入4 mol/L盐酸10 mL,混合均匀,室温放置20 min后沸水浴10 min,-20 ℃冰浴30 min,加入氯仿和甲醇各10 mL,振荡30 min,5 000 r/min离心3 min,静置分层,分离下部氯仿层,65℃干燥2 h,称质量并计算油脂含量及产量。
色素的提取与含量测定[29-30]:在1g湿菌体中加入4mol/L的盐酸溶液6 mL,室温振荡浸泡30 min,沸水浴5 min,冰水混合物中迅速冷却10 min后进行细胞破碎。在细胞破碎液中加入4 mL丙酮,避光振荡30 min,离心收集丙酮浸提液。采用紫外可见分光光度计在波长400~600nm处对丙酮浸提液进行扫描,获得最高吸收波长及其对应的吸光度值,计算色素的产量。
2 结果与分析
2.1 菌株的分离
经多次划线纯化,从PDA培养基平板上分离出一株红色单菌落,命名为YH0902,采用形态观察、生理生化试验及分子生物学技术对其进行鉴定。
2.2 菌株YH0902的鉴定
2.2.1 形态观察
菌株YH0902在PDA培养基上的菌落及细胞形态见图1。由图1a可知,该菌落呈玫红色,湿润不透明,菌落凸起,表面光滑,边缘完整。由图1b可知,菌株YH0902的细胞呈椭圆形,有明显的芽体产生,部分细胞内有明显的高折光率颗粒区域,可能是富集油脂的原因。根据《酵母菌的特征与鉴定手册》可知,菌株YH0902的菌落特征与细胞形态特征与酵母菌高度相符[31-32]。
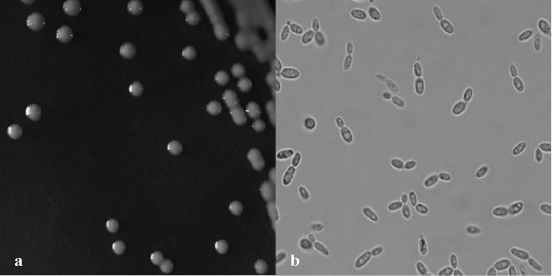
图1 菌株YH0902的菌落(a)和细胞(b)形态
Fig.1 Colony(a)and cell(b)morphology of strain YH0902
2.2.2 生理生化特征分析
菌株YH0902的碳源利用结果见表1。由表1可知,菌株YH0902可以利用D-阿洛酮糖、L-山梨糖、D-苷露醇、麦芽三糖、D-棉子糖、α-D-葡萄糖、D-半乳糖磺,琥珀酸和D-木糖等碳源;不能利用乙酸、D-纤维二糖、N-乙酰基D-葡萄糖、麦芽糖醇、I-赤藻糖醇等碳源。
表1 菌株YH0902的碳源利用结果
Table 1 Results of carbon source utilization of strain YH0902
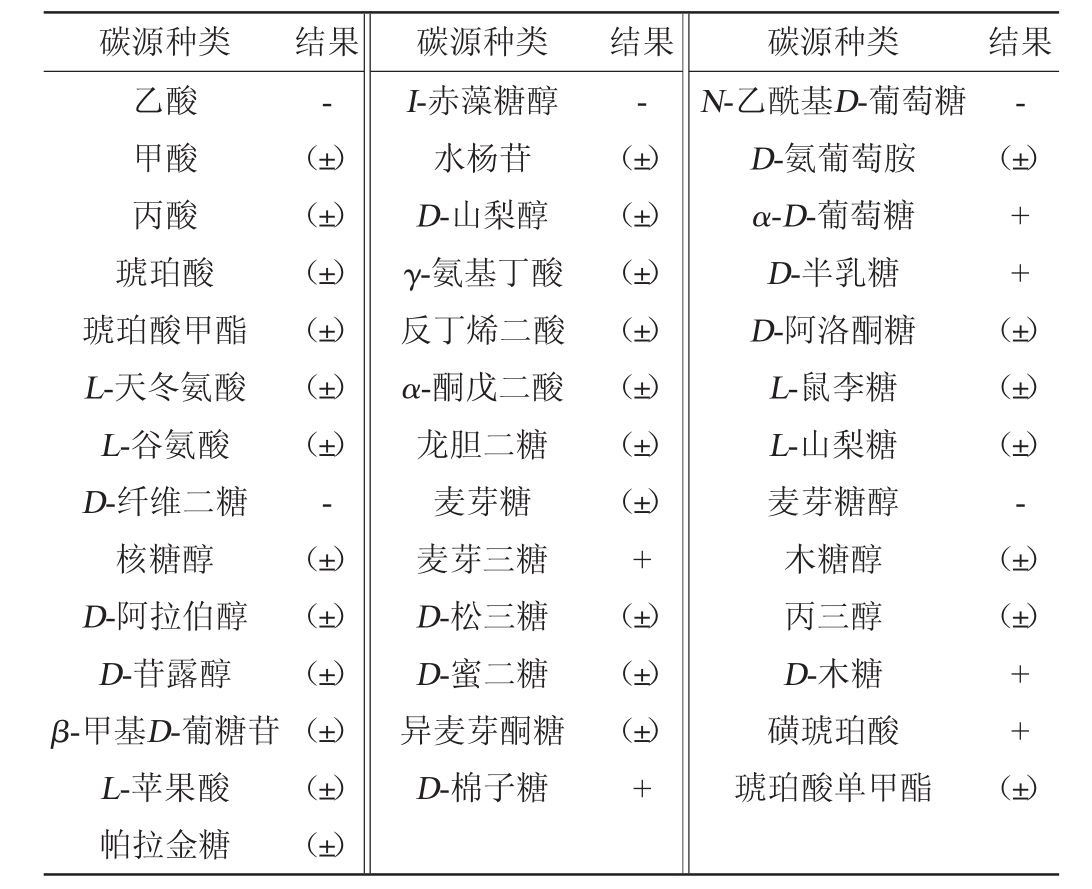
注:“+”表示结果为阳性;“-”表示结果为阴性;“(±)”表示结果为弱阳性。
碳源种类 结果 碳源种类乙酸甲酸丙酸琥珀酸琥珀酸甲酯L-天冬氨酸L-谷氨酸D-纤维二糖核糖醇D-阿拉伯醇D-苷露醇β-甲基D-葡糖苷L-苹果酸帕拉金糖-(±)(±)(±)(±)(±)(±)-(±)(±)(±)(±)(±)(±)I-赤藻糖醇水杨苷D-山梨醇γ-氨基丁酸反丁烯二酸α-酮戊二酸龙胆二糖麦芽糖麦芽三糖D-松三糖D-蜜二糖异麦芽酮糖D-棉子糖结果 碳源种类 结果-(±)(±)(±)(±)(±)(±)(±)+(±)(±)(±)+N-乙酰基D-葡萄糖D-氨葡萄胺α-D-葡萄糖D-半乳糖D-阿洛酮糖L-鼠李糖L-山梨糖麦芽糖醇木糖醇丙三醇D-木糖磺琥珀酸琥珀酸单甲酯-(±)++(±)(±)(±)-(±)(±)++(±)
2.2.3分子生物学鉴定
以菌株YH0902基因组为模板,ITS 1、ITS 2为引物进行PCR扩增,对PCR扩增产物进行琼脂糖凝胶电泳检测,结果见图2。由图2可知,PCR扩增产物的电泳条带位于500~600 bp,与预期结果相符。
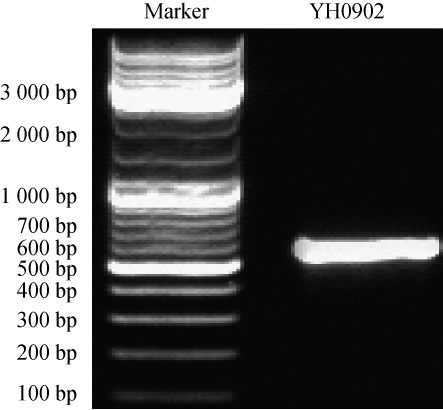
图2 菌株YH0902的ITS序列PCR扩增产物电泳图
Fig.2 Electrophoresis of PCR amplified products of ITS sequence of strain YH0902
测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genbank数据库中进行BLAST同源性比对,选取同源性较高的12株酵母菌,采用MEGA 6.05软件中的邻接(neighbor joining,NJ)法构建系统进化树,结果见图3。由图3可知,菌株YH0902与近玫色锁掷孢酵母(Sporidiobolus pararoseus)聚于同一分支,亲缘关系最近。结合菌株YH0902的形态观察及生理生化试验结果,鉴定其为一株近玫色锁掷孢酵母(Sporidiobolus pararoseus)。

图3 基于ITS序列菌株YH0902的系统发育树
Fig.3 Phylogenetic tree of strain YH0902 based on ITS sequences
2.3 菌株YH0902胞内色素及油脂的初步分析
采用紫外可见分光光度计在波长400~600 nm处对丙酮浸提液进行扫描,结果见图4。由图4可知,菌株YH0902细胞色素的丙酮提取液的扫描图谱与类胡萝卜素的扫描光谱图基本一致[29],具有明显的双肩峰特征,最大吸收波长为488 nm。因此,可以推测菌株YH0902细胞内含有大量的类胡萝卜素。
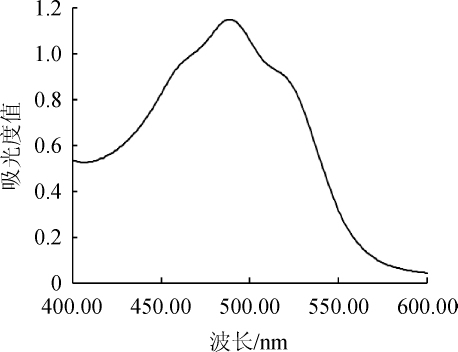
图4 菌株YH0902胞内色素丙酮提取液的扫描光谱
Fig.4 Scanned spectrum of intracellular pigment acetone extracting solution of strain YH0902
菌株YH0902的生物量、胞内油脂及色素的分析结果如表2所示。由表2可知,菌株YH0902在PDW中,30℃、150r/min条件下培养4 d,发酵液中菌体湿质量为(48.53±0.36)g/L,干质量为(10.63±0.15)g/L。菌株YH0902油脂产量可达(3.30±0.17)g/L,占细胞干质量的(31.04±0.23)%,油脂含量相对较高。菌株YH0902胞内色素产量为(4.33±0.19)mg/L。本实验采用商品化PDW进行发酵,成本较高,但生物量相对较低。因此,下一步的实验需要探索廉价的基质进行发酵培养,如食品酿造废水等,通过发酵优化和营养物质的添加,提高发酵产物色素或油脂的产量。
表2 菌株YH0902的生物量、胞内油脂及色素
Table 2 Biomass,intracellular lipid and pigment of strain YH0902

指标 结果湿质量/(g·L-1)干质量/(g·L-1)油脂含量/%油脂产量/(g·L-1)色素产量/(mg·L-1)48.53±0.36 10.63±0.15 31.04±0.23 3.30±0.17 4.33±0.19
3 结论
本研究采用PDA培养基从烟草废水中分离出一株红色酵母菌YH0902,通过形态观察、生理生化实验及分子生物鉴定其为一株近玫色锁掷孢酵母(Sporidiobolus pararoseus)。该菌株可利用PDW培养基产生油脂和色素,30℃、150r/min条件下培养4d,湿质量为(48.53±0.36)g/L,干质量为(10.63±0.15)g/L,胞内油脂产量可达(3.30±0.17)g/L,色素产量为(4.33±0.19)mg/L。因此,菌株YH0902在微生物源天然色素及油脂开发领域具有一定的应用前景。
[1]LI C,ZHANG N,SONG J,et al.Increased torulene accumulation in red yeast Sporidiobolus pararoseus NGR as stress response to high salt conditions[J].Food Chem,2017,237:1041-1047.
[2]王蓉,曹海宁,邓小美.不同碳源对粘性红酵母WP3生长及类胡萝卜素产量的影响[J].中国酿造,2017,36(9):132-136.
[3]LI C,ZHANG N,LI B,et al.A single desaturase gene from red yeast Sporidiobolus pararoseusis responsible for both four-and five-step dehydrogenation of phytoene[J].Gene,2016,590(1):169-176.
[4]乔凤杰,李炯书,欧阳亚旭,等.利用粘红酵母生产微生物油脂研究进展[J].食品工业科技,2014,35(11):391-395.
[5]魏涛,王丽娟,毛多斌,等.粘红酵母H810产油脂培养基、发酵条件优化及其油脂组分的分析[J].中国酿造,2013,32(10):49-52.
[6]金连豆,李晓艳,王晓辉,等.海洋胶红酵母菌CD-008产超氧化物歧化酶发酵条件优化及酶分离纯化[J].中国酿造,2016,35(3):17-22.
[7]SMANIOTTO A,SKOVRONSKI A,RIGO E,et al.Synthetic lipase production from a newly isolated Sporidiobolus pararoseus strain by submerged fermentation[J].Braz J Microbiol,2012,43(4):1490-1498.
[8]樊竹青,李治滢,董明华,等.云南抚仙湖产类胡萝卜素酵母菌的资源调查[J].微生物学通报,2017,44(2):296-304.
[9]商潘路,陈胜男,黄廷林,等.深水型水库热分层诱导水质及真菌种群结构垂向演替[J].环境科学,2018,39(3):1141-1150.
[10]CHAIYASO T,SRISUWAN W,TECHAPUN C,et al.Direct bioconversion of rice residue from canteen waste into lipids by new amylolytic oleaginous yeast Sporidiobolus pararoseus KX709872[J].Prep Biochem Biotechnol,2018,48(4):361-371.
[11]韩梅,徐致远,钱和,等.锁掷酵母油中营养成分的分离和鉴定[J].微生物学通报,2016,43(1):60-68.
[12]CHAO D,GUO Y H,CHENG Y L,et al.Anti-cancer effects of torulene,isolated from Sporidiobolus pararoseus,on human prostate cancer LNCaP and PC-3 cells via a mitochondrial signal pathway and the down-regulation of AR expression[J].RSC Adv,2017,7(5):2466-2474.
[13]VALDUGA E,RIBEIRO A H R,CENCE K,et al.Carotenoids production from a newly isolatedSporidiobolus pararoseusstrain using agroindustrial substrates[J].Biocatal Agric Biotechnol,2014,3(2):207-213.
[14]HAN M,XU Z Y,DU C,et al.Effects of nitrogen on the lipid and carotenoid accumulation of oleaginous yeastSporidiobolus pararoseus[J].Bioproc Biosyst Eng,2016,39(9):1425-1433.
[15]侯杰,孙启星,邓冲,等.酵母抽提物风味成分研究进展[J].中国酿造,2018,37(11):13-16.
[16]LI Q F,LI C L,LI P X,et al.The biocontrol effect ofSporidiobolus pararoseusY16 against postharvest diseases in table grapes caused byAspergillus nigerand the possible mechanisms involved[J].Biol Control,2017,113:18-25.
[17]魏娜,徐琼,张宁,等.掷孢酵母及其应用研究进展[J].微生物学通报,2014,41(6):1211-1218.
[18]韩梅,翟玉贵,王小波,等.锁掷酵母与海洋红酵母的营养成分分析[J].食品与发酵工业,2013,39(1):11-15.
[19]XI Y,SHEN Y F,YANG F,et al.Removal of azo dye from aqueous solution by a new biosorbent prepared withAspergillus nidulanscultured in tobacco wastewater[J].J Taiwan Inst Chem Eng,2013,44(5):815-820.
[20]ZHENG Y X,WANG Y L,PAN J,et al.Semi-continuous production of high-activity pectinases by immobilized Rhizopus oryzaeusing tobacco wastewater as substrate and their utilization in the hydrolysis of pectincontaining lignocellulosic biomass at high solid content[J].Bioresour Technol,2017,241:1138-1144.
[21]李文君,钱正强,金蕊,等.云南大理烟区烟叶内生真菌多样性及分布特征[J].微生物学通报,2013,40(5):783-791.
[22]徐慧,杨根华,张敏,等.云南烟草叶片内生及叶际细菌、真菌多样性研究[J].云南农业大学学报(自然科学版),2014,29(2):149-154.
[23]刘宏玉,金慧清,王佳莹,等.烟草内生真菌多样性和种群结构[J].菌物学报,2015,34(6):1058-1067.
[24]张鹏,李盼盼,高林,等.烟草内生真菌多样性及其功能研究进展[J].中国烟草科学,2017,38(2):93-99.
[25]张可可,王雅棋,张莉,等.红薯淀粉废水中乳酸菌的筛选及其对食源性致病菌的抑制作用[J].中国酿造,2017,36(10):32-35.
[26]卫春会,杨晓东,黄治国,等.浓香型大曲中两株酵母菌的分离及其Biolog 微生物鉴定[J].酿酒科技,2013,33(4):30-32.
[27]席宇,吉彦龙,李敏睿,等.一株利用烟草废水红酵母的筛选鉴定及发酵性能研究[J].郑州大学学报(理学版),2012,44(3):101-105.
[28]王姣,陈彦好,张向磊,等.废弃烟梗提取液为基质的产油脂酵母菌的筛选与鉴定[J].烟草科技,2015,48(8):15-19.
[29]郭大城,陈彦好,梁景辉,等.一株固态发酵烟梗产类胡萝卜素脉孢菌的分离鉴定[J].天然产物研究与开发,2014,26(4):531-533.
[30]郭大城,张可可,董贵彬,等.深红酵母JLC固态发酵废弃烟梗制备类胡萝卜素研究[J].天然产物研究与开发,2015,27(2):232-235.
[31]巴尼特.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:354-367.
[32]杨雨蒙,徐敬国,胡伊旻,等.夏黑葡萄附生酵母菌分离及多相分类鉴定[J].食品工业科技,2017,38(22):100-104.