白色念珠菌(Canidia albicans)为念珠菌属,又称白假丝酵母菌,是一种酵母样条件性致病真菌,广泛存在于自然界,可在健康人和畜禽的口腔、呼吸道、消化道黏膜和肠道等处寄居,当维生素缺乏、营养不良、抵抗力下降、机体内微生态平衡遭到破坏时容易引发疾病[1-2]。目前,白色念珠菌拮抗菌株的筛选来源主要集中于陆地和海洋,其中,海洋微生物由于生存环境具有高盐、高压、低温和稀营养的特点,为了长期适应复杂的海洋环境而生存,可能产生区别于陆生微生物的次生代谢产物,成为近年来研究的热点[3-12]。王勇勇等[13]从渤海湾不同站位分离获得的海洋丝状真菌中筛选获得4株对野生型白色念珠菌SC5314具有较强抑菌活性的海洋真菌,其最小抑菌浓度(minimal inhibitory concentration,MIC)分别为65 g/mL、19 g/mL、54 g/mL、23 g/mL;ZHANG Y等[14]从褐藻囊藻(Colpomenia sinuosa)中分离到一株对白色念珠菌有较好的抑制效果的海洋真菌黑曲霉(Aspergillus niger)EN-13;WEN L等[15]从台湾地区红树林中分离到一株对白色念珠菌有较好抑制效果的真菌拟青霉属(Paecilomycessp.)Tree1-7。但关于抑制白色念珠菌的北冰洋来源海洋微生物的研究鲜见报道。
本研究从北冰洋沉积物样品中筛选能够抑制白色念珠菌的海洋微生物,采用形态观察、生理生化试验及分子生物学技术对其进行鉴定,并研究其抑菌谱。为进一步研究其具有抗菌性的次级代谢产物,寻找可能的新的抗菌药物奠定一定的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
样品:中国第六次北极考察的北冰洋沉积物样品。
1.1.2 指示菌
白色念珠菌(Canidia albicans)SN250、大肠杆菌(Escherichiacoli)CMCC44102、金黄色葡萄球菌(Staphylococcus aureus)ATCC6538、副溶血弧菌(Vibrio parahaemolyticu)CGMCC1.1616、铜绿假单胞菌(Pseudomonas aeruginosa)PAO1、鼠伤寒沙门氏菌(Salmonella typhimurium)CICC 21484、鲍曼不动杆菌(Acinetobacter baumannii)BNCC 194496、屎肠球菌(Enterococcus faecium)BNCC 336951、肺炎克雷伯氏菌(Klebsiella pneumoniae)BNCC 186113:本实验室保藏。
1.1.3 主要试剂
聚合酶链式反应(polymerase chainreaction,PCR)试剂:大连宝生物公司。琼脂、酵母浸粉、葡萄糖、胰化蛋白胨(均为生化试剂):奥博星生物技术公司。其他试剂均为国产分析纯。
1.1.4 培养基
LB海水培养基:酵母提取物5 g,胰蛋白胨10 g,琼脂20 g,氯化钠10 g,海水1 L,pH 7.0。液体培养基中不加入琼脂。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠5 g,琼脂20 g,去离子水1 L,pH 7.0。
营养肉汤(nutrient broth,NB)培养基:蛋白胨10 g/L,牛肉粉3 g/L,氯化钠5 g/L,pH 7.2。
脑心浸液肉汤(brainheart infusion broth,BHI)培养基:蛋白胨10 g/L,脱水小牛脑浸粉12.5 g/L,脱水牛心浸粉5 g/L,氯化钠5 g/L,葡萄糖2 g/L,Na2HPO42.5 g/L,pH 7.0。
MRS培养基。以上培养基均在121℃条件下灭菌20min。
1.2 仪器与设备
HVE-50高压灭菌器:日本HIRAYAMA公司;SW-CJ-2FD洁净工作台:苏州安泰空气技术有限公司;DHG-9070A电热恒温干燥箱:上海精宏实验设备有限公司;MT-180B生化恒温培养箱:上海新苗医疗器械制造有限公司;RE-52A旋转蒸发仪:上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 海洋微生物的分离和纯化
采用涂布平板法分离海洋微生物菌株[16]。取0.5 g沉积物样品,加入4.5 mL陈海水,混匀后静置2 h。采用陈海水10倍梯度稀释至10-1~10-7,选取稀释度为10-4~10-7的稀释液50 μL涂布于LB海水培养基平板。28℃条件下倒置培养1~2 d,获得单菌落。挑取单菌落,采用平板划线法纯化菌株,并进行编号、保藏。
1.3.2 白色念珠菌拮抗菌株的初筛
采用对峙培养法进行初筛[16]。将白色念珠菌培养液以0.1%(V/V)的接种量加入LB培养基中,摇匀,倒平板,待凝固后,将上述分离纯化的菌株划线于培养基上,置于30℃恒温培养箱进行培养,观察是否有抑菌圈,将具有抑菌圈的单菌落作为初筛菌株。
1.3.3 白色念珠菌拮抗菌株的复筛
参考张静楠等[16]的方法,将初筛获得的菌株接种于100 mL LB海水液体培养基中,28℃、180 r/min条件下培养3~4d,得到的发酵液在4℃、8000r/min条件下离心10min,取上清液旋蒸浓缩,并将浓缩液经0.22 μm无菌微孔滤膜过滤,得到5 mL浓缩发酵液。
采用琼脂扩散法测定浓缩发酵液对白色念珠菌的抑菌活性[16]。将白色念珠菌以0.1%(V/V)的接种量加入LB培养基中,待平板凝固后,用打孔器打直径为9 mm的孔,每孔加入400 μL浓缩发酵液,37℃培养24 h,游标卡尺测量抑菌圈的直径,当抑菌圈直径>9 mm,认为具有抑菌活性[13]。实验重复3次。
1.3.4 菌株的鉴定
形态学鉴定及生理生化鉴定:参考《伯杰细菌鉴定手册》[17]和《常见细菌系统鉴定手册》[18]对筛选得到的菌株进行形态学和生理生化鉴定。生理生化实验项目包括柠檬酸盐实验、硝酸盐实验、V-P实验、淀粉水解实验、接触酶实验、吲哚实验、甲基红实验、H2S产生实验、明胶液化实验、葡萄糖产气实验和尿素实验等。
分子生物学鉴定:筛选出的菌株在LB海水培养基中,28℃培养36 h。采用煮沸法提取脱氧核糖核酸(deoxyribonucleic acid,DNA)。以其为模板,采用通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492r(5'-AAGTCGTAACAAGGTAACG-3')对菌株的16S rDNA序列进行PCR扩增[19]。PCR扩增体系:模板DNA1.0μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)Mixture 1.0 μL,rTaq酶(5 U/μL)0.25 μL,引物27F(10 μmol/L)1.0 μL,引物1492r(10 μmol/L)1.0 μL,10×Loading Buffer 4.0 μL,无菌双蒸水(ddH2O)补充至50 μL。PCR扩增条件:95℃预变性5 min;94℃变性30 s,50℃退火30 s,72℃延伸1 min,共30个循环;72℃再延伸10 min。PCR扩增产物于4℃保存。
PCR扩增产物经1%琼脂糖凝胶电泳检测后,送至大连宝生物公司进行测序,将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST比对,选取同源性较高的模式菌株的16S rDNA序列,利用MEGA 6.0软件中的邻接(neighbor joining,NJ)法构建系统发育树,以确定该菌株的分类地位[20]。
1.3.5 抑菌谱的测定
将筛选得到的菌株按0.1%(V/V)的接种量接种到200mL LB海水液体培养基中,28℃、180 r/min条件下培养24 h,4℃、6 000 r/min条件下离心10 min,取上清,50℃条件下旋蒸至干,加入3 mL超纯水,将浓缩液经0.22 μm无菌微孔滤膜过滤,得到粗发酵液。
采用琼脂扩散法测定发酵液对8种病原微生物(大肠杆菌、金黄色葡萄球菌、副溶血弧菌、铜绿假单胞菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌、屎肠球菌、鲍曼不动杆菌)的抑菌活性。其中,肺炎克雷伯菌采用NB培养基;鲍曼不动杆菌采用BHI培养基;屎肠球菌采用MRS培养基;其余5种常见病原微生物采用LB培养基。
培养基融化后,室温放置至40℃左右,接入100 μL病原微生物,轻摇混匀后倒平板,待平板凝固后用直径9 mm的打孔器打孔,孔中加入300 μL海洋微生物的粗发酵液,37℃条件下培养24h,用游标卡尺测量每个抑菌圈的直径。实验重复3次。
2 结果与分析
2.1 海洋微生物的分离纯化
从北冰洋沉积物样品中共分离纯化得到314株菌,编号为1~314。
2.2 白色念珠菌拮抗菌株的筛选
采用对峙培养法从314株菌株中筛选出4株对白色念珠菌有明显抑制作用的菌株,菌株编号为56#、83#、95#、103#。采用琼脂扩散法测定4株菌株的抑菌圈直径,结果见表1。由表1可知,菌株56#的抑菌圈直径最大,为(32.14±0.72)mm,其次为菌株83#,抑菌圈直径为(28.24±0.41)mm,菌株103#的抑菌圈最小,为(20.22±0.32)mm。其中,菌株56#发酵液的抑菌效果见图1。由图1可知,接种菌株56#浓缩发酵液的孔周围出现明显的透明圈。
表1 菌株抑菌圈测定结果
Table 1 Determination results of inhibition zone of strains

菌株编号 抑菌圈直径/mm 56#83#95#103#32.14±0.72 28.24±0.41 23.62±0.38 20.22±0.32

图1 菌株56#发酵液的抑菌效果
Fig.1 Inhibition effect of fermentation broth of strain 56#
2.3 菌株的鉴定
菌株56#在LB海水培养基平板上的菌落形态及细胞形态见图2。由图2可知,菌株56#的菌落呈微隆起的圆形,黄白色,无褶皱。在电镜下可见,菌株为明显的杆状,并有芽孢。

图2 菌株56#的菌落(a)及细胞(b)形态
Fig.2 Colonial(a)and cell(b)morphology of strain 56#
菌株56#的生理生化鉴定结果见表2。由表2可知,菌株56#为革兰氏阳性菌,柠檬酸盐实验、硝酸盐实验、V-P实验、淀粉水解实验、接触酶实验、明胶液化实验、葡萄糖产气实验均呈阳性;吲哚实验、甲基红实验、H2S实验和尿素实验均呈阴性。参考《伯杰细菌鉴定手册》[17]和《常见细菌系统鉴定手册》[18]并结合形态观察结果,初步判定菌株56属于芽孢杆菌属(Bacillus)。
表2 菌株56#的生理生化试验结果
Table 2 Physiological and biochemical tests results of strain 56#

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果革兰氏染色柠檬酸盐实验硝酸盐实验V-P实验淀粉水解实验接触酶实验++++++吲哚实验甲基红实验H2S产生实验尿素实验明胶液化实验葡萄糖产气实验- - - - + +
采用MEGA 6.0软件中的NJ法构建系统发育树,结果见图3。
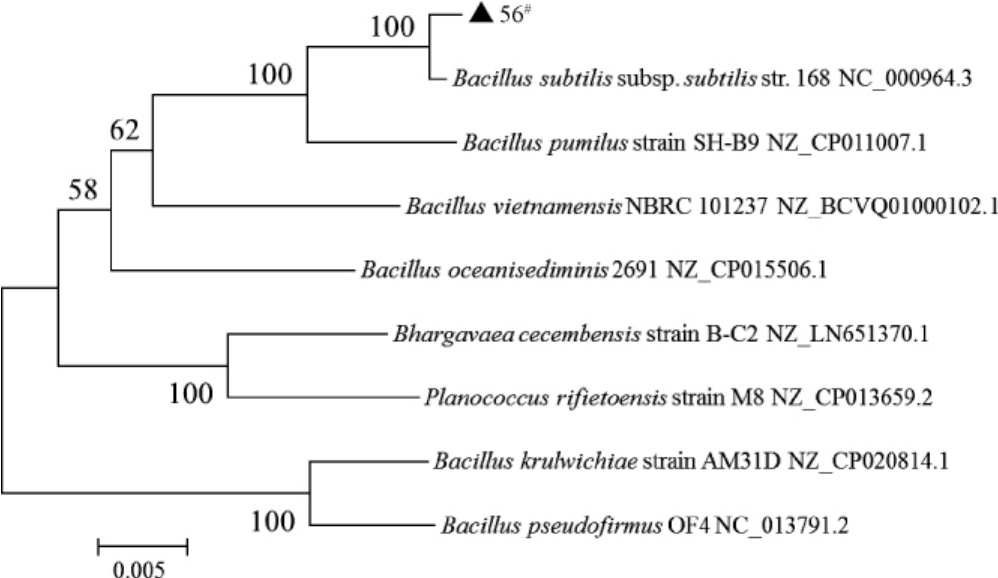
图3 菌株56#基于16S rDNA序列的系统发育树
Fig.3 Phylogenetic tree of strain 56#based on 16S rDNA sequences
由图3可知,菌株56#与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近,因此,鉴定菌株56#为枯草芽孢杆菌(Bacillus subtilis)。
2.4 抑菌谱测定结果
菌株56#对8种病原微生物的抑菌效果见表3。由表3可知,菌株56#对大肠杆菌、副溶血弧菌、铜绿假单胞菌、鼠伤寒沙门氏菌、肺炎克雷伯菌、屎肠球菌、金黄色葡萄球菌和鲍曼不动杆菌都有一定的抑制作用,是一株广谱抗菌的海洋微生物。
表3 菌株56#抑菌谱的测定结果
Table 3 Determination results of antimicrobial spectrum of strain 56#

注:“+”表示抑菌圈直径为12~17 mm,低敏;“++”表示抑菌圈直径为17~22 mm,高敏。
指示菌 抑菌活性 指示菌 抑菌活性大肠杆菌鼠伤寒沙门氏菌副溶血弧菌金黄色葡萄球菌+++++++++铜绿假单胞菌肺炎克雷伯氏杆菌鲍曼不动杆菌屎肠球菌++
3 结论
本实验从北冰洋沉积物样品中分离纯化出314株菌株,通过初筛得到4株对白色念珠菌有明显拮抗作用的菌株,通过复筛,得到1株拮抗效果最好的菌株,编号为56,其抑菌圈直径为(32.14±0.72)mm。通过形态观察、生理生化试验及分子生物学技术鉴定菌株56#为枯草芽孢杆菌(Bacillus subtilis),其对大肠杆菌、副溶血性弧菌、铜绿假单胞菌、鼠伤寒沙门氏菌、肺炎克雷伯氏菌、屎肠球菌、金黄色葡萄球菌和鲍曼不动杆菌等多种食源性致病菌都有一定的抑制作用,是一株广谱抗菌的海洋微生物。
[1]阎力君,张多,卢文,等.正交试验优化白头翁汤抗白色念珠菌物质的提取工艺[J].黑龙江畜牧兽医,2017(12):137-139.
[2]沈洁,张欣,刘建钗,等.鸡白色念珠菌和烟曲霉双重SYBR GreenⅠ荧光定量PCR检测方法的建立[J].中国兽医科学,2018,48(4):484-487.
[3]房耀维,王淑军,刘姝,等.西沙群岛海域海洋放线菌的分离及其抗菌活性[J].微生物学杂志,2014,34(4):47-52.
[4]BULL A T,STACH,J E M.Marine actinobacteria:new opportunities for natural product search and discovery[J].Trends Microbiol,2007,15:491-499.
[5]CHEN G,WANG H,PEI Y.Secondary metabolites from marine-derived microorganisms[J].J Asian Nat Prod Res,2014,16(1):105-122.
[6]WANG K W,DING P.New bioactive metabolites from the marine-derived fungiAspergillus[J].Mini Rev Med Chem,2018,18(13):1072-1094.
[7]WU B,WIESE J,LABES A,et al.Lindgomycin,an unusual antibiotic polyketidefroma marine fungusofthe Lindgomycetaceae[J].Mar Drugs,2015,13(8):4617-4632.
[8]IMHOFF J F.Natural products from marine fungi-still an underrepresented resource[J].Mar Drugs,2016,14(1):19.
[9]王碧霞,吴祺豪,李鑫,等.中国东海及东太平洋海山区来源抗菌活性海洋微生物的筛选研究[J].中国海洋药物,2017,36(5):9-15.
[10]金黎明,金鑫浩,侯熙彦,等.具有抗菌活性的海洋真菌天然产物研究进展[J].中国海洋药物,2017,36(4):66-74.
[11]TARMAN K,LINDEQUIST U,WENDE K,et al.Isolation of a new natural product and cytotoxic and antimicrobial activities of extracts from fungi of Indonesian marine habitats[J].Mar Drugs,2011,9(3):294-306.
[12]GEBREYOHANNES G,MOGES F,SAHILE S,et al.Isolation and characterization of potential antibiotic producing actinomycetes from water and sediments of Lake Tana,Ethiopia[J].Asian Pac J Trop B,2013,3(6):426-435.
[13]王勇勇,蒙春蕾,蔡爽,等.抗白色念珠菌海洋真菌的筛选及抑菌活性初探[J].中国酿造,2015,34(2):55-59.
[14]ZHANG Y,LI X M,WANG C Y,et al.A new naphthoquinoneimine derivative from the marine algal derived endophytic fungusAspergillus nigerEN-13[J].Chin Chem Lett,2007,18(8):951-953.
[15]WEN L,LIN Y C,SHE Z G,et al.Paeciloxanthone,a new cytotoxic xanthone from the marine mangrove fungusPaecilomycessp.(Tree1-7)[J].J Asian Nat Prod Res,2008,10(2):133-137.
[16]张静楠,聂灿玉,赵胜楠,等.抗白色念珠菌的海洋微生物的分离与鉴定[J].天津农业科学,2016,22(1):79-81
[17]BUCHANANRE,GIBBONSNE.伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:729-736.
[18]蔡妙英,东秀珠.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-386.
[19]杨耀刚,郜晋楠,田瑞华.自然发酵玉米秸秆中优良乳酸菌的筛选鉴定及混菌发酵试验[J].黑龙江畜牧兽医,2018(7):145-148.
[20]王硕,孟庆丽,武天娇,等.抗金葡菌深海真菌的分离鉴定及抑菌谱研究[J].生物技术,2015,25(2):169-172.