颜色是判断葡萄酒品质的重要依据,其中花色苷是葡萄及葡萄酒中主要的呈色物质,对葡萄酒的颜色起着决定作用[1-2]。花色苷的累积生成随着果实的发育而变化,在赤霞珠果实中,果皮中的花色苷在花后9~10周缓慢累积,花后10周后快速增加[3]。花色苷是花色素与糖以糖苷键结合而成的,呈现红色、紫色或者蓝色的一类酚类化合物,对葡萄果实和葡萄酒颜色至关重要[4]。花色苷根据结构可分为基本花色苷,经过合成之后进一步修饰可分为糖基化、甲基化和酰基化,酰化花色苷较稳定,在酿酒葡萄果实及葡萄酒中起到积极作用[5-6]。红色酿酒葡萄果实中主要有六大类花色苷,分别为花葵素(pelargonidin)、花青素(cyanidin)、花翠素(delphinidin)、甲基花青素(peonidin)、甲基花翠素(petunidin)以及二甲花翠素(malvidin)[7]。葡萄果实中花色苷的组分和含量受气候、土壤和栽培方式等因素影响[8-11]。光照、温度都可作为环境信号起作用,对葡萄果实品质起到调控作用[12-13]。
有实验通过摘叶处理,改善葡萄树通风透光条件,增加果实光照量,进而提高果实品质[14]。有研究表明,遮阳网具有提高环境湿度以及降低光照强度、水分蒸发量和环境温度等作用,可以通过改善微气候条件来影响果实的发育生长[15],采用遮阳网遮光是常见的调节果实微环境中光照强度的方法。新疆地区光照强、昼夜温差大、降雨量少、全年日照时数居全国之首[16],研究表明,光强对葡萄浆果着色有显著影响,光照强度过高会影响花色苷的合成[17],针对新疆特殊的地理条件,关于光照条件对赤霞珠果实中花色苷累积的研究较少,尤其是选择遮光时间以及设置不同遮光强度的研究更欠缺。因此,本实验以酿酒葡萄赤霞珠为试材,采用两种遮光率的遮阳网对果实处于不同成熟期间进行不同遮光处理,分析遮光处理后对果皮中花色苷含量及组分结构的影响,为提高本地区酿酒葡萄的品质提供理论依据。
1 材料与方法
1.1 材料与试剂
葡萄果实:采于2016年新疆昌吉州榆树沟镇遗韵酒庄葡萄园试验地的酿酒葡萄赤霞珠,所摘果实均果粒饱满,大小均匀,采摘时兼顾阴面与阳面,每穗果实的顶、中、尾部均顾及。随机选择果实300颗,采回实验室用液氮迅速冷冻,将样品放于-80℃用于检测。
遮阳网1(50%遮光)、遮阳网2(20%遮光):遮阳网的规格为1.5 m×45 m,市售。
甲醇、乙腈、甲酸和乙酸(均为色谱纯):美国Fisher公司;去离子水:采取Nili-Q系统提取的去离子水。纯净水:杭州娃哈哈集团有限公司。二甲花翠素-3-O-葡萄糖苷(malvidin-3-O-glucoside)标准样品:法国ExtrASynthese SA公司。
1.2 仪器与设备
HOBO H21-002小型气象站(探头型号为S-LIA-M003和S-THB-M002):美国Onset公司;HZS-H型水浴振荡器:武汉爱斯佩科学仪器有限公司;RE-52AA旋转蒸发器:上海亚荣生化仪器厂;FD-1D-50冷冻干燥机:北京博医康实验仪器有限公司;GL-20G-II型离心机:北京鑫骉腾达仪器设备有限公司;LC/MSD离子阱液相色谱-质谱联用仪:美国安捷伦公司。
1.3 方法
1.3.1 遮光处理
当果实分别达到5%转色(花后9周)、100%转色(花后13周)时对果树树体顶端分别用不同遮光网进行遮光处理,搭网后1周(即花后10周、花后14周),以及浆果完全成熟到达采收期时进行样品采集。每个处理均有三个生物学平行。本试验中共有5种处理,分别为空白对照(CK):果实正常生长,不遮光;Q1:5%转色-完全成熟采用网1遮光;Q2:5%转色-完全成熟采用网2遮光;H1:100%转色-完全成熟采用网1遮光;H2:100%转色-完全成熟采用网2遮光。
1.3.2 测定方法
在整个试验期间使用HOBO小型气象站来监测这两种规格的遮阳网处理与正常生长果实之间的果际微气候差异,收集数据包括日均温度、相对湿度、太阳总辐射和光合有效辐射,每5 min进行一次数据采集。
葡萄皮中花色苷:按照参考文献[18-20]的方法对葡萄皮中的花色苷进行提取、定性、定量分析。
1.3.3 数据处理
平均值、标准偏差使用Microsoft Excel 2003软件进行计算平均值及标准偏差。通过Origin Pro 8.5进行绘图。偏最小二乘法判别分析(partial least squares discrimination analysis,PLS-DA)通过代谢组学数据分析网站http:/www.metaboanalyst.ca/完成。
2 结果与分析
2.1 遮光处理对果际微气候的影响
由图1可以看出,使用不同的遮光网对葡萄果穗周围的温度和相对湿度均没有明显改变,遮光后使果际周围的光和有效辐射及太阳总辐射均低于对照,且网1使果穗附近接受光合有效辐射的量降低了50%左右,网2使果穗附近接受光合有效辐射的量降低了20%左右。表明遮光处理在完成有效避光的同时,对葡萄果穗周围的温度和相对湿度均没有明显改变。
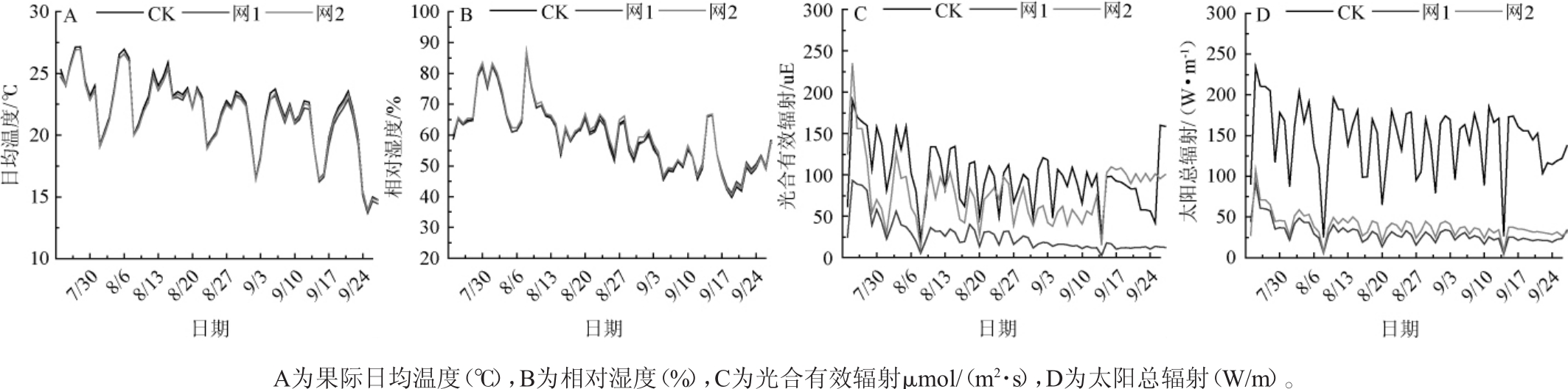
图1 树体遮光对果际微气候的影响
Fig.1 Effect of tree shading on microclimate
2.2 遮光处理对花色苷总量的影响
由表1可以看出,未遮光处理的样品中果皮在花后14周花色苷含量达到最大值,采收期时降低。花后10周时,遮光处理降低了果皮中的花色苷含量,且Q2处理的抑制效果更为明显。花后14周时,Q2、H1、H2处理均使样品中花色苷的含量增加。果实达到采收期时,CK中的花色苷含量为11.287 9 mg/g,Q1、Q2处理的样品花色苷含量分别达到了17.4725mg/g、16.527 1mg/g,分别高于CK 54.79%、46.41%;H1、H2处理与花后14周相比有所降低,分别为8.5959mg/g、14.029 3 mg/g。上述结果表明,Q1、Q2、H2处理均增加了采收期时果皮中花色苷的含量,且Q1、Q2处理增幅较大,该时间段进行遮光处理可有效提高果皮中花色苷的含量。
表1 不同遮光处理对花色苷总量的影响
Table 1 Effect of different shading treatments on total anthocyanins content

遮光处理花后10周/(mg·g-1)花后14周/(mg·g-1)采收期/(mg·g-1)未遮光(CK)Q1 Q2 H1 H2 2.9150±0.3364 2.5304±0.2837 1.5584±0.0916 14.7779±0.769 0 14.1200±0.179 1 15.7088±0.466 5 16.1100±0.712 4 16.1341±0.413 7 11.2879±0.5754 17.4725±1.0323 16.5271±0.4192 8.5959±0.3750 14.0293±0.2496
2.3 遮光处理对二甲花翠素类花色苷含量的影响
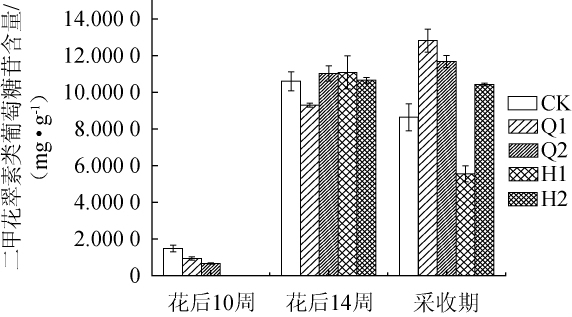
图2 不同遮光处理对二甲花翠素类葡萄糖苷含量的影响
Fig.2 Effect of different shading treatments on malvidin-3-glucoside content
由图2可知,在果实的整个生长时期中,采用不同遮光处理后赤霞珠葡萄果皮中二甲花翠素类葡萄糖苷的含量存在差异,但二甲花翠素类葡萄糖苷仍为花色苷中主要的花色苷。花后10周时,CK中二甲花翠素类葡萄糖苷含量为1.478 3 mg/g,Q1、Q2处理后其含量分别为0.935 7 mg/L、0.665 5 mg/L,此时遮光抑制了该类物质的累积。花后14周时,Q2、H1、H2处理后的二甲花翠素类葡萄糖苷含量高于CK,但Q1处理后的二甲花翠素葡萄糖苷含量仍低于CK。果实达到采收期时,CK中二甲花翠素类葡萄糖苷含量为8.642 8 mg/g,Q1、Q2处理后的样品中二甲花翠素类葡萄糖苷含量分别为12.825 4 mg/g、11.682 5 mg/g,分别高于CK 48.35%、35.13%;H2处理后的样品中二甲花翠素类葡萄糖苷含量为10.422 9 mg/g,H1处理后含量仅为5.558 5 mg/g。上述结果表明,Q1、Q2、H2处理均能有效增加采收期时果皮中二甲花翠素类葡萄糖苷的含量,但H1处理降低了采收期的果皮中二甲花翠素类葡萄糖苷的含量。
2.4 遮光处理对花青素类葡萄糖苷含量的影响
由图3可知,赤霞珠葡萄果皮中花青素类葡萄糖苷在不同遮光处理后其含量存在差异。未经遮光处理的样品中,其花青素类葡萄糖苷的含量随着果实的成熟其含量呈现下降趋势。花后10周时,Q1、Q2处理对花青素类葡萄糖苷含量的累积均为抑制作用,且Q2处理的抑制效果更为明显。花后14周时,4种遮光处理的样品中花青素类葡萄糖苷的含量仍低于CK。果实达到采收期时,Q1、Q2、H1、H2处理后其花青素葡萄糖苷的含量分别为0.1739mg/g、0.2103mg/g、0.148 1 mg/g、0.162 5 mg/g,CK为0.089 9 mg/L。上述结果表明,采用4种遮光处理均能增加果皮中花青素类葡萄糖苷的含量。
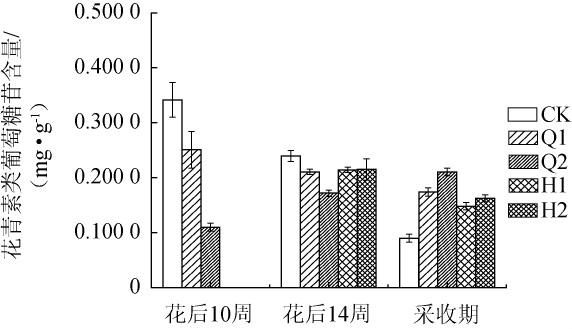
图3 不同遮光处理对花青素类葡萄糖苷含量的影响
Fig.3 Effect of different shading treatments on cyanidin-3-glucoside content
2.5 遮光处理对花翠素类葡萄糖苷含量的影响
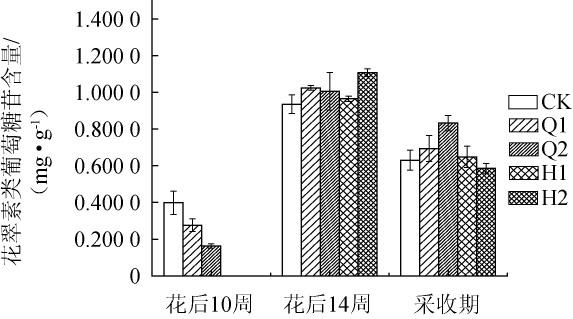
图4 不同遮光处理对花翠素类葡萄糖苷含量的影响
Fig.4 Effect of different shading treatments on dephinidin-3-glucoside content
由图4可知,赤霞珠葡萄果皮中花翠素类葡萄糖苷在不同遮光处理后其含量存在差异。随着果实达到成熟,遮光样品与CK样品中花翠素类葡萄糖苷的含量的变化趋势相同,均为先增加后降低。花后10周时,Q1、Q2处理均抑制了花翠素类葡萄糖苷的累积,且Q2处理的抑制效果更为明显。花后14周时,4种遮光处理样品中的花翠素类葡萄糖苷含量均高于CK,其中Q1优于Q2,H2优于H1。果实达到采收期时,CK中花翠素类葡萄糖苷含量为0.630 7 mg/g,Q1、Q2处理后的样品花翠素类葡萄糖苷含量分别为0.694 3 mg/g、0.832 8 mg/g,分别高于CK10.07%、32.03%,H1、H2处理后的花翠素类葡萄糖苷含量分别为0.6488mg/g、0.5868mg/g。上述结果表明,Q1、Q2、H1处理均能有效增加采收期时花翠素类葡萄糖苷的含量,但H2处理降低了采收期的花翠素类葡萄糖苷的含量。
2.6 遮光处理对甲基花青素类葡萄糖苷含量的影响
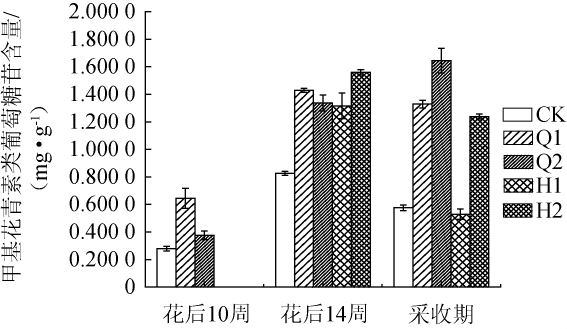
图5 不同遮光处理对甲基花青素类葡萄糖苷含量的影响
Fig.5 Effect of different shading treatments on peonidin-3-glucoside content
由图5可知,不同遮光处理对赤霞珠葡萄中甲基花青素葡萄糖苷的影响存在差异。在整个生长阶段(花后10周、花后14周),4种遮光处理后该物质的含量均高于CK。CK样品中,甲基花青素类葡萄糖苷的含量在生长过程中呈现先升高后降低的趋势。果实达到采收期时,CK中甲基花青素类葡萄糖苷含量为0.576 5 mg/g,Q1、Q2、H1、H2处理后其含量为1.329 2 mg/g、1.644 9 mg/g、0.529 6 mg/g、1.239 0 mg/g。上述结果表明,Q1、Q2、H2处理均能有效增加采收期时甲基花青素葡萄糖苷的含量,但H1处理降低了采收期的甲基花青素葡萄糖苷的含量。
2.7 遮光处理对甲基花翠素类葡萄糖苷含量的影响
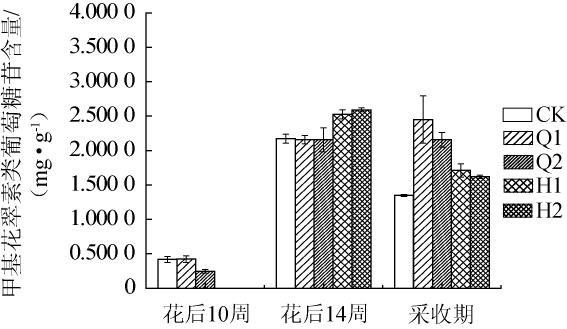
图6 不同遮光处理对甲基花翠素类葡萄糖苷含量的影响
Fig.6 Effect of different shading treatments on petunidin-3-glucoside content
由图6可知,赤霞珠葡萄中甲基花翠素类葡萄糖苷的含量在不同遮光时间、不同遮光率的遮光网处理后其含量存在差异。未经遮光处理的样品中,其甲基花翠素类葡萄糖苷的含量在花后14周达到最大值,为2.172 9 mg/g,此时Q1、Q2处理对甲基花翠素类葡萄糖苷并无明显效果,H1、H2处理后增加了甲基花翠素类葡萄糖苷含量的累积。果实达到采收期时,4种遮光处理与CK相比,甲基花翠素类葡萄糖苷的含量均明显增加。CK甲基花翠素类葡萄糖苷含量为1.3479mg/g,Q1、Q2处理后该物质含量分别为2.4498mg/g、2.156 6 mg/g,分别高于CK81.75%、60.00%,H1、H2处理后,样品中该物质含量分别为1.7109mg/g、1.6181mg/g。结果表明,4种遮光处理均增加了果皮中甲基花翠素葡萄糖苷的含量,其中Q1处理增加幅度最大,其次分别为Q2、H1、H2。
2.8 遮光处理对花色苷组分的影响
为更直观的了解遮光处理对赤霞珠葡萄中花色苷组分构成的影响,进行了偏最小二乘法分析(PLS-DA),结果如图7所示。
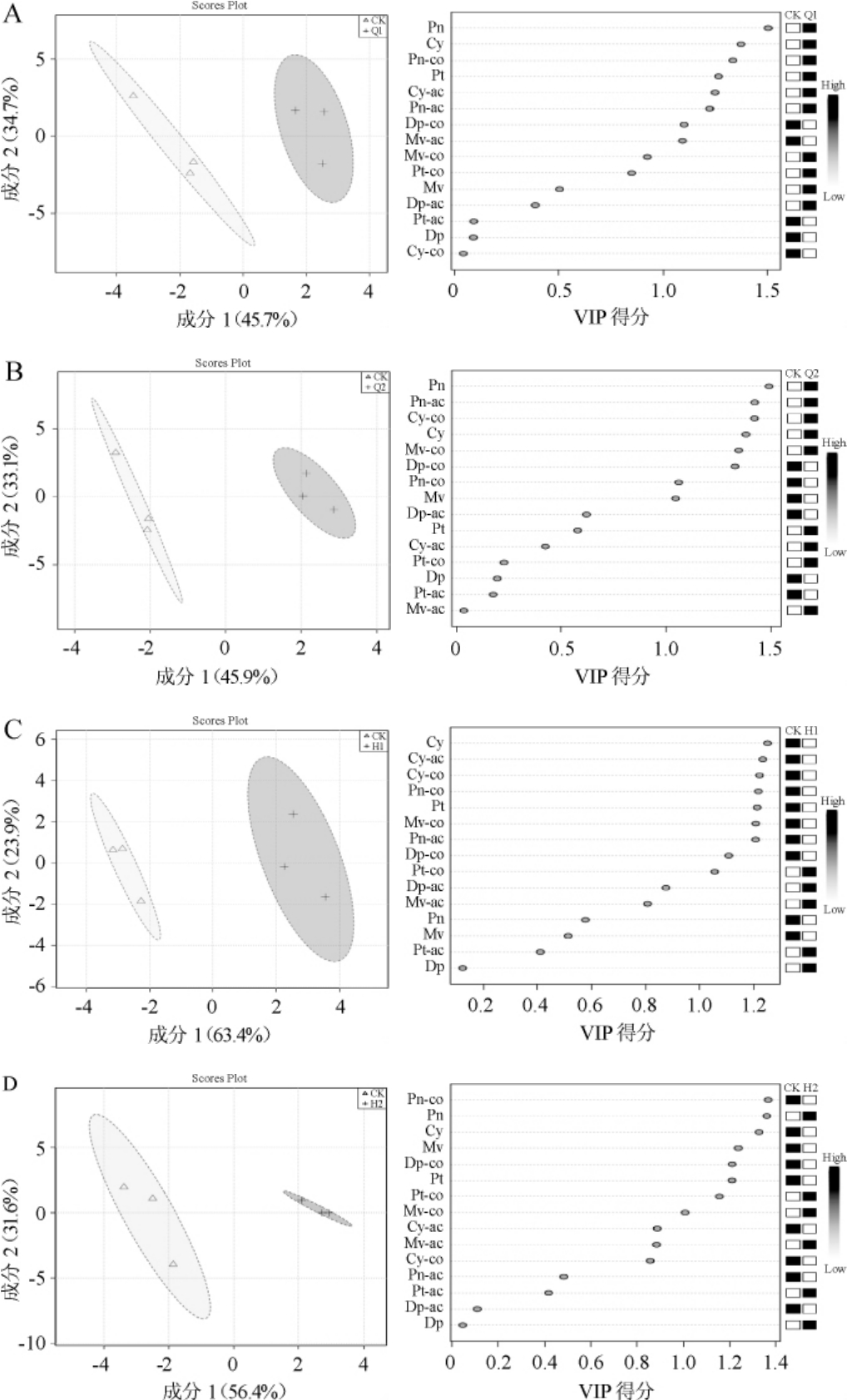
图7 不同遮光处理赤霞珠葡萄花色苷的偏最小二乘法分析
Fig.7 Partial least squares discriminant analysis of anthocyanins in Cabernet Sauvignon with different shading treatments
由图7可知,几种遮光处理都可与CK明显分开,且CK处理位于负半轴,遮光处理均位于正半轴,表明遮光处理后对果实中的花色苷的组分构成及含量与对照相比均有明显差异。从样品得分图可以看出,每个遮光处理对果皮中的赤霞珠组分构成及含量有不同影响(得分>1.0),Q1、Q2处理主要提高赤霞珠葡萄果皮中甲基花青素葡萄糖苷(Pn)、花青素葡萄糖苷(cy)、甲基花青素乙酰化葡萄糖苷(Pn-ac)的含量,同时降低赤霞珠葡萄果皮中花翠素香豆酰化葡萄糖苷(顺式+反式)(Dp-co)的含量;H1、H2处理增加了甲基花翠素香豆酰化葡萄糖苷(Pt-co)的含量,同时降低了甲基花青素香豆酰化葡萄糖苷(Pn-co)、花青素葡萄糖苷(Cy)、甲基花翠素葡萄糖苷(Pt)、花翠素香豆酰化葡萄糖苷(顺式+反式)(Dp-co)的含量。
3 讨论
本实验中采用遮阳网进行遮光处理,在达到有效遮光的同时,对葡萄果穗周围的温度和相对湿度均没有明显改变。由此证明,本实验中的遮光处理主要通过改变果际光照条件对果实品质产生影响。在5%转色-完全成熟期间的遮光处理中(Q1、Q2),果皮中的花色苷含量呈现上升趋势,这可能是因为葡萄浆果达到采收时,浆果与植株之间的物质交换基本停止,但果实中含糖量逐渐累积[21],延迟采收尤其会导致蔗糖含量大幅度升高并逐渐趋于稳定[22]。而浆果成熟后积累的蔗糖作为信号分子,激活或抑制特定基因表达[23],蔗糖以代谢糖的身份参与并诱导多酚类物质积累,从而导致果实内多酚物质的累积[24]。在本实验中100%转色-完全成熟期间采用网1遮光(H1)降低了果皮中花色苷的含量,与前人研究结果一致[25]。但是同时期采用网2进行遮光处理,检测到该处理后的果实达到采收期后其花色苷的含量高于CK,说明遮阳网的遮光率也是影响花色苷含量及组分的影响之一[26]。
4 结论
本实验以酿酒葡萄赤霞珠为实验材料,5%转色-完全成熟期间,20%、50%的遮光增加了成熟果实中花色苷的总量,并且使花青素类葡萄糖苷、花翠素类葡萄糖苷、甲基花青素类葡萄糖苷、甲基花翠素类葡萄糖苷、二甲花翠素类葡萄糖苷的含量也有所上调。100%转色-完全成熟期间采用20%的遮光使花色苷总量、花青素类葡萄糖苷、甲基花青素类葡萄糖苷、甲基花翠素类葡萄糖苷、二甲花翠素类葡萄糖苷的含量均有增加。
通过PLS-DA分析可发现,5%转色-完全成熟期间对树体遮光主要影响赤霞珠葡萄果皮中甲基花青素葡萄糖苷(Pn)、花青素葡萄糖苷(cy)、甲基花青素乙酰化葡萄糖苷(Pn-ac)、花翠素香豆酰化葡萄糖苷(顺式+反式)(Dp-co)的含量。100%转色-完全成熟期间遮光主要影响赤霞珠葡萄果皮中甲基花翠素香豆酰化葡萄糖苷(Pt-co)、甲基花青素香豆酰化葡萄糖苷(Pn-co)、花青素葡萄糖苷(Cy)、甲基花翠素葡萄糖苷(Pt)、花翠素香豆酰化葡萄糖苷(顺式+反式)(Dp-co)的含量。
[1]MAZZA G,FRANCIS F J.Anthocyanins in grapes and grape products[J].Crit Rev Food Sci,1995,35(4):341-371.
[2]韩富亮,李杨,李记明,等.红葡萄酒花色苷结构和颜色的关系研究进展[J].食品与生物技术学报,2011,30(3):328-336.
[3]BOSS P K,ROBINSON D S P.Analysis of the expression of anthocyanin pathway genes in developing Vitis vinifera L.cv Shiraz grape berries and the implications for pathway regulation[J].Plant Physiol,1996,111(4):1059-1066.
[4]张庆田,艾军,李昌禹,等.果实花色苷的生物合成及调控[J].特产研究,2010,32(4):65-67.
[5]SPRINGOB K,NAKAJIMA J I,YAMAZAKI M,et al.Recent advances in the biosynthesis and accumulation of anthocyanins[J].Nat Prod Rep,2003,20(3):288-303.
[6]IBERNGORNEZ M,ANDRESLACUEVA C,LAMUCLARAVENTOS R M,et al.Rapid HPLC analysis of phenolic compounds in red wines[J].Am J Enol Viticult,2002,53(3):218-221.
[7]HOLTON T A,CORNISH E C.Genetics and biochemistry of anthocyanin biosynthesis[J].Plant Cell,1995,7(7):1071-1083.
[8]黄敬寒,温可睿,潘秋红,等.环境条件和栽培技术对葡萄花色苷生物合成的影响(上)——环境条件对葡萄花色苷生物合成的影响[J].中外葡萄与葡萄酒,2011(9):71-76.
[9]张彦芳.河西走廊不同产地美乐(Merlot)果实成熟期间及原酒中花色苷成分比较[D].兰州:甘肃农业大学,2015.
[10]LEMUT M S,TROST K,SIVILOTTI P,et al.Pinot Noir grape colour related phenolics as affected by leaf removal treatments in the Vipava Valley[J].J Food Compos Anal,2011,24(6):777-784.
[11]陈继峰.红葡萄酒颜色研究进展[J].农业工程学报,2004,20(z1):18-24.
[12]李艳春.果实成熟期光照对赤霞珠葡萄光合作用、果实品质及养分积累的影响[D].保定:河北农业大学,2009.
[13]王达,王帅,包永睿,等.UPLC测定不同产地菟丝子药材中6种黄酮类成分的含量[J].中国实验方剂学杂志,2016,22(5):96-100.
[14]林朴.摘叶处理对赤霞珠葡萄和葡萄酒品质的影响[J].中外葡萄与葡萄酒,2013(4):10-13.
[15]孔云,姚允聪,SHAHAKY.光选择性网在园艺作物上的应用研究进展[J].中国农学通报,2011,27(31):82-87.
[16]苏铁锋.新疆伊犁红地球葡萄优质高效栽培技术[J].果树实用技术与信息,2012(8):9-12.
[17]孟祥云.光照强度对红地球葡萄果实着色的影响[D].石河子:石河子大学,2014.
[18]张珍珍,邓玉杰,陈新军,等.新疆伊犁地区赤霞珠葡萄成熟过程中花色苷组成及含量变化研究[J].现代食品科技,2018,34(2):20-24,211.
[19]孙建平.葡萄与葡萄酒中酚类物质LC-UV-MS/MS谱库构建及应用[D].北京:中国农业大学,2006.
[20]杨晓慧,陈为凯,何非,等.5个红色酿酒葡萄品种花色苷组成差异分析[J].西北农业学报,2017(11):84-90.
[21]李华.葡萄酒工艺学[M].北京:科学出版社,2007:50-57.
[22]刘亮.延迟采收对红地球葡萄树体营养和果实品质的影响[D].银川:宁夏大学,2010.
[23]SOLFANELLIC,POGGIA,LORETi E,et al.Sucrose-specific induction of the anthocyanin biosynthetic pathway in Arabidopsis[J].Plant Physiol,2006,140(2):637-646.
[24]田莉.葡萄果实查耳酮合成酶研究——基因克隆、表达、纯化、抗体的制备以及UV、糖对葡萄果实查耳酮合成酶的调节[D].北京:中国农业大学,2007.
[25]KOYAMA K,GOTO-YAMAMOTO N.Bunch shading during different developmental stages affects the phenolic biosynthesis in berry skins of"Cabernet Sauvignon"grapes[J].J Am Soc Hortic Sci,2008,133(6):743-753.
[26]倪志婧,马文平,王薇,等.遮光处理对酿酒葡萄果实品质的影响[J].合肥工业大学学报(自然科学版),2016,39(11):1563-1566.