亚铁(Fe2+)是含铁蛋白(酶)的关键组分,在携氧运输、蛋白质与核酸等大分子合成、生物氧化、神经细胞发育和细胞增殖与分化等过程中具有重要作用[1-2],亚铁不足可引发缺铁性贫血(iron-deficiency anemia,IDA)、帕金森病(Parkinson"s disease,PD)和阿兹海默病(Alzheimer"s disease,AD)等神经退行性疾病。多肽一级结构含有大量螯合金属阳离子的有效部位,其一级结构中的氢键、表面配位键及动态共价键等可实现多肽分子与金属的配位螯合[3];一级结构中的羧基O原子、咪唑基N原子及巯基S原子等具有较强给电子能力,易与金属离子发生配位螯合[4];除N-端氨基和C-端羧基及氨基酸侧链某些基团可供配位之外,多肽链中的羰基和亚氨基也可参与金属配合[5-6],金属配位有高度定向性,且配位螯合后可有效影响多肽二级结构并调控其生物学活性[7],以多肽为配体螯合金属离子制备金属营养补充剂是当前重要的制备策略。
食物中大部分以高价铁(Fe3+)形式存在,吸收效率低,只有以亚铁形式存在时,生物利用率才高且结构更稳定,易为人体胃肠道消化、吸收和转运。亚铁药物补充主要以无机铁盐或简单有机酸铁盐进行,存在稳定性差、胃肠刺激大、易受肠内容物干扰、生物利用率低和存在一定毒副作用等缺陷,补充效果不理想[8]。生物多肽与亚铁配位螯合后可明显改善亚铁吸收利用率和稳定性,并能减少金属元素间拮抗[9],且多肽与亚铁螯合后能以完整多肽被肠上皮细胞吸收,经门静脉进入肝脏代谢利用,具有吸收率高,毒副作用少和安全边际高等优点[10]。花生肽与亚铁经配位螯合制备成花生肽亚铁(peanut peptide-ferrous,PPF)营养补充剂后,其稳定性是应用研究的基础,研究其稳定性可为花生肽亚铁营养补充剂的制剂研究和探索储运条件提供良好的理论支持。目前,亚铁营养补充剂的研究主要有鳕鱼多肽亚铁[11]、罗非鱼胶原蛋白肽亚铁[12]、带鱼蛋白多肽亚铁[13]、林蛙胶原蛋白多肽亚铁[14]、米蛋白肽亚铁[15]以及本课题研究的花生多肽亚铁[10,16]等。但目前,关于多肽亚铁营养补充剂的稳定性研究鲜见。本研究以花生多肽(分子质量<1.0kDa)为配体,以氯化亚铁(FeCl2),采用液相合成法制备得到花生肽亚铁金属配位螯合物,研究确认其结构,考察其热稳定性、pH稳定性及醇溶性,为花生肽亚铁营养补充剂的制剂研究和探索储运条件提供良好的理论支持。
1 材料与方法
1.1 材料与试剂
花生肽亚铁螯合物:实验室自制[10];无水乙醇、氢氧化钠,盐酸,硫酸、醋酸、乙酸钠、硫酸亚铁铵、盐酸羟铵:国药集团化学试剂有限公司;邻菲啰啉:天津市大茂化学试剂厂。所有本实验使用的试剂均为分析纯。
1.2 仪器与设备
DK-98-11A型电热恒温水浴箱:天津市泰斯特仪器有限公司;UV-2500紫外可见分光光度计、IRPrestige-21傅立叶变换红外光谱仪:日本岛津公司;HERMLE Z323K冷冻离心机:德国Hermle公司;PHS-3C型pH计:上海雷磁仪器厂;AL204分析天平:梅特勒-托利多集团;DF-101S集热式恒温加热磁力搅拌器:郑州予华仪器制造有限公司。
1.3 试验方法
1.3.1 花生肽亚铁金属配位螯合物的制备工艺
以分子质量<1.0 kDa为配体,以氯化亚铁为金属配位螯合剂,在多肽:亚铁配比为4.31∶1(g∶g)、25.4 ℃和pH 7.5条件下螯合28.5min,用无水乙醇沉淀,静置2h并于8000r/min条件下离心20 min,制备得到花生肽亚铁螯合物,经紫外(ultraviolet,UV)光谱分析和傅里叶变换红外(Fourier transform-infrared,FT-IR)光谱分析进行结构确证[16]。
1.3.2 花生肽亚铁金属配位螯合物的结构分析
(1)紫外扫描
利用紫外吸收光谱对氯化亚铁、花生肽及花生肽亚铁螯合物进行紫外扫描和结构解析。
(2)红外扫描
将花生肽和花生肽亚铁螯合物提纯后,除去样品结晶水和游离水,准确称取2 mg放入玛瑙研钵中与干燥光谱纯溴化钾(KBr)200 mg混合研磨均匀(红外灯下进行)、压片并进行红外光谱扫描和结构解析。
1.3.3 花生肽亚铁金属配位螯合物的热稳定性
准确称取花生肽亚铁金属配位螯合物配制10.0 mg/L的花生肽亚铁溶液(pH自然),于10~100℃条件下保温1h,用无水乙醇沉淀,8 000 r/min条件下离心20 min,取上清液测定亚铁螯合率。
1.3.4 花生肽亚铁金属配位螯合物的pH稳定性
准确称取花生肽亚铁配位螯合物配制10.0 mg/L的花生肽亚铁溶液,用0.5 mol/L的NaOH或HCl调节溶液pH至1.0~13.0,于37 ℃保温1 h,用无水乙醇沉淀,8 000 r/min离心20 min,取上清液测定亚铁螯合率。
1.3.5 花生肽亚铁金属配位螯合物的醇溶性
准确称取1.0 mg花生肽亚铁,37℃溶解于100 mL不同体积分数乙醇溶液中(以纯水中的花生肽亚铁溶解度作为参比,定义为100%),8 000 r/min条件离心20 min,取上清液测定亚铁含量。醇溶性计算公式如下:
1.3.6 花生肽亚铁螯合率的测定
采用改进的乙醇沉淀法进行花生肽亚铁螯合率的测定[17-18]。取样品2.00 mL加入8.00 mL无水乙醇,混匀,静置2 h后于8 000 r/min离心20 min,去除沉淀后将上清液浓缩至2 mL,加入8倍体积的无水乙醇,静置2 h后8 000 r/min离心20 min,测定上清液中亚铁含量。铁含量采取邻菲啰啉510 nm比色法[16]测定。花生肽亚铁螯合率计算公式如下:
式中:M 1为2 mL样品中所含的总铁含量,mg;M 2为上清液中游离铁含量,mg。
2 结果与分析
2.1 花生肽亚铁金属配位螯合物结构分析
2.1.1 紫外光谱扫描
为确认花生肽与亚铁是否有效螯合,将氯化亚铁(FeCl2)、花生肽和花生肽亚铁螯合物分别进行紫外光谱扫描,结果如图1所示。
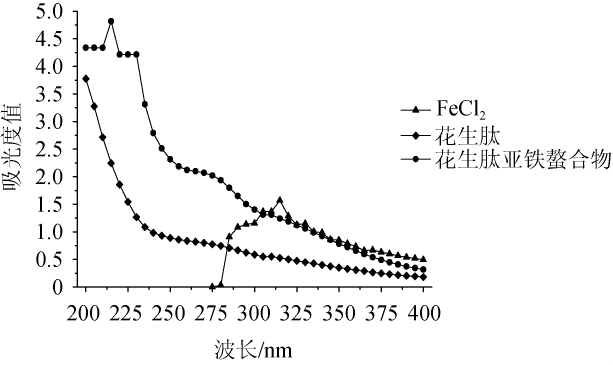
图1 FeCl2、花生肽和花生肽亚铁金属配位螯合物紫外吸收光谱
Fig.1 Ultraviolet absorption spectrum of FeCl2,peanut peptide and peanut peptide-ferrous metal coordination chelator
由图1可以看出,氯化亚铁在波长310 nm处有吸收峰,未螯合花生肽样品在波长范围200~400 nm没有明显吸收峰,而花生肽亚铁螯合物在波长215 nm处有明显吸收峰。其原因是由于多肽与亚铁螯合后使紫外吸收发生了位移,由此可推断,花生肽与亚铁进行了有效螯合[16]。
2.1.2 红外光谱扫描
分别将花生肽和花生肽亚铁螯合物进行了红外光谱扫描,结果如图2所示。
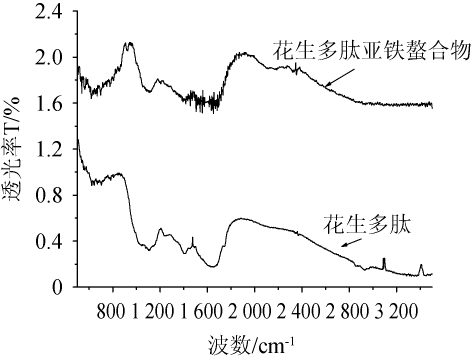
图2 花生多肽和花生肽亚铁金属配位螯合物红外吸收光谱图
Fig.2 Infrared absorption spectrogram of peanut peptide and peanut peptide-ferrous metal coordination chelator
由图2可以看出,花生肽与亚铁配位螯合后,红外图谱中的一些主要吸收峰发生明显变化。在花生肽红外光谱图谱中,由于N-H的伸缩振动,-NH2在波数3 404 cm-1处具有吸收峰[19],而花生肽亚铁配位螯合后,-NH2峰消失,而在波数1 110 cm-1处出现了PtNH2吸收峰,由此可以说明,亚铁离子与多肽中的氨基进行配位螯合;此外,在波数1654.92cm-1和1 226.73 cm-1处有两个很强的羰基吸收峰,其波数差(Δσ)为428.19 cm-1,说明花生肽亚铁配位螯合后,伸缩振动和变角振动等受到了遏制[16,20]。花生肽亚铁配位螯合物中的亚铁离子可能与羰基以共价配位健键合形成共轭结构环,花生多肽中氨基N与羧基O均参与了亚铁的配位螯合[16],其可能结构如图3所示。
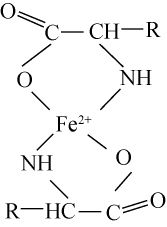
图3 花生肽亚铁金属配位螯合物可能结构
Fig.3 Possible structure of peanut peptide-ferrous metal coordination chelator
2.2 花生肽亚铁金属配位螯合物的热稳定性
将10.0 mg/L的花生肽亚铁金属配位螯合物于10~100℃条件下保温1 h,乙醇沉淀后测定花生肽亚铁螯合率,评价花生肽亚铁的热稳定性,结果如图4所示。
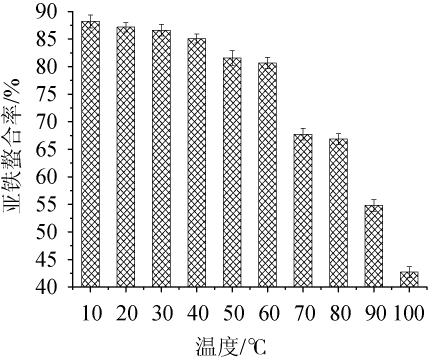
图4 花生肽亚铁金属配位螯合物的热稳定性
Fig.4 Thermal stability of peanut peptide-ferrous metal coordination chelator
由图4可以看出,温度在10~60℃范围内,花生肽亚铁金属配位螯合物保持较好的热稳定性;温度超过60℃后,亚铁螯合率明显下降。主要是由于温度过高,花生肽亚铁热变性而热沉,使花生肽亚铁中的亚铁离子由结合态变为游离态[21]。通常情况下,花生肽亚铁的储运和使用温度为常温;温度37℃条件以下,亚铁螯合率可保持在88%以上。由此可以说明,花生肽亚铁金属配位螯合物具有较好的热稳定性。
2.3 花生肽亚铁金属配位螯合物的pH稳定性
考察了花生肽亚铁配位螯合物在pH值为1~13范围内的pH稳定性,结果如图5所示。
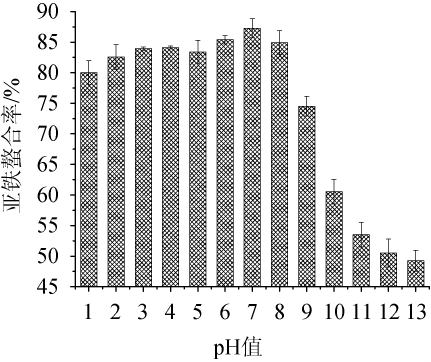
图5 花生肽亚铁金属配位螯合物的pH稳定性
Fig.5 pH stability of peanut peptide-ferrous metal coordination chelator
由图5可以看出,花生肽亚铁金属配位螯合物在pH值为1~8范围内保持较好的稳定性。人体胃液的pH值一般在1.5~2.0左右,而花生肽亚铁在pH值为1~2范围内也能保持80%以上的亚铁螯合率,由此可以说明,花生肽亚铁具有较好的酸耐受性,可耐受胃酸的降解作用。当花生肽亚铁作为亚铁营养补充剂采用口服给药时,可在胃内不被胃酸进行大量降解,仍可以以结合形式经肠小皮黏膜细胞进入门静脉有肝脏进行代谢[22]。
2.4 花生肽亚铁金属配位螯合物的醇溶性
考察了花生肽亚铁金属配位螯合物在不同体积分数乙醇媒介中的溶解性,结果如图6所示。
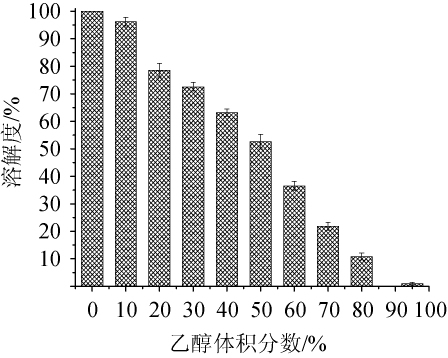
图6 花生肽亚铁金属配位螯合物的醇溶性
Fig.6 Alcohol solubility of peanut peptide-ferrous metal coordination chelator
由图6可以看出,花生肽亚铁金属配合螯合物在不同体积分数乙醇溶液媒介中的溶解度存在差异,以水溶液中的溶解度最好(溶解度定义为100%并作对照)。在体积分数为10%的乙醇溶液中也具有较好的溶解性(溶解度为(96.25±1.63)%);随着乙醇体积分数的增加,花生肽亚铁溶解度呈下降趋势,特别是在无水乙醇中溶解度基本不溶[12,14],高浓度乙醇溶液中溶解性变差,不适宜以高浓度乙醇作为花生肽亚铁的溶媒。由试验结果可知,在花生肽亚铁制剂时可选择去离子水或低浓度乙醇浓度作为溶媒。
3 结论
花生肽亚铁配位螯合物可作为亚铁营养补充剂,其稳定性是应用研究的基础,研究其稳定性可为花生肽亚铁营养强化剂的制剂研究及储运提供良好理论支持。本研究对花生肽亚铁进行了结构确诊,并分析其热稳定性、pH稳定性以及醇溶性。经UV和FT-IR分析确定,花生肽亚铁成功螯合,亚铁离子与花生肽配体的羰基以共价配位健键合形成共轭结构环,多肽中氨基N与羧基O均参与了亚铁的配位螯合。研究结果表明,花生肽亚铁具有很好的热稳定性和pH稳定性。花生肽亚铁在10~60℃条件下具有较好的热稳定性,在pH值1~8范围内保持较好的pH值稳定性,在纯水和体积分数为10%稀乙醇溶液中,花生肽亚铁保持较好的溶解性,而在高浓度乙醇溶液中溶解性较差。
[1]DEV S,BABITT J L.Overview of iron metabolism in health and disease[J].Hemod Int,2017(21):S6-S20.
[2]WILSON K,SLOAN J M.Iron-deficiency anemia[J].New Engl J Med,2018,373(5):485.
[3]何乃普,逯盛芳,赵伟刚,等.基于蛋白质分子自组装体系的构建[J].化学进展,2014,26(2):303-309.
[4]DOKMANIC′I,SIKIC′M,TOMIC′S.Metals in proteins:correlation between the metal-ion type,coordination number and the amino-acid residues involved in the coordination[J].Acta Crystallogr,2008,64(3):257-263.
[5]马晓川,费浩.金属配位在多肽与蛋白质研究中的应用[J].化学进展,2016,28(2):184-192.
[6]张晨羽,李雪,钱海,等.自组装多肽在生物医药领域的研究进展[J].中国药科大学学报,2015,46(2):250-256.
[7]蒋明,沈涛,徐辉碧,等.金属离子对蛋白质的折叠、识别、自组装及功能的影响[J].化学进展,2002,14(4):263-272.
[8]方细娟,曾庆祝,战宇,等.肽-金属元素配合物的研究进展及发展前景[J].食品工业科技,2012,33(4):413-416.
[9]李玉珍,肖怀秋.微波固相合成技术及其在多肽(氨基酸)金属螯合物合成中的应用[J].现代食品科技,2017(2):262-269.
[10]李玉珍,肖怀秋,姜明姣,等.响应面优化微波固相合成花生肽亚铁金属配位螯合工艺[J].中国油脂,2017,42(9):38-43.
[11]邓尚贵,徐涛,满德慧,等.鳕鱼(Gadous macrocephaius)皮水解蛋白亚铁修饰对大鼠营养性贫血改善的实验研究[J].海洋与湖沼,2010,41(5):719-724.
[12]段秀,杨成涛,孙云,等.罗非鱼皮胶原蛋白肽亚铁螯合修饰及螯合物性质的研究[J].食品工业科技,2014,35(18):157-160,166.
[13]黄赛博,林慧敏,邓尚贵.响应面法优化带鱼蛋白多肽螯合亚铁制备工艺[J].食品工业科技,2016,37(4):266-270,277.
[14]靳秋.林蛙胶原蛋白多肽亚铁螯合物的制备及其性质研究[D].吉林:吉林大学,2018.
[15]曹银娣.米蛋白肽亚铁螯合物生产工艺及产品稳态化研究[D].南昌:南昌大学,2007.
[16]李玉珍,肖怀秋,赵谋明,等.冷榨花生粕蛋白多肽-亚铁螯合物制备工艺优化及结构分析[J].中国粮油学报,2017,32(4):64-69.
[17]TEDESCHI C,CLEMENT V,ROUVET M,etal.Dissolution tests as a tool for predicting bioaccessibility of nutrients during digestion[J].Food Hydrocolloid,2009,23(4):1228-1235.
[18]杜芬,侯虎,赵玉然,等.鳕鱼源金属螯合肽体外模拟胃肠消化稳定性研究[J].现代食品科技,2016(7):33-38.
[19]SUREWICZ W K,MANTSCH H H,CHAPMAN D.Determination of protein secondary structure by Fourier transform infrared spectroscopy:a critical assessment[J].Biochemistry,1993,32(2):389-394.
[20]宋莎莎,高菲,任迪峰,等.乌鸡肽铁(II)螯合物的制备及红外光谱鉴定[J].食品与发酵工业,2013,39(6):13-17.
[21]安志丛,周惠明,朱科学.预处理对小麦面筋蛋白二级结构及其酶解产物螯合亚铁离子能力的影响[J].粮食与饲料工业,2009(8):18-20.
[22]李玉珍,肖怀秋,姜明姣,等.体外人胃肠模拟系统在食物消化行为研究中的应用进展[J].中国酿造,2017,36(7):153-156.