黄酒是世界上三大酿造酒之一,在中国人民的日常生活中扮演着重要角色。按照用曲和原料,可以将黄酒分为三类:小麦酒(山东省的即墨老酒),麦曲酒(浙江省绍兴黄酒)和红曲酒(主要分布在福建省的红曲酒)。黄酒中包含多种潜在的生物活性物质(如氨基酸、多肽、寡糖和多糖以及酚类化合物[1-3])。红曲酒与其他黄酒最大的不同是在发酵过程中使用红曲作为发酵曲[4]。红曲含有一系列的次级代谢产物(如红曲色素、莫纳克林和γ-氨基丁酸等),这些产物赋予红曲酒明亮的红色、微妙的甜味以及较高的保健功能[5]。
红曲是我国传统的发酵产品,以大米作为主要原料,接种红曲霉固态发酵得到紫红色米曲,因其颜色鲜艳也称为丹曲或者赤曲。红曲米具有多种生理活性,如降血压、降血糖、抗氧化、抑菌、抗疲劳、降血脂等,此外红曲糖化力高、酯化力强、有独特的曲香,广泛用于各种黄酒、白酒、醋和酱的酿造。红曲因其发酵工艺、地点和季节的不同会导致所含微生物产生差异,最常见的是乌衣红曲和古田红曲。LIU Z B等[6]测定了古田红曲和乌衣红曲两种红曲微生物的差异,发现红曲霉是其主要的微生物,占70%以上,接下来分别是细菌属和芽孢杆菌属,其在红曲酒发酵的不同阶段中所起的作用不同。LU Q Y等[7]采用高效液相色谱-二极管阵列检测器-电喷雾电离串联质谱法(high-performance liquid chromatography-diode array detector-electrospray ionization-tandem mass spectrometer,HPLC-DAD-ESI-MS/MS)对5年陈酿的古越龙山黄酒中的生物活性物质进行了定性和定量分析,测出9种酚类物质,其中有3种酚类物质没有被报道过,同时发现,古越龙山黄酒的抗氧化能力比白酒高,但比葡萄酒的总酚含量和抗氧化活性低。胡均亮等[8]测定了本次研究所用的红曲米中酚类物质及其抗氧化活性,实验结果表明,自制红曲米中含有10种酚类物质,红曲米样品中,总多酚和总黄酮含量与抗氧化性指标1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2"-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2"-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基清除率表现出显著的相关性。红曲酒中多酚的来源主要是酿造原料和酿造用曲。涂璐等[9]研究了糯米和燕麦两种原料对黄酒总多酚和抗氧化活性的影响,研究发现燕麦红曲酒中的总多酚和抗氧化活性比糯米黄酒更高。目前有关红曲米对红曲酒多酚和抗氧化活性的影响研究尚不多。课题组前期用单因素和响应面优化法优化了红曲酒的酿造条件,并发现红曲米添加量为10%时红曲酒的风味和口感最佳,红曲米过高会使得红曲酒曲味过重[10]。该实验主要探讨红曲米添加量对红曲多酚类物质的含量和种类的影响,以及红曲米添加量对红曲酒抗氧化活性的影响,为红曲酒多酚来源和成分的研究提供科学依据和数据支持。
1 材料与方法
1.1 材料与试剂
酿酒大米、中温糖化酶(252.89±20.38 U):广东省九江酒厂提供;红曲米:实验室自制;福林酚试剂(分析纯):广州市齐云生物技术有限公司;没食子酸、硫氰酸铵(分析纯):天津市福晨化学试剂厂;Na2CO3(分析纯):天津市大茂化学试剂厂;亚油酸:Aladdin试剂公司;磷酸二氢钾、磷酸氢二钾、乙醇、甲醇(分析纯):天津市大茂化学试剂厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2"-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2"-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)(≥99%):美国Sigma-Aldrich公司;二丁基羟基甲苯(butylated hydroxytoluene,BHT)、过硫酸钾、维生素C(vitamin C,VC)(分析纯)、没食子酸、绿原酸、对羟基苯甲酸、芥子酸、阿魏酸、2种黄酮(芦丁、槲皮素)(均为色谱纯):上海阿拉丁生化科技股份有限公司;乙酸钠、乙酸、HCl(均为分析纯):国药集团化学试剂有限公司;FeCl3(分析纯):天津市福晨化学试剂厂;2,4,6-三(2-吡啶基)三嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)(纯度≥99%):美国Sigma公司;乙腈(色谱纯):美国Fisher公司。
1.2 仪器与设备
BS224S型分析天平:赛多利斯科学仪器有限公司;MP502B型电子天平:上海精密实验器材有限公司;SW-CK-1洁净工作台:苏州安泰空气技术有限公司;ZWYD-2402恒温培养振荡器(摇床):智城分析仪器制造有限公司;LRH-150B型生化培养箱:韶关市泰宏医疗器械有限公司;Waters 2695高效液相色谱仪、2475HPLC紫外检测器:美国Waters公司;5804R台式超速大容量离心机:德国Eppendorf公司。
1.3 实验方法
1.3.1 红曲酒发酵工艺流程及操作要点
大米浸泡→灭菌→冷却至室温→接种→前酵→后酵→过滤→煎酒→保存→成品
操作要点:
大米浸泡、灭菌、冷却至室温:将淘洗干净的大米用蒸馏水浸泡24 h,用灭菌锅115℃灭菌20 min,灭菌完毕放置于超净台中自然降温至室温。
接种:冷却至室温的大米按照课题组之前研究[10]的配方接种酵母2‰、料水比为大米∶水=1∶2(g∶mL)、接种7.2‰中温糖化酶,添加一定量的红曲米。
前酵:保鲜膜封口,置于30℃的恒温箱发酵7 d。
后酵:改变温度为25℃,继续在恒温箱中发酵7 d。
过滤、煎酒、保存:将发酵好的酒液,用4层纱布挤压过滤,在80℃的恒温水浴锅中煎酒15 min左右,待沉降完全后,转移至无菌储液瓶并封口,置于低温条件下(-4℃)保藏。
1.3.2 红曲米添加量对红曲酒多酚的影响
分别添加不同量的红曲米(0、2.5%、5.0%、7.5%、10.0%),并用白米补齐红曲米添加的减少量,得到五组不同的红曲酒,研究红曲酒中多酚和抗氧化活性的变化。
1.3.3 测定方法
总酚含量:采用福林酚试剂方法[11],以没食子酸当量表示。取1 mL适当稀释的红曲酒液,加入0.5 mL福林酚试剂,充分摇匀后,反应3~8min,加入1.5mL 200mg/LNa2CO3溶液,摇匀,加蒸馏水定容至10 mL,室温条件下放置反应60 min,于波长765 nm处测定吸光度值。
总抗氧化能力的测定:采用硫氰酸盐法测定酒样对亚油酸体系总抗氧化作用[12]。
DPPH自由基清除能力:采用参考文献[13]的方法,稍作调整。反应体系包括400μL的DPPH甲醇溶液(100μmol/L)和50 μL稀释到合适倍数的酒样。将混合液置于旋转涡旋仪上混匀,黑暗环境中,25℃反应30 min。用酶标仪测定其在波长517 nm处的吸光度值,平行测定3次。酒样DPPH自由基清除率计算公式如下:
式中:A 0为未加样品时DPPH溶液在波长517 nm处的吸光度值;A 1为DPPH溶液和酒样反应后在波长517 nm处吸光度值。
ABTS+自由基清除能力:采用参考文献[14]的方法,稍作调整。等体积混合过硫酸钾(2.45 mmol/L)氧化ABTS(7 mmol/L),在25℃条件下,黑暗环境中反应16 h,制备新鲜的ABTS+自由基溶液。将新鲜制备的ABTS+溶液用乙醇稀释至吸光度值为0.70±0.02(波长734 nm处)待用。ABTS+自由基清除测试反应体系包含100 μL稀释适当倍数的酒样与400 μL ABTS+稀释液,将混合液置于旋转涡旋仪上混匀,置于黑暗环境,25℃反应10 min。用酶标仪测定混合液在波长734 nm处的吸光度值。酒样ABTS+自由基清除率计算公式如下:
式中:A 0为未加样品时ABTS+溶液在波长734 nm处的吸光度值;A 1为ABTS+溶液和样品的反应后在波长734 nm处的吸光度值。

式中:a、b分别为VC ABTS+(DPPH)自由基清除率标准曲线的斜率和截距;K为对应酒样的稀释倍数。
铁还原/抗氧化能力(ferricionreducingantioxidantpower,FRAP)测定:采用参考文献[15]的方法,稍作调整。FRAP反应体系包括3 mL FRAP试剂与100 μL稀释合适倍数的酒样,将反应液置于旋转涡旋仪上混匀,在室温条件下孵育30min后,测定其在波长593 nm处的吸光度值。用1g/L的BHT作为阳性对照,进行FRAP试验。样品的铁离子还原氧化力用每1 L相当于VC的摩尔数表示。所有样品测试均执行3次。
多酚测定:采用参考文献[16]的方法,稍作调整。采用高效液相色谱(HPLC)法分析,二极官阵列检测器(DAD)检测酒样中的多酚组成,红曲酒样品用0.22 μm有机滤膜过滤。HPLC色谱系统包括Waters e2695分离系统和Waters2998 PDA检测系统;色谱柱为Sunfire C18反相色谱柱(250mm×4.6mm,5 μm),柱温30 ℃;样品进样体积10 μL;流动相分A相和B相,A相为磷酸缓冲液(pH=2.5),B相为乙腈;洗脱流速0.8 mL/min,采取梯度洗脱(0~35 min,15%B;35~36 min,50%B;36~40min,80%B;40~45min,20%B;45~55 min,15%A),洗脱时间55 min;二极管阵列检测器(DAD)检测波长200~600 nm,记录多酚光谱,提取色谱图波长280 nm。通过对比标准品的HPLC保留时间和紫外光谱,对多酚提取液的组成成分进行初步分析鉴定。
2 结果与分析
2.1 红曲米添加量对红曲酒总酚含量的影响
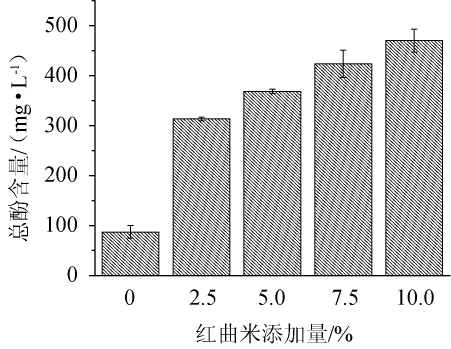
图1 不同红曲米添加量对红曲酒总酚含量的影响
Fig.1 Effect of different Hongqu rice addition on total phenolic content of Hongqu rice wine
由图1可知,红曲米添加量为0、2.5%、5.0%、7.5%、10.0%时,红曲酒的总酚含量分别为87.19 mg/L、313.28 mg/L、368.51 mg/L、423.74 mg/L、470.07 mg/L,红曲米添加量越大,红曲酒的总酚含量越高,红曲米添加量为10%和7.5%的红曲酒总酚含量差异明显(P<0.01),表明红曲米的添加量对红曲酒总酚含量影响很大。红曲酒总酚含量增加将有助于提升其健康价值,总酚含量与抗氧化性具有很大的相关性[17],酚类物质具有清除活性氧(reactive oxygen species,ROS)[18-20]、抑制油系统氧化[21]、抑制人体低密度脂蛋白(low density lipoprotein,LDL)氧化[22-23]、降低人体患心血管疾病的能力[24-26]。红曲酒中总酚含量越高,说明抑制油脂过氧化和降低人体患心血管、癌症等疾病的能力越强,保健功效越好。因此选择红曲米添加量10%为宜。
2.2 红曲米添加量对红曲酒多酚成分的影响
酚酸和类黄酮存在于谷物中的形式有游离和共轭两种,如水稻中主要酚类物质阿魏酸和对-香豆酸是以游离、可溶和不可溶等形式存在[27]。在酿酒过程,原料大米中原来不可溶的多酚类物质,由于微生物生命活动,发生酶作用而不断的释放,使酒体中可溶性多酚含量升高。用HPLC定性并定量分析不同红曲米添加量对红曲酒5种酚酸、2种黄酮成分的影响,结果如表1所示。
表1 不同红曲米添加量对红曲酒多酚化合物含量的影响
Table 1 Effect of different Hongqu rice addition on polyphenolic compounds content of Hongqu rice wine mg/L
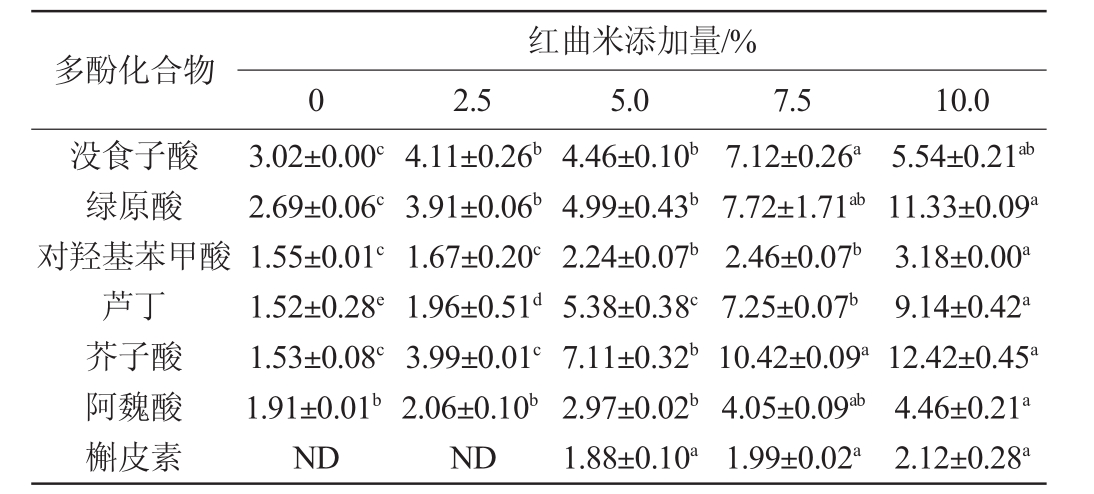
注:同行小写字母不同表示差异显著(P<0.05);“ND”表示未检出。
多酚化合物没食子酸绿原酸对羟基苯甲酸芦丁芥子酸阿魏酸槲皮素红曲米添加量/%0 2.5 5.0 7.5 10.0 3.02±0.00c 2.69±0.06c 1.55±0.01c 1.52±0.28e 1.53±0.08c 1.91±0.01b ND 4.11±0.26b 3.91±0.06b 1.67±0.20c 1.96±0.51d 3.99±0.01c 2.06±0.10b ND 4.46±0.10b 4.99±0.43b 2.24±0.07b 5.38±0.38c 7.11±0.32b 2.97±0.02b 1.88±0.10a 7.12±0.26a 7.72±1.71ab 2.46±0.07b 7.25±0.07b 10.42±0.09a 4.05±0.09ab 1.99±0.02a 5.54±0.21ab 11.33±0.09a 3.18±0.00a 9.14±0.42a 12.42±0.45a 4.46±0.21a 2.12±0.28a
由表1可知,随着红曲米添加量的增加,没食子酸、绿原酸、对羟基苯甲酸、芥子酸、阿魏酸和芦丁也随之增加,与总酚含量的增加趋势一致。添加量为10.0%时含量分别为5.54 mg/L、11.33 mg/L、3.18 mg/L、9.14 mg/L、12.42 mg/L和4.46 mg/L,分别是未接种时的1.83、4.21、2.05、6.01、8.12和2.34倍。而槲皮素只有在红曲米添加量为5.0%时才能检测出。说明随着红曲米添加量的增加,红曲酒中的单体多酚种类和含量也有所增加,提高了红曲酒的抗氧化活性。
2.3 红曲米添加量对红曲酒总抗氧化能力的影响
脂质过氧化是由多种自由基作用引发的现象,因此亚油酸脂质过氧化体系常用作为评价样品的总抗氧化能力[28],样品的抗亚油酸过氧化抑制率越高表明样品的总抗氧化能力越强。不同红曲米添加量对红曲酒总抗氧化能力的影响见图2。
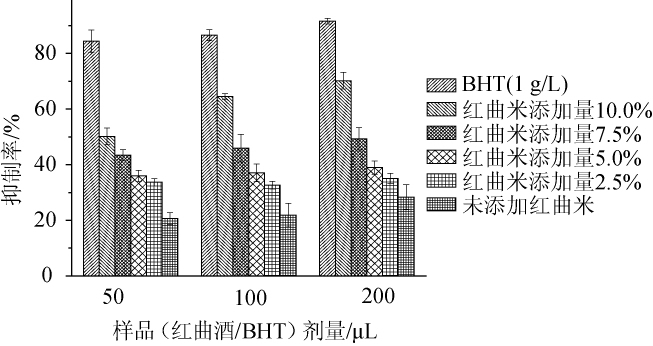
图2 不同红曲米添加量对红曲酒的总抗氧化能力的影响
Fig.2 Effect of different Hongqu rice addition on total antioxidant activity of Hongqu rice wine
由图2可知,红曲酒剂量为200 μL时,红曲米添加量为10.0%、7.5%、5.0%、2.5%、0和阳性对照BHT(1 g/L)的抑制率分别是70.2%、49.3%、39.0%、35.0%、28.3%和91.7%,即除了阳性对照BHT外,红曲米添加量10%的抑制率相对于其他酒样的抑制率最高,是不添加红曲米的2.48倍。不添加红曲米时抑制率较其他样品都低,说明提高红曲米添加量,可提高红曲酒的总抗氧化能力。但总体来说,5种红曲酒的脂质过氧化抑制效果都不如BHT。
2.4 不同红曲米添加量对红曲酒的抗氧化活性影响
2.4.1 DPPH自由基清除能力
DPPH自由基清除实验是备受欢迎的评价样品的体外抗氧化能力的基础实验[29-31]。不同红曲米添加量对红曲酒DPPH自由基清除能力的影响见图3。
由图3可知,随着红曲米添加量的增加,各酒样的DPPH自由基清除能力也相应增加,当红曲米添加量为10.0%时,红曲酒的DPPH自由基清除能力达到最大,为129.20mg VC/L,是不添加红曲米的3.36倍,与前面测定的总酚含量以及总抗氧化能力测定的结果相一致,说明提高红曲米的添加量可提高酒样中的总酚含量,从而提高其抗氧化活性。
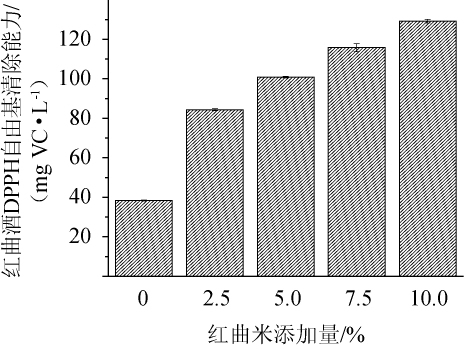
图3 不同红曲米添加量对红曲酒DPPH自由基清除能力的影响
Fig.3 Effect of different Hongqu rice addition on DPPH free radical scavenging capacity of Hongqu rice wine
半抑制量(50%inhibiting concentration,IC50)值被广泛用于进一步评价样品抗氧化能力强弱的指标,其值越小,样品的抗氧化能力越强。本实验测定了不同酒样DPPH清除能力的IC50值,结果如图4所示。
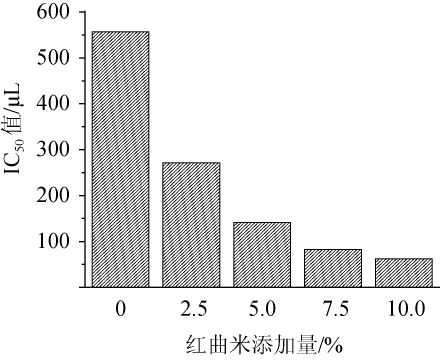
图4 不同红曲米添加量对红曲酒的DPPH自由基半抑制量(IC50值)的影响
Fig.4 Effect of different Hongqu rice addition on IC 50 value of DPPH free radical of Hongqu rice wine
由图4可知,不添加红曲米的红曲酒IC50值明显高于其他酒样,为557.30 μL,是红曲米添加量10.0%的8.95倍。酒样IC50值的结果与总酚、总抗氧化能力以及DPPH自由基清除能力的测定结果规律一致,说明提高红曲米的添加有利于红曲酒抗氧化活性的提高。
2.4.2 ABTS+自由基清除能力
ABTS+自由基清除能力是抗氧化剂另一种体外抗氧化能力常用的测定方法,相比于醇溶性的DPPH,ABTS试剂既具有水溶性又具有醇溶性,即能和亲脂性和亲水性的抗氧化剂快速反应[32]。不同红曲米添加量对红曲酒ABTS+自由基清除能力的影响如图5所示。
由图5可知,红曲酒的ABTS+自由基清除能力随着红曲米添加量的增加而上升,与DPPH自由基清除率趋势一致。红曲米添加量为10.0%时的红曲酒ABTS+自由基清除率最大,为367.66mg VC/L,是不添加红曲米的7.82倍。说明红曲米的添加量增加,提高了红曲酒的自由基清除活性。
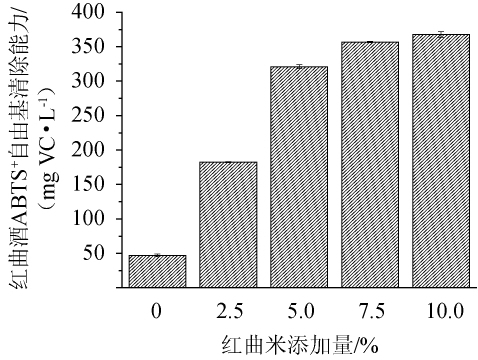
图5 不同红曲米添加量对红曲酒ABTS+自由基清除能力的影响
Fig.5 Effect of different Hongqu rice addition on ABTS+free radical scavenging capacity of Hongqu rice wine
2.4.3 还原力FRAP值
FRAP值是测定分析样品将铁(Fe3+)还原成亚铁(Fe2+)状态方面的抗氧化能力[33],不同红曲米添加量对红曲酒的FRAP值影响如图6所示。由图6可知,随着红曲米添加量的增加,红曲酒的FRAP值也在增加,说明提高红曲米添加量有助于提升红曲酒的还原力。红曲米添加量为10%的红曲酒还原力最高,可达到1 574.54 μmol/L,是不添加红曲米的2.35倍。但低于食品加工常用的抗氧化剂BHT(1 g/L)的FRAP值(2 391.94 μmol/L)。
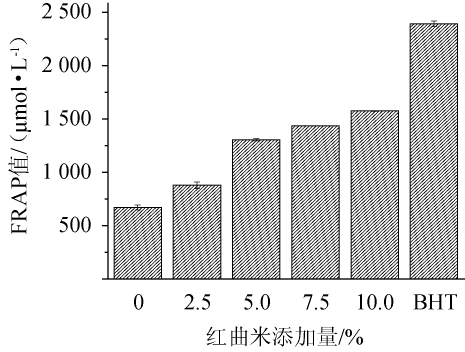
图6 不同红曲米添加量对红曲酒的FRAP值的影响
Fig.6 Effect of different Hongqu rice addition on FRAP value of Hongqu rice wine
2.5 酚类化合物和抗氧化活性的相关性分析
为探究红曲酒中主要的多酚化合物的抗氧化活性,对多酚化合物含量与抗氧化活性进行了相关性矩阵分析,结果如表2所示。
由表2可知,红曲酒中主要的酚类物质含量均与总抗氧化能力、DPPH自由基清除能力、ABTS+自由基能力和还原力(FRAP)相关。总抗氧化能力与绿原酸含量高度相关(R=0.995,P<0.01),而与对羟基苯甲酸、芦丁、芥子酸、阿魏酸的含量具有较高的相关性(R>0.920,P<0.05),与没食子酸和槲皮素的含量相关性不高。DPPH和ABTS+自由基清除能力与芦丁、芥子酸和阿魏酸的含量具有较高的相关性(R>0.896,P<0.05),而且ABTS+自由基清除能力还与槲皮素含量具有较高的相关性(R=0.936,P<0.05)。还原力与芦丁、芥子酸和槲皮素含量高度相关(R>0.960,P<0.01),与绿原酸、对羟基苯甲酸、阿魏酸的含量具有较高的相关性(R>0.890,P<0.05)。总之,芥子酸、阿魏酸、芦丁这三种酚类物质的含量与红曲酒的总抗氧化能力、DPPH和ABTS+自由基清除能力以及还原力都有较高的相关性(R>0.890,P<0.05)。
表2 红曲酒酚类化合物和抗氧化活性的相关性分析
Table 2 Correlation analysis of phenolic compounds and antioxidant activities of Hongqu rice wine
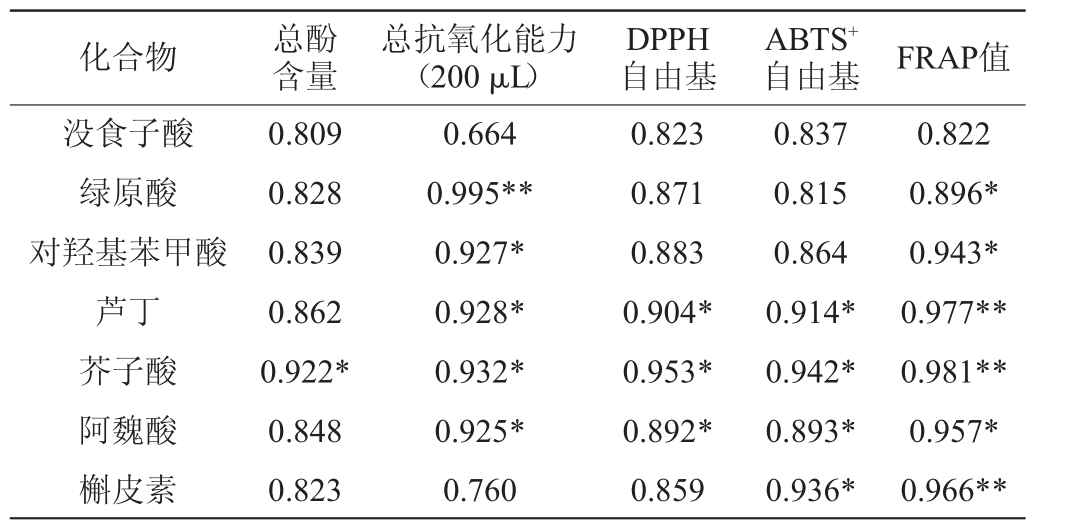
注:“*”表示在0.05水平显著相关;“**”表示在0.01水平显著相关。
化合物 总酚含量总抗氧化能力(200 μL)DPPH自由基ABTS+自由基 FRAP值没食子酸绿原酸对羟基苯甲酸芦丁芥子酸阿魏酸槲皮素0.809 0.828 0.839 0.862 0.922*0.848 0.823 0.664 0.995**0.927*0.928*0.932*0.925*0.760 0.823 0.871 0.883 0.904*0.953*0.892*0.859 0.837 0.815 0.864 0.914*0.942*0.893*0.936*0.822 0.896*0.943*0.977**0.981**0.957*0.966**
3 结论
各酒样总酚含量随红曲米添加量的增加而增加,说明红曲米是红曲酒中多酚类物质的重要来源,而且总酚测定的结果与DPPH自由基清除能力、ABTS+自由基清除能力和FRAP法测定酒样的还原力结果相吻合,均随着红曲米添加量的增加而增加。红曲酒的单体酚酸种类和含量随着红曲米添加量的增加有所提升,没食子酸、绿原酸、对羟基苯甲酸、芥子酸、阿魏酸和芦丁在红曲米添加量为10%时的含量分别达到5.54 mg/L、11.33 mg/L、3.18 mg/L、9.14 mg/L、12.42 mg/L和4.46 mg/L,而槲皮素只有在红曲米添加量增加到一定程度的红曲酒中才能检测出。芥子酸、阿魏酸、芦丁这三种酚类物质与红曲酒的总抗氧化能力、DPPH和ABTS+自由基清除能力以及还原力都有较高的相关性(R>0.890,P<0.05)。本结果为深入研究红曲酒多酚的来源和抗氧化活性的提高提供了参考和数据支持。
[1]NIU X,SHEN F,YU Y,et al.Analysis of sugars in Chinese rice wine by Fourier transform near-infrared spectroscopy with partial least-squares regression[J].J Agr Food Chem,2008,56(16):7271-7278.
[2]SHEN C,MAO J,CHEN Y,et al.Extraction optimization of polysaccharides from Chinese rice wine from the Shaoxing region and evaluation of its immunity activities[J].J Sci Food Agr,2015,95(10):1991-1996.
[3]QUE F,MAO L,PAN X.Antioxidant activities of five Chinese rice wines and the involvement of phenolic compounds[J].Food Res Int,2006,39(5):581-587.
[4]PARK K H,LIU Z,PARK C,et al.Microbiota associated with the starter cultures and brewing process of traditional Hong Qu glutinous rice wine[J].Food Sci Biotechnol,2016,25(3):649-658.
[5]LV X,HUANG R,CHEN F,et al.Bacterial community dynamics during the traditional brewing of Wuyi Hong Qu glutinus rice wine as determined by culture-independent methods[J].Food Control,2013,34(2):300-306.
[6]LIU Z B,WANG Z Y,LV X C,et al.Comparison study of the volatile profilesand microbial communitiesof Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[7]LU Q Y,LEE R P,HUANG J J,et al.Quantification of bioactive constituentsand antioxidant activity of Chinese yellow wine[J].J Food Compos Anal,2015,44:86-92.
[8]胡均亮,陆方菊,陈功,等.不同来源红曲米多酚类化合物和抗氧化活性的聚类分析[J].中国酿造,2017(3):39-43.
[9]涂璐,王爱莉,李再贵.燕麦红曲黄酒多酚含量及抗氧化性研究[J].中国酿造,2012,31(1):43-45.
[10]胡均亮.红曲酒挥发性风味物质和抗氧化活性的研究[D].广州:华南理工大学,2017.
[11]BEI Q,LIU Y,WANG L,et al.Improving free,conjugated,and bound phenolic fractions in fermented oats(Avena sativa L.)with Monascus anka,and their antioxidant activity[J].J Funct Food,2017,32:185-194.
[12]孙芸,徐宝才,谷文英,等.葡萄籽原花青素的聚合度与抗氧化活性关系[J].食品与发酵工业,2006,32(10):41-46.
[13]HAMMI K M,JDEY A,ABDELLY C,et al.Optimization of ultrasoundassisted extraction of antioxidant compounds from Tunisian Zizyphus lotus fruits using response surface methodology[J].Food Chem,2015,184:80-89.
[14]SASIPRIYA G,SIDDHURAJU P.Effect of different processing methods on antioxidant activity of underutilized legumes,Entada scandens seed kernel and Canavalia gladiata seeds[J].Food Chem Toxicol,2012,50(8):2864-2872.
[15]BENZIE I F,STRAIN J J.The ferric reducing ability of plasma(FRAP)as a measure of'antioxidant power':the FRAP assay[J].Anal Biochem,1996,239(1):70-76.
[16]GASKIN R E,WOON G W.Antagonistic effects of 2,4-D),MCPA and MCPB on uptake and translocation of haloxyfop-ethoxyethyl in oat(Avena sativa L.)[J].Weed Res,2010,34(6):437-444.
[17]ROUSSIS I G,LAMBROPOULOS I,TZIMAS P,et al.Antioxidant activities of some Greek wines and wine phenolic extracts[J].J Food Compos Anal,2008,21(8):614-621.
[18]SÁNCHEZ-MORENO C,LARRAURI J A,SAURA-CALIXTO F.Free radical scavenging capacity of selected red,rosé and white wines[J].J Sci Food Agr,1999,79(10):1301-1304.
[19]ROUSSIS I G,LAMBROPOULOS I,SOULTI K.Scavenging capacities of some wines and wine phenolic extracts[J].Food Technol Biot,2005,43(4):351-358.
[20]ROUSSOU I,LAMBROPOULOS I,PAGOULATOS G N,et al.Decrease of heat shock protein levels and cell populations by wine phenolic extracts[J].J Agr Food Chem,2004,52(4):1017-1024.
[21]SÁNCHEZ-MORENO C,SATUÉ-GRACIA M T,FRANKEL E N.Antioxidant activity of selected spanish wines in corn oil emulsions[J].J Ag Food Chem,2000,48(11):5581-5587.
[22]FRANKEL E N,GERMAN J B,KINSELLA J E,et al.Inhibition of oxidation of human low-density lipoprotein by phenolic substances in red wine[J].The Lancet,1993,341(8843):454-457.
[23]TSELEPIS A D,LOURIDA E S,TZIMAS P C,et al.Comparative antioxidant effectiveness of white and red wine and their phenolic extracts towards low-density lipoprotein oxidation[J].Food Biotechnol,2005,19(1):1-14.
[24]NARDINI M,D"AQUINO M,TOMASSI G,et al.Inhibition of human low-density lipoprotein oxidation by caffeic acid and other hydroxycinnamic acid derivatives[J].Free Rad Biol Med,1995,19(5):541-552.
[25]NL K,M A.Red wine and fractionated phenolic compounds prepared from red wine inhibit low density lipoprotein oxidation in vitro[J].Atherosclerosis,1997,135(1):93-102.
[26]DONOVAN J L,BELL J R,KASIM-KARAKAS S,et al.Catechin is present as metabolites in human plasma after consumption of red wine[J].J Nutr,1999,129(9):1662-1668.
[27]SOSULSKI F,KRYGIER K,HOGGE L.Free,esterified,and insolublebound phenolic acids.3.Composition of phenolic acids in cereal and potato flours[J].J Agr Food Chem,1982,30(2):337-340.
[28]周剑,丁玉峰.大孔吸附树脂分离中草药有效成分的应用[J].中国医院药学杂志,2006(1):69-71.
[29]ALMA M H,MAVI A,YILDIRIM A,et al.Screening chemical composition and in vitro antioxidant and antimicrobial activities of the essential oils from Origanum syriacum L.growing in Turkey[J].Biol Pharmaceut Bull,2003,26(12):1725-1729.
[30]KORDALI S,CAKIR A,MAVI A,et al.Screening of chemical composition and antifungal and antioxidant activities of the essential oils from three Turkish Artemisia species[J].J Agr Food Chem,2005,53(5):1408-1416.
[31]KARIOTI A,HADJIPAVLOU-LITINA D,MENSAH M L,et al.Composition and antioxidant activity of the essential oils of Xylopia aethiopica(Dun)A.Rich.(Annonaceae)leaves,stem bark,root bark,and fresh and dried fruits,growing in Ghana[J].J Agr Food Chem,2004,52(26):8094.
[32]TEOW C C,TRUONG V,MCFEETERS R F,et al.Antioxidant activities,phenolic and β-carotene contents of sweet potato genotypes with varying flesh colours[J].Food Chem,2007,103(3):829-838.
[33]FERNÁNDEZ-ARROYO S,RODRÍGUEZ-MEDINA I C,BELTRÁNDEBÓN R,et al.Quantification of the polyphenolic fraction and in vitro antioxidant and in vivo anti-hyperlipemic activities of Hibiscus sabdariffa aqueous extract[J].Food Res Int,2011,44(5):1490-1495.