γ-谷维素(γ-oryzanol)是由三萜烯醇类为主体,阿魏酸酯与甾醇类阿魏酸酯组成的混合物,广泛存在于多种植物油中[1-3]。其最早在米糠油中发现,甾醇部分主要为菜油甾醇(campesterol)、谷甾醇(sitosterol),三萜醇部分主要是环木菠萝烯醇(cycloartenol)、2,4-亚甲基环木菠萝烯醇(2,4-methylene cycloartanol)[4],其被认为是最有效的天然抗氧化剂之一,含量及成分在不同品种之间存在显著差异[5-6]。国内外大量研究证明,γ-谷维素除了具有清除自由基、抗氧化的作用外[7-9],还能降血脂[10-11]、调节糖代谢[12-13]、抗炎症[14],且具有调节神经系统[15]、消化系统[16]、治疗心血管疾病[17-18]等功效。洛伐他汀(lovastatin)是美国食品及药物管理局(food and drugadministration,FDA)于1987年批准的第一种降低胆固醇的他汀类药物,能降低心血管和脑血管发病率[19],目前其生产主要来源于红曲菌发酵[20]。
目前,γ-谷维素的制备主要采用物理和化学方法[21],通过生物转化获得谷维素的研究甚少。采用微生物合成以提高其功能性成分含量的方法已成为广泛关注的热点科学问题[22],如利用微生物发酵生产单细胞蛋白[23];从可再生原料直接发酵生产L-丝氨酸[24]等。贺圣凌等[25]利用红曲霉菌发酵薏米糠,使米糠中γ-谷维素与α-生育酚含量明显增加;KELLY C M等[26]研究证实,采用米根霉米糠固态培养提高了γ-谷维素的回收率,改善了米糠的功能特性。
贵州地理优势独特,小宗粮食丰富,且营养价值较高,但目前深度开发仍较匮乏,因此,如何结合区域特点,变资源优势为经济优势,成为企业与科技工作者们共同关注的问题。本研究拟采用微生物发酵转化法开发贵州特色杂粮薏米、苦荞、燕麦米、小米,以筛选最适产γ-谷维素的杂粮基质,并通过单因素及正交试验优化筛获高产γ-谷维素的杂粮发酵工艺参数,为贵州特色杂粮精深加工开发,提高杂粮品质及功能活性提供技术支撑及工艺参数。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
薏米:贵州仁信农业开发有限公司;苦荞米:贵州省威宁县东方神谷有限责任公司;燕麦米、小米、大米:贵阳市花溪区。紫红曲霉菌(Monascus purpureus)3.462 9:中国普通微生物菌种保藏管理中心。
1.1.2 化学试剂
正己烷(色谱纯):天津科密欧化学试剂有限公司;γ-谷维素标品(纯度99.9%)、洛伐他汀(纯度99.9%):美国西格玛公司;其他化学试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potatodextroseagar,PDA)培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
TCL-16B高速台式离心机:上海安亭科学仪器厂;KQ3200E型超声波清洗器:昆山市超声波仪器有限公司;101-0AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;DK-8D三孔电热恒温水槽:上海一恒科学仪器有限公司;LDZX-50KB立式压力蒸汽灭菌器:上海申安医疗器械厂;HH-B11·600BY电热恒温培养箱:上海跃进医疗器械有限公司;800-Y高速多功能粉碎机:永康市铂欧五金制品有限公司;TU-1810PC紫外可见分光光度计:北京普析通用仪器有限责任公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪(配有可变波长紫外检测器和色谱工作站):美国安捷伦(Agilent)公司。
1.3 方法
1.3.1 发酵方法
紫红曲霉孢子悬浮液的制备:紫红曲霉斜面培养基中加入30 mL无菌水,采用接种环轻刮菌落表面将菌丝及孢子洗下,随即移入带玻璃珠的无菌三角瓶中,充分振荡均匀并过滤。
紫红曲霉种子液的制备:取大米粉0.9 g、NaNO3 0.15 g、KH2PO4 0.045 g、MgSO4 0.03 g于150 mL三角瓶中,加入蒸馏水30 mL,121℃灭菌20 min,接入紫红曲霉孢子悬浮液1.5 mL,于30℃、180 r/min摇床培养3 d。
杂粮固态发酵:将薏米、苦荞、小米、燕麦米与大米浸泡6 h后沥干,分别称取30 g于250 mL三角瓶中,杂粮与蒸馏水料液比为3∶1(g∶mL),121 ℃灭菌20 min,接入8%红曲菌种子液(活菌含量≥108 CFU/mL),于30℃静置培养9 d。
1.3.2 分析检测
(1)色价测定
参照国标GB 1886.19—2015《食品安全国家标准食品添加剂红曲米》。
(2)γ-谷维素含量的测定
采用高效液相色谱法测定。
样品处理:将发酵物置于60℃干燥箱中烘干至恒质量,取出用粉碎机粉碎,过60目筛。称取杂粮粉1g,加入5mL正己烷,振荡充分混匀,于60℃水浴锅中加热20min,3000r/min离心10 min,吸取上清液,重复提取3次,合并上清液。旋转蒸发挥干提取液,挥干物中加入1 mL正己烷,超声完全溶解,3 000 r/min离心10 min,吸取上清液过滤膜入进样瓶。
HPLC色谱条件:SUPELCOSILTMLC-SI色谱柱(25cm×4.6mm,5μm);流动相:含0.8%乙酸乙酯与0.8%冰乙酸的正己烷溶液;洗脱方式:等度洗脱;进样量:80μL;流速:1.5mL/min;柱温:22℃;检测波长:290 nm;检测器:紫外检测器[25]。得到标准曲线方程为:y=64 957x+150.96,相关系数R2=0.999 8。
(3)洛伐他汀的测定
采用高效液相色谱法测定。
HPLC色谱条件:以甲醇为浸提液超声提取30 min,8 000 r/min离心15 min,吸取上清液,重复提取3次,合并上清液定容至10 mL,过滤膜入进样瓶。AgilentTC-C18色谱柱(4.6 mm×250 mm,5 μm);流动相:甲醇:0.1%磷酸水=80∶20(V/V);洗脱方式:等度洗脱;进样量:10μL;流速:1mL/min;检测波长237nm;柱温;30℃;检测器:紫外检测器[27]。得到标准曲线方程为:y=37.05001x+12.42066,相关系数R2=0.9997。
1.3.3 发酵条件优化单因素试验
选取初始pH值、料液比、接种量及发酵温度进行单因素试验。设置初始pH值分别为3.0、4.0、5.0、6.0、7.0(料液比3∶1(g∶mL),接种量8%,发酵温度30 ℃);料液比水平分别为15∶1、6∶1、3∶1、2∶1、3∶2(g∶mL)(初始pH值6.0,接种量8%,发酵温度30℃);接种量水平分别为4%、8%、12%、16%、20%(初始pH值6.0,料液比3∶1(g∶mL),发酵温度30 ℃);发酵温度分别为26℃、28℃、30℃、32℃、34℃(初始pH值6.0,料液比3∶1(g∶mL),接种量8%),发酵完成后检测样品中γ-谷维素含量。
1.3.4 发酵条件优化正交试验
在单因素试验基础上,选取料液比(A)、接种量(B)及发酵温度(C)3个因素,每个因素设置3个水平进行正交试验。正交试验各因素与水平设计见表1。
表1 发酵条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for fermentation process optimization
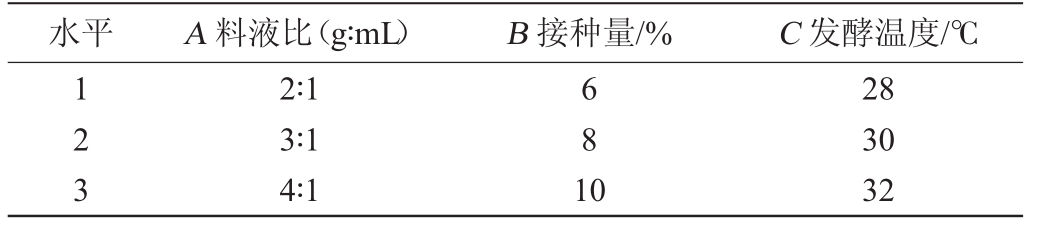
水平 A料液比(g∶mL) B接种量/% C发酵温度/℃123 2∶1 3∶1 4∶1 681 0 28 30 32
1.3.5 统计分析
每个试验处理重复3次,采用SPSS 17.0统计软件进行数据分析。
2 结果与分析
2.1 红曲发酵杂粮感官分析
将发酵物置于60℃干燥箱中烘干至恒质量,取出用粉碎机粉碎,得到杂粮粉,过60目筛(见图1),以未发酵杂粮为空白对照组(CK组),对杂粮粉进行色价测定,结果见图2。

图1 各杂粮基质发酵前后外观对比图
Fig.1 Comparison of the appearance before and after fermentation of each coarse cereals matrix
由图1可知,经紫红曲霉发酵后,各杂粮基质均呈现出红色。小米相比其他杂粮颜色较浅,呈褐色。原因是小米颗粒经高温高压灭菌后粘性增加,导致颗粒间空气不能良好流通,因紫红曲霉为好氧菌而只能在其表面生长而难以均匀分布在小米颗粒上,不利于红曲色素的累积。其他杂粮与小米相比灭菌后粘性较小,颗粒松散,有助于紫红曲霉均匀生长分布在颗粒表面。说明紫红曲霉可作为适生菌株在薏米、苦荞、燕麦与大米基质上生长,累积红曲色素,而小米基质色素累积效果不佳。
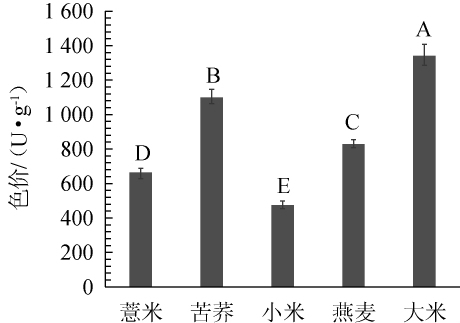
不同大写字母表示差异极显著(P<0.01)。图2 红曲霉菌发酵后各杂粮基质色价对比
Fig.2 Comparison of color value of each coarse cereals matrix after fermented by Monascus purpureus
由图2可知,各杂粮基质发酵后色价呈显著性差异(P<0.01)。小米色价最低,仅为475.05 U/g,曹晋宜等[28]制备的薏米、苦荞与小米杂粮红曲中,小米的色价也为最低,与本实验结果相符。其次为薏米,色价为664.24 U/g,较苦荞、燕麦和大米色价低。大米色价最高,达1 340.83 U/g,高于苦荞(1 099.21 U/g)与燕麦(827.59 U/g)。色价由高到低顺序依次为:大米>苦荞>燕麦>薏米>小米,表明紫红曲霉发酵杂粮能达到累积红曲色素的目的,其中以大米与苦荞作为发酵基质效果较好。
2.2 产γ-谷维素发酵杂粮基质的筛选
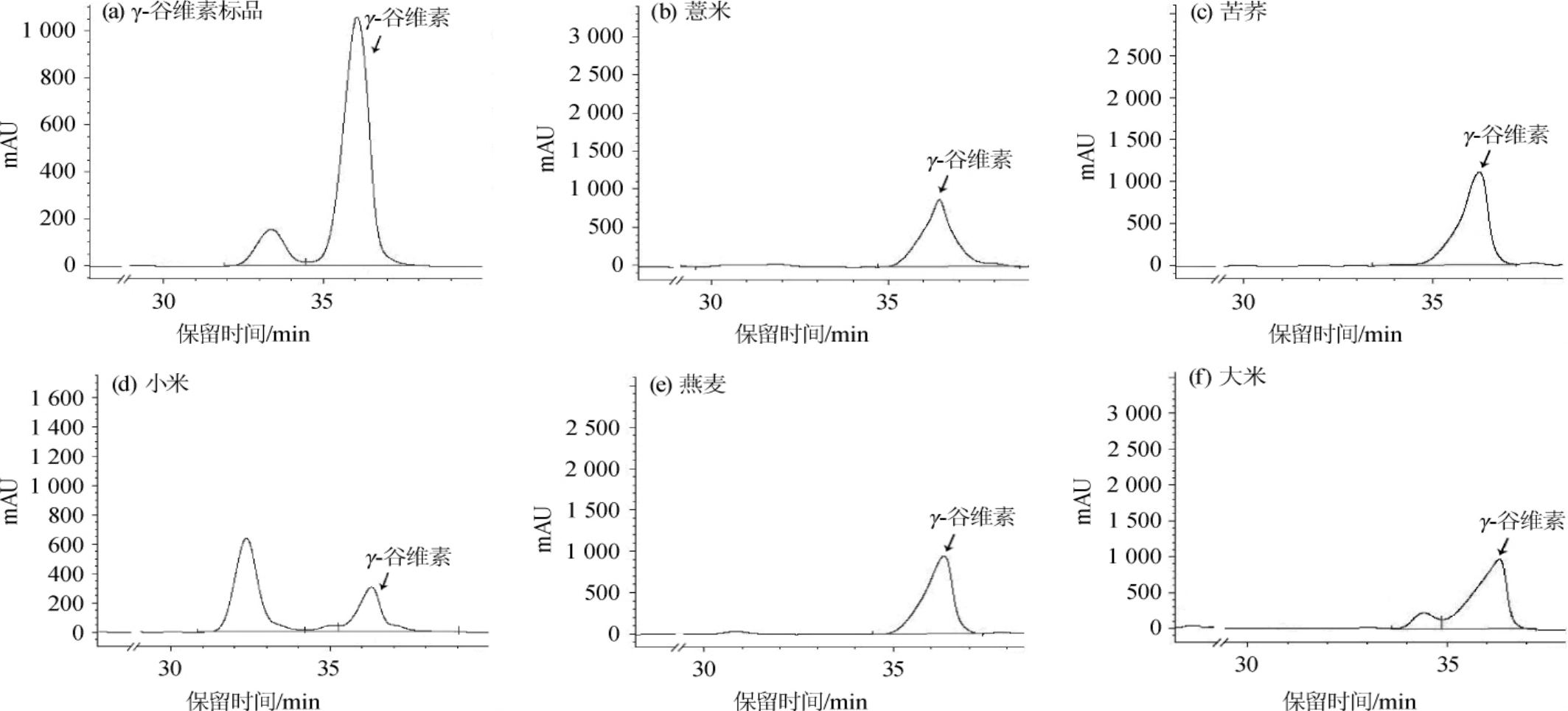
图3 γ-谷维素标品及各杂粮红曲发酵产物正已烷提取物中γ-谷维素分析HPLC色谱图
Fig.3 HPLC chromatogram of γ-oryzanol standard and γ-oryzanol in hexane extract of coarse cereals fermented by Monascus purpureus
测定杂粮红曲发酵产物正己烷提取物中γ-谷维素的含量,HPLC色谱图见图3。结合γ-谷维素标准曲线,以未发酵杂粮为对照组,进一步对杂粮红曲发酵产物正己烷提取物中的γ-谷维素含量进行定量分析。结果见图4。
由图3可知,γ-谷维素标品出峰时间在36.295 min,经紫红曲霉发酵后,薏米、苦荞、小米、燕麦、大米红曲发酵产物正已烷提取物中γ-谷维素的出峰时间分别为36.508 min、36.476 min、36.554 min、36.531 min、36.563 min,其中苦荞红曲发酵产物正己烷提取物的峰面积最大。
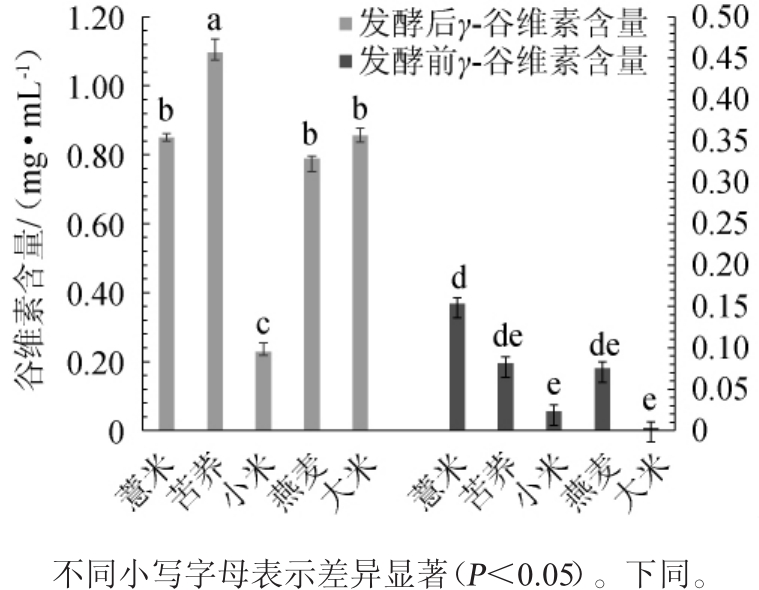
图4 各杂粮红曲发酵产物正已烷提取物中γ-谷维素含量对比
Fig.4 Comparison of γ-oryzanol contents in hexane extract of coarse cereals fermented by Monascus purpureus
由图4可知,苦荞红曲发酵产物正己烷提取物中γ-谷维素增量最大,从0.08 mg/mL增加到1.10 mg/mL,与其余3种杂粮和大米差异显著(P<0.05)。小米经高压灭菌后黏性大,紫红曲霉不能均匀生长,对发酵底物的利用率低,生长不旺盛,阻碍了代谢物的产生,因此,发酵完成后γ-谷维素含量较低。薏米、燕麦和大米红曲发酵产物正己烷提取物中γ-谷维素含量分别为0.85 mg/mL、0.79mg/mL、0.85 mg/mL,差异不显著(P>0.05),但与发酵前相比γ-谷维素含量均呈现显著性增长(P<0.05)。苦荞比其余3种杂粮与大米吸水性都好,经浸泡后能更好地储存水分,且灭菌后颗粒松散,存在空隙保证了空气流通,有利于紫红曲霉的生长和代谢,故苦荞红曲发酵产物正己烷提取物中γ-谷维素含量最高。为获得高产γ-谷维素杂粮发酵体系,选择苦荞作为培养基质进行后续发酵工艺优化。
2.3 高产γ-谷维素发酵工艺优化
2.3.1 单因素试验
初始pH值、料液比、接种量与温度对苦荞红曲发酵产物正己烷提取物中γ-谷维素含量的影响结果见图5。
由图5a可知,初始pH值为5.0时,γ-谷维素含量达到峰值1.52 mg/mL,之后显著降低(P<0.05),紫红曲霉是嗜酸菌,偏酸性的环境有利于红曲菌生长代谢,这与遇靓[29]的试验结果相符。γ-谷维素含量在初始pH值3.0~5.0范围内差异不显著(P>0.05),说明在酸性环境下,初始pH值对γ-谷维素含量影响不大,因此,在后续发酵过程中,初始pH值设定为5.0。
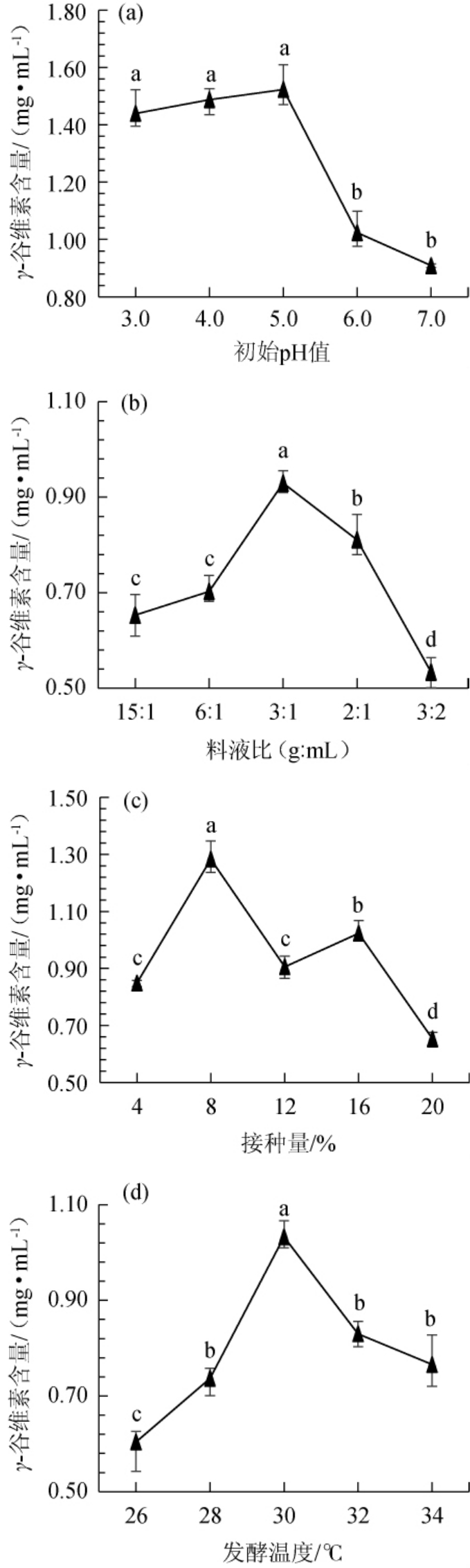
图5 发酵条件对苦荞红曲发酵产物正已烷提取物中γ-谷维素含量的影响
Fig.5 Effect of fermentation conditions on γ-oryzanol contents in hexane extract of tartary buckwheat fermented by Monascus purpureus
由图5b可知,各杂粮红曲发酵产物正己烷提取物中γ-谷维素含量随料液比的升高而增大,在料液比为3∶1(g∶mL)时达到峰值,为0.93 mg/mL,含水量过高会导致苦荞发酵基质发黏,透气性不佳,红曲菌生长受阻,因此,γ-谷维素含量显著下降。因此,确定最佳料液比为3∶1(g∶mL)。
由图5c可知,接种量<8%时,菌体繁殖速度慢,不利于目标产物的生成,因此,γ-谷维素含量低;接种量为8%时,γ-谷维素含量最高,达到1.28 mg/mL;但发酵体系中的营养物质有限,接种量过高,菌体数量达到一定程度时,反而会制约菌体生长及代谢产物的形成,因此接种量>8%之后,γ-谷维素含量显著下降。因此,确定最佳接种量为8%。
由图5d可知,发酵温度为26~30℃范围内,γ-谷维素含量与发酵温度呈正相关,在30℃时达到峰值1.03mg/mL,较高的温度(30℃)有利于紫红曲霉菌体的生长[30];发酵温度>30℃后,温度过高影响紫红曲霉正常生长代谢,γ-谷维素含量随温度的升高而降低。因此,确定最适初始pH值为5.0,料液比为3∶1(g∶mL),接种量为8%,发酵温度为30 ℃。
2.3.2 正交试验优化发酵工艺
根据单因素试验结果,说明在酸性条件下初始pH值对γ-谷维素含量影响不大,初始pH值为5.0时γ-谷维素含量相对较高,因此,在后续发酵过程中,初始pH值设定为5.0。因此以料液比(A)、接种量(B)与发酵温度(C)为试验因素,以γ-谷维素含量为评价指标,考察发酵过程中不同因素对其含量的影响。正交试验设计与结果见表2,其方差分析结果见表3。
表2 发酵工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for fermentation process optimization
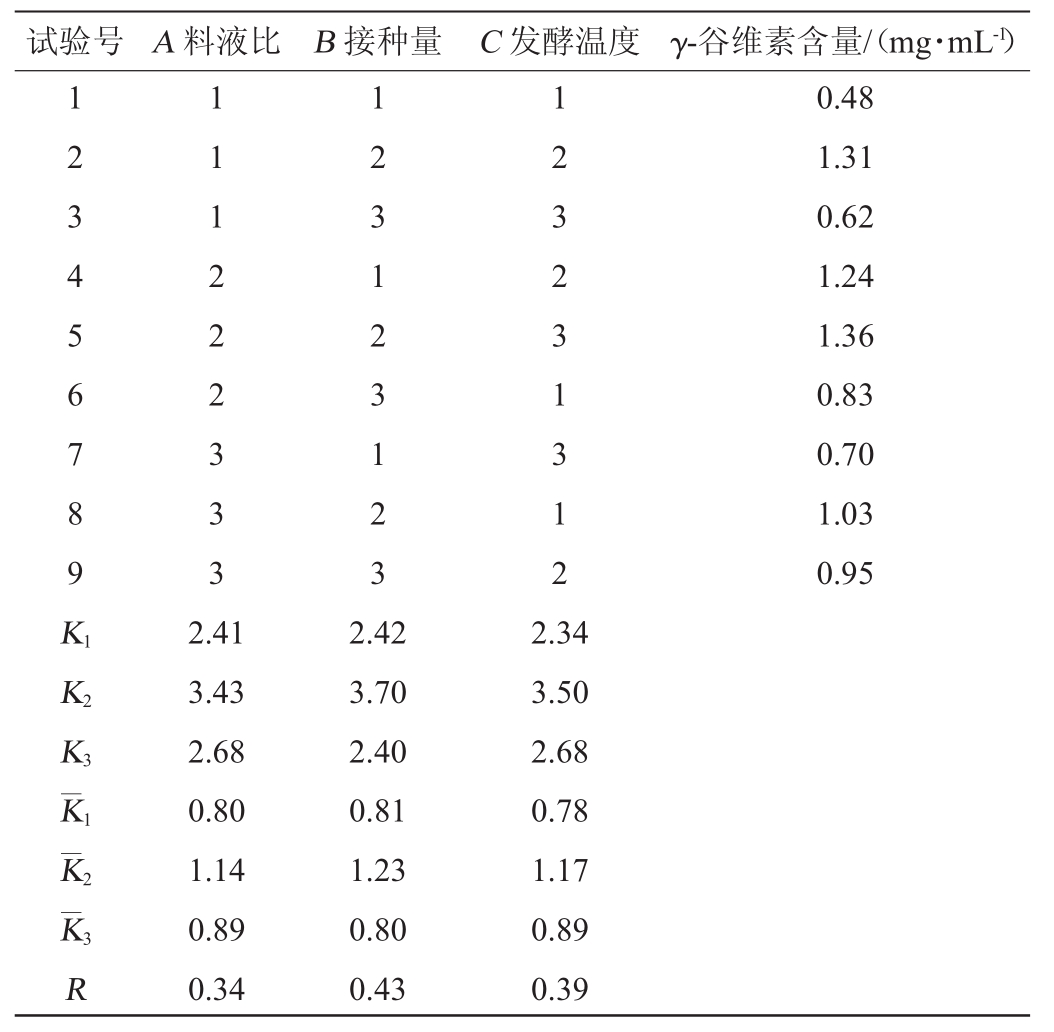
试验号A料液比B接种量C发酵温度γ-谷维素含量/(mg·mL-1)1 2 3 4 5 6 7 8 9 K 1K 2K 3K 1K 2K 3R 1 1 1 2 2 2 3 3 3 1 2 3 1 2 3 1 2 3 1 2 3 2 3 1 3 1 2 0.48 1.31 0.62 1.24 1.36 0.83 0.70 1.03 0.95 2.41 3.43 2.68 0.80 1.14 0.89 0.34 2.42 3.70 2.40 0.81 1.23 0.80 0.43 2.34 3.50 2.68 0.78 1.17 0.89 0.39
由表2可知,在紫红曲霉发酵苦荞基质过程中,各因素对γ-谷维素含量的影响依次为:接种量>发酵温度>料液比,即接种量对γ-谷维素含量影响最大,其次为发酵温度,料液比对γ-谷维素含量影响最小。优化后最佳发酵条件组合为A 2B2C2,即料液比为3∶1(g∶mL),接种量8%,发酵温度30℃。在此优化条件下发酵苦荞基质9 d后,测得发酵产物正己烷提取物中γ-谷维素含量为1.59 mg/mL,比优化前提高了44.55%。此外,测得色价为1 428.77 U/g,洛伐他汀质量浓度为132 μg/mL。表明紫红曲霉固态发酵苦荞基质不仅能够增加γ-谷维素含量,同时还能获得较高色价的红曲色素以及具有降低胆固醇[31]功能的洛伐他汀活性组分。由表3可知,料液比、接种量与发酵温度3个因素对γ-谷维素含量均有极显著影响(P<0.01)。
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
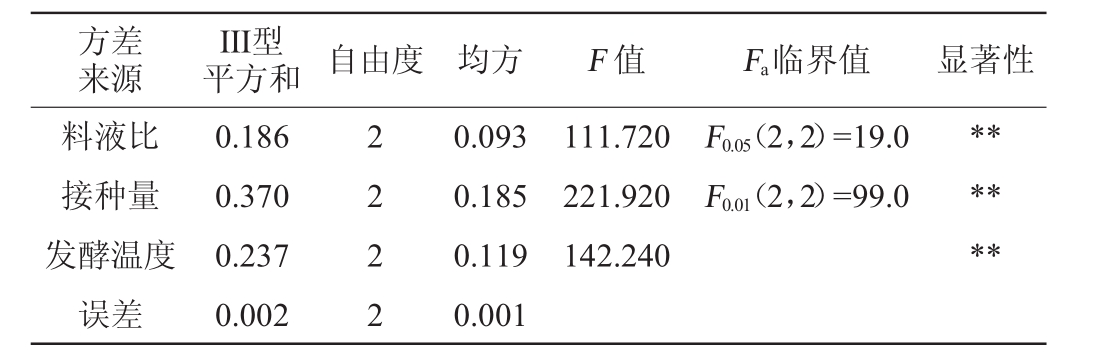
注:“**”表示对结果影响极显著(P<0.01)。
方差来源III型平方和 自由度 均方 F值 F a临界值 显著性料液比接种量发酵温度误差0.186 0.370 0.237 0.002 2 2 2 2 0.093 0.185 0.119 0.001 111.720 221.920 142.240 F0.05(2,2)=19.0 F0.01(2,2)=99.0******
3 结论
经紫红曲霉发酵后,各杂粮(薏米、苦荞、小米、燕麦)与大米正己烷提取物中γ-谷维素含量均有显著提高,其中苦荞基质最为明显,γ-谷维素含量从0.08 mg/mL增加到1.10mg/mL。以苦荞作为培养基质进行后续工艺参数优化,得到最佳发酵参数:料液比为3∶1(g∶mL),紫红曲霉接种量8%,发酵温度30℃。在此优化发酵工艺条件下发酵9d,γ-谷维素含量为1.59 mg/mL,比优化前提高了44.55%,同时测得红曲色价1 428.77 U/g,洛伐他汀质量浓度为132 μg/mL。通过生物转化实现特征性活性组分γ-谷维素的富集,不仅拓展了红曲米的研究方向,为开拓多功能性红曲产品奠定了基础,也对贵州特色杂粮的精深加工和深度开发提供了理论指导与技术支撑。
[1]OTAVIO M I,VALENTINI FF,RENATA C C,et al.Antioxidant activity of γ-oryzanol:a complex network of interactions[J].Int J Mol Sci,2016,17(8):1107.
[2]蒋维维,易金娥,谭柱良.γ-谷维素的生物活性研究进展[J].食品与发酵工业,2015,41(6):253-258.
[3]YOSHIE A,KANDAA,NAKAMURAT,et al.Comparison ofγ-oryzanol contents in crude rice bran oils from different sources by various determination methods[J].J Oleo Sci,2009,58(10):511-518.
[4]向思亭,朱利娟,赵静,等.米糠油中γ-谷维素的抗氧化作用及机理研究进展[J].中兽医医药杂志,2016,35(3):22-25.
[5]ANGELIS A,URBAIN A,HALABALAKI M,et al.One-step isolation of γ-oryzanol from rice bran oil by nonaqueous hydrostatic countercurrent chromatography[J].J Sep Sci,2015,34(18):2528-2537.
[6]MINATEL I O,HAN S I,ALDINI G,et al.Fat-soluble bioactive compo-nents in colored rice varieties[J].J Med Food,2014,17(10):1134-1141.
[7]沈鸿,熊志琴,姜绍通.谷维素对3种食用植物油的抗氧化效果研究[J].中国油脂,2017,42(1):22-25,30.
[8]SAMYOR D,DAS A B,DEKA S C.Pigmented rice a potential source of bioactive compounds:a review[J].Int J Food Sci Technol,2017,52(5):1073-1081.
[9]RUNGRATANAWANICH W,ABATE G,SERAFINI M M,et al.Characterization of the antioxidant effects of γ-oryzanol:involvement of the Nrf2 pathway[J].Oxidat Med Cell Long,2018,2018:2987249.
[10]BHASKARAGOUD G,RAJATH S,MAHENDRA V P,et al.Hypolipidemic mechanism of oryzanol components-ferulic acid and phytosterols[J].Biochem Biophys Res Commun,2016,476(2):82-89.
[11]CHISAYO K,TADASHI K,CHIGUSA S O,et al.Impact of brown ricespecific γ-oryzanol on epigenetic modulation of dopamine D2 receptors in brain striatum in high-fat-diet-induced obesity in mice[J].Diabetologia,2017,60(8):1502-1511.
[12]WANG O,LIU J,CHENG Q,et al.Effects of ferulic acid and γ-oryzanol on high-fat and high-fructose diet-induced metabolic syndrome in rats[J].Plos One,2015,10(2):1-14.
[13]孙新娟,陈金安,张洁,等.谷维素在糖尿病神经病变中的应用研究进展[J].转化医学电子杂志,2017,4(11):65-68.
[14]PANCHAL S S,PATIDAR R K,JHA A B,et al.Anti-inflammatory and antioxidative stress effects of oryzanol in glaucomatous rabbits[J].J Ophthalmol,2017,2017:1468716.
[15]ABHISHEK B J,SHITAL S P.Neuroprotection and cognitive enhancement by treatment with γ-oryzanol in sporadic Alzheimer"s disease[J].J Appl Biomed,2017,15(4):265-281.
[16]李俊红.黛力新与谷维素治疗功能性消化不良86例临床观察[J].世界最新医学信息文摘,2015,15(38):121.
[17]CRISTINA P T,MARIA A S,MARIA D H.Contribution of ferulic acid,γ-oryzanol and tocotrienols to the cardiometabolic protective effects of rice bran[J].J Funct Food,2017,32:58-71.
[18]李孝权.不同剂量谷维素在心血管神经症治疗中的疗效对比分析[J].临床医药文献杂志,2018,5(5):189.
[19]PENG Y K,HE G C,TANG D,et al.Lovastatin inhibits cancer stem cells and sensitizes to chemo-and photodynamic therapy in nasopharyngeal carcinoma[J].J Cancer,2017,8(9):1655-1664.
[20]车鑫,毛健,刘双平,等.产洛伐他汀红曲菌的筛选及中药对其固态发酵的影响[J].食品科学,2016,37(13):114-119.
[21]刘瑞菊,褚建波,陈启云.谷维素的研究进展[J].河南科技大学学报(医学版),2015,33(3):237-240.
[22]SCHMIDT C G,GONÇALVES L M,PRIETTO L,et al.Antioxidant activity and enzyme inhibition of phenolic acids from fermented rice bran with fungus Rizhopus oryzae[J].Food Chem,2014,146(3):371-377.
[23]高瑞,段钰汀,戴震,等.微生物发酵废弃生物质合成单细胞蛋白的研究现状进展[J].环境工程,2018,36(5):150-156.
[24]ZHANG X M,XU G Q,SHI J S,et al.Microbial production of L-serine from renewable feedstocks[J].Trend Biotechnol,2018,36(7):700-712.
[25]贺圣凌,曾海英,李勇,等.红曲发酵薏苡糠亲脂化合物量变规律探究[J].食品科技,2017,42(3):174-179.
[26]KELLY C M,TAIANA D S,CAROLINA C C,et al.The impact of Rhizopus oryzae cultivation on rice bran:gamma-oryzanol recovery and its antioxidant properties[J].Food Chem,2017,228:43-49.
[27]陈勉华,吉达维,马人杰,等.不同发酵基质对红曲重要代谢产物的影响[J].中国酿造,2013,32(3):22-24.
[28]曹晋宜,宋春雪.复合杂粮红曲的制备及其对老陈醋品质的影响[J].食品工程,2015(4):48-53.
[29]遇靓.红曲固态发酵薏米茶工艺及品质研究[D].贵阳:贵州大学,2016.
[30]江利香,葛锋,刘畅.红曲洛伐他汀的高产策略[J].中草药,2011,42(7):1446-1452.
[31]ISTVAN E S,DEISENHOFER J.Structural mechanism for statin inhibition of HMG-CoA reductase[J].Science,2001,292(5519):1160-1164.