地球分布着丰富的绿色资源,纤维素(cellulose)约占整个植物干质量的50%,是植物细胞壁的主要组成,所以纤维素的生产在地球上分布广泛[1-5]。纤维素酶(cellulase)是降解纤维素以产生葡萄糖的一组酶的总称。它是一种协同多组分酶系统,是一种复合酶,主要由内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶组成。
由于反刍动物主要食物来源为绿色植物,因此纤维素是反刍动物的主要能量来源。瘤胃作为反刍动物消化食道中最重要的部位,也是进行消化最重要的复胃,因此,瘤胃中的纤维素降解菌则是反刍动物对粗纤维进行消化的重要执行者[6-9]。从动物瘤胃筛选产纤维素酶菌株优点是菌株来自动物本源,因此,在之后的工业生产酶制剂和益生菌制剂更加适合动物本身,酶制剂特性更加符合动物胃肠道的消化过程,益生菌制剂更加容易在动物胃肠道定植。
响应面法(response surface methodology,RSM)在多种发酵优化方法里是一种寻找多因素系统中最佳发酵条件的统计方法,响应面法由于用拟合面的方式来完成,且更加直观和清晰。而且具有试验次数少、周期短、效率精度高等优点,因此,已被广泛应用于生化反应,发酵过程优化[10-12]。
因为西藏地区特殊的生态环境特点(海拔高、温度低和含氧量低),使西藏黄牛耐寒、耐低氧能力突出,并且瘤胃中的各类微生物产纤维素酶的能力较高。由于其地理环境和生态环境的限制,西藏地区各类产业尤其农牧业发展一直较为缓慢,而当地经济中农牧业占很大比例。因此,如何促进西藏地区农牧业发展是为当务之急。本研究从西藏黄牛瘤胃中分离出一株纤维素酶高产菌类芽孢杆菌(Paenibacillus)菌株N30,通过单因素试验和响应面设计试验优化其发酵条件,首先基于Plackett-Burman(PB)试验设计找出重要影响因子,进而通过Design Expert.V8.0.6软件中响应面Box-Behnken(BB)试验设计对响应过程变量进行数学建模及研究,进一步优化响应因子,确定最优发酵条件,为提高纤维素酶的活力,从而为该纤维素酶更深入研究及中试生产奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
类芽孢杆菌(Paenibacillus)N30:从西藏娟姗纯种繁育示范基地的4.5岁雌性黄牛瘤胃中筛选得到,保藏在辽宁省海洋微生物工程技术研究中心。
1.1.2 主要试剂
酵母粉、胰蛋白胨、羧甲基纤维素钠(carboxymethyl cellulose-Na,CMC-Na)、牛肉膏、MgSO4·7H2O、琼脂粉、氯化钠、KH2PO4、(NH4)2SO4:生物工程(上海)股份有限公司。试验所用化学试剂均为分析纯或生化试剂。
1.1.3 培养基
种子培养基:蛋白胨5 g,CMC-Na 10 g,KH2PO4 2 g,(NH4)2SO4 1 g ,MgSO4·7H2O 1 g,FeSO4·7H2O 10 mg,NaCl 3 g,MnSO4·H2O 5 mg,pH7.0,蒸馏水定容至1 000 mL。
发酵培养基:蛋白胨2 g,酵母膏1 g,CMC-Na 20 g,KH2PO4 2 g,MgSO4·7H2O 1 g,(NH4)2SO4 2 g,FeSO4·7H2O 10mg,MnSO4·H2O 5mg,NaCl 3g,蒸馏水定容至1000mL。
1.2 仪器与设备
HZP-250全温振荡培养箱:上海精宏实验设备有限公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司;UV-2102C紫外可见分光光度计:尼柯仪器科技有限公司;LDZX-40BI立式压力蒸汽灭菌器:上海申安医疗器械厂。
1.3 方法
1.3.1 种子液的制备
在无菌环境中将斜面保藏的菌株N30接种于发酵培养基中,37℃、160 r/min培养24 h作为种子液。
1.3.2 粗酶液的制备
将种子液按照2%(V/V)的接种量接种到液体发酵培养基中,并在37℃、160 r/min条件下进行培养,将发酵液在4℃、4000r/min离心15min,弃去沉淀,收集上清作为粗酶液。
1.3.3 酶活测定方法
(1)葡萄糖标准曲线的绘制:取7支试管,分别加入2.0mg/mL葡萄糖标准溶液0、0.2mL、0.4mL、0.6 mL、0.8mL、1.0 mL、1.2 mL和蒸馏水2.0 mL、1.8 mL、1.6 mL、1.4 mL、1.2 mL、1.1 mL、0.8 mL,向各试管中加入DNS 2.0 mL后在100℃水浴中加热2 min以显色,加热后即刻用流水迅速冷却,并用蒸馏水补充至15 mL。混合后,在波长540 nm处测定OD540nm值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线。
(2)纤维素酶活力的测定:制备A和B管并加入1.8 mL 1%羧甲基纤维素钠(用pH 4.8、0.2 mol/L乙酸缓冲液配制)。使用A管作为测定管,添加0.2mL酶溶液,B管作为空管。将A和B管放于50℃恒温水浴中60 min。结束后取出,快速加入2mL DNS溶液至管中,然后加入0.2 mL酶溶液至B管中,再水溶10 min,快速用流水冷却,加入蒸馏水补充使用B管至零点。用分光光度计在波长540nm条件下测量OD540nm值。纤维素酶活力定义:1 min水解底物生成1 μmol葡萄糖所需的酶量为1个活力单位(U)。
1.3.4 菌株N30产纤维素酶发酵条件优化单因素试验
碳源、氮源优化:分别在发酵培养基中加入CMC-Na、麸皮、秸秆粉、葡萄糖及蔗糖作为碳源,添加量为2%;分别在发酵培养基中加入蛋白胨、酵母粉、牛肉膏、(NH4)2SO4及尿素作为氮源,添加量为0.7%。在37℃、160 r/min条件下培养72 h,按照酶活测定方法测定酶活,考察碳源、氮源种类对菌株N30产纤维素酶的影响。每个处理做3个平行。
麸皮添加量为1.0%~3.0%(梯度为0.5%)、蛋白胨添加量为0.3%~0.7%(梯度为0.1%)、培养基初始pH值为5.0~9.0(梯度为1)、发酵温度为31~43℃(梯度为3℃)、接种量为0.5%~2.5%(梯度为0.5%)、转速为130~170 r/min(梯度为10 r/min)、装液量为75~175 mL/250 mL(梯度为25 mL/250 mL)、种龄为16~48 h(梯度为8 h)、KH2PO4添加量为0.1%~0.5%(梯度为0.1%)。在37℃、160 r/min条件下培养72 h,按照酶活测定方法测定酶活。每个处理做3个平行。
1.3.5 Plackett-Burman设计
在单因素试验的基础上,选取9个影响因子作为研究目标,以纤维素酶酶活(Y)为响应值,进行Plackett-Burman(PB)试验设计,PB试验设计的因素与水平见表1。
表1 PB试验设计因素与水平
Table 1 Factors and levels of PB experiments design
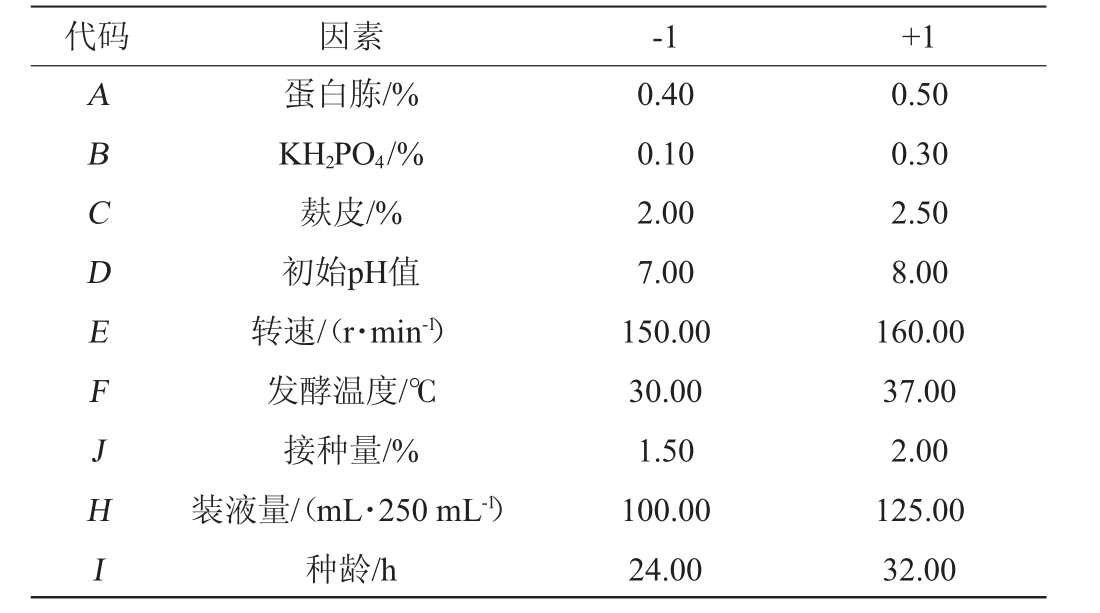
代码 因素-1 +1 ABCDEFJHI蛋白胨/%KH2PO4/%麸皮/%初始pH值转速/(r·min-1)发酵温度/℃接种量/%装液量/(mL·250 mL-1)种龄/h 0.40 0.10 2.00 7.00 150.00 30.00 1.50 100.00 24.00 0.50 0.30 2.50 8.00 160.00 37.00 2.00 125.00 32.00
1.3.6 最陡爬坡试验设计
通过Plackett-Burman试验结果中各个显著影响因素效应的大小来设定步长及变化方向,寻找峰值,迅速接近最佳值区域。
1.3.7 中心组合试验设计
通过最佳爬坡试验结果,将酶活最高的一组数值作为中心组合试验中心点,使用Minitab15软件进行Box-Behnken试验设计,运用响应面分析法对产酶条件参数进行优化分析。使用Minitab 15软件分析得到最优结果,最后对预测值进行验证。每个处理做3个平行。Box-Behnken试验设计因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design
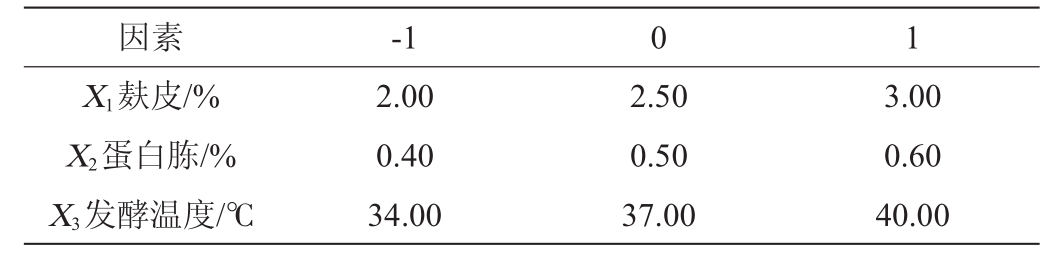
因素-1 0 1 X 1麸皮/%X2蛋白胨/%X3发酵温度/℃2.00 0.40 34.00 2.50 0.50 37.00 3.00 0.60 40.00
2 结果与分析
2.1 菌株N30产纤维素酶发酵条件优化单因素试验
2.1.1 碳源的确定
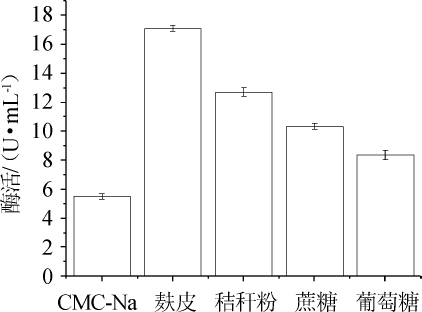
图1 不同碳源对纤维素酶酶活的影响
Fig.1 Effects of different carbon sources on cellulase activity
由图1可知,当麸皮为唯一碳源时,纤维素酶酶活最高达17.1 U/mL,秸秆粉次之。因此,菌株N30发酵产纤维素酶的最佳碳源为麸皮。
2.1.2 麸皮添加量的确定

图2 麸皮添加量对纤维素酶酶活的影响
Fig.2 Effects of bran addition on cellulase activity
由图2可知,当麸皮添加量为1.0%~2.5%时纤维素酶酶活逐渐升高,在麸皮添加量为2.5%时最大,为19.6 U/mL,麸皮添加量>2.5%之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳麸皮添加量为2.5%。
2.1.3 氮源的确定
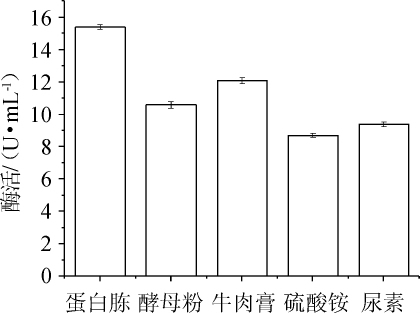
图3 不同氮源对纤维素酶酶活的影响
Fig.3 Effects of different nitrogen sources on cellulase activity
由图3可知,当蛋白胨作为唯一氮源时,纤维素酶酶活最大,为15.4 U/mL,牛肉膏、酵母粉次之,当硫酸铵、尿素为唯一氮源时,纤维素酶酶活较低,可见菌株主要利用有机氮源。因此,菌株N30发酵产纤维素酶的最佳氮源为蛋白胨。
2.1.4 蛋白胨添加量的确定
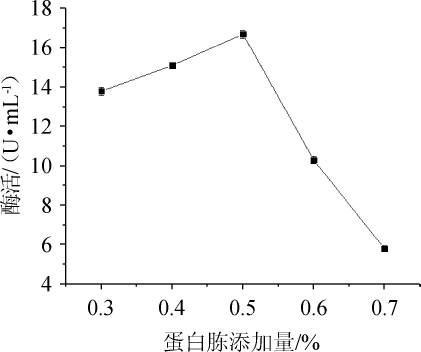
图4 蛋白胨添加量对纤维素酶活的影响
Fig.4 Effect of peptone addition on cellulase activity
由图4可知,当蛋白胨添加量为0.3%~0.5%时,酶活逐渐增大,酶活在添加量为0.5%时达到最大,为16.7 U/mL,当蛋白胨添加量>0.5%之后,酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳蛋白胨添加量为0.5%。
2.1.5 初始pH值的确定
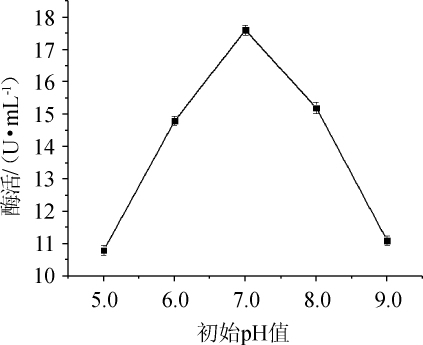
图5 培养基初始pH对纤维素酶活的影响
Fig.5 Effect of initial pH of medium on cellulase activity
由图5可知,当初始pH值为5.0~7.0时酶活逐渐增大,在pH值为7.0时酶活最大,为17.6 U/mL,当初始pH值>7.0时酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳初始pH值为7.0。
2.1.6 发酵温度的确定
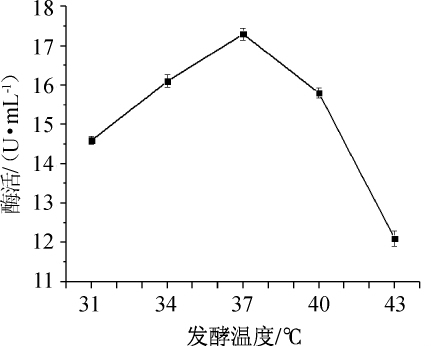
图6 发酵温度对纤维素酶酶活的影响
Fig.6 Effect of fermentation temperature on cellulase activity
由图6可知,当发酵温度为31~37℃时,纤维素酶酶活随发酵温度增加逐渐增大,当发酵温度为37℃时,纤维素酶酶活最大,为17.3U/mL,当发酵温度>37℃之后,纤维素酶酶活降低。因此,菌株N30发酵产纤维素酶最佳发酵温度为37℃。
2.1.7 接种量的确定
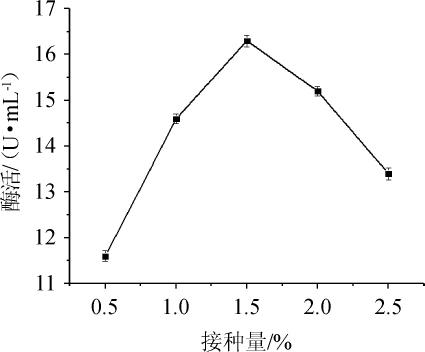
图7 接种量对纤维素酶酶活的影响
Fig.7 Effect of inoculum on cellulase activity
由图7可知,当接种量为0.5%~1.5%时,纤维素酶酶活逐渐增大,当接种量为1.5%纤维素酶酶活最大,为16.3 U/mL,当接种量>1.5%之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳接种量为1.5%。
2.1.8 转速的确定
由图8可知,当转速为130~150 r/min时,纤维素酶酶活随转速的升高逐渐升高,当转速为150 r/min时,纤维素酶酶活最大,为16.6 U/mL,当转速>150 r/min之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳转速为150 r/min。
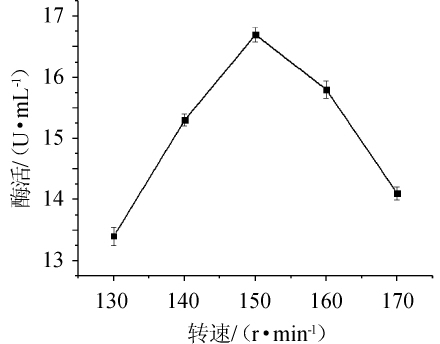
图8 转速对纤维素酶酶活的影响
Fig.8 Effect of rotational speed on cellulase activity
2.1.9 装液量的确定
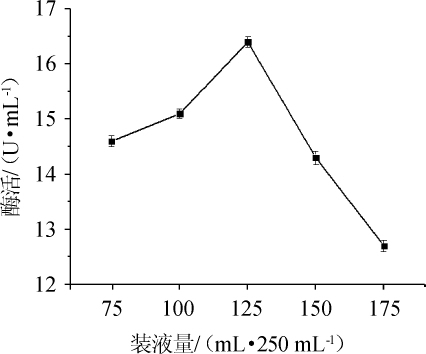
图9 装液量对纤维素酶酶活的影响
Fig.9 Effect of liquid loading volume on cellulase activity
由图9可知,当装液量为(75~125)mL/250mL时,纤维素酶酶活逐渐增加,当装液量为125 mL/250 mL时,纤维素酶酶活最大为16.4 U/mL,当装液量>125 mL/250 mL之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳装液量为125mL/250mL。
2.1.10 种龄的确定
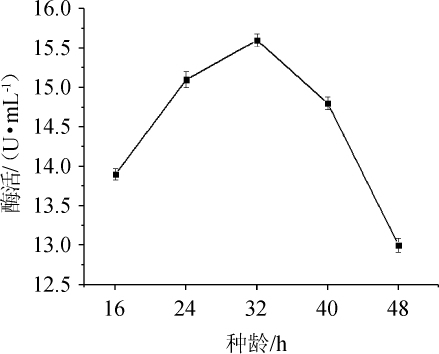
图10 种龄对纤维素酶酶活的影响
Fig.10 Effect of seed age on cellulase activity
由图10可知,当种龄为16~32 h时,纤维素酶酶活逐渐增大,当种龄为32 h时,纤维素酶酶活最大,为15.6 U/mL,当种龄>32h之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳种龄为32 h。
2.1.11 KH2PO4添加量的确定
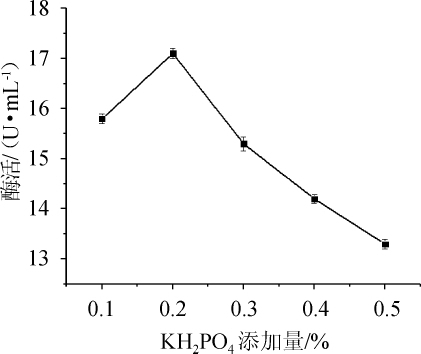
图11 KH2PO4添加量对纤维素酶酶活的影响
Fig.11 Effect of KH2PO4 addition on cellulase activity
由图11可知,当KH2PO4添加量为0.1%~0.2%时,纤维素酶酶活逐渐增加,当KH2PO4添加量为0.2%时,纤维素酶酶活最大,为17.1 U/mL,当KH2PO4添加量>0.2%之后,纤维素酶酶活逐渐降低。因此,菌株N30发酵产纤维素酶最佳KH2PO4添加量为0.2%。
2.2 Plackett-Burman设计筛选显著因子[13-16]
在单因素试验的前提上,设计Plackett-Burman(N=12)试验,对影响纤维素酶发酵中9个因素的显著性进行研究。试验的设计及结果见表3,利用Minitab15软件进行主效应分析,结果见表4。
表3 Plackett-Burman试验结果
Table 3 Results of Plackett-Burman experiments
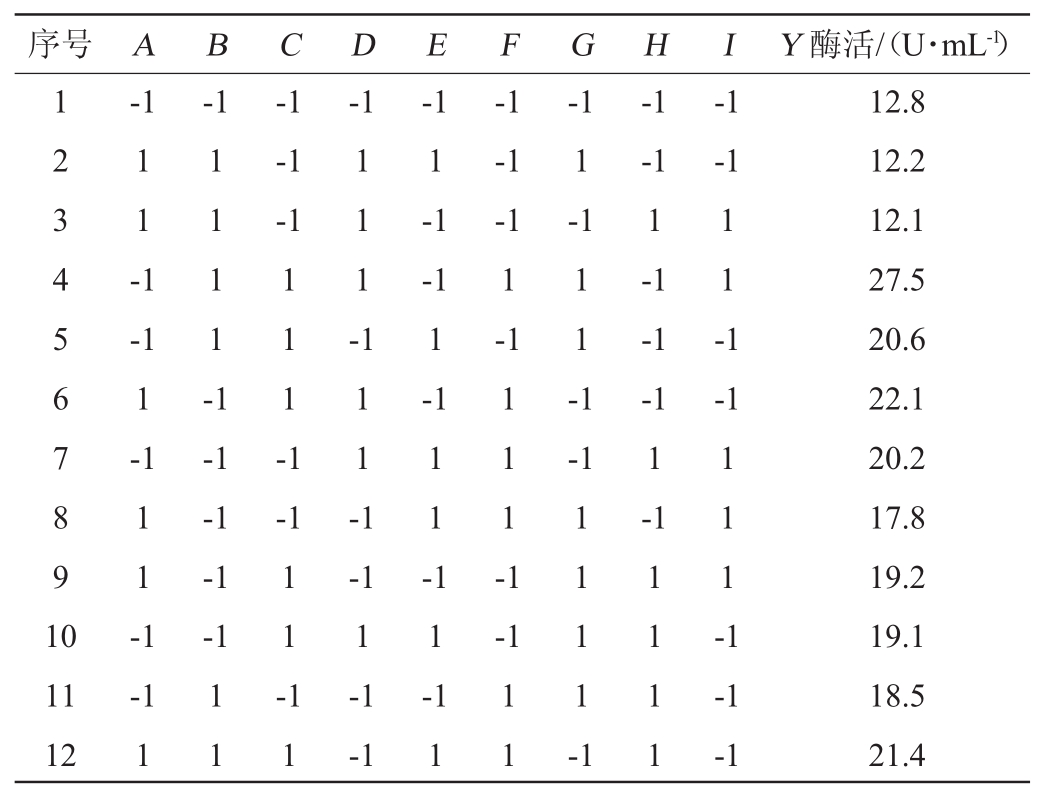
序号A B C D E F G H I Y酶活/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0-1-1-1 1 1 -1-1-1-1-1 1-1-1-1-1 1-1 1 1 1 1 -1 1 1 1 -1 1 1 1 --1 1-1-1 1-1-1-1-1 1-1 1 1 -1 1 1 -1-1 1 1 -1-1-1-1-1 1 1 1 -1 1 1 -1 1 1 -1-1-1-1-1 1-1-1-1 1-1 1 1 --1 1-1-1 1 1 --1 1 1 1 -1 11 12-1 1 1 1 1 1 1 1 1 1 1 1 1 1 -1 1 1 1 1-1-1 12.8 12.2 12.1 27.5 20.6 22.1 20.2 17.8 19.2 19.1 18.5 21.4
由表4可知,麸皮、发酵温度、蛋白胨的P值分别为0.004、0.005、0.026,由于这3个因素的P值均<0.05,所以这3个因素对试验结果的影响均>95%,达到显著水平,在所选因素中对试验结果影响最大,其中麸皮、发酵温度具有正效应,蛋白胨具有负效应。因此,选麸皮添加量、发酵温度、蛋白胨添加量进行最陡爬坡试验。
表4 Plackett-Burman试验设计的各因素水平及显著性分析
Table 4 Factors,levels and significance analysis of Plackett-Burman experiments design

代码 因素 t值 P值 重要性水平-1 +1 ABCDEFGHI蛋白胨/%KH2PO4/%麸皮/%初始pH值转速/(r·min-1)发酵温度/℃接种量/%装液量/(mL·250mL-1)种龄/h 0.40 0.10 2.00 7.00 15.00 34.00 1.50 100.00 24.00 0.50 0.30 2.5 8.00 16.00 40.00 2.00 125.00 32.00-6.14 0.70 15.87 1.23-0.35 13.77 2.28-1.23 4.82 0.026 0.556 0.004 0.344 0.759 0.005 0.150 0.344 0.040 3 7 1 6 8 2 5 6 4
2.3 最陡爬坡试验
最陡爬坡试验是为了确定显著影响因素的取值逼近中心点以及提高纤维素酶的产量,麸皮添加量(X 1)、蛋白胨添加量(X 2)及发酵温度(X 3)这3个因素的变化方向和步长的试验设计及结果见表5。由表5可知,3个显著影响因素的中心点在第2组试验附近,因此,确定以第2组的数据作为响应面试验的中心点,即麸皮添加量(X1)、蛋白胨添加量(X 2)及发酵温度(X 3)分别为2.50%,0.50%和37℃。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent experiments
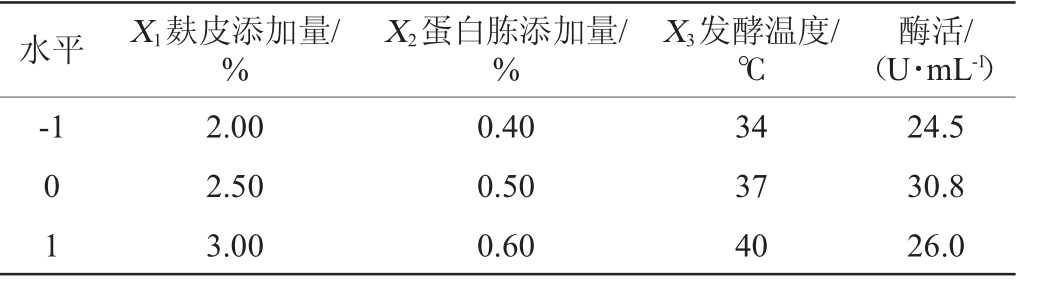
水平 X1麸皮添加量/%酶活/(U·mL-1)-1 X 2蛋白胨添加量/%X3发酵温度/℃0 1 2.00 2.50 3.00 0.40 0.50 0.60 34 37 40 24.5 30.8 26.0
2.4 响应面试验设计
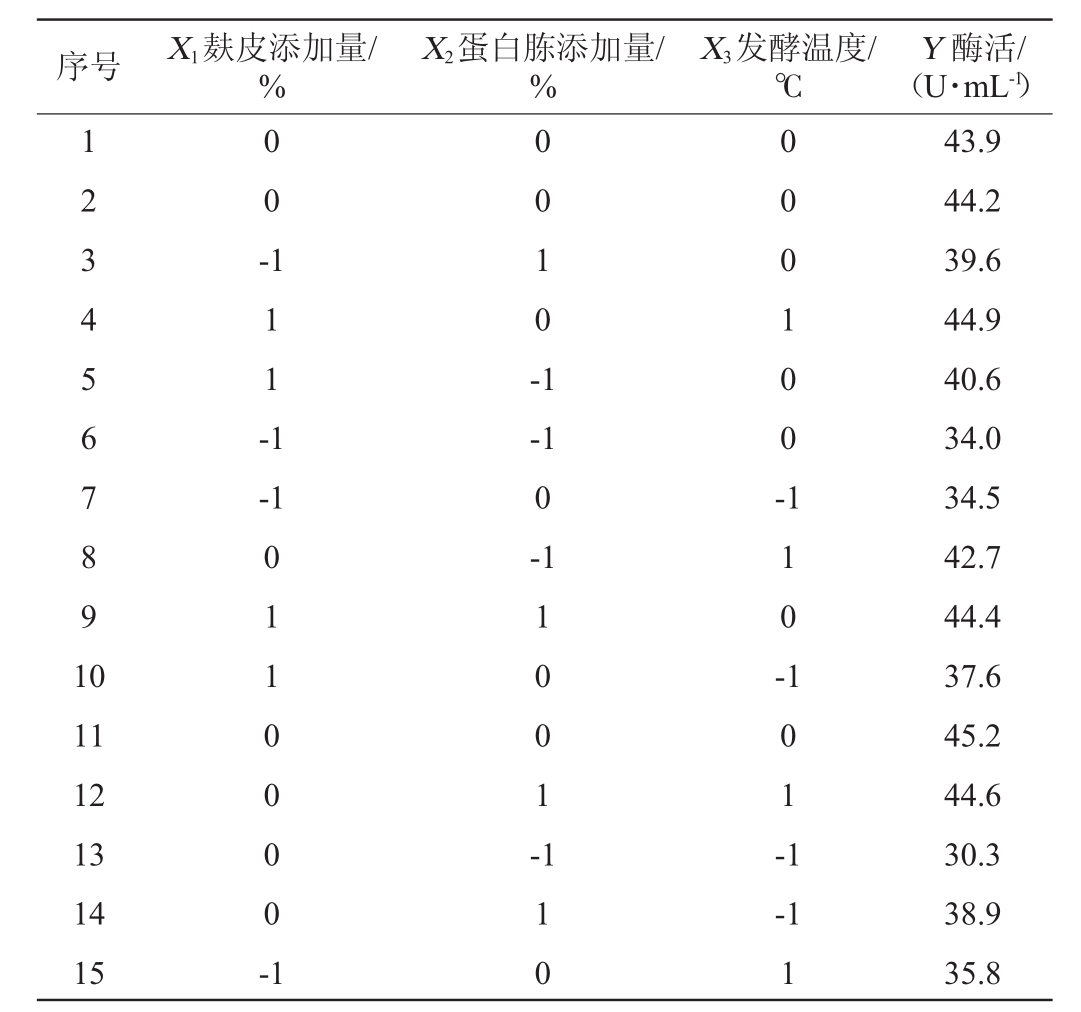
利用上述Plackett-Burman试验结果,在PB试验和最陡爬坡试验确定的3因素3水平的基础上,以纤维素酶活(Y)为响应值,响应面试验设计及结果见表6。
运用Minitab15软件对表6试验数据进行回归模型方差分析,结果见表7。对各因素进行二次多项式回归拟合后,得到回归方程如下:
由表7可知,该回归模型的影响达到极显著水平(P<0.01),其自变量X1、X2、X3、X32对响应值影响极显著(P<0.01),二次项X12、X 22对结果影响显著(P<0.05),其他项影响均不显著(P>0.05)。失拟项表示所用模型与试验的拟合程度,该设计失拟项P值为0.110>0.05不显著,因而无失拟因素存在。回归方程的决定系数R2=0.960 8>0.9,校正决定系数 为0.931 7>0.9,表明响应值变化有93.17%来自所选变量,说明模型拟合度较好,该回归方程可用于代替试验真实点对试验结果进行初步分析和预测[17-20]。
为0.931 7>0.9,表明响应值变化有93.17%来自所选变量,说明模型拟合度较好,该回归方程可用于代替试验真实点对试验结果进行初步分析和预测[17-20]。
表6 Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments
)
表7 回归模型方差分析
Table 7 Variance analysis of regression model
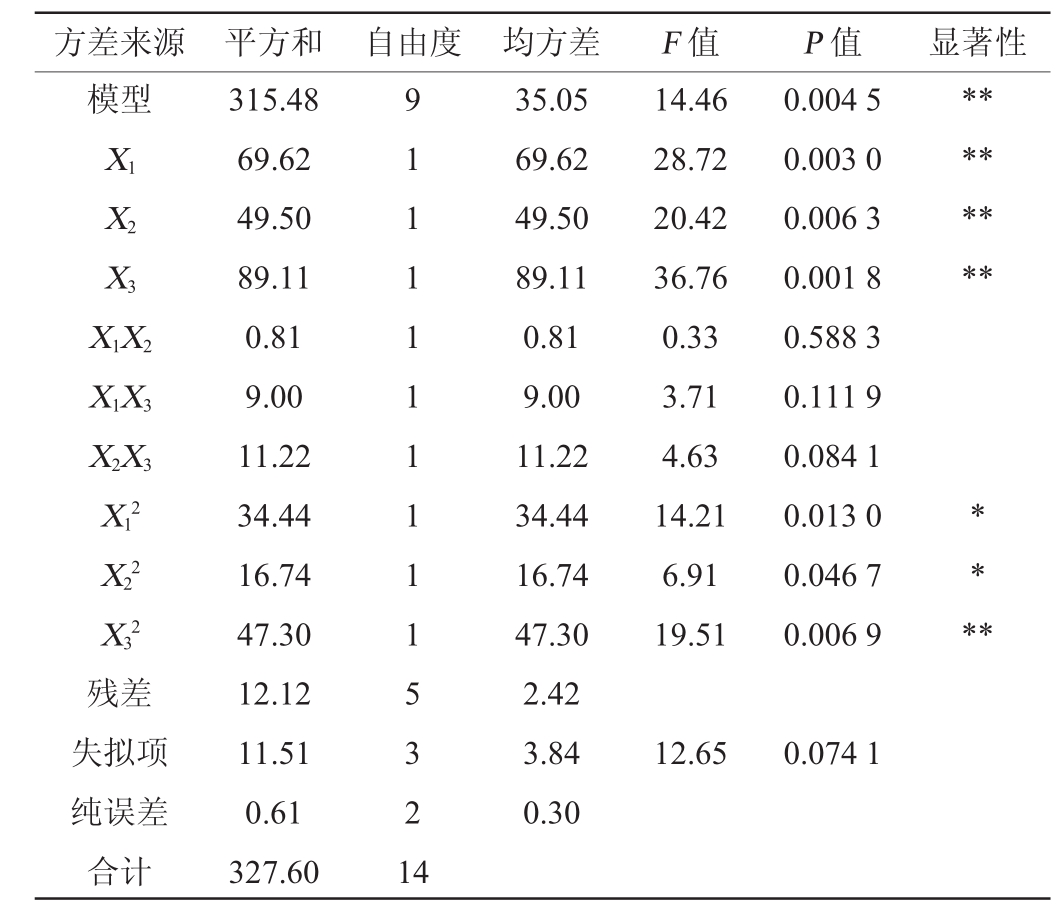
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方差 F值 P值 显著性模型X1X2X3********X 1X2 X 1X3 X 2X3 X12 X22 X32 14.46 28.72 20.42 36.76 0.33 3.71 4.63 14.21 6.91 19.51 0.004 5 0.003 0 0.006 3 0.001 8 0.588 3 0.111 9 0.084 1 0.013 0 0.046 7 0.006 9* * **残差失拟项纯误差合计315.48 69.62 49.50 89.11 0.81 9.00 11.22 34.44 16.74 47.30 12.12 11.51 0.61 327.60 9 1 1 1 1 1 1 1 1 1 5 3 2 1 4 35.05 69.62 49.50 89.11 0.81 9.00 11.22 34.44 16.74 47.30 2.42 3.84 0.30 12.65 0.074 1
经Minitab15分析获得酶活预测值最大时对应的发酵条件为麸皮添加量2.81%,蛋白胨添加量0.53%,发酵温度38.67℃,预测最大酶活为46.7U/mL。为了便于实际操作,将发酵条件修改为麸皮添加量2.8%,蛋白胨添加量0.5%,发酵温度38℃,验证试验做3次平行,平均酶活为42.5 U/mL,与理论值符合,证明采用响应面法优化得到的最佳发酵条件有效可行。优化后酶活是优化前(12.1 U/mL)的3.5倍。
3 结论
本实验对类芽孢杆菌N30产纤维素酶发酵条件进行优化。在单因素试验前提上,采用Plackett-Burman试验得出麸皮添加量、蛋白胨添加量、发酵温度是最重要的3个影响菌株N30产纤维素酶的因素,利用Box-Behnken模型对类芽孢杆菌N30发酵生产纤维素酶的产酶条件进行响应面优化,进行回归模型方差分析后证明模型拟合度良好。单因素优化结果为麸皮添加量2.5%、蛋白胨添加量0.5%、初始pH7.0、发酵温度37℃、接种量1.5%、转速150 r/min、装液量125 mL/250 mL、种龄32 h、KH2PO4 0.2%。响应面优化后发酵条件为麸皮添加量2.8%,蛋白添加量胨0.5%,发酵温度38℃。在此优化条件下酶活为42.5 U/mL,是优化前酶活(12.1U/mL)的3.5倍。
菌株N30来自于西藏黄牛瘤胃,与其他从西藏地区动物胃肠道中筛选得到的产纤维素酶菌株相比酶活较高[21-22],并且与从其他来源菌株所产纤维素酶相比更加适应当地畜牧业,酶制剂特性更加符合动物胃肠道的消化过程,在之后用作生产酶制剂的潜力更大。因此,菌株N30的发酵条件优化研究可为后续发酵放大至工业生产提供基础与依据。
[1]郭璟.分离自青海湖的三株耐盐菌及嗜盐菌的鉴定及纤维素降解能力的研究[J].青海畜牧兽医杂志,2015,45(5):23-26.
[2]KUHAD R C,DESWAL D,SHARMA S,et al.Revisiting cellulase production and redefining current strategies based on major challenges[J].Renew Sustain Energy Rev,2016,55:249-272.
[3]RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al.The path forward for biofuels and biomaterials[J].Science,2006,311(5760):484-489.
[4]王盼星,陶施淼,薛藩.纤维素降解菌研究进展[J].绿色科技,2018(12):161-163.
[5]林鑫,武国庆.纤维素乙醇产业进展[J].当代化工,2015,44(8):2028-2031,2035.
[6]曹阳春,杨红建,沈博通.高产纤维降解酶牦牛瘤胃厌氧真菌分离株的筛选与鉴定[J].中国农业大学学报,2010,15(3):70-74.
[7]刘锁珠,李龙,付冠华,等.藏猪源高产纤维素酶菌株的筛选及鉴定[J].西北农林科技大学学报(自然科学版),2017,45(3):43-50.
[8]赵梦迪,邸凌峰,唐泽宇,等.单宁与饲用纤维素酶对湖羊瘤胃微生物菌群的影响[J].中国畜牧兽医,2019,46(1):112-122.
[9]王文丹,唐新仁,吴天佑,等.纤维素酶在奶牛生产上的应用[J].畜牧与饲料科学,2017,38(12):34-37.
[10]李勇昊,周长海,丁雷,等.发酵培养基优化策略[J].北京联合大学学报(自然科学版),2011,25(2):53-59.
[11]张广臣,雷虹,何欣,等.微生物发酵培养基优化中的现代数学统计学方法[J].食品与发酵工业,2010,36(5):110-113.
[12]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):894-903.
[13]姜春宇,张媱,孙燕飞,等.产低温蛋白酶酵母菌株的筛选及发酵培养基优化[J].中国酿造,2018,37(11):45-50.
[14]齐西珍,王利强,孟鹏,等.利用响应面法优化α-糖苷酶抑制剂发酵培养基[J].微生物学通报,2012,39(2):203-210.
[15]袁慎亮,邢德明,窦少华,等.高产纤溶酶菌株CNY16发酵条件优化及其酶学特性初步研究[J].微生物学通报,2014,41(8):1621-1628.
[16]王春雨,迟乃玉,张庆芳,等.产低温脂肪酶菌株CZW001发酵培养基优化研究[J].微生物学通报,2013,40(9):1541-1549.
[17]王瑶,李琪,李平兰.响应面法优化植物乳杆菌LPL-1产细菌素发酵条件及细菌素理化性质分析[J].食品科学,2018,39(22):101-109.
[18]蒋彪,王常高,杜馨,等.响应面法优化芽孢杆菌CJPE209产角蛋白酶发酵培养基的研究[J].中国酿造,2017,36(5):76-80.
[19]杨梦晨,户红通,刘子强,等.响应面分析优化L-色氨酸清液发酵培养基[J].生物资源,2017,39(6):464-471.
[20]周新尚,逄飞,窦少华,等.海洋生淀粉酶菌株发酵条件响应面优化[J].中国酿造,2017,36(7):80-84.
[21]何佳佳,关琳燕,刘小舟,等.一株阿里地区产纤维素酶菌株的筛选与鉴定[J].中国酿造,2016,35(11):64-68.
[22]李君风,原现军,董志浩,等.西藏地区牦牛瘤胃中兼性厌氧纤维素降解菌的分离鉴定[J].草业学报,2017,26(6):176-184.