细菌纤维素是由某些微生物合成的一种多糖类高分子[1],其三维网状结构与植物纤维素的三维网状结构基本相同,都属于天然纤维素。但细菌纤维素的纯度比植物纤维素的纯度大,且合成效率也比植物纤维素的合成效率高,故细菌纤维素有植物纤维素无法比拟的特性[2-3]。在国内,对细菌纤维素的研究时间较短,研究人员已经认识到其蕴藏的发展前景和巨大的商机[4-5]。
工业化生产纤维素的菌株必须满足纤维素产量高、生产成本低、菌体生长速度快、菌体传代培养后遗传性状稳定等条件[6]。目前,能够应用于工业化生产的菌株只有醋酸菌属(Acetobacter)中的某些菌株[7]。醋酸菌属中的木醋杆菌(Acetobacter xylinum)是细菌纤维素工业化生产中使用的典型菌种,也是细菌纤维素合成机理、形貌特征及结构研究的典型菌株[8-9]。当培养菌株的环境条件变化时,需要对优良菌株的培养基和培养条件进行优化,使菌种在短时间内的群体遗传过程占优势并具有较高的细菌纤维素生产能力[10-11]。根据菌种的生理特性,选择合适的培养条件培养得到代谢旺盛的种子液,不仅可有效缩短发酵生产周期,而且可提高设备利用率[12]。
目前,基于Plackeet-Burman设计法的响应面分析法被越来越多的应用在细菌纤维素发酵培养基的优化上[13-14],但是应用于细菌纤维素种子液扩大培养条件优化研究还鲜有报道。因此,本试验以木醋杆菌NUST4.2为研究对象,OD600 nm值为响应值,采用Plackett-Burman设计法、最陡爬坡路径法和响应面分析法相结合对木醋杆菌NUST4.2种子扩大培养条件进行优化[15-17],为工业化生产细菌纤维素提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
木醋杆菌(Acetobacter xylinum)NUST4.2:由本实验室从残次水果中筛选出产纤维素的野生菌,对其进行紫外诱变改良获得,并4℃保藏于本实验室。
1.1.2 试剂
纤维素酶(10 000 U/g):阿拉丁化学试剂有限公司;葡萄糖、柠檬酸、硫酸镁:国药集团化学试剂有限公司;蔗糖:上海西王糖淀粉有限公司;磷酸二氢钾:上海凌峰化学试剂有限公司;蛋白胨:上海博维生物科技有限公司;酵母浸粉、琼脂粉:北京奥博星生物技术有限责任公司。以上试剂均为生化试剂或分析纯。
1.1.3 培养基
斜面培养基:葡萄糖20 g/L,蔗糖10 g/L,硫酸镁0.4 g/L,磷酸二氢钾2.5 g/L,柠檬酸1.1 g/L,蛋白胨10 g/L,酵母浸粉1.0 g/L,琼脂粉18 g/L,pH值6.0,用去离子水配制。121℃灭菌30 min。
种子培养基:葡萄糖20 g/L,硫酸镁0.4 g/L,磷酸二氢钾2.5 g/L,柠檬酸1.1 g/L,蛋白胨10 g/L,酵母浸粉1.0 g/L,自然pH,用去离子水配制。121℃灭菌30 min。
1.2 仪器与设备
YXQ-LS-75S11立式压力蒸汽灭菌器:上海博迅实业有限公司医疗设备厂;QHZ-98A全温度振荡培养箱:太仓市华美生化仪器厂;FZ-D20L机械搅拌种子罐:江苏丰泽生物工程设备制造有限公司;UV-1100可见-紫外分光光度计:上海美谱达仪器有限公司。
1.3 试验方法
1.3.1 木醋杆菌NUST4.2种子扩大培养
挑取一环活化的斜面菌种至种子培养基中,30℃、150 r/min条件下振荡培养24 h,然后以10%(V/V)的接种量将种子液转移至20 L机械搅拌种子罐中扩大培养,30℃动态培养36 h,取样测定菌体密度(OD600nm值)。
1.3.2 木醋杆菌NUST4.2种子扩大培养条件优化
Plackett-Burman(PB)试验:Plackett-Burman试验是一种近饱和两水平试验设计方法,能以最少的试验次数对多种因素中的主效应进行估计,可以快速有效地从众多待考察的因素中筛选出关键的影响因素,为进一步研究提供依据[14]。因此,以菌体OD600nm值(Y)为响应值,选取对木醋杆菌NUST4.2种子扩大培养影响的装液量(A)、初始pH值(B)、搅拌转速(D)、消泡剂用量(E)、罐压(G)和通气量(H)6个因素,采用N=12的试验设计进行筛选优化,每个因素取2水平,分别设为-1和1,C和F为空白项。PB试验因素与水平见表1。
最陡爬坡法试验:采取最陡爬坡试验法寻找响应值最大时的因素组合,以最大值组合作为中心组合设计的中心点进行响应面优化试验。
中心组合设计(central compositedesign,CCD):CCD是国际上常用的一种响应面法,能够用有限的试验次数对影响生物生长代谢过程的主要因素及其交互作用进行有效评价,并且能够优化各因子[18]。在PB试验和最陡爬坡试验的基础上,依据中心组合设计原理设计响应面分析试验,对拟合数学模型和方差进行分析,通过各因素及其交互作用对微生物生长的影响进行评价,得到响应值最大时的最优条件。
表1 Plackett-Burman试验设计的因素与水平
Table 1 Factors and levels of Plackett-Burman experimental design
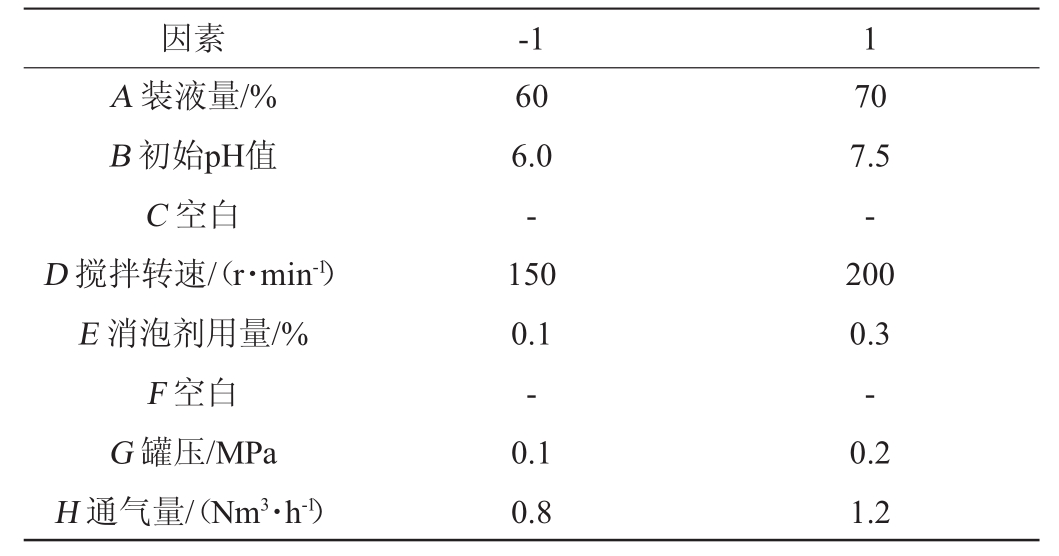
因素 -1 1 A装液量/%B初始pH值C空白D搅拌转速/(r·min-1)E消泡剂用量/%F空白G罐压/MPa H通气量/(Nm3·h-1)60 6.0-150 0.1-0.1 0.8 70 7.5-200 0.3-0.2 1.2
验证试验:利用优化后的培养条件进行发酵验证试验,重复3次,取平均值。
1.3.3 测定方法
菌体密度的测定:比浊法测定[18-19]。取纤维素酶2 g置于100 mL 0.1 mol/L醋酸钾-醋酸缓冲溶液中进行活化。取菌液10 mL置于10 mL纤维素酶溶液中,在50℃、pH 5.0条件下充分水解2 h,稀释20倍后,于波长600 nm处测定吸光度值(OD600nm)。
2 结果与分析
2.1 菌体浓度与OD600nm值的线性关系
通过线性拟合得到菌体浓度(x)与OD600nm值(y)的线性关系方程式为y=1.098x+0.022 7,其相关性系数R2=0.996 8。因此,采用种子液的OD600nm值来表示其生长情况具有较高的可靠性。
2.2 木醋杆菌NUST4.2种子扩大培养条件优化响应面试验
2.2.1 Plackett-Burman试验结果与分析
Plackett-Burman试验设计与结果见表2,方差分析结果见表3。
表2 Plackett-Burman试验设计与结果
Table 2 Design and results of Plackett-Burman experiments
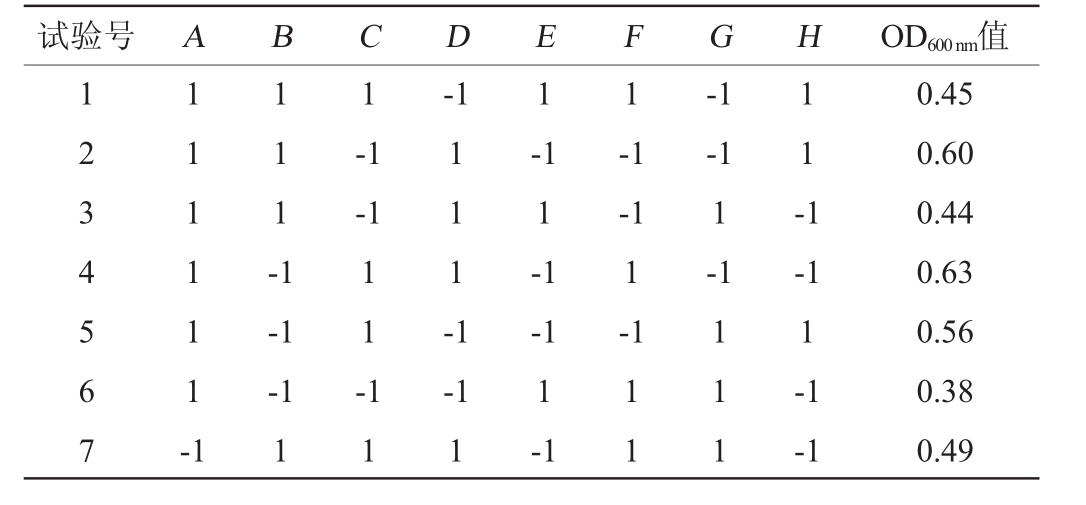
试验号 A B C D E F G H OD600nm值1 2 3 4 5 6 7 1 1 1 1 1 1 -1 1 1 1 -1 1-1 1 1-1-1-1-1 1-1 1 1 -1-1-1 1 1 1 -1 1 1 -1-1-1 1-1 1 1-1 1-1 1-1-1 1-1 1 1 1 1 1-1 1-1-1 0.45 0.60 0.44 0.63 0.56 0.38 0.49
续表
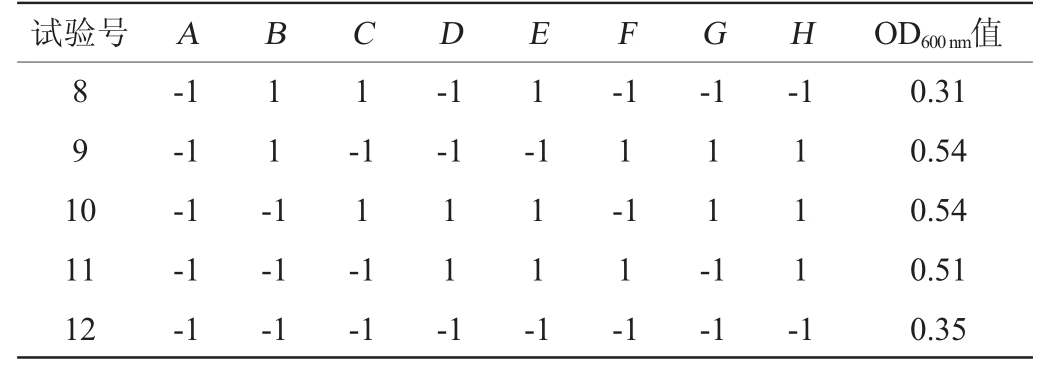
试验号 A B C D E F G H OD600nm值8 9 1 0 1 1 -1 1-1-1 1-1-1-1-1-1-1-1 11 12-1-1-1 1-1-1-1 1 1 -1 1 1 -1-1 1-1 1-1 1 1 -1-1 1 1 1 -1 0.31 0.54 0.54 0.51 0.35
表3 Plackett-Burman试验结果方差分析
Table 3 Variance analysis of Plackett-Burman experiments results
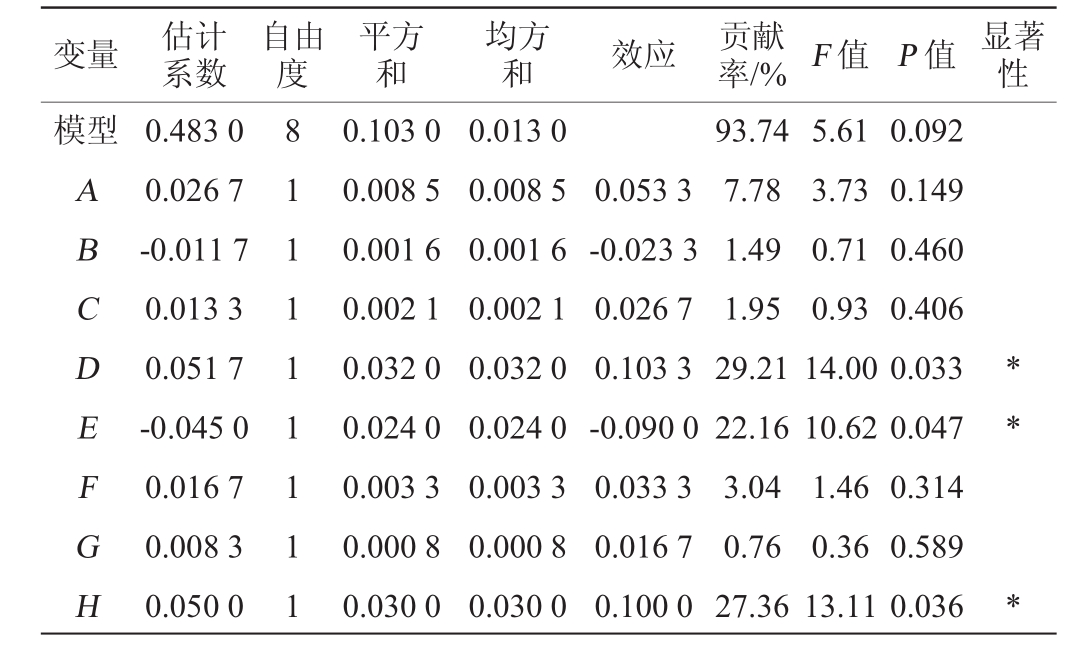
注:“*”表示对结果影响显著(P<0.05)。
变量 估计系数自由度平方和均方和效应贡献率/%F值P值显著性模型ABCDEFGH 0.483 0 0.026 7-0.011 7 0.013 3 0.051 7-0.045 0 0.016 7 0.008 3 0.050 0 8 1 1 1 1 1 1 1 1 0.103 0 0.008 5 0.001 6 0.002 1 0.032 0 0.024 0 0.003 3 0.000 8 0.030 0 0.013 0 0.008 5 0.001 6 0.002 1 0.032 0 0.024 0 0.003 3 0.000 8 0.030 0 0.053 3-0.023 3 0.026 7 0.103 3-0.090 0 0.033 3 0.016 7 0.100 0 93.74 7.78 1.49 1.95 29.21 22.16 3.04 0.76 27.36 5.61 3.73 0.71 0.93 14.00 10.62 1.46 0.36 13.11 0.092 0.149 0.460 0.406 0.033 0.047 0.314 0.589 0.036* * *
由表3可知,在6个对木醋杆菌NUST4.2 OD600nm值有影响的因素中有3个显著性因素,分别为D、E和H,即搅拌转速、消泡剂用量和通气量,影响主次顺序为D>H>E,其中搅拌转速和通气量对木醋杆菌NUST4.2 OD600nm值的影响呈现正效应,而消泡剂用量对木醋杆菌NUST4.2 OD600nm值的影响呈现负效应,即提高搅拌转速、增大通气量并减少消泡剂用量有利于提高木醋杆菌NUST4.2种子液的菌体浓度,确定3种显著因素后进行最陡爬坡试验。
2.2.2 最陡爬坡试验结果与分析
在PB试验的基础上,确定显著影响因素(搅拌转速、消泡剂用量和通气量)的爬坡方向和步长,最陡爬坡试验设计及结果见表4。
表4 最陡爬坡试验设计及结果
Table 4 Design and results of the steepest ascent experiments
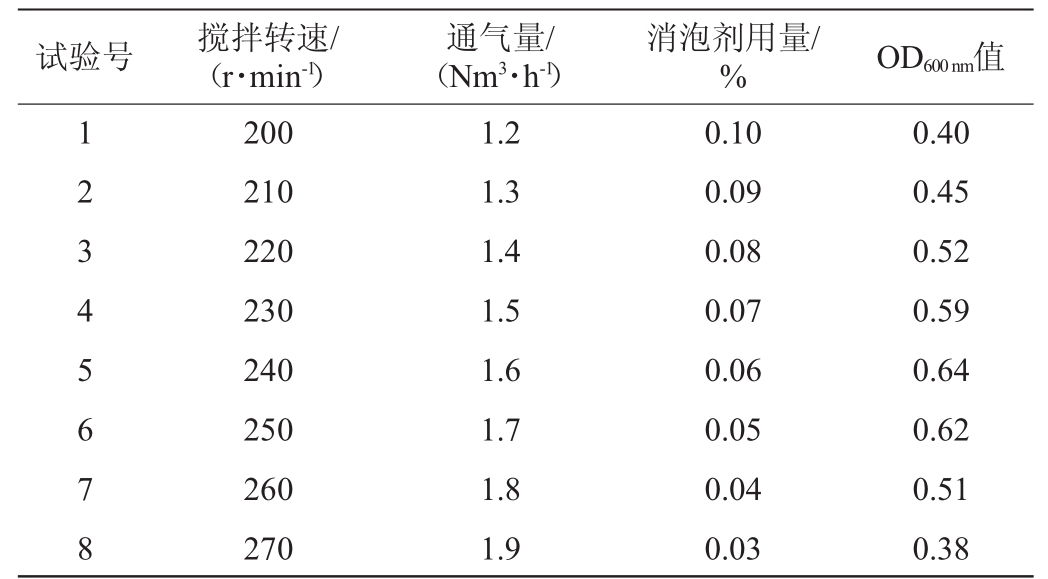
试验号 搅拌转速/(r·min-1)通气量/(Nm3·h-1)消泡剂用量/% OD600nm值1 2 3 4 5 6 7 8 200 210 220 230 240 250 260 270 1.2 1.3 1.4 1.5 1.6 1.7 1.8 1.9 0.10 0.09 0.08 0.07 0.06 0.05 0.04 0.03 0.40 0.45 0.52 0.59 0.64 0.62 0.51 0.38
由表4可知,当搅拌转速为240r/min、通气量为1.6Nm3/h、消泡剂用量为0.06%时,OD600nm值最大,以此组合为中心进行中心组合试验,以确定主要影响因素的最优水平。
2.2.3 中心组合试验结果与分析
采用二次回归的旋转中心组合设计,以搅拌转速(X 1)、通气量(X 2)、消泡剂用量(X 3)为自变量,以OD600 nm值(Y)为响应值,进行3因素5水平的响应面优化试验,5个水平分别为-α、-1、0、1、α(其中α=2k/4,k=3,α=1.682),中心组合试验因素与水平见表5,结果与分析见表6,方差分析结果见表7。
表5 中心组合试验的因素与水平
Table 5 Factors and levels of central composite experiments
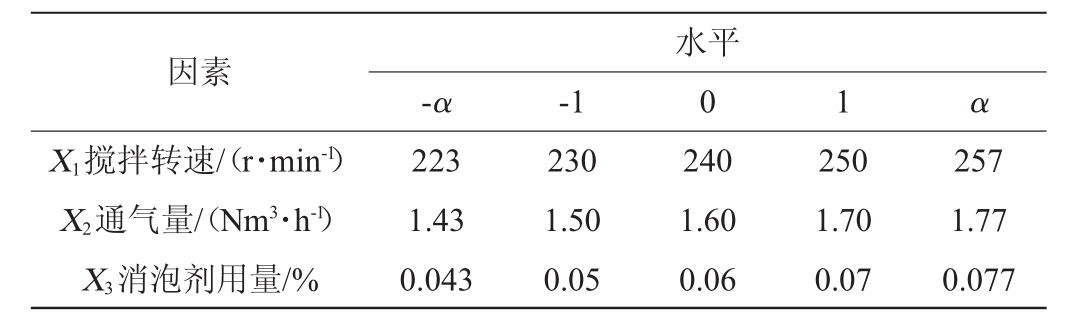
因素X1搅拌转速/(r·min-1)X2通气量/(Nm3·h-1)X3消泡剂用量/%-α -1水平0 1 α 223 1.43 0.043 230 1.50 0.05 240 1.60 0.06 250 1.70 0.07 257 1.77 0.077
表6 中心组合试验的结果与分析
Table 6 Results and analysis of central composite experiments
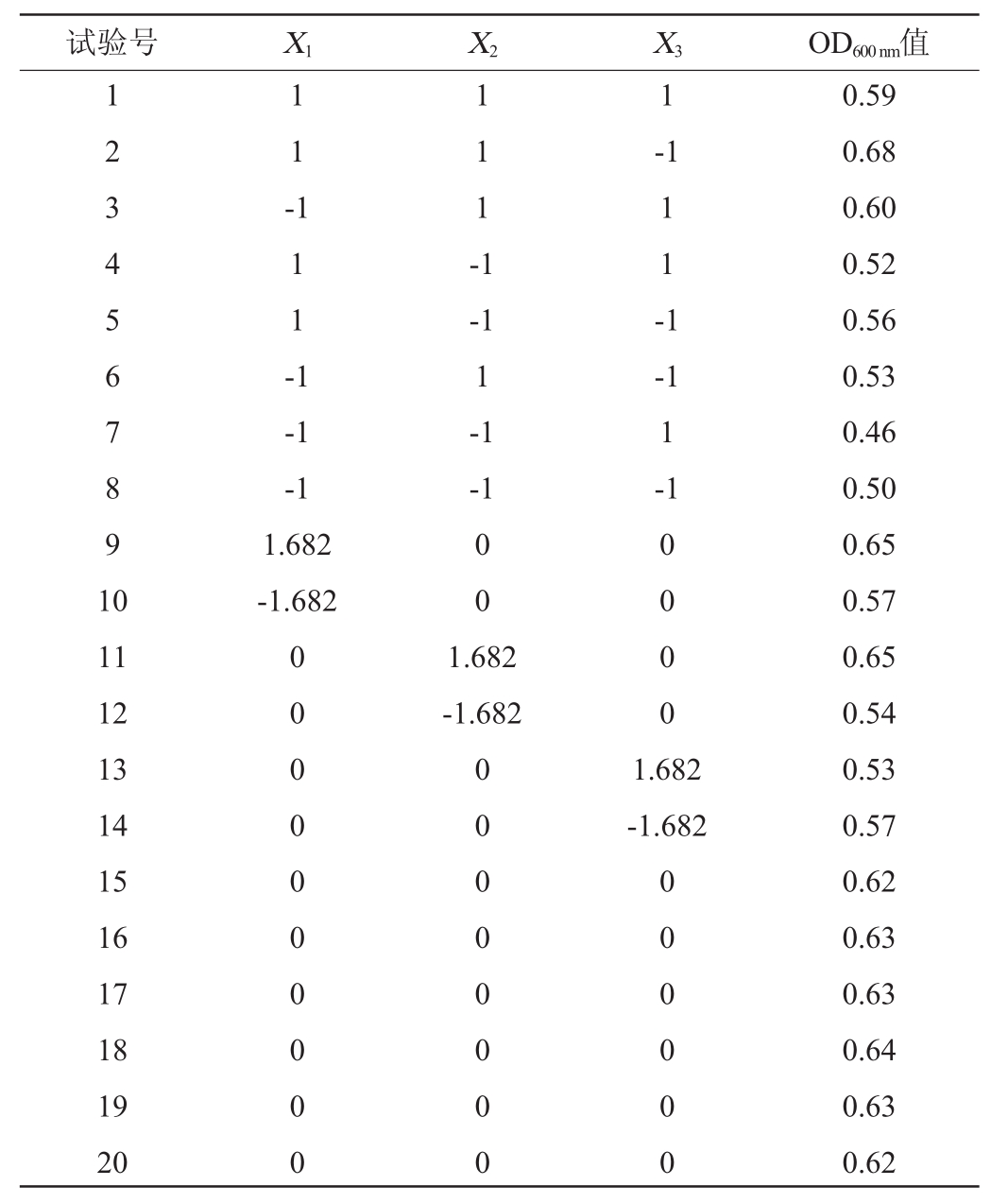
试验号X1 X2 X 3 OD600 nm值1 2 3 4 5 6 7 8 9 1 0 1 1 -1-1 1 1 1 -1 1 1 1 -1 1 1 -1-1-1 1.682-1.682-1 1-1-1-1 1-1 0 0 11 12 13 14 15 16 17 18 19 20 0 0 0 0 0 0 0 0 0 0 1.682-1.682 0 0 0 0 0 0 0 0 0 0 0 0 1.682-1.682 0 0 0 0 0 0 0.59 0.68 0.60 0.52 0.56 0.53 0.46 0.50 0.65 0.57 0.65 0.54 0.53 0.57 0.62 0.63 0.63 0.64 0.63 0.62
利用Minitab软件对表6数据进行多元回归拟合,得出以OD600nm值为响应指标的二次回归拟合方程:Y=0.629 2+0.028 89X 1+0.039 91X 2-0.012 25X 3-0.012 26X 12-0.017 56X 22-0.03347X 32+0.00250X 1X 2-0.02000X 1X 3+0.00750X 2X 3。由表7可知,回归模型P值为0.01,失拟项P值>0.01,表明模型可靠,无失拟因素存在。模型的决定系数R2=89.87%,与调整决定系数R2adj=80.76%接近,表明回归模型的拟合效果较好。一次项X 1、X 2和二次项X 32对结果影响极显著(P<0.01);二次项X 22对结果影响显著(P<0.05);其他项对结果影响不显著(P>0.05)。
表7 回归模型的方差分析
Table 7 Variance analysis of the regression model
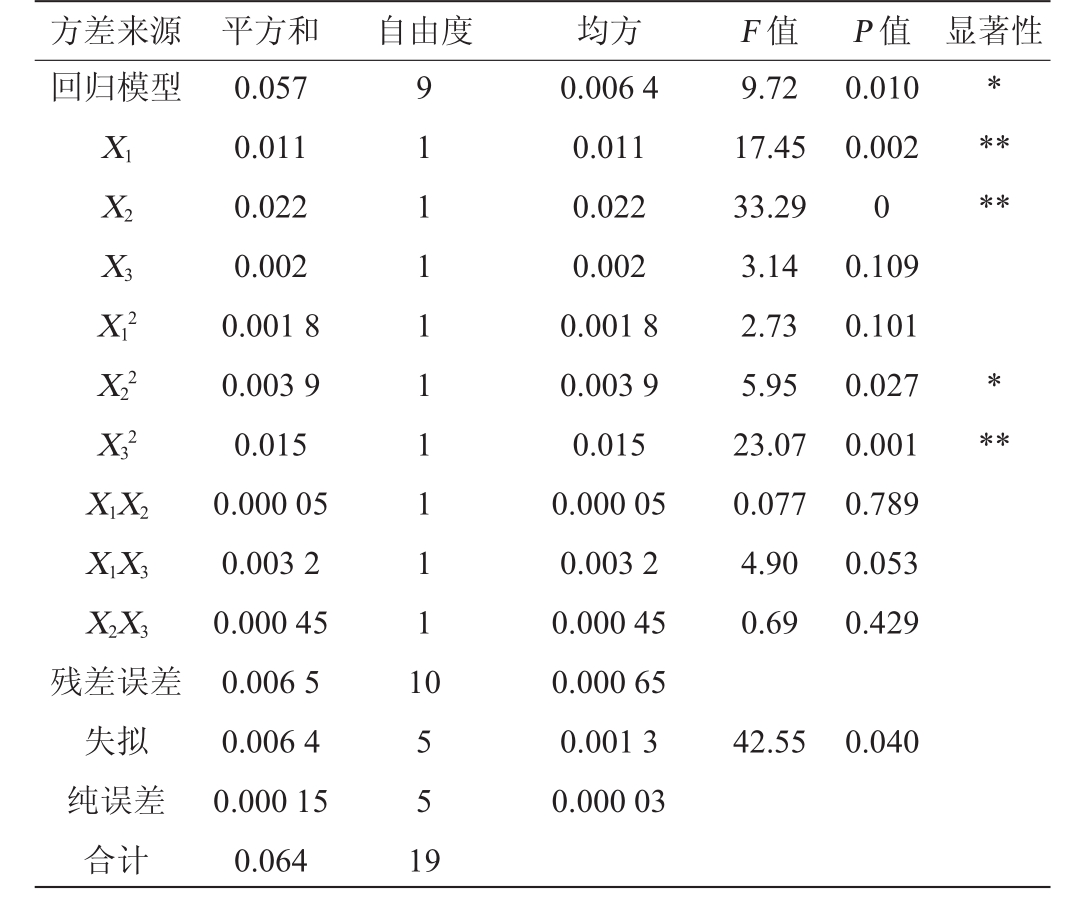
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F值 P值 显著性回归模型*X1X2X3****X12 X22*X32**X1X 2 X1X 3 X2X 3 9.72 17.45 33.29 3.14 2.73 5.95 23.07 0.077 4.90 0.69 0.010 0.002 0 0.109 0.101 0.027 0.001 0.789 0.053 0.429残差误差失拟纯误差合计0.057 0.011 0.022 0.002 0.001 8 0.003 9 0.015 0.000 05 0.003 2 0.000 45 0.006 5 0.006 4 0.000 15 0.064 9 1 1 1 1 1 1 1 1 1 1 0 5 5 1 9 0.006 4 0.011 0.022 0.002 0.001 8 0.003 9 0.015 0.000 05 0.003 2 0.000 45 0.000 65 0.001 3 0.000 03 42.55 0.040
经响应面优化得出,木醋杆菌NUST4.2种子扩大培养的最优条件为搅拌转速257 r/min,通气量为1.72 Nm3/h,消泡剂用量0.054%。在此优化条件下,OD600nm值最大,理论值为0.681。
2.3 验证试验
在给定的最优条件下,即搅拌转速257 r/min,通气量1.72 Nm3/h,消泡剂用量0.054%,木醋杆菌培养36 h后,OD600 nm值为0.70,与回归模型的预测值接近,说明模型的拟合比较理想,证实了模型的有效性。
3 结论
本研究应用Plackett-Burman设计试验,快速有效地从6个影响种子扩大培养的因素中筛选出3个显著性影响因素:搅拌转速、通气量和消泡剂用量。然后利用最陡爬坡法逼近最大响应值区域,并用中心组合设计得出最优培养条件:装液量70%、初始pH值6.0、搅拌转速257 r/min、消泡剂用量0.054%、罐压0.2 MPa、通气量1.72 Nm3/h。在最优培养条件下,种子扩大培养的菌体密度OD600nm值为0.70,较优化前提高10%。
[1]HESTRINS,SCHRAMM M.Synthesis of cellulose by Acetobacter xylinum.II.preparation of freeze-dried cells capable of polymerizing glucose to cellulose[J].Biochem J,1954,58(2):345.
[2]HUANG Y,ZHU C L,YANG J Z,et al.Recent advances in bacterial cellulose[J].Cellulose,2014,21(1):1-30.
[3]SANTOS S M,CARBAJOP J M,QUINTANA E,et al.Characterization of purified bacterial cellulose focused on its use on paper restoration[J].Carbohyd Polym,2015,116:173-181.
[4]KLEMM D,KRAMERF,MORITA S,et al.Nanocelluloses:A new family of nature-based materials[J].Angew Chem Int Edit,2011,50(24):5438-5466.
[5]AGUADO B A,GRIM J C,ROSALES A M,et al.Engineering precision biomaterialsfor personalized medicine[J].Sci Translat Med,2018,10(424):eaam8645.
[6]徐安书.工业菌种制备技术[M].北京:化学工业出版社,2016:133-139.
[7]高洁,汤烈贵.纤维素科学[M].北京:科学出版社,1996:45-61.
[8]CHAWLA P R,BAJAJ I B,SURVASE S A,et al.Microbial cellulose:fermentative production and applications[J].Food Technol Biotech,2009,47(2):107-124.
[9]ZHANG H,CHEN C T,ZHU C L,et al.Production of bacterial cellulose by Acetobacter xylinum effects of carbon nitrogen-ratio on cell growth and methabolite production[J].Cellulose Chem Technol,2016,50(9-10):997-1003.
[10]HWANG J W,YANG Y K,HWANG J K,et al.Effects of pH and dissolved oxygen on cellulose production by Acetobacter xylinum BRC5 in agitated culture[J].J Biosci Bioeng,1999,88(2):183-188.
[11]CHENG K C,CARCHMARK J M,DEMIRCI A.Effects of CMC addition on bacterial cellulose production in a biofilm reactor and its paper sheets analysis[J].Biomacromolecules,2011,12(3):730-736.
[12]余龙江.发酵工程原理与技术应用[M].北京:化学工业出版社,2006:78-85.
[13]CHAOY,ISHIDA T,SUGANO Y,et al.Bacterial cellulose production by Acetobacter xylinum in a 50-Linternal-loop airlift reactor[J].Biotechnol Bioeng,2015,68(3):345-352.
[14]WANG Y C.Optimization of gluconacetobacter fermentation for bacterial cellulose production by response surface method[J].Transact China Pulp Paper,2012,27(2):45-49.
[15]MENG F X,XING A G,LI Y T,et al.The optimization of Marasmius androsaceus submerged fermentation conditions in five-liter fermentor[J].Saudi J Biol Sci,2016,23(1):S99-S105.
[16]杨铭.Minitab用于中心复合设计与数据处理[J].药学服务与研究,2007,7(3):231-234.
[17]LIU A H,CHU I M,HWANG S M.Factorial designs combined with the steepest ascent method to optimize serum-free media for CHO cells[J].Enzyme Microb Technol,2001,28(4):314-321.
[18]殷智超.Acetobacter xylinum NUST4.2产细菌纤维素的发酵动力学初步研究[D].南京:南京理工大学,2010.
[19]李艳.细菌纤维素高产菌株筛选鉴定与发酵工艺优化[D].杨凌:西北农林科技大学,2013.
[20]PAN H F,BAO W N,XIE Z P,et al.Optimization of medium composition for cisepoxysuccinate hydrolase production in Escherichia coli by response surface methodology[J].Afr J Biotechnol,2012,9(9):559-572.