嗜酸乳杆菌(Lactobacillus acidophilus)属于乳杆菌属,是肠道中的重要微生物[1],作为机体的有益菌群[2]和制备益生菌制剂[3]的常用菌种之一,当其达到一定数量时,具有调节肠道微生物菌群[4-5]、抑制病原菌[6-7]、增强免疫力[4,8]、降血脂[9-10]等作用,起到健康促进效果。嗜酸乳杆菌成为目前乳酸菌家族中极为重视研究与开发的益生菌之一,被视为第三代酸乳发酵剂菌种[6]。因此,对嗜酸乳杆菌高密度培养和干粉发酵剂的研制具有重要的理论意义与实用价值。
益生菌对饲料加工过程、制粒工艺中的髙温、储存运输和胃肠液的胃酸及胆汁的耐受性较差,能活着到达动物胃肠道体内定植并且发挥作用的种类和数量不多[11]。微胶囊由于其独特优势被视为解决这一系列问题的可行途径[12-14]。目前饲用益生菌微胶囊的制备工艺大多属于发酵后包被[15-16],得到的产品具有球形度差,颗粒大小不均匀和囊内细胞密度低等缺点[17-18]。ZHANG L等[11]选取粪肠球菌进行乳化凝胶化基础上的发酵前包被和喷雾干燥基础上的发酵后包被,发现微囊化粪肠球菌的储藏、高温、胃液和肠液胁迫作用的抵抗能力要显著高于未包被菌粉和发酵后包被,其中常温条件下储存5个月后发酵前包被粪肠球菌的活性比未包被的菌粉组与后包被组分别提高19.46%和6.90%。贠婷婷[19]以酿酒酵母和粪肠球菌为模式菌株进行微囊化,发酵前包被酿酒酵母和粪肠球菌的中试产品球形度好、大小均一,粒径分布均匀,能够有效降低高温制粒过程中活菌数的损失。发酵前包被技术能够更好的改善微囊化产品的形态和稳定性[20],但尚无规模化生产。嗜酸乳杆菌生长繁殖对营养条件较为苛刻[21],探讨高密度培养条件[22]和提高菌粉存活率[3]是制备高活性嗜酸乳杆菌菌粉的关键。本研究通过响应面试验优化嗜酸乳杆菌包被发酵的培养基以及发酵条件,从而提高包被型嗜酸乳杆菌单位浓度的活菌数,为包被嗜酸乳杆菌的高密度浓缩型发酵剂及活菌剂产品的开发奠定基础,为嗜酸乳杆菌包被发酵的工业化生产和产品开发提供科学依据。
1 材料与试剂
1.1 材料与试剂
1.1.1 菌株
嗜酸乳杆菌(Lactobacillus acidophilus,La)XW118(以下简称LaXW118):由江西省科学院微生物研究所分子生物学实验室保藏。
1.1.2 化学试剂
蛋白胨、酵母粉、牛肉膏(均为生化试剂):安琪酵母股份有限公司;琼脂粉、海藻酸钠:生工生物工程(上海)股份有限公司;葡萄糖、柠檬酸三铵、乙酸钠、吐温-80、磷酸二氢钾、硫酸镁、硫酸锰(均为分析纯):国药集团化学试剂有限公司;纳米碳酸钙:江西永发化工公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基:蛋白胨10.0 g、牛肉膏8.0 g、酵母粉4.0 g、葡萄糖20.0 g、吐温80 1.0 mL、K2HPO4·7H2O 2.0 g、NaAc·3H2O 5.0 g、柠檬酸三铵2.0 g、MgSO4·7H2O 0.68 g、MnSO·4H2O 0.25 g,将上述成分加入1 000 mL蒸馏水中,加热溶解,调节pH 值为6.5,110~115 ℃高压灭菌30 min;此培养基用于菌种活化、复壮[4]。
MRS固体培养基:在MRS液体培养基成分中再加入1.5%~2.0%琼脂粉,煮沸混匀,调节pH后于110~115 ℃高压灭菌30 min;此培养基用于活菌计数。
基础发酵培养基:蛋白胨10.0 g、牛肉膏8.0 g、酵母粉4.0 g、葡萄糖20.0 g、吐温-80 1.0 mL、K2HPO4·7H2O 2.0 g、NaAc·3H2O 5.0 g、柠檬酸三铵2.0 g、MgSO4·7H2O 0.68 g、MnSO·4H2O 0.25 g、海藻酸钠10 g、纳米碳酸钙20 g,溶于1 000 mL 蒸馏水中,110~115 ℃高压灭菌30 min。
1.2 仪器与设备
DSX-280A手提压力灭菌锅:上海申安仪表有限公司;SPX-250B-Z型生化培养箱:上海博迅实业有限公司;AL204电子天平:梅特勒-托利多仪器(上海)股份有限公司;TG16-WST台式高速离心机:上海卢湘仪离心机仪器有限公司;FD系列冷冻干燥机:上海拓纷机械设备有限公司;5 L发酵罐:上海保兴生物设备工程有限公司。
1.3 方法
1.3.1 菌种的活化、种子液的制备及培养
取冻存甘油管菌株LaXW118室温静置5 min,用接种环蘸取菌种接于MRS液体培养基,37 ℃厌氧培养20 h后,划线接种到MRS固体培养基上,长出单个菌落,挑取菌落的一半进行革兰染色镜检,确认为纯种,将菌落的另一半接种至MRS液体培养基中扩培。将活化后的菌株LaXW118接种于MRS液体培养基,于37 ℃厌氧静置培养18 h,得到种子液,备用。
将制备的种子液按照4%接种量接种于5 L发酵罐发酵培养基中,37 ℃、100 r/min恒温厌氧培养20 h,制备的发酵液用于各指标测定。
1.3.2 活菌计数[19]
取1 mL菌液于0.1 mol/L磷酸缓冲液(pH 6.2)中,适当稀释数倍后,取3个浓度梯度(10-6~10-8)进行平板倾注,每个梯度设3 个平行,培养24 h后进行活菌计数。
1.3.3 Plackett-Burman 试验设计
在前期单因素试验的基础上,对培养基每种成分选高低2 个水平,以(-1、1)编码各值,其中高水平是低水平的1.5倍,以微囊包被发酵活菌浓度(R)作为响应值进行试验分析[23],从中筛选出对包被活菌含量影响显著的培养基组分。Plackett-Burman(PB)试验设计的因素及水平如表1所示,每组试验设置3个平行试验以减少试验误差,取3组试验的平均值。分别计算各因素效应,并进行重要性评价。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experimental design
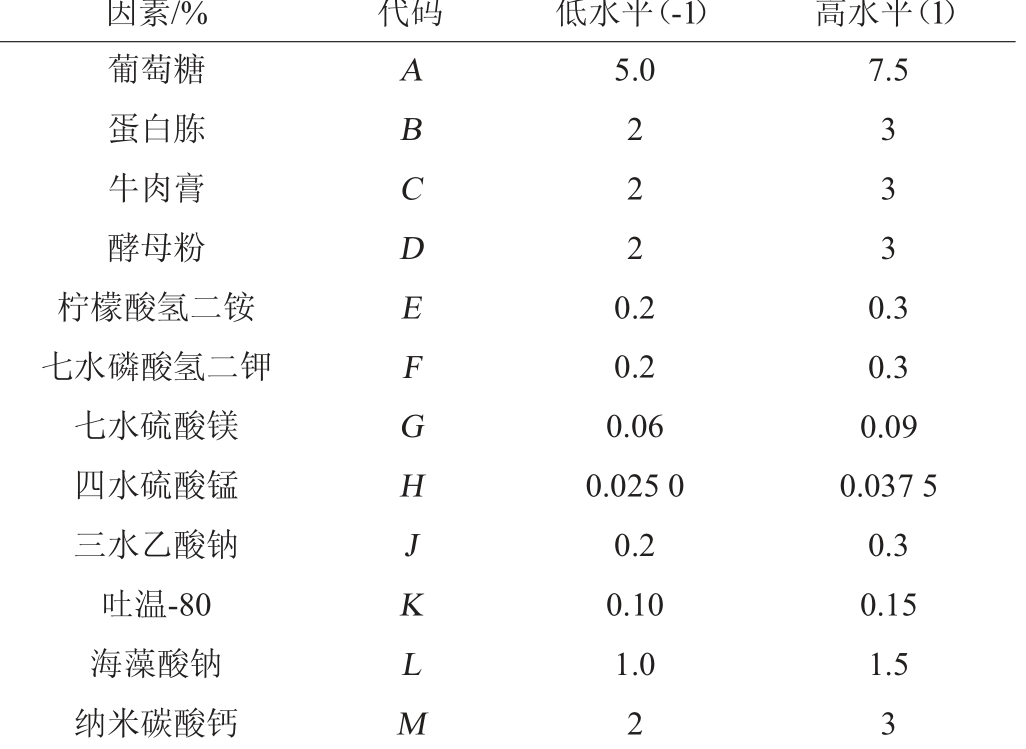
因素/% 代码 低水平(-1) 高水平(1)葡萄糖蛋白胨牛肉膏酵母粉柠檬酸氢二铵七水磷酸氢二钾七水硫酸镁四水硫酸锰三水乙酸钠吐温-80海藻酸钠纳米碳酸钙ABCDEFGHJKLM 5.0 7.5 2 2 2 3 3 3 0.2 0.2 0.06 0.025 0 0.2 0.10 1.0 2 0.3 0.3 0.09 0.037 5 0.3 0.15 1.5 3
1.3.4 最陡爬坡试验
响应面拟合方程的最优邻域才能充分反映真实情形,最速上升法可以迅速的达到其附近。根据表1试验数据的分析结果,从众多影响因子中筛选出3 个影响微囊包被发酵活菌浓度的最显著因子,以此来确定各因素的水平,表现为正效应的因素取高水平,表现为负效应的因素取低水平。根据这3 个因素效应的大小设定最陡爬坡试验的方向和步长,剩余因子均取低水平值,通过微囊包被活菌浓度的变化趋势,确定中心组合设计试验中3 因素的中心点。
1.3.5 响应面法优化培养基组成
采用响应面中心组合设计(central composite design,CCD)对微囊包被发酵活菌浓度的显著影响因子进一步优化,根据Plackett-Burman 和最陡爬坡法试验结果,结合因素的效应大小和试验中的实际情况,以3 个显著影响因子为响应面设计的自变量,选择下一步试验水平的中心点和各水平的步长,响应值为微囊包被发酵活菌浓度(R),各因子和代码水平见表2。其他因子的高低水平根据Plackett-Burman试验分析结果确定,表现为正效应的因素取高水平,表现为负效应的因素取低水平,每个试验点进行3次平行试验。
表2 中心组合设计试验因素与水平
Table 2 Factors and levels of central composite design experiments
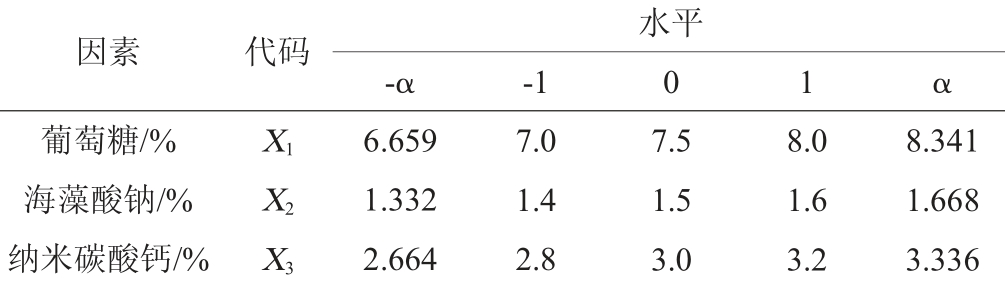
因素 代码葡萄糖/%海藻酸钠/%纳米碳酸钙/%-α -1水平0 1 α X1X2X3 6.659 1.332 2.664 7.0 1.4 2.8 7.5 1.5 3.0 8.0 1.6 3.2 8.341 1.668 3.336
1.3.6 冻干粉的制备[24]
将菌液离心,弃去上清液,收集菌泥;在离心所得的菌泥中加入复合保护剂并混匀,置-40 ℃预冻处理5 h以上,放入真空冷冻干燥器内冻干。
1.3.7 包被型嗜酸乳杆菌的加速储存稳定性试验[25]
取适量包被型嗜酸乳杆菌固态产品在37 ℃条件下分别贮藏0、10 d、30 d、65 d、100 d取样,以相同处理条件下的游离嗜酸乳杆菌固态产品为对照,每个处理3个重复。采用平板计数法计算每克产品的活菌数,通过测定活菌数变化情况来评价其贮存性能。
2 结果与分析
2.1 包被型嗜酸乳杆菌发酵
菌株LaXW118在5 L发酵罐中以基础发酵培养基于37 ℃、100 r/min恒温厌氧培养,包被发酵嗜酸乳杆菌的镜检结果见图1A。由图1A可知,嗜酸乳杆菌LaXW118在培养8 h后开始出现微囊,培养至12 h时,菌体细胞充满整个微胶囊,囊内菌体密度较大,并未出现破囊现象,菌体也没有明显泄漏;以MRS液体培养基游离培养的菌株LaXW118的镜检结果见图1B。由图1B可知,菌株LaXW118细胞呈链杆状,不聚团。结果表明,采用包被发酵的嗜酸乳杆菌具有不同于游离培养条件下的特征,即普遍都有聚集成团的现象,且所形成的细胞团大小比较均匀,成球形良好,细胞团之间界限明显,其优势是通过聚团提高了细胞的密度。

图1 包被发酵和游离培养后的嗜酸乳杆菌的镜检结果
Fig. 1 Microscopy examination results of Lactobacillus acidophilus after encapsulated fermentation and free culture
2.2 Plackett-Burman试验及结果分析
根据前期单因素试验结果,选取12个对包被活菌浓度影响较大的因素,通过Design Expert 8.0 软件进行N=16的Plackett-Burman试验设计,把每个因素设计成高(1)和低(-1)2个水平,高水平是低水平的1.5倍,每组试验设置3个平行,以菌株LaXW118的包被活菌浓度(R)为响应值,Plackett-Burman试验设计结果见表3。
表3 Plackett-Burman试验设计结果
Table 3 Results of Plackett-Burman experimental design
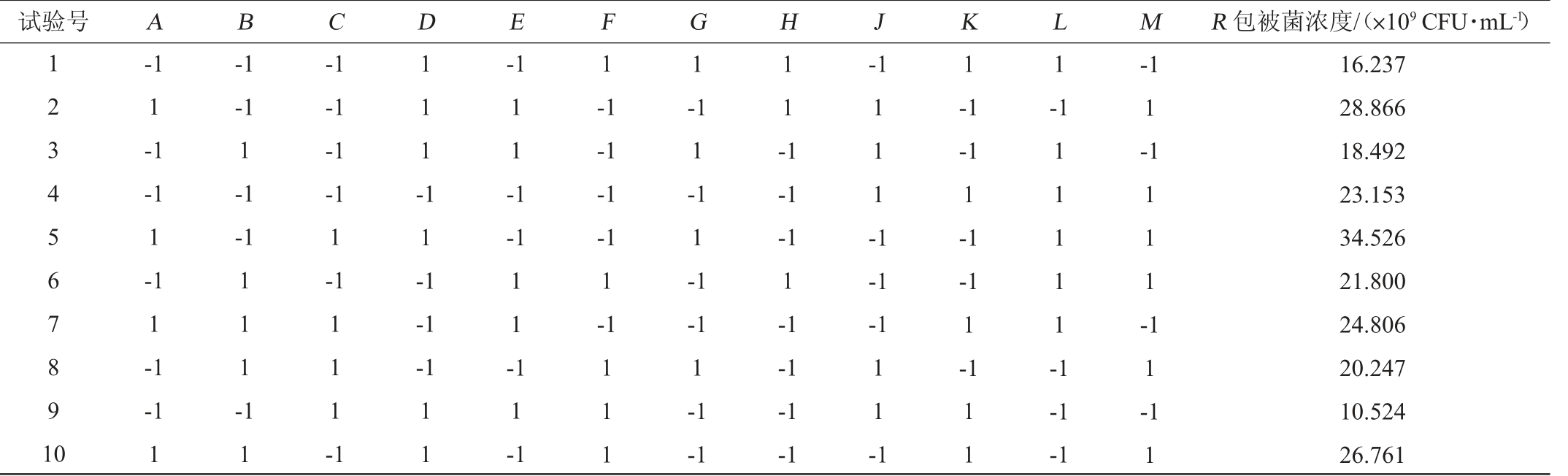
试验号 A B C D E F G H J K L M R 包被菌浓度/(×109 CFU·mL-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1-1 1-1 1-1-1 1-1-1 1-1-1 1 1 1 --1 1-1-1-1-1 1-1 1 1 1 -1-1 1 1-1-1 1-1 1 1 -1-1 1 1 1 -1 1 1 1 -1 1 -1-1-1 1 1 --1-1-1-1 1-1-1-1-1-1 1-1-1 1-1 1 1 1 1 1 -1 1 1 1 -1 1 1 1 1 -1 1 1 1 1 -1 1 1 1-1 1-1 1-1-1 1-1-1-1-1 1-1-1-1-1 1 1 -1 1 1-1-1 1 1 -1 1 16.237 28.866 18.492 23.153 34.526 21.800 24.806 20.247 10.524 26.761
续表
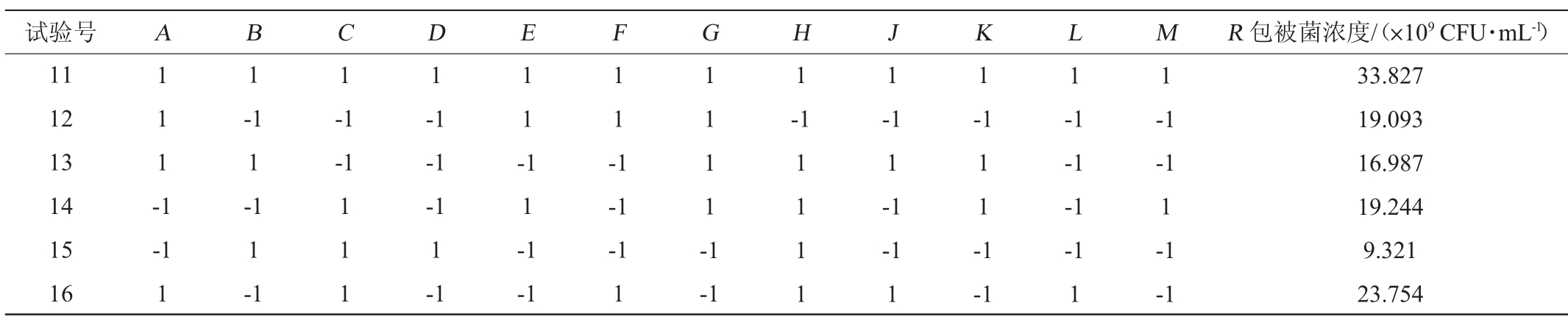
试验号 A B C D E F G H J K L M R 包被菌浓度/(×109 CFU·mL-1)11 12 13 14 15 16 1 1 1 -1 1 1 1 1 1 1 -1 1 1 1 -1 1 1-1-1-1-1-1 1-1 1-1 1-1 1 1 1-1-1-1 1-1 1 1 -1 1 1 1 1 -1 1 1 -1-1-1-1 1-1 1 1 1 1-1 1-1-1 1-1-1-1-1-1 1-1-1 1-1-1 33.827 19.093 16.987 19.244 9.321 23.754
采用Design-expert V8.0对表3结果进行方差分析,结果见表4。由表4可知,该模型的决定系数R2为98.10%,其校正决定系数R2adj为90.50%,说明与包被活菌浓度相关因素中,不能由此模式解释的基本不足10%;模型的P值为0.029 0<0.05,证明该模型能较好的拟合数据,较好地反映了各因素之间的关系。
表4 Plackett-Burman试验设计方差分析
Table 4 Variance analysis of Plackett-Burman experimental design
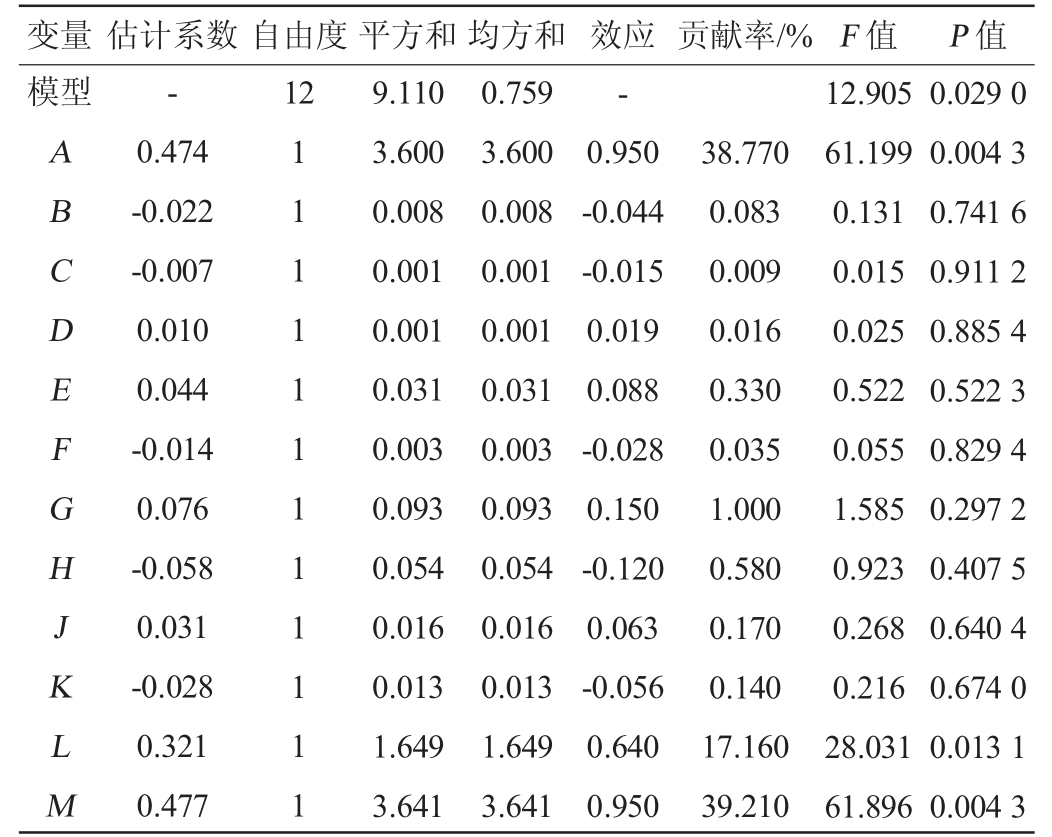
变量 估计系数自由度平方和均方和 效应 贡献率/% F 值 P 值模型-12-ABCDEFGHJKLM 0.474-0.022-0.007 0.010 0.044-0.014 0.076-0.058 0.031-0.028 0.321 0.477 1 1 1 1 1 1 1 1 1 1 1 1 9.110 3.600 0.008 0.001 0.001 0.031 0.003 0.093 0.054 0.016 0.013 1.649 3.641 0.759 3.600 0.008 0.001 0.001 0.031 0.003 0.093 0.054 0.016 0.013 1.649 3.641 0.950-0.044-0.015 0.019 0.088-0.028 0.150-0.120 0.063-0.056 0.640 0.950 38.770 0.083 0.009 0.016 0.330 0.035 1.000 0.580 0.170 0.140 17.160 39.210 12.905 61.199 0.131 0.015 0.025 0.522 0.055 1.585 0.923 0.268 0.216 28.031 61.896 0.029 0 0.004 3 0.741 6 0.911 2 0.885 4 0.522 3 0.829 4 0.297 2 0.407 5 0.640 4 0.674 0 0.013 1 0.004 3
由表4可知,葡萄糖、酵母粉、柠檬酸氢二铵、硫酸镁、乙酸钠、海藻酸钠、纳米碳酸钙对菌株LaXW118包被发酵为正效应,即随着添加量的增大,包被活菌浓度呈现升高趋势,选择高浓度;蛋白胨、牛肉膏、七水磷酸氢二钾、四水硫酸锰、吐温-80对LaXW118包被发酵为负效应,选择低浓度。由P值和贡献率可知,葡萄糖和纳米碳酸钙对液芯微胶囊包被发酵的活菌浓度影响极显著(P<0.01),海藻酸钠对包被发酵的活菌浓度影响显著(P<0.05)。因此,选择葡萄糖、海藻酸钠、纳米碳酸钙3 个因素作为主要研究对象,对菌株LaXW118微囊包被发酵培养基进行进一步优化。
2.3 最陡爬坡试验
根据Plackett-Burman试验结果分析确定了葡萄糖、海藻酸钠和纳米碳酸钙3个因素为影响包被活菌浓度的显著性因素,对菌株LaXW118影响均为正效应,因此上升方向为各因素浓度梯度递增;以低水平(-1)到高水平(1)的1/5为步长进行最速上升试验,确定中心点,试验设计及结果如表5 所示。
表5 最陡爬坡试验设计结果
Table 5 Results of the steepest ascent experimental design
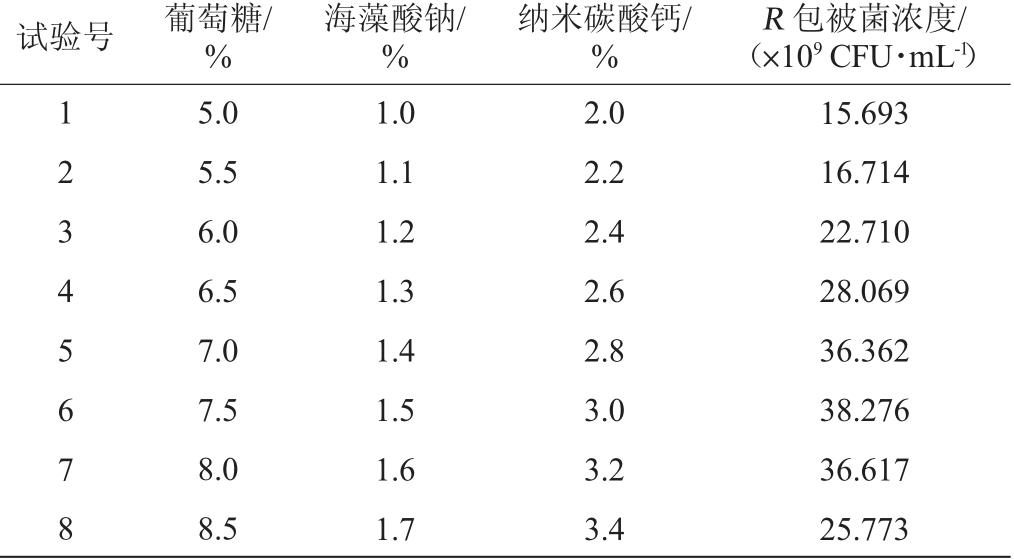
试验号 葡萄%糖/海藻%酸钠/纳米碳%酸钙/(R×1 包09 被C F菌U·浓m度L-/)1 1 5.01.02.015.693 2 5.51.12.216.714 3 6.01.22.422.710 4 6.51.32.628.069 5 7.01.42.836.362 6 7.51.53.038.276 7 8.01.63.236.617 88.51.73.425.773
由表5可知,随着葡萄糖、海藻酸钠和纳米碳酸钙浓度的变化,包被活菌浓度呈现先上升后下降的趋势。在试验号6组达到最高值,此时各因素含量为:葡萄糖7.5%、海藻酸钠1.5%、纳米碳酸钙3.0%,因此选择这3个因子浓度为中心点,进行响应面分析。
2.4 中心组合设计优化包被型嗜酸乳杆菌发酵培养基
通过最陡爬坡试验确定了主要影响因素的具体浓度的取值区间,以葡萄糖(X1)、海藻酸钠(X2)、纳米碳酸钙(X3)3个因素为自变量,包被型菌株LaXW118活菌浓度(R)为响应值,通过Design-expert 软件设计3因素5水平的中心组合设计试验,试验设计和结果如表6所示。
表6 中心组合试验设计结果
Table 6 Results of central composite experimental design

试验号 区组 X1葡萄糖/%X2海藻酸钠/%X3纳米碳酸钙/%R 包被菌浓度/(×109 CFU·mL-1 1 2 3 4 5 1 1 1 1 1 1 1 1 -1 1 1 -1-1-1 1-1 1-1 1-1 29.076 27.168 38.028 30.252 22.140)
续表
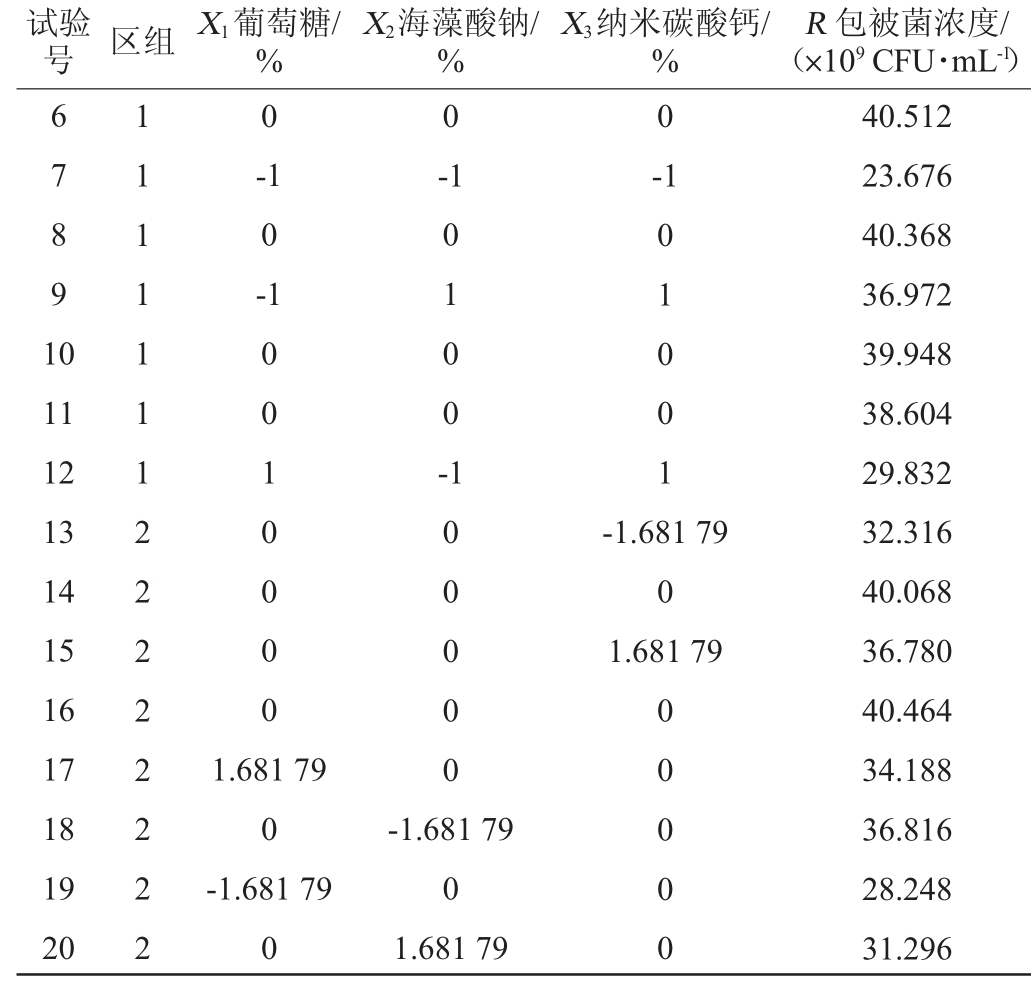
试验号 区组 X1葡萄糖/%X2海藻酸钠/%X3纳米碳酸钙/%R 包被菌浓度/(×109 CFU·mL-1)6 7 8 9 1 0 0-1 0 -0 0 1 1 1 1 1 1 1 2 2 2 2 2 2 2 2-1-1 11 12 13 14 15 16 17 18 19 20 1 0 0 1 0 0 0 0 0 1 0 0 -0 1 0 0 1-1.681 79 0 1.681 79 1.681 79 0-1.681 79 0 1 0 0 0 0 0-1.681 79 0 1.681 79 0 0 0 0 0 40.512 23.676 40.368 36.972 39.948 38.604 29.832 32.316 40.068 36.780 40.464 34.188 36.816 28.248 31.296
应用Design Expert 8.0 软件对表6 的数据进行软件分析得到回归方程的参数估计和方差分析,结果见表7。对表6中的试验数据进行二次多项回归拟合,得到拟合回归方程如下:
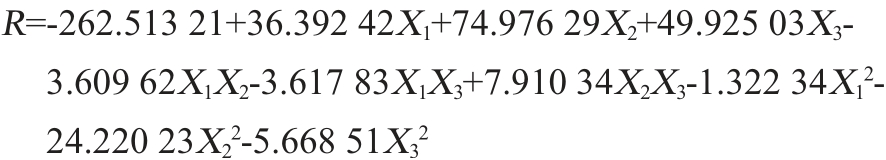
表7 响应面试验结果方差分析
Table 7 Variance analysis of response surface experiments results
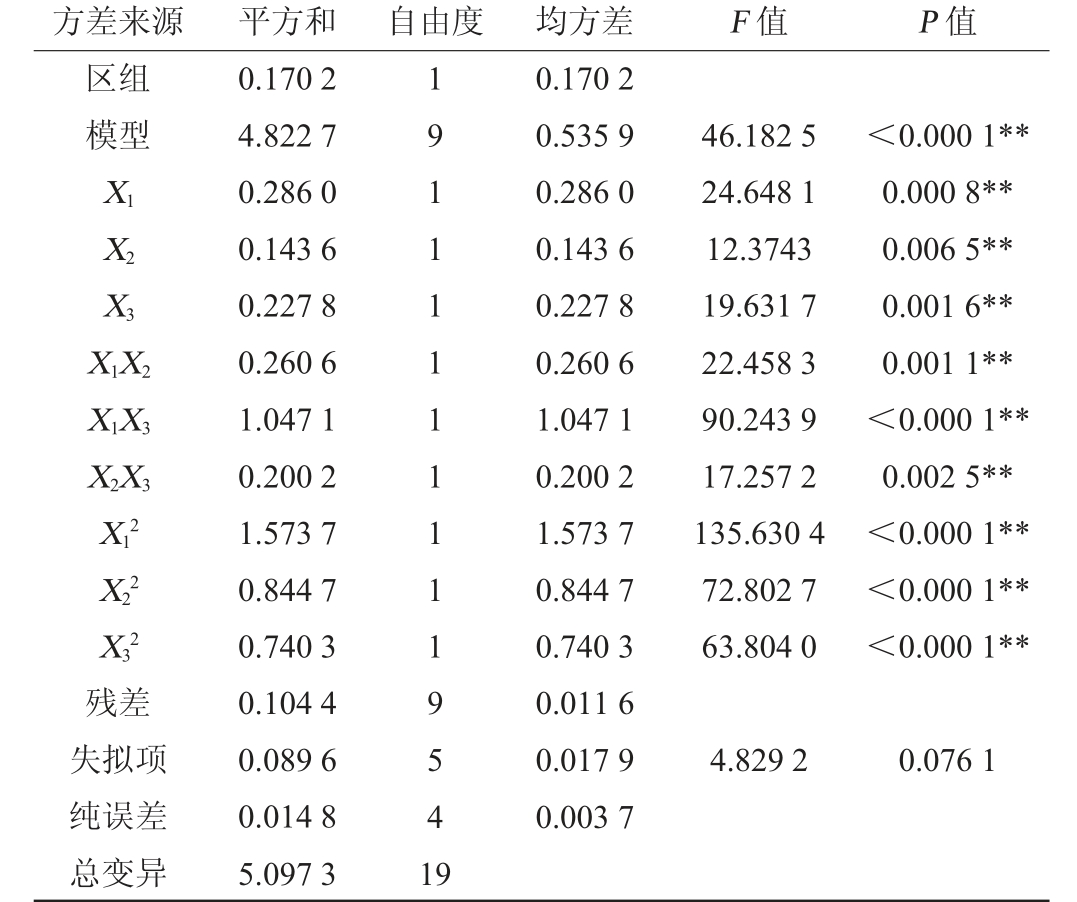
注:“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方差 F 值 P 值区组模型X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32残差失拟项纯误差总变异0.170 2 4.822 7 0.286 0 0.143 6 0.227 8 0.260 6 1.047 1 0.200 2 1.573 7 0.844 7 0.740 3 0.104 4 0.089 6 0.014 8 5.097 3 191111111119541 9 0.170 2 0.535 9 0.286 0 0.143 6 0.227 8 0.260 6 1.047 1 0.200 2 1.573 7 0.844 7 0.740 3 0.011 6 0.017 9 0.003 7 46.182 5 24.648 1 12.3743 19.631 7 22.458 3 90.243 9 17.257 2 135.630 4 72.802 7 63.804 0<0.000 1**0.000 8**0.006 5**0.001 6**0.001 1**<0.000 1**0.002 5**<0.000 1**<0.000 1**<0.000 1**4.829 2 0.076 1
由表7可知,二次响应面回归模型的决定系数R2为97.88%,校正后的决定系数R2adj为95.76%,只有总变异4.24%
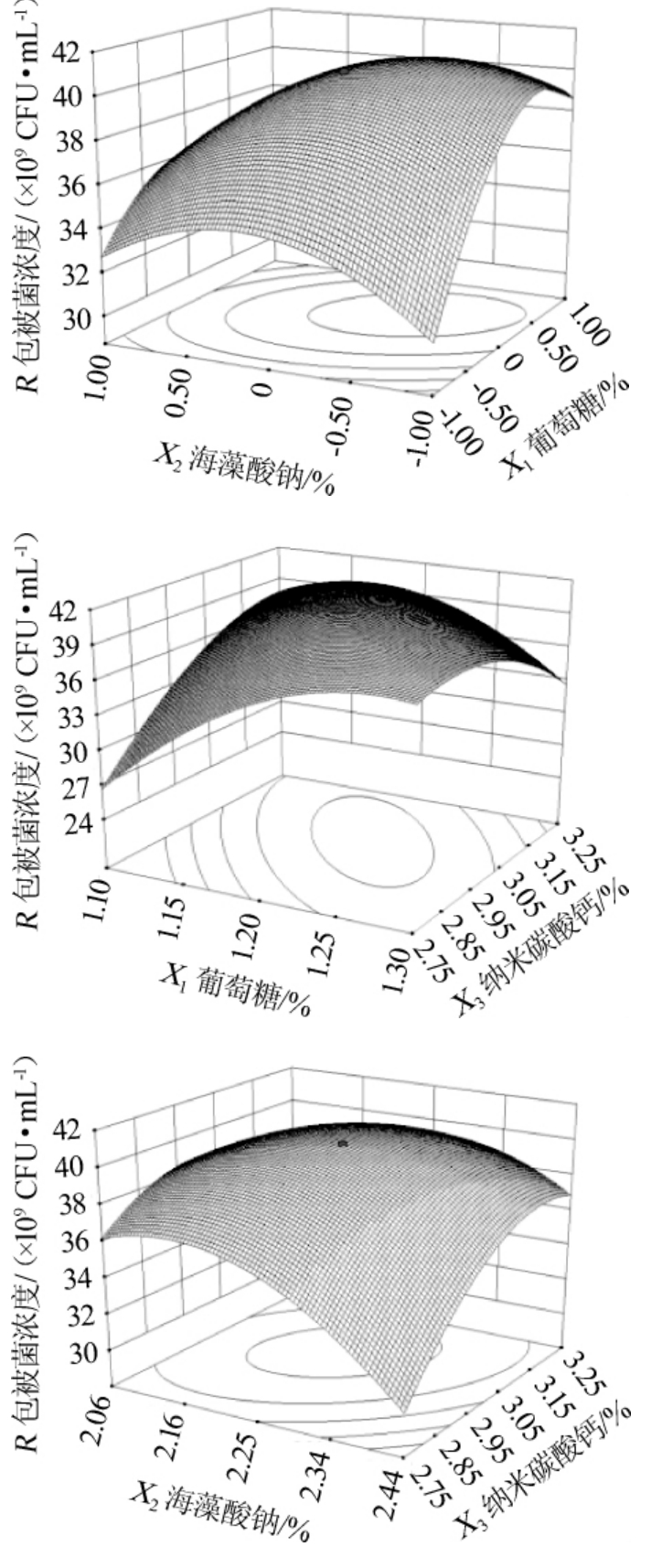
图2 各因素交互作用对包被嗜酸乳杆菌浓度影响的响应面及等高线
Fig. 2 Response surface plots and contour line of effects of interaction between each factors on encapsulated Lactobacillus acidophilus concentration
由拟合方程可绘制响应面三维分析图见图2。每个响应面三维分析图和对应的等高线图分别为当一个变量保持0水平时,另2 个独立变量之间的交互作用。由图2可知,葡的情况不能用该模型解释,变异系数(coefficient of variation,CV)为1.85%<4.00%,说明该模型拟合度好,模型精准度较高,模型可信;该回归方程的F值为46.18,P值<0.000 1,出现噪声的机会<0.01%,说明该试验模型的自变量和因变量之间的函数关系极其显著(P<0.05),在概率为0.05的水平上足够拟合试验数据;并且失拟检验的F值为4.82,P值为0.076 1>0.05,说明失拟项对于误差不显著,进一步说明回归模型显著,该试验模型可信度高,能够较好的解释包被型嗜酸乳杆菌浓度的变化,因此可利用该模型对包被型嗜酸乳杆菌高密度发酵培养基优化与生物量进行预测。萄糖与纳米碳酸钙,葡萄糖与海藻酸钠、海藻酸钠与纳米碳酸钙对发酵后包被活菌浓度的交互作用极显著(P<0.01),说明它们之间对发酵后包被活菌浓度的影响并不是简单的线性关系;在一定范围内,随着葡萄糖、海藻酸钠和纳米碳酸钙浓的增加,发酵后包被活菌浓度随之增加;当达到最大值后,随着各因素浓度的继续增加,发酵后包被活菌浓度的产量逐渐减小,进一步说明各因素之间存在交互作用共同影响着包被型嗜酸乳杆菌高密度发酵,只有在各因素浓度适宜的条件下,发酵后包被活菌浓度的产量才会达到最大值。
在获得回归非线性模型和响应面之后对已回归的非线性模型方程求极值,可以得到曲面的最大点。对回归方程求解最大值可得:当X1=0.538、X2=-0.518、X3=-0.325,即当葡萄糖为7.77%、海藻酸钠为1.45%、纳米碳酸钙为2.93%。在此最佳条件下,嗜酸乳杆菌包被发酵的菌体浓度预测值为4.11×1010 CFU/mL。
2.5 验证试验
按4%的接种量接种到发酵罐中,于37 ℃、100 r/min恒温厌氧培养20 h,每隔1 h取样,得到包被发酵和游离培养的嗜酸乳杆菌的生长曲线见图3。由图3可知,游离培养的嗜酸乳杆菌在0~8 h时处于延迟期,8~16 h处于对数生长期,16 h后进入衰亡期。包被发酵的嗜酸乳杆菌在短暂的延迟期后,迅速进入对数生长期,与游离培养的生长曲线相比较,包被发酵比游离培养的提前3 h进入对数生长期,且在对数生长期菌体的生长速率明显高于游离培养的菌体生长,最终生物量为4.322×1010 CFU/mL,是游离培养的4.25倍。从pH 变化曲线可以看出,整个生长周期中pH逐渐下降,在对数期中增殖菌体伴随乳酸产生,下降速率较快,进入衰亡期后游离培养的pH降至3.38,但在包被发酵的整个生长周期pH值都在5.6以上,在对数期时下降速率显著低于游离培养(P<0.05)。包被发酵为实现高密度培养提供较稳定pH环境,从而提高菌体浓度。
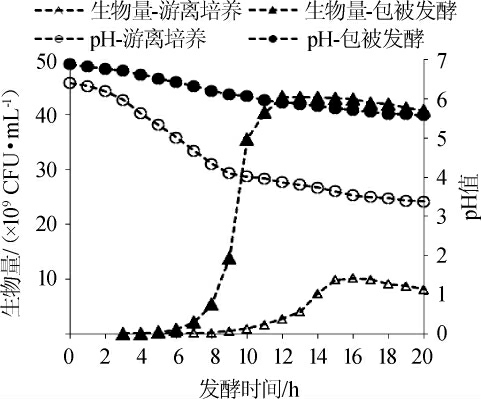
图3 包被发酵和游离培养的嗜酸乳杆菌的生长曲线
Fig. 3 Growth curve of Lactobacillus acidophilus in encapsulated fermentation and free culture
2.6 游离及包被嗜酸乳杆菌固态产品贮藏稳定性
将包被发酵和游离培养后的嗜酸乳杆菌离心收集菌泥,添加复合保护剂真空冷冻干燥后制备成冻干粉,取适量包被发酵和游离培养后的嗜酸乳杆菌的冻干菌粉在37 ℃条件下的加速贮藏试验,分别在第0、10、30、65、100天取样检测每克产品的活菌数,判断其贮藏稳定性。由表8可知,游离培养得到的嗜酸乳杆菌冻干粉在37 ℃条件下贮藏,活菌数急速下降,第10天存活率降至1.5%;而包被发酵得到的嗜酸乳杆菌冻干粉在37 ℃条件下贮藏10 d内活菌数没有明显的下降,第100天存活率还有75.2%。说明包被发酵嗜酸乳杆菌冻干粉具有很好的稳定性和较长的货架期,这为今后嗜酸乳杆菌包被发酵的工业化生产及推广应用提供依据。
表8 冻干菌粉在37 ℃条件下的加速储存试验结果
Table 8 Results of freeze-dried bacteria powder at 37 ℃for acceleration storage

注:“-”表示未检出。
培养方式游离培养包被发酵第0天108 CFU/g 存活率/% 存活率/% 存活率/%第100天108 CFU/g 存活率/%2 438 8 127第10天108 CFU/g第30天108 CFU/g第65天108 CFU/g 37 7 848 1.5 96.6 91.4 83.1---7 429 6 751 6 112 75.2
3 结论
采用中心组合设计探索包被型嗜酸乳杆菌高密度发酵的最优增菌培养基,通过Plackett-Burman 试验设计快速筛选出葡萄糖、海藻酸钠和纳米碳酸钙3个对嗜酸乳杆菌包被发酵的生物量影响显著,并通过最陡爬坡试验进一步确定了它们的取值范围,最后通过响应面设计优化法建立多项数学模型,运用统计分析对模型进行显著性检验来优化包被发酵培养基的最佳组成。优化后的嗜酸乳杆菌包被发酵的增菌培养基为:葡萄糖7.77%、蛋白胨2%、牛肉膏2%、酵母粉3%、柠檬酸氢二铵0.3%、七水磷酸氢二钾0.2%、七水硫酸镁0.09%、四水硫酸锰0.025%、三水乙酸钠0.3%、吐温-80 0.1%、海藻酸钠1.45%、纳米碳酸钙2.93%。在此优化条件下,嗜酸乳杆菌包被发酵的菌体浓度达4.322×1010 CFU/mL,是游离培养的4.25倍,与预测值相近,基本达到了嗜酸乳杆菌高密度培养的要求,为嗜酸乳杆菌包被发酵的工业化生产提供科学依据。
采用本实验室包被发酵技术培养嗜酸乳杆菌后,发现菌体细胞聚集成团的形成微胶囊,囊内菌体密度较大,未出现破囊现象,菌体也没有明显泄漏,且所形成的微囊大小较均匀,成球形良好,界限明显。离心收集冷冻干燥制备成冻干粉的加速储存稳定性试验中发现,包被发酵嗜酸乳杆菌冻干粉在37 ℃条件下贮藏10 d内活菌数没有明显的下降,活菌仍保留75%以上的存活。包被发酵嗜酸乳杆菌冻干粉具有很好的稳定性和较长的货架期,为嗜酸乳杆菌益生菌产品的开发打下了基础。
[1]SAITO T.Selection of useful probiotic lactic acid bacteria from the Lactobacillus acidophilus group and their applications to functional foods[J].Animal Sci J,2005,75(1):1-13.
[2]刘齐,孙美玲,王鲁峰,等.益生菌的功能活性及其分子机理探究的研究进展[J].中国酿造,2014,33(1):14-19.
[3]张宇,王连艳,王艳萍.嗜酸乳杆菌微胶囊制备及工艺优化[J].食品与发酵工业,2018,44(6):132-138.
[4]HOSEINIFAR S H,ROOSTA Z,HAJIMORADLOO A,et al.The effects of Lactobacillus acidophilus as feed supplement on skin mucosal immune parameters, intestinal microbiota, stress resistance and growth performance of black swordtail (Xiphophorus helleri)[J]. Fish Shellfish Immunol,2015,42(2):533-538.
[5] LV C H,WANG T,REGMI N, et al. Effects of dietary supplementation of selenium-enriched probiotics on production performance and intestinal microbiota of weanling piglets raised under high ambient temperature[J].J Anim Physiol Anim Nutr,2015,99(6):1161-1171.
[6]MENG J,ZHANG Q X,LU R R.Surface layer protein from Lactobacillus acidophilus,NCFM inhibit intestinal pathogen-induced apoptosis in HT-29 cells[J].Int J Biol Macromol,2017,96(3):766-774.
[7] PACHECO ORDAZ R,WALL MEDRANO A,GOÑI M G,et al. Effect of phenolic compounds on the growth of selected probiotic and pathogenic bacteria[J].Lett Appl Microbiol,2018,66(1):25-31.
[8] WEN K, LI G, BUI T, et al. High dose and low dose Lactobacilli acidophilus exerted differential immune modulating effects on T cell immune responses induced by an oral human rotavirus vaccine in gnotobiotic pigs[J].Vaccine,2012,30(6):1198-1207.
[9] HASANI S,SARI A A,HESHMATI A,et al.Physicochemical and sensory attributes assessment of functional low-fat yogurt produced by incorporation of barley bran and Lactobacillus acidophilus[J].Food Sci Nutr,2017,5(4):875-880.
[10]ZARRATI M,SALEHI E,NOURIJELYANI K,et al.Effects of probiotic yogurt on fat distribution and gene expression of proinflammatory factors in peripheral blood mononuclear cells in overweight and obese people with or without weight-loss diet[J]. J Am Coll Nutr, 2014, 33(6):417-425.
[11]ZHANG L,LI J,YUN T T,et al Effects of pre-encapsulated and pro-encapsulated Enterococcus faecalis on growth performance,blood characteristics,and cecal microflora in broiler chickens[J].Poultry Sci,2015,94(11):2821-2830.
[12]潘秋月,高红岩,南天月,等.益生菌的微胶囊研究进展[J].食品科技,2014,39(7):31-36.
[13]GORANOV B,BLAZHEVA D,KOSTOV G,et al.Lactic acid fermentation with encapsulated Lactobacillus casei ssp.rhamnosus ATCC 11979(NBIMCC 1013) in alginate/ chitosan matrices[J]. Bulgar J Agr Sci,2013,19(2):101-104.
[14]秦腾飞,贠婷婷,王春玲,等.发酵前包被布拉迪酵母生长代谢及其抗逆性机理[J].食品科学,2017,38(22):137-14.
[15]OZYURT V H,ÃTLES S.Properties of probiotics and encapsulated probiotics in food[J]. Acta Scient Polon Technol Aliment, 2014, 13(4):413-424.
[16]张娅,冷一非,李建华,等.响应面法优化嗜酸乳杆菌增殖培养基[J].中国酿造,2011,30(9):134-137.
[17]陈婷,王玉华,蔡丹,等.益生菌微胶囊技术研究进展[J].中国乳品工业,2016,44(1):31-37.
[18]宋娇娇,包秋华,王亚利,等.瑞士乳杆菌MG9-2 微胶囊的制备工艺优化及其性能分析[J].食品科学,2017,38(14):49-57.
[19]贠婷婷.饲用益生菌保护技术的研究进展[C].2017 第二届中国畜牧生物科技大会论文集.北京:中国农业科学院饲料研究所、第十五届中国畜牧业博览会组委会、新饲料传媒,2017.
[20]张琳,贠婷婷,綦文涛,等.发酵前及发酵后包被粪肠球菌微胶囊抗胁迫作用的研究[J].粮油食品科技,2016,24(2):80-84.
[21] DONNARUMMA G, MOLINARO A, CIMINI D, et al. Lactobacillus crispatus L1: high cell density cultivation and exopolysaccharide structure characterization to highlight potentially beneficial effects against vaginal pathogens[J].BMC Microbiol,2014,14(1):137.
[22]吴军林,柏建玲,莫树平,等.乳酸菌R8 高密度培养的发酵工艺研究[J].现代食品科技,2018,34(2):164-170,251.
[23] CHEN H, NIU J, QIN T, et al. Optimization of the medium for Lactobacillus acidophilus by Plackett-Burman and steepest ascent experiment[J].Acta Scient Polon Technol Aliment,2015,14(3):227-232.
[24]ÇABUK B,HARSA S,T.Improved viability of Lactobacillus acidophilus NRRL-B 4495 during freeze-drying in whey protein-pullulan microcapsules[J].J Microencapsul,2015,32(3):300-307.
[25]李卫娟,王计伟,王宇霄,等.粪肠球菌耐热型保护剂的筛选及加速储存稳定性研究[J].食品与发酵工业,2015,41(12):144-147.