木糖的乙醇发酵是木质纤维原料生物转化生产乙醇的重要因素。以农作物秸秆等农业残留物为代表的天然木质纤维素原料中,木糖含量占很大比重,部分微生物可利用木糖发酵生产乙醇。因此选育乙醇产量大的菌种,有助于农业残留物的回收利用并改善环境。
能利用木糖发酵生产乙醇的少数菌种包括休哈塔假丝酵母(Candida albicans),黄达明等[1]分别选取木糖、玉米秸秆和葡萄糖对Candida albicans进行单底物发酵,30 ℃发酵48 h后乙醇含量分别为15.35 g/L、12.38 g/L和21.06 g/L。江枫等[2]共培养Candida albicans及Saccharomyces cerevisiae,并对混合菌固定包埋;葡萄糖及木糖混合物为底物、30 ℃发酵24 h后的乙醇含量为14.89 g/L。李晴等[3]同样共培养Candida albicans及Saccharomyces cerevisiae,葡萄糖及木糖混合物为底物、30 ℃发酵24 h后的乙醇含量为21.84 g/L。蒋发现等[4]在以葡萄糖及木糖混合物为底物的Candida albicans发酵培养基中添加玉米秸秆烯酸处理液,30 ℃发酵36 h后乙醇含量为22.5 g/L。余学军等[5]以竹粉酶解液作为Candida albicans发酵底物,最优发酵条件下,发酵60 h后的乙醇含量为11.56 g/L。余恒等[6]以甘蔗渣浆酶解液作为Candida albicans的发酵底物,30℃发酵18 h后的乙醇含量为22.98g/L。刘红梅[7]以蔗糖渣酶水解液作为酵母菌发酵底物,Candida albicans在30 ℃发酵48 h后的乙醇含量为15.15 g/L,较Pichia stipits高78.24%。
休哈塔假丝酵母(Candida albicans)HDYXHT-01利用80 g/L木糖在30 ℃条件下发酵48 h,最多可得15.31 g/L乙醇。该菌株发酵木糖生产乙醇能力有待加强,这就需要对菌株进行改造。物理诱变因操作简单、易于环保及对人体伤害小等优点得到广泛应用。物理诱变中常用的诱变方式是紫外线诱变,紫外线会使生物体DNA中两个相邻的嘧啶共价连接,形成嘧啶二聚体[8-9]。二聚体的出现会导致生物体DNA中碱基的非正常配对,从而导致突变。He-Ne激光诱变具有稳定性好、无污染等优点,因此也作为物理诱变方式之一[10],低频氦(He)-氖(Ne)激光照射微生物细胞,可使细胞发生形态及生理水平的改变[11];段良和等[12]对Saccharomyces cerevisiae进行He-Ne激光诱变,筛得1株乙醇高产突变株,其乙醇产量较对照株提高7.40%。微波作为低频电磁波,场力和转化能的协同作用导致生物体突变是其作用机理。电磁波作用于生物体能够产生强烈的生物响应,导致生物体生理生化功能发生变化[13-15]。三种物理诱变方式从不同角度改变待测菌株的基因组成。因此,本研究利用3种诱变(紫外线、He-Ne激光和微波)方式,分别对出发菌株HDYXHT-01进行诱变,目的在于获得高产乙醇菌株,并结合试验结果比较不同物理诱变方式对修哈塔假丝酵母产乙醇的影响,最终确定出最佳物理诱变因子。为提高工作效率并进一步对菌株进行改良工作奠定基础,同时对于将农作物秸秆等农业残留物转化为燃料乙醇具有重要的实际应用及节能环保价值[16]。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
休哈塔假丝酵母(Candida albicans)HDYXHT-01:由黑龙江大学微生物重点实验室保藏。
1.1.2 化学试剂
木糖(纯度99%):七台河市美化木糖有限责任公司;酵母粉、蛋白胨(均为生化试剂)、磷酸二氢钾(分析纯)、(NH4)2SO4(分析纯)、MgSO4·7H2O(分析纯):天津市科密欧化学试剂有限公司;2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC):北京索莱宝科技有限公司;琼脂粉(生化试剂):上海生物工程有限公司。
1.1.3 培养基
种子液培养基:木糖10 g/L,酵母粉5 g/L,蛋白胨10 g/L,蒸馏水500 mL。
木糖发酵培养基[17]:木糖40 g/L,酵母粉2.5 g/L,磷酸二氢钾1.34 g/L,(NH)42SO4 0.18 g/L,MgSO·47H2O 0.05 g/L,pH 4.8,蒸馏水500 mL。TTC下层培养基:木糖15 g/L,酵母粉2.5 g/L,磷酸二氢钾1.34 g/L,MgSO4·7H2O 0.05 g/L,(NH4)2SO4 0.18 g/L,琼脂10 g/L,pH 4.8,蒸馏水500 mL。
TTC上层培养基:木糖0.25 g,TTC 0.025 g,琼脂0.75 g,蒸馏水500 mL。
上述培养基均在108 ℃灭菌20 min,固体培养基均添加2%琼脂。
1.2 仪器与设备
JT-150 双人超净工作台:沈阳医用净化设备厂;MLS-3780高压蒸汽灭菌锅:日本SANYO 公司;ZHWY-211C 全温度恒温摇床:上海智城分析仪器制造有限公司;Beckman Coulter AllegarR X-15R 离心机:德国Bechman 公司;HH·Ⅱ420-S 恒温培养箱:上海跃进医疗器械厂;HPX-87H 色谱柱:美国BIO-RAD公司:SCL-10A 高效液相色谱:日本岛津公司;He-Ne激光器:黑龙江大学电子工程学院自制。
1.3 方法
1.3.1 菌种及种子液的制备
菌种活化:接种环挑取4 ℃保藏的斜面菌种并转接于种子液斜面培养基上,于30 ℃培养箱中培养24 h。
种子液的制备:活化好的斜面菌种,接于种子液液体培养基中,装液量为100 mL/250 mL,于30 ℃、160 r/min振荡培养24 h。
发酵培养:种子液以10%接种量接于木糖发酵培养基中,装液量为80mL/250mL,于30℃、160r/min振荡培养48h。
1.3.2 突变株产乙醇能力分析方法
(1)分析方法
发酵液中乙醇及木糖含量采用高效液相色谱(high performance liquid chromatography,HPLC)法检测[18-19]。取1 mL发酵液于1.5 mL离心管中,3 500 r/min、4 ℃离心20 min,取上清液用无菌水稀释100倍后,取1 mL样本用于HPLC进样测定,乙醇出峰时间为16.26min,木糖出峰时间为7.06min。测定结果需要换算成未稀释发酵液成分含量。
HPLC条件:HPX-87H色谱柱(300 mm×7.8 mm),样品上样量20 μL,0.005 mol/L H2SO4作为流动相,流速0.8 mL/min,色谱柱、示差检测器温度分别为:65 ℃、40 ℃,分析时间20 min。
(2)物质含量计算公式
式中:y1为乙醇含量,g/L;x1为乙醇峰面积;y2为木糖含量,g/L;x2为木糖峰面积;y3为乙醇得率,g/g;y4为木糖利用率,%。
1.3.3 诱变试验方法
菌悬液制备:取50 mL对数生长中期的菌液3 500 r/min离心20 min,无菌0.9%NaCl溶液洗涤并重悬菌体,制成浓度为107个/mL的菌悬液。
(1)紫外诱变
在无菌条件下取3 mL菌悬液于直径6 cm且放入无菌大头针的无菌培养皿中,培养皿开盖并置于磁力搅拌器上,15 W紫外灯下30 cm处放置磁力搅拌器。开启磁力搅拌器并开始诱变。诱变时间梯度为0、30 s、40 s、50 s、60 s、70 s、80 s。
(2)He-Ne 激光诱变
取1.5 mL菌悬液于离心管中,3 500 r/min离心20 min后,距离He-Ne激光诱变仪30 cm进行照射,诱变仪功率恒定为15W。照射时间梯度为0、10min、20min、30min、60min、90 min、120 min。
(3)微波诱变
在无菌试管中加入5 mL制备好的菌悬液,将其放入装有蒸馏水的烧杯中,保证烧杯中的水位没过试管中菌悬液的刻度。置于微波处理器(功率800 W、频率2 450 MHz)中,处理时间梯度为0、40 s、60 s、80 s、100 s、120 s、140 s、160 s。
诱变后的菌液,采用10倍稀释法用无菌0.9%NaCl溶液稀释至10-3,取该梯度的菌液100 μL涂布于种子培养基平板上(每个时间点做3组平行试验),置于30 ℃培养箱中培养48 h后,统计平板上长出的菌落个数,计算致死率(紫外线诱变后的该步操作在避光条件下进行,避免光复活)。各物理诱变方式中正突变率最高的诱变时间确定为最适诱变时间。

1.3.4 突变株的筛选方法
初筛:采用TTC作为出发菌株产乙醇能力的显色剂,待平板长出菌落后,将10 mL TTC上层培养基倾倒在其上,置于30 ℃培养箱中培养2~3 h[20]。挑取深红色且菌落较大的突变菌株进行突变株复筛。
复筛:对初筛得到的突变株按1.3.1的方法进行发酵培养。发酵液3 500 r/min、4 ℃离心20 min后,稀释100倍的上清液用于HPLC检测乙醇及木糖含量。选择乙醇含量及木糖利用率均较高的突变株作为目的菌株。
1.3.5 数据处理
数据分析按Duncan's新复极差检测进行数据分析,不同字母表示处理间差异显著;“*”代表t检验表明试验组与对照组之间的差异显著(P<0.05),“**”代表t检验表明试验组与对照组之间的差异极显著(P<0.01)。
2 结果与分析
2.1 紫外线诱变
不同紫外线诱变时间对菌株HDYXHT-01致死率的影响结果见图1。由图1可知,该菌株致死率随紫外线照射时间的延长渐渐升高,在诱变30 s、60 s时菌株致死率分别为51.91%、89.82%,70~80 s时菌株致死率接近100%。

图1 不同紫外线诱变时间对菌株HDYXHT-01致死率的影响
Fig. 1 Effect of different ultraviolet mutagensis time on lethal rate of strain HDYXHT-01
不同紫外线诱变时间对菌株HDYXHT-01诱变效应的影响结果见图2。由图2可知,诱变30~50 s过程中,正突变率渐渐加大,50 s时正突变率最大,为6.62%,50 s后突变株正突变率呈下降趋势,70 s后正突变率为0。因此,确定紫外线对菌株HDYXHT-01的最佳诱变时间为50 s。

图2 不同紫外线诱变时间对菌株HDYXHT-01诱变效应的影响
Fig. 2 Effect of different ultraviolet mutagenesis time on mutagenic effect of strain HDYXHT-01

图3 不同紫外线诱变突变株的木糖利用率
Fig. 3 Xylose utilization rate of different ultraviolet mutants
不同紫外线突变株的木糖利用率结果见图3。由图3可知,紫外线突变株的木糖利用率均有下降,下降范围为0.38%~11.12%。
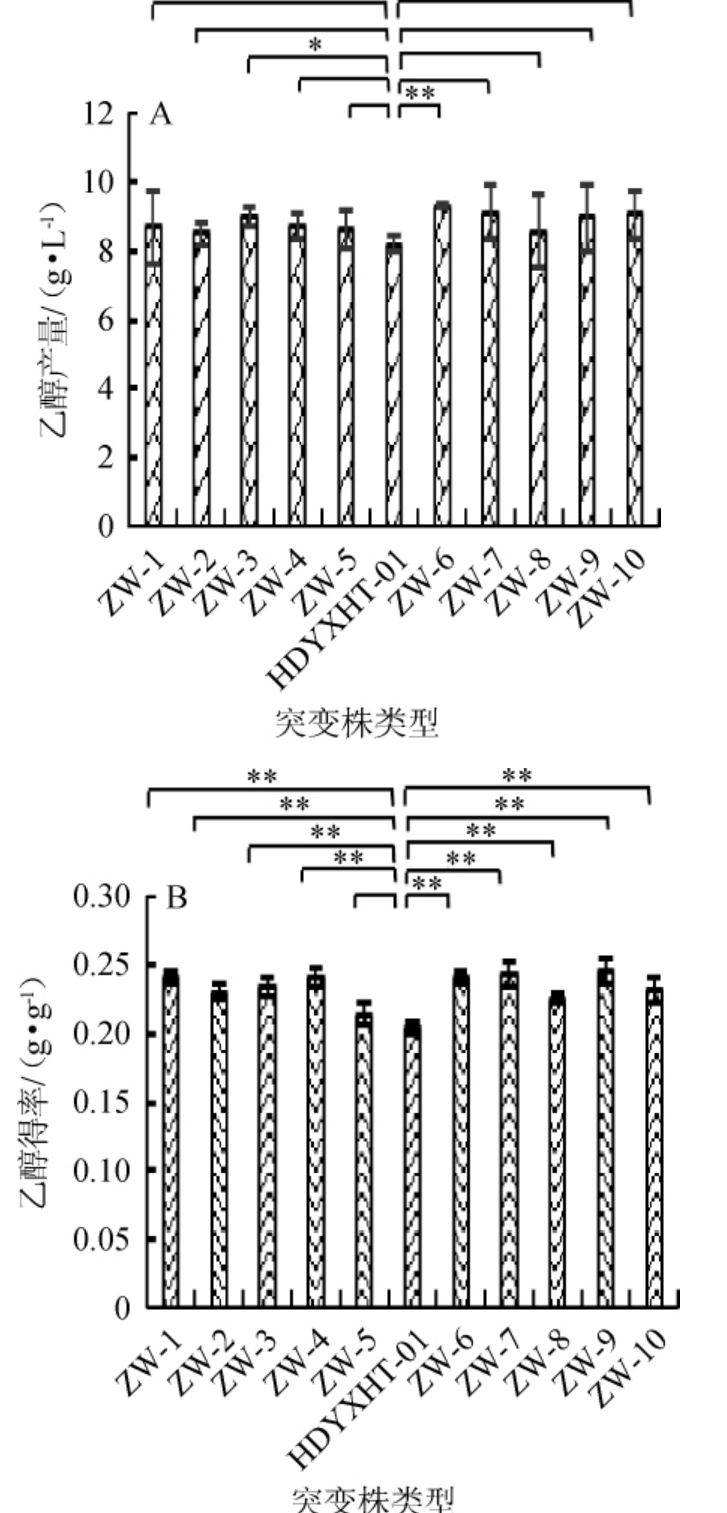
图4 不同紫外线诱变突变株的乙醇产量(A)及得率(B)
Fig. 4 Ethanol production (A) and yield (B) of different UV mutants
不同紫外线突变株的乙醇产量(A)及得率(B)结果见图4。由图4可知,紫外线突变株的乙醇产量及乙醇得率均有不同程度的上升,乙醇产量上升范围在3.03%~12.88%,乙醇得率上升范围在5.05%~20.09%。分析造成这种现象的原因是与Candida albicans代谢木糖产乙醇路径中的关键酶酶活发生变化有关。木糖还原酶(xylosereduetase,XR)及木糖醇脱氢酶(xylitol dehydrogenase,XDH)被认为是Candida albicans木糖代谢途径的两种关键酶[21]。丙酮酸脱羧酶(pyruvate decarboxylase,PDC)及乙醇脱氢酶(alcohol dehydrogenase,ADH)被认为是Candida albicans乙醇生成途径的两种关键酶。本试验中,紫外线突变株的木糖利用率均有下降,表明突变菌株代谢木糖的能力减弱,进一步推测紫外线可能对Candida albicans木糖代谢途径的两种关键酶酶活具有削弱作用;紫外线突变株的乙醇产量及乙醇得率均有不同程度的上升,表明突变菌株生成乙醇能力加强,进一步推测紫外线可能对Candida albicans乙醇生成路径中的两种关键酶酶活具有增强作用。其中菌株ZW-6的乙醇产量最大,达9.29 g/L,乙醇得率为0.239 8 g/g,较原始菌株HDYXHT-01分别提高12.88%和17.78%。
2.2 He-Ne激光诱变
不同He-Ne激光诱变时间对HDYXHT-01致死率的影响结果见图5。由图5可知,前30 min内诱变对菌株的致死效应逐渐增大,致死率逐渐提高,由32.12%上升至46.36%。诱变30 min后,致死率减小,表明菌体恢复生长。随着激光照射时间加长,原始菌株细胞恢复生长效果越发明显,诱变90 min后致死率为负值,随着照射时间进一步加长,原始菌株生长繁殖再次受到抑制,诱变120 min时致死率为-33.61%。结果表明,He-Ne激光可影响原始菌株的生理活性,加快或抑制其生长繁殖。

图5 不同He-Ne激光诱变时间对HDYXHT-01致死率的影响
Fig. 5 Effect of different He-Ne laser mutagenic time on lethal rate of strain HDYXHT-01
不同He-Ne激光诱变时间对HDYXHT-01诱变效应的影响结果见图6。由图6可知,诱变前60 min,正突变率均较高,诱变10 min时正突变率为48.62%,诱变30 min时正突变率为37.61%,诱变60 min时正突变率为24.45%。由此可见,在He-Ne激光诱变的过程中,突变菌株正突变率普遍较高,可能是Candida albicans细胞内乙醇生成路径中关键酶的生理活性与激光剂量直接相关。

图6 不同He-Ne激光诱变时间对HDYXHT-01诱变效应的影响
Fig. 6 Effect of different He-Ne laser mutagenesis time on mutagenic effects of strain HDYXHT-01
不同He-Ne激光诱变突变株的木糖利用率结果见图7。由图7可知,He-Ne激光诱变突变株,木糖利用率均有上升,上升范围为1.69%~44.77%。表明突变株的木糖代谢能力增强,进一步推测造成这种现象的原因可能是He-Ne激光对原始菌株木糖代谢途径的两种关键酶酶活具有增强作用。

图7 不同He-Ne激光诱变突变株的木糖利用率
Fig. 7 Xylose utilization rate of different He-Ne laser mutagenized mutants
不同He-Ne激光诱变突变株的乙醇产量(A)及得率(B)结果见图8。

图8 不同He-Ne激光诱变突变株的乙醇产量(A)及得率(B)
Fig. 8 Ethanol production (A) and yield (B) of different He-Ne laser mutagenized mutants
由图8可知,突变菌株的乙醇产量及乙醇得率均有提高。提高最多的为菌株HN-3,乙醇产量达17.34 g/L,乙醇得率为0.351 8 g/g,较原始菌株分别提高39.61%和44.75%。
2.3 微波诱变
不同微波诱变处理时间对HDYXHT-01致死率的影响结果见图9。由图9可知,该菌株致死率随诱变时间的增长渐渐加大。诱变40 s时致死率为44.94%,诱变80 s时致死率达67.29%;诱变140 s后致死率上升幅度减小且接近100%。

图9 不同微波诱变处理时间对HDYXHT-01致死率的影响
Fig. 9 Effect of different microwave mutagenesis time on lethal rate of strain HDYXHT-01
不同微波诱变时间对HDYXHT-01诱变效应的影响结果见图10。由图10可知,诱变40~100 s过程中,正突变率渐渐加大,100 s时正突变率最大为20.44%。100 s后正突变率呈下降趋势,160 s时正突变率达到最低为3.03%。因此,确定微波对菌株HDYXHT-01的最佳诱变时间为100 s。

图10 不同微波诱变时间对HDYXHT-01诱变效应的影响
Fig. 10 Effect of different microwave mutagenesis time on mutagenic effects of strain HDYXHT-01
不同微波诱变突变株的木糖利用率结果见图11。由图11可知,相比于原始菌株,就木糖利用率而言,菌株WB-4、WB-6、WB-7分别提高3.43%、2.15%、3.61%;其余6株微波突变菌株木糖利用率均有下降,下降范围在3.11%~15.19%。
不同微波诱变突变株的乙醇产量(A)及得率(B)结果见图12。

图11 不同微波诱变突变株的木糖利用率
Fig. 11 Xylose utilization rate of different microwave mutagenized mutants

图12 不同微波诱变突变株的乙醇产量(A)及得率(B)
Fig. 12 Ethanol production (A) and yield (B) of different microwave mutagenized mutants
由图12可知,就乙醇产量而言,除菌株WB-8乙醇产量下降3.01%外其余突变株均有提高,范围在2.94%~11.31%,进一步推测造成这些现象的原因是微波可能对出发菌株木糖代谢途径及乙醇生成路径中的几种关键酶酶活的增强或削弱作用具有随机性,其中WB-3的乙醇产量最高,达17.03 g/L,较原始菌株提高11.31%;就乙醇得率而言,各突变株的乙醇得率均有提高,范围在0.74%~20.36%。
3 几种物理诱变方法的比较
不同突变株的木糖利用率结果见图13。由图13可知,菌株HN-3的木糖利用率较原始菌株提高0.13%,菌株ZW-6、WB-3的木糖利用率分别较原始菌株降低1.92%、0.97%。不同突变株的乙醇产量(A)及得率(B)结果见图14。
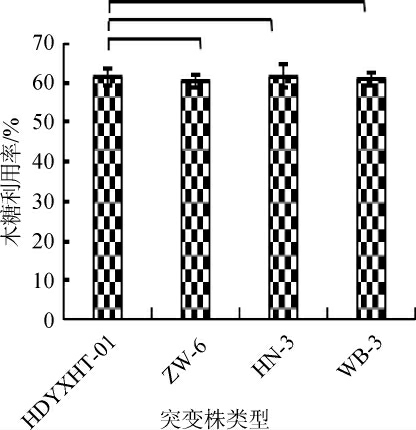
图13 不同突变株的木糖利用率
Fig. 13 Xylose utilization rate of different mutants

图14 不同突变株的乙醇产量(A)及得率(B)
Fig. 14 Ethanol production (A) and yield (B) of different mutants
由图14可知,菌株ZW-6、HN-3、WB-2的乙醇产量及得率均有不同程度的上升。菌株ZW-6、HN-3、WB-2的乙醇产量分别为17.44 g/L、18.49 g/L、18.11 g/L,分别较原始菌株提高13.91%、20.77%、18.29%;菌株ZW-6、HN-3、WB-2的乙醇得率分别为0.353 7 g/g、0.382 8 g/g、0.371 4 g/g,分别较原始菌株提高13.80%、23.17%、19.50%。
4 结论
本研究以休哈塔假丝酵母(Candida albicans)HDYXHT-01作为出发菌株,采用紫外线、He-Ne激光、微波三种不同的物理诱变方式对其进行诱变,目的在于选育高产乙醇菌株的同时确定最佳的物理诱变因子。结果表明,与紫外线及微波各诱变菌株相比,He-Ne激光诱变菌株的正突变率高,激光照射10 min时,正突变率高达48.62%;He-Ne激光诱变菌株的木糖利用率、乙醇产量、乙醇得率均提高最多,提高的范围最大,分别较原始菌株提高1.69%~44.77%、13.12%~40.59%、29.73%~47.75%。因此,确定He-Ne激光为最佳物理诱变因子。最佳物理诱变因子的确定为提高科研工作效率及进一步对菌株进行改造工作奠定基础;木糖利用率及乙醇产量高的突变菌株的获得,在为利用休哈塔假丝酵母大规模生产乙醇提供数据参考的同时,有助于农业残留物的回收利用做到节能减排,并具有一定意义的环保价值。
[1]黄达明,王美娟,管国强,等.运动发酵单胞菌和休哈塔假丝酵母混合发酵秸秆产乙醇[J].食品与发酵工业,2017,43(1):31-36.
[2]江枫,房伶晏,王浩,等.固定化混合菌利用戊糖和己糖共发酵制备乙醇[J].林业工程学报,2017,2(4):90-95.
[3]李晴,宋向阳,范晓阳,等.混菌戊糖己糖发酵产乙醇的研究[J].林产化学与工业,2015,35(2):111-116.
[4]蒋发现,黄萍,徐勇,等.稀酸预处理玉米秸秆共发酵产乙醇抑制物的来源探究[J].林产化学与工业,2015,35(4):85-91.
[5]余学军,张帆.在第十一届中国林业青年学术年会第8 分会场上的讲话[C]//中国林业青年学术年会第8 分会场论文集选.北京:中国林学会,2014:263-269.
[6]余恒,刘宝田,欧阳嘉.亚硫酸盐甘蔗渣浆酶解液发酵制备乙醇[J].生物加工过程,2013,11(5):7-10.
[7]刘红梅.多菌种混合共发酵甘蔗渣纤维素和半纤维素制备燃料乙醇的研究[D].广州:暨南大学,2015.
[8] GUO X, LIU Z, SONG Q, et al. Dynamics and mechanism of UV-damaged DNA Repair in indole-thymine dimer adduct:molecular origin of low repair quantum efficiency[J].J Phys Chem B,2015,119(8):3446-3355.
[9]吴雪昌,汪志芸,周婕,等.提高产抗生素链霉菌紫外诱变正变率的研究[J].遗传,2004,26(4):499-504.
[10]陈恒雷,徐辉,吕长武,等.激光诱变育种的研究概况[J].激光生物学报,2006,15(4):436-440.
[11]汪峰.氦氖激光器谐振腔调试实验的改进及研究[J].山东工业技术,2016(4):228.
[12]段良和,雷玉明,陈有为.氦氖激光对酒精酵母菌刺激效应的研究[J].昆明理工大学学报,1997,22(4):116-119.
[13]杜康,李广悦,丁德馨,等.产脲酶芽胞杆菌的微波诱变育种[J].微生物学杂志,2016,36(3):20-23.
[14]吴殿恺.微波诱变的实验研究与理论探讨[J].哈尔滨工业大学学报,1981(3):91-102.
[15]贾红华,周华,韦萍.微波诱变育种研究及应用进展[J].工业微生物,2003,33(2):46-50.
[16]葛菁萍,孙红兵,王轶男,等.氖激光和亚硝基胍复合诱变选育高产乙醇的休哈塔假丝酵母[J].激光生物学报,2011,20(3):292-298.
[17] MOHAGHEGHIA, EVANSK, CHOU Y C, et al. Cofermentation of glucose, xylose, and arabinose by genomic DNA-integrated xylose/arabinose fermenting strain of Zymomonas mobilis AX01[J].Appl Biochem Biotechnol,2002,98-100(1-9):885-898.
[18]宋莲芳.HPLC 法测定木糖母液中的糖组分[J].安徽化工,2016,42(1):88-90.
[19]刘文信.HPLC 在酒精发酵醪液检测中的应用[J].化学工程师,2013,27(2):28-30.
[20]MARIS A J A,WINKLER A A,KUYPER M,et al.Development of efficient xylose fermentation in Saccharomyces cerevisiae: Xylose isomerase as a key component[J].Biofuels,2007,108:179-204.
[21]杜仁鹏,黄守峰,裴芳艺,等.休哈塔假丝酵母木糖还原酶基因(xyl1)的克隆与序列分析[J].中国农学通报,2015,31(11):124-129.