β-甘露聚糖酶是一类能够水解含β-1,4-D-甘露糖苷键的内切水解酶[1],可以水解葡萄甘露聚糖、甘露聚糖、半乳甘露聚糖及半乳葡萄甘露聚糖等,广泛存在于自然界中。目前,β-甘露聚糖酶被用于多个领域,包括食品、饲料、医药、造纸、石油开采等领域[2-4],具有良好的应用前景。
代谢通量分析包括基于物料平衡的代谢通量、基于同位素示踪的代谢通量和基于基因组尺度的代谢通量,是研究代谢工程的一种重要的方法[5]。物料平衡代谢通量分析是基于化学计量系数的研究方法,它根据细胞内所有的生化反应方程式建立数学平衡模型,计算胞内外物质的代谢通量,基于物料平衡的代谢通量已被广泛应用于多项研究[6-9],然而关于β-甘露聚糖酶的代谢流的研究却鲜有报道[10]。本研究建立并验证了基因工程大肠杆菌(Escherichia coli)BL21产β-甘露聚糖酶的代谢流模型,分析菌体比生长速率和β-甘露聚糖酶合成通量最大时的极端代谢流分布,并对代谢网络节点(葡糖糖-6-磷酸、丙酮酸)进行分析,为基因工程大肠杆菌BL21产β-甘露聚糖酶的研究提供了理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
基因工程大肠杆菌BL21(含枯草芽孢杆菌(Bacillus subtilis)168来源的β-甘露聚糖酶基因):由安琪酵母菌种保藏中心提供,具有氨苄抗性。
1.1.2 培养基
斜面培养基:酵母蛋白胨10 g,NaCl 10 g,酵母抽提物5 g,琼脂粉15 g,121 ℃灭菌15 min。
种子培养基[11]:甘油8.00 g,酵母抽提物17.50 g,酵母蛋白胨7.50 g,NaCl 6.00 g,Na2HPO4 8.50 g,KH2PO4 4.25 g,K2HPO4 4.25 g,MgSO4 1.00 g,pH 7.0,121 ℃灭菌15 min。
发酵培养基:葡萄糖20.00 g,酵母抽提物13.32 g,Na2HPO·412H2O 17.10 g,KH2PO4 3.00 g,NaCl 0.50 g,MgSO4 0.24 g,微量元素10.00 mL/L,pH 7.0,121 ℃灭菌15 min。
微量元素[12]:FeCl3 1.23 g,Na2MoO4 0.06 g,ZnCl2 0.36 g,CuCl2 0.043 g,CaCl2 0.16 g,CoCl2 0.06 g,MnCl2 0.10 g,121 ℃灭菌15 min。
1.1.3 试剂
氨苄西林钠(分析纯):中诺药业(石家庄)有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG):上海源叶生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
FUS-50 L(A)型新概念发酵罐:上海国强生化工程装备有限公司;PAS7000型生物尾气分析仪:重庆哈特曼科技有限公司;ZHWY-211D脚踏开门型大容量全温度恒温摇床:上海智城生物科技有限公司;SP-754型紫外可见光分光光度计:上海天普分析仪器有限公司;Chromaster高效液相色谱(high performance liquid chromatography,HPLC)仪:日立高新技术公司。
1.3 方法
1.3.1 培养方法
一级种子液:将斜面上的菌种接种至装液量为25 mL的250 mL三角瓶中,于37 ℃、200 r/min条件下培养24 h。
二级种子液:将一级种子液接种至装液量为500 mL的5 L三角瓶中,接种量4%(V/V),于37 ℃、200 r/min条件下培养24 h。
分批发酵:将二级种子液按4%(V/V)的接种量接入新概念发酵罐中,装液量为30 L,转速为200 r/min,通气量1.67 vvm,0.035 MPa条件下发酵培养12 h,第2小时末加入终浓度为0.4 mmol/L的IPTG(过滤灭菌)诱导β-甘露聚糖酶表达。
1.3.2 分析方法
葡萄糖含量:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法进行测定[13];菌体浓度:采用分光光度计法测定[14],细胞干质量由干质量(y)与菌体浓度(x)的回归方程(y=0.441 86x-0.006 34)计算得到;乙酸含量:采用HPLC法测定[15];β-甘露聚糖酶活力:参考文献[16]。CO2释放速率:由Biostar 1.5在线分析控制系统计算。
t时刻的葡萄糖摄取通量[mmol(/g·h)]、乙酸分泌通量[mmol/(g·h)]、菌体合成通量(h-1)及CO2释放通量[mmol/(g·h)]的计算公式分别见(1)、(2)、(3)、(4)。

1.3.3 模型的构建与运算
ÖZKAN P等[17]已报道了重组大肠杆菌BL21表达外源蛋白质的模型,本研究在其基础上简化合并了部分代谢通路,并将β-甘露聚糖酶的代谢途径加入到简化的代谢网络中,构建了重组大肠杆菌BL21产β-甘露聚糖酶的代谢网络见图1。该代谢网络包括糖酵解(embden-meyerhof-parnas,EMP)途径、戊糖磷酸途径(hexose monophosphate pathway,HMP)、柠檬酸循环(citric acid cycle,TCA)、氨基酸和乙酸合成途径、回补反应、磷酸烯醇式丙酮酸-糖磷酸转移酶系统(phosphoenolpyruvate:carbohydrate phosphotransferase system,PTS)、菌体合成以及β-甘露聚糖酶的合成途径8个部分,共41个反应(表1),也即41个未知反应通量。

图1 大肠杆菌BL21合成β-甘露聚糖酶的代谢途径
Fig. 1 Metabolic pathway of the β-mannanase production by Escherichia coli BL21
表1 代谢模型的反应式
Table 1 Reaction formulas of metabolic model
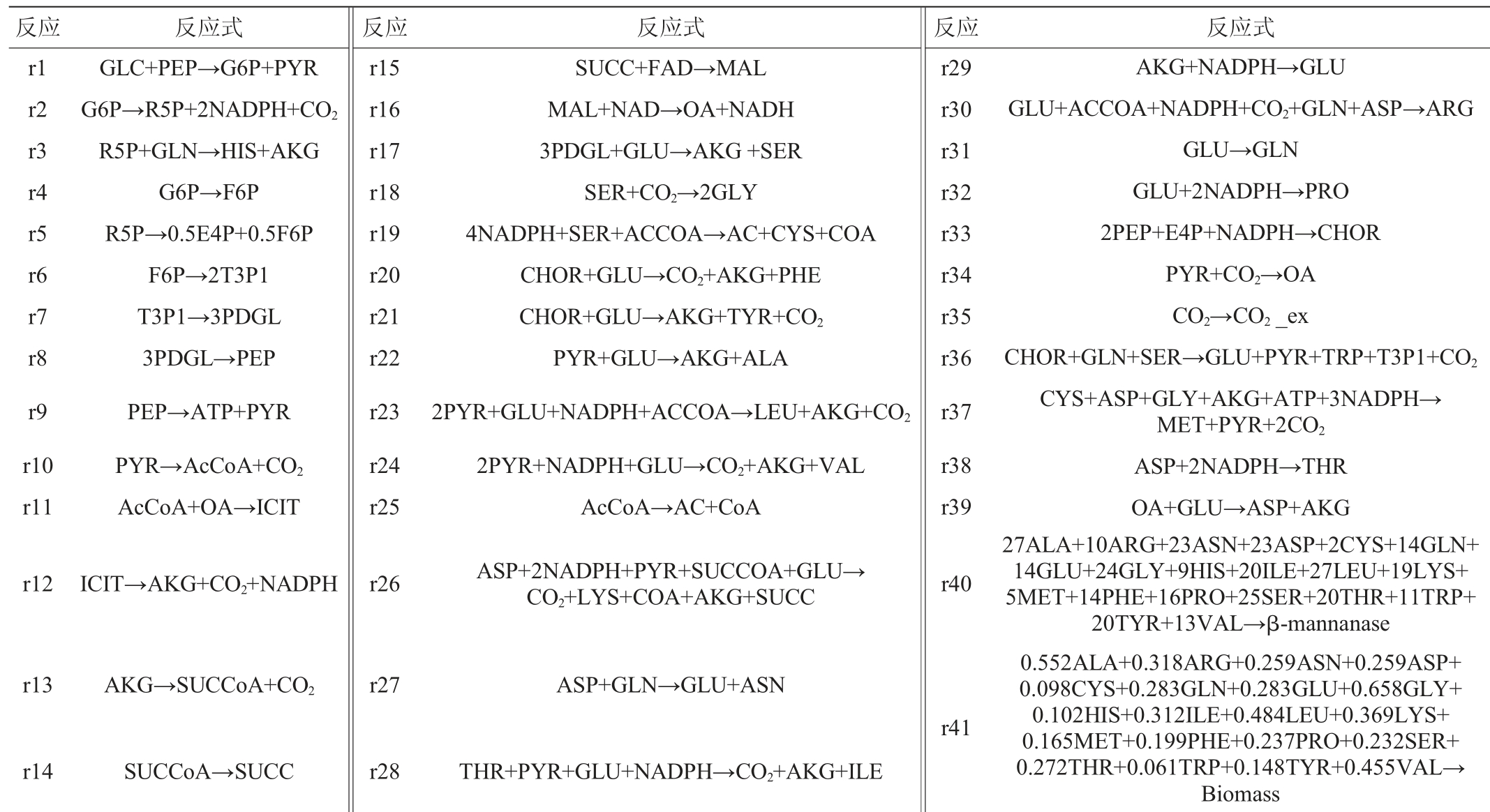
反应 反应式 反应 反应式 反应 反应式r1 r2 r3 r4 r5 r6 r7 r8 r9 r10 r11 GLC+PEP→G6P+PYR G6P→R5P+2NADPH+CO2 R5P+GLN→HIS+AKG G6P→F6P R5P→0.5E4P+0.5F6P F6P→2T3P1 T3P1→3PDGL 3PDGL→PEP PEP→ATP+PYR PYR→AcCoA+CO2 AcCoA+OA→ICIT r15 r16 r17 r18 r19 r20 r21 r22 r23 r24 r25 SUCC+FAD→MAL MAL+NAD→OA+NADH 3PDGL+GLU→AKG+SER SER+CO2→2GLY 4NADPH+SER+ACCOA→AC+CYS+COA CHOR+GLU→CO2+AKG+PHE CHOR+GLU→AKG+TYR+CO2 PYR+GLU→AKG+ALA 2PYR+GLU+NADPH+ACCOA→LEU+AKG+CO2 2PYR+NADPH+GLU→CO2+AKG+VAL AcCoA→AC+CoA r29 r30 r31 r32 r33 r34 r35 r36 r37 r38 r39 r12 ICIT→AKG+CO2+NADPH r26 ASP+2NADPH+PYR+SUCCOA+GLU→CO2+LYS+COA+AKG+SUCC r40 r13 AKG→SUCCoA+CO2 r27 ASP+GLN→GLU+ASN r41 r14 SUCCoA→SUCC r28 THR+PYR+GLU+NADPH→CO2+AKG+ILE AKG+NADPH→GLU GLU+ACCOA+NADPH+CO2+GLN+ASP→ARG GLU→GLN GLU+2NADPH→PRO 2PEP+E4P+NADPH→CHOR PYR+CO2→OA CO2→CO2_ex CHOR+GLN+SER→GLU+PYR+TRP+T3P1+CO2 CYS+ASP+GLY+AKG+ATP+3NADPH→MET+PYR+2CO2 ASP+2NADPH→THR OA+GLU→ASP+AKG 27ALA+10ARG+23ASN+23ASP+2CYS+14GLN+14GLU+24GLY+9HIS+20ILE+27LEU+19LYS+5MET+14PHE+16PRO+25SER+20THR+11TRP+20TYR+13VAL→β-mannanase 0.552ALA+0.318ARG+0.259ASN+0.259ASP+0.098CYS+0.283GLN+0.283GLU+0.658GLY+0.102HIS+0.312ILE+0.484LEU+0.369LYS+0.165MET+0.199PHE+0.237PRO+0.232SER+0.272THR+0.061TRP+0.148TYR+0.455VAL→Biomass
采用CellNetAnalyzer 2018.1[18]计算代谢通量,将41个反应式输入CellNetAnalyzer,软件显示代谢网络的自由度为3,即需要3个反应通量即可求出所有41个未知通量。在本研究中,选择葡萄糖摄取通量、乙酸分泌通量和菌体合成通量3个外部可测通量,求解整个代谢通量的分布。
2 结果与分析
2.1 模型的验证
为了验证模型的准确性,将葡萄糖摄取通量(r1)、乙酸分泌通量(r25)和菌体合成通量(r41)输入至CellNetAnalyzer,从而获得整个代谢网络每步反应(r1~r41)的代谢通量。通过比较计算获得的CO2释放通量(r35)和实验测定获得的CO2释放通量,验证模型的可靠性。每小时重组菌E.coli BL21分批发酵产生的葡萄糖、乙酸、菌体干质量和CO2释放速率及其代谢通量的测定结果见表2。
表2 部分物质的含量及代谢通量测定结果
Table 2 Determined results of concentrations and metabolic fluxes of some substances
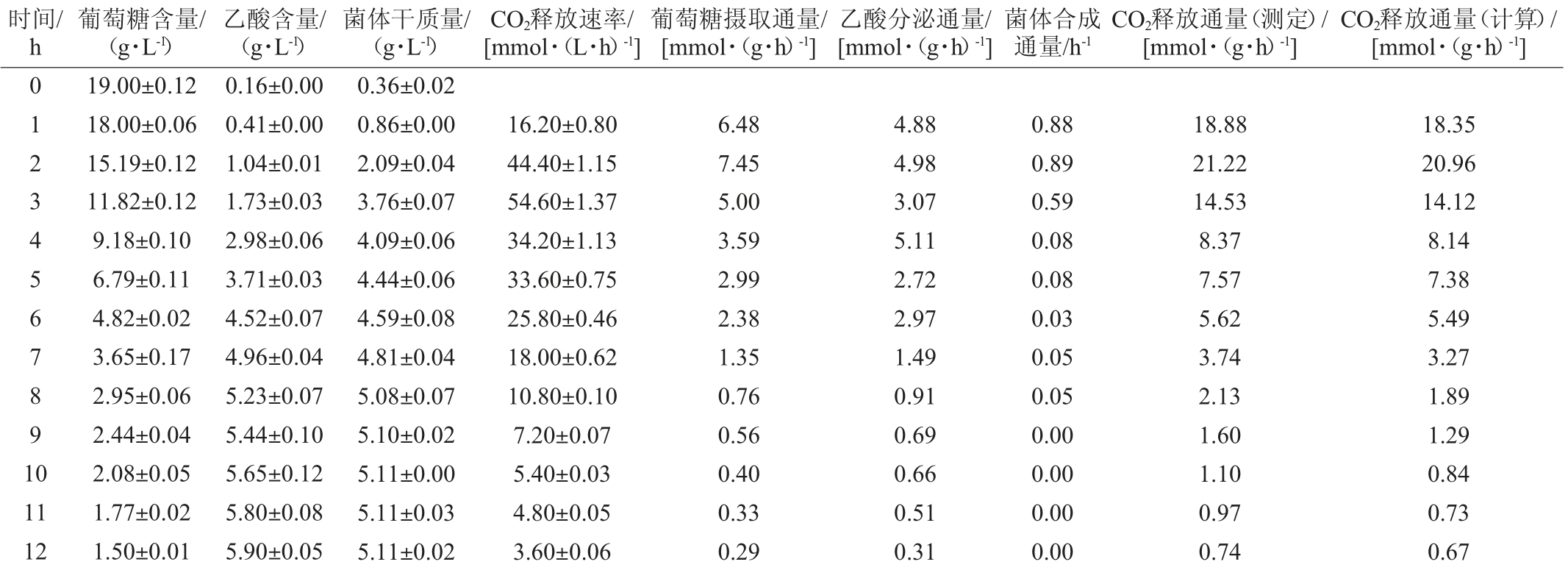
时间/h葡萄糖含量/(g·L-1)乙酸含量/(g·L-1)菌体干质量/(g·L-1)CO2释放速率/[mmol·(L·h)-1]葡萄糖摄取通量/[mmol·(g·h)-1]乙酸分泌通量/[mmol·(g·h)-1]菌体合成通量/h-1 CO2释放通量(测定)/[mmol·(g·h)-1]CO2释放通量(计算)/[mmol·(g·h)-1]012 19.00±0.12 18.00±0.06 15.19±0.12 0.16±0.00 0.41±0.00 1.04±0.01 0.36±0.02 0.86±0.00 2.09±0.04 16.20±0.80 44.40±1.15 6.48 7.45 4.88 4.98 0.88 0.89 18.88 21.22 18.35 20.96 34567891 0 11 12 11.82±0.12 9.18±0.10 6.79±0.11 4.82±0.02 3.65±0.17 2.95±0.06 2.44±0.04 2.08±0.05 1.77±0.02 1.50±0.01 1.73±0.03 2.98±0.06 3.71±0.03 4.52±0.07 4.96±0.04 5.23±0.07 5.44±0.10 5.65±0.12 5.80±0.08 5.90±0.05 3.76±0.07 4.09±0.06 4.44±0.06 4.59±0.08 4.81±0.04 5.08±0.07 5.10±0.02 5.11±0.00 5.11±0.03 5.11±0.02 54.60±1.37 34.20±1.13 33.60±0.75 25.80±0.46 18.00±0.62 10.80±0.10 7.20±0.07 5.40±0.03 4.80±0.05 3.60±0.06 5.00 3.59 2.99 2.38 1.35 0.76 0.56 0.40 0.33 0.29 3.07 5.11 2.72 2.97 1.49 0.91 0.69 0.66 0.51 0.31 0.59 0.08 0.08 0.03 0.05 0.05 0.00 0.00 0.00 0.00 14.53 8.37 7.57 5.62 3.74 2.13 1.60 1.10 0.97 0.74 14.12 8.14 7.38 5.49 3.27 1.89 1.29 0.84 0.73 0.67
由表2可知,重组大肠杆菌BL21分批发酵0~12 h过程中,每个时刻计算得到的CO2释放通量与实验测定的每个时刻CO2释放通量无显著性差异(P>0.05),即由模型计算得到的CO2释放通量可以准确反映实际CO2释放通量,说明重组大肠杆菌产β-甘露聚糖酶的模型是可靠的,可以被用于大肠杆菌BL21产β-甘露聚糖酶的代谢流分析。
2.2 极端代谢流分布
2.2.1 菌体合成通量最大时的极端代谢流分布
在代谢网络中,由于代谢流的外溢造成底物浪费,降低了底物转化率,所以为了获得最大的菌体合成通量代谢流分布,将r25假设为0,即将乙酰辅酶A转化为乙酸的代谢通量假设为0。同时,令r40=0,也即β-甘露聚糖酶的通量为0,此时,计算得到的通量分布即为菌体合成通量最大时菌体代谢通量的分布。以葡萄糖通量为对照,标准化乙酸分泌和菌体合成通量。计算得到的41个反应的代谢通量,结果如表3所示。
表3 两种极端代谢流分布
Table 3 Distributions of two kind of extreme metabolic fluxes
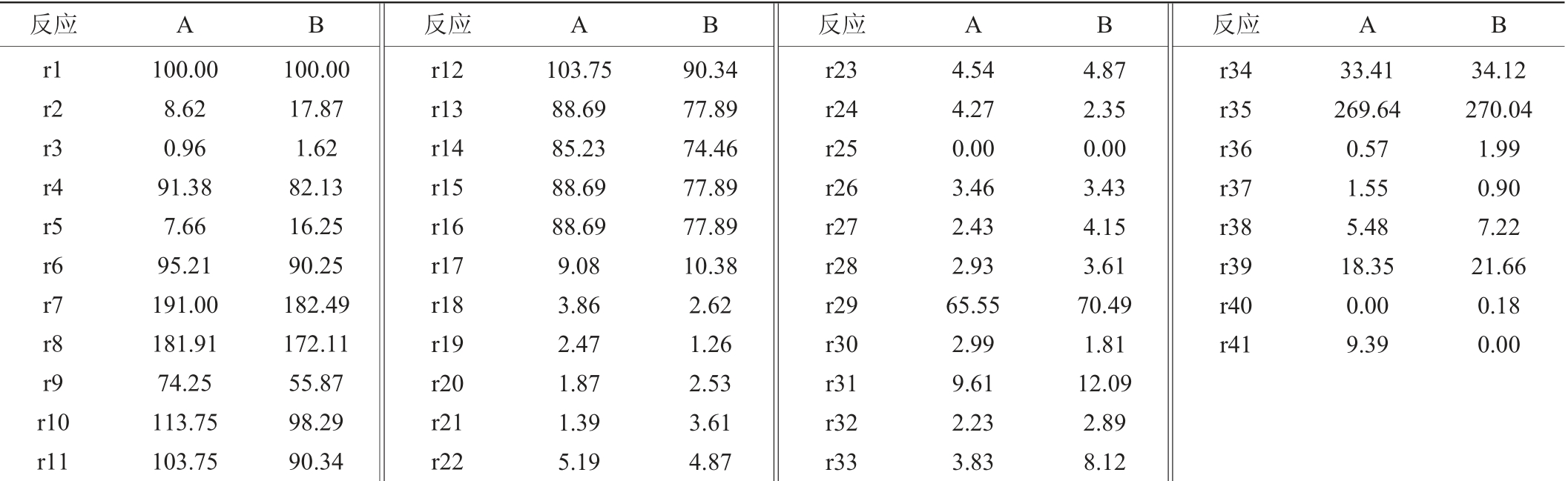
注:表中A为菌体合成通量最大时的极端代谢流分布;B为β-甘露聚糖酶合成通量最大时的极端代谢流分布;其中菌体合成通量的单位是h-1,其他通量单位均为mmol·(g·h)-1。
反应 A B 反应 A B 反应 A B 反应 A B r1 r2 r3 r4 r5 r6 r7 r8 r9 r10 r11 100.00 8.62 0.96 91.38 7.66 95.21 191.00 181.91 74.25 113.75 103.75 100.00 17.87 1.62 82.13 16.25 90.25 182.49 172.11 55.87 98.29 90.34 r12 r13 r14 r15 r16 r17 r18 r19 r20 r21 r22 103.75 88.69 85.23 88.69 88.69 9.08 3.86 2.47 1.87 1.39 5.19 90.34 77.89 74.46 77.89 77.89 10.38 2.62 1.26 2.53 3.61 4.87 r23 r24 r25 r26 r27 r28 r29 r30 r31 r32 r33 4.54 4.27 0.00 3.46 2.43 2.93 65.55 2.99 9.61 2.23 3.83 4.87 2.35 0.00 3.43 4.15 3.61 70.49 1.81 12.09 2.89 8.12 r34 r35 r36 r37 r38 r39 r40 r41 33.41 269.64 0.57 1.55 5.48 18.35 0.00 9.39 34.12 270.04 1.99 0.90 7.22 21.66 0.18 0.00
由表3可知,当乙酸分泌通量和β-甘露聚糖酶合成通量均为0时,理论最大菌体合成通量r41为9.39 h-1。此时,流经HMP途径的通量r2为8.62 mmol(/g·h),流经EMP途径的通量r4为91.38 mmol(/g·h),也即8.62%的底物分配到HMP途径,91.38%的底物分配到EMP途径。此外进入TCA循环的流量r11为103.75 mmol(/g·h),但是考虑到葡萄糖经EMP途径进入TCA循环途径时,一分子的葡萄糖会变为为两分子的丙酮酸,所以真实分配到TCA循环途径的底物占初始底物的51.88%。
在生化网络中,EMP途径和TCA循环主要为细胞提供能量和部分前体物质,而HMP途径的生物学意义主要在于提供给细胞还原力和核酸合成前体[19]。根据代谢流分布结果可知,大量的底物被分配到EMP途径和TCA循环进行有氧呼吸,用来产生大量的三磷酸腺苷(adenosine triphosphate,ATP),这说明菌体生长需要大量的ATP供应。只有<9%的底物被分配到HMP途径,用来产生菌体增殖所必须的还原力和核酸。另外,由于丙酮酸是多种氨基酸生物合成的前体,所以丙酮酸流向TCA循环的流量被分流到氨基酸合成,导致TCA循环途径流量变小。
2.2.2 β-甘露聚糖酶合成通量最大时的极端代谢流分布
为了获得最大β-甘露聚糖酶合成通量,令r25=0且r41=0,也即乙酰辅酶A转化为乙酸的代谢通量和菌体合成通量均为0。以葡萄糖通量为对照,标准化乙酸分泌和菌体合成通量。计算得到的41个反应的代谢通量,结果如表3所示。
由表3可知,当乙酸分泌和菌体合成通量均为0时,理论最大β-甘露聚糖酶合成通量r41为0.18 mmol(/g·h)。此时,流经HMP途径的通量r2为17.87 mmol(/g·h),流经EMP途径的通量r4为82.13 mmol(/g·h),也即17.87%的底物分配到HMP途径,82.13%的底物分配到EMP途径。
根据HMP途径和EMP途径流量分配结果来看,在菌体表达外源蛋白β-甘露聚糖酶时,仍然有大量的底物被分解代谢产生能量供菌体合成β-甘露聚糖酶使用,同时,当β-甘露聚糖酶合成通量最大时,有17.87%的底物分配到HMP途径,与表3A中的HMP途径的通量相比,表3中HMP途径的通量增加了107.31%。说明当菌体进行外源蛋白β-甘露聚糖酶表达时,菌体对HMP途径产生还原力的需求更旺盛。
2.3 代谢节点分析
葡萄糖-6-磷酸连接着糖酵解途径和戊糖磷酸途径;丙酮酸连接着糖酵解途径、柠檬酸循环途径和部分氨基酸合成途径;这两个节点在生化网络中是关键性的节点,所以选择这两个节点进行分析。
2.3.1 葡糖糖-6-磷酸节点代谢流分析
两种不同极端代谢流在葡萄糖-6-磷酸节点的流向如图2所示,葡萄糖-6-磷酸一部分流向果糖-6-磷酸进入糖酵解途径,另一部分流向核糖-5-磷酸进入戊糖磷酸途径。
由图2可知,在两种极端代谢流分布情况下,葡萄糖-6-磷酸代谢流进入糖酵解途径(91.38/82.13mmol(/g·h))都占主导地位,剩余部分进入磷酸戊糖途径(8.62/17.87mmol(/g·h)),但两种情况下的代谢流分配仍有差异。进入糖酵解途径的代谢流在以菌体合成为主时较高,相反,进入戊糖磷酸途径的代谢流在以β-甘露聚糖酶合成为主时较高。结果表明,无论是合成菌体还是合成外源蛋白β-甘露聚糖酶,都需要大量的能量供给,并且在合成β-甘露聚糖酶时,菌体对戊糖磷酸途径的依赖性更高,同时也表明,葡萄糖-6-磷酸节点是一个受外界调控的节点。
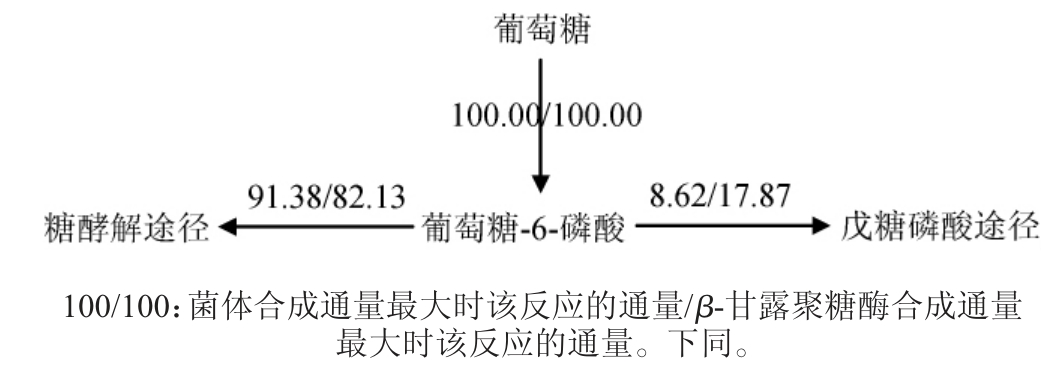
图2 葡糖糖-6-磷酸节点代谢流分布
Fig. 2 Metabolic flux distributions at glucose-6-phosphate node
2.3.2 丙酮酸节点代谢流分析
丙酮酸节点代谢流分布如图3所示,共有5部分构成,包括葡萄糖、磷酸烯醇式丙酮酸、草酰乙酸、乙酰辅酶A、氨基酸。
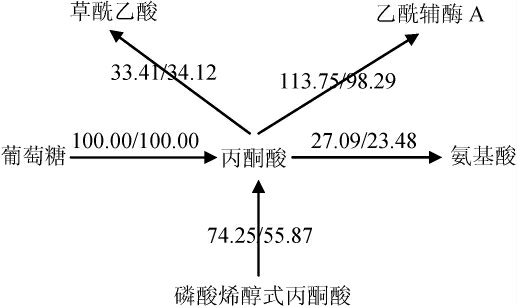
图3 丙酮酸节点代谢流分布
Fig. 3 Metabolic flux distributions at pyruvate node
由图3可知,由于两种极端情况下,葡萄糖-6-磷酸节点流向糖酵解的通量不同(91.38/82.13 mmol(/g·h)),导致了两种极端情况下磷酸烯醇式丙酮酸流向丙酮酸通量的差异(74.25/55.87 mmol(/g·h)),也间接导致了丙酮酸流向乙酰辅酶A通量的差异(113.75/98.29 mmol(/g·h))。在两种极端条件下,丙酮酸流向草酰乙酸的通量是极度保守的(33.41/34.12 mmol(/g·h)),同时流向氨基酸的通量差异也很小(27.09/23.48 mmol(/g·h)),这些现象证实了丙酮酸节点是一个刚性节点,不受外界调控,与QUIRÓS M等[20]的研究结果一致。
3 结论
本研究成功构建了基因工程大肠杆菌(Escherichia coli)BL21合成β-甘露聚糖酶的代谢网络,建立了基于物料平衡的代谢流模型,并通过分批发酵验证模型是可靠的,应用该模型计算出最大菌体合成通量为9.39 h-1,最大β-甘露聚糖酶合成通量为0.18 mmol(/g·h)。菌体在合成β-甘露聚糖酶时,流向HMP途径的碳骨架增加了107.31%,HMP途径更为活跃。葡萄糖-6-磷酸节点是一个可调控的节点,而丙酮酸节点受外界环境调控较小,为理性改造产β-甘露聚糖酶大肠杆菌提供了理论基础,同时也为β-甘露聚糖酶的生产指明了调控方向。
[1]郭尚旭,王瑶,那金,等.细菌β-甘露聚糖酶研究进展[J].中国农学通报,2017,33(27):61-65.
[2]许牡丹,杨伟东,许宝红,等.微生物β-甘露聚糖酶的制备与应用研究进展[J].动物医学进展,2006,27(9):31-34.
[3]杨苗.β-甘露聚糖酶产生菌的筛选鉴定、产酶条件优化及酶学特性研究[D].武汉:湖北工业大学,2016.
[4]唐存多.β-甘露聚糖酶的基因克隆、分子改造及低聚甘露糖的酶法制备[D].无锡:江南大学,2013.
[5]高振,熊强,徐晴,等.代谢通量分析在酶合成过程中的应用研究进展[J].化工进展,2013,32(7):1625-1628.
[6]李智涛,卢志洪,吕扬勇,等.谷氨酸棒杆菌S9114 在不同溶氧条件下发酵生产谷氨酸的代谢流分析[J].中国酿造,2010,29(10):72-76.
[7]张洪志,徐庆阳,曹华杰,等.α-淀粉酶抑制剂生物合成途径和代谢流分析[J].食品科学,2017,38(4):118-124.
[8] SARMA S, ANAND A, DUBEY V K, et al. Metabolic flux network analysis of hydrogen production from crude glycerol by Clostridium pasteurianum[J].Bioresource Technol,2017,242:169-177.
[9] WU X, YAO H, LIU Q, et al. Producing acetic acid of acetobacter pasteurianus by fermentation characteristics and metabolic flux analysis[J].Appl Biochem and Biotech,2018,186(1):1-16.
[10]刘朝辉,齐崴,何志敏.地衣芽孢杆菌发酵生产β-甘露聚糖酶的代谢通量分析[J].过程工程学报,2007,7(6):1163-1168.
[11]潘冬瑞,李啸,张瑶,等.重组大肠杆菌E.coli P84A/MC1061 发酵生产卤醇脱卤酶的研究[J].天津农业科学,2013,19(7):6-9.
[12]庞伟. 13C 标记技术测定Escherichia coli TUQ2 厌氧中心碳代谢途径通量分布[D].天津:天津大学,2008.
[13]廖祥兵,陈晓明,肖伟,等.DNS 法定量测定还原糖的波长选择[J].中国农学通报,2017,33(15):144-149.
[14]谢涛,廖安平,黄春妤,等.浊度法快速测定甘露醇发酵液中的生物量[J].广西民族大学学报:自然科学版,2008,14(3):75-77.
[15]谭松林.反相超高效液相色谱法测定水质中的乙酸含量[J].绿色科技,2017(20):40-41.
[16]张建新,穆广亚,陈琳,等.类芽孢杆菌产β-甘露聚糖酶的分离与纯化[J].中国酿造,2016,35(10):68-71.
[17]ÖZKAN P,SARIYAR B,ÜTKÜR F Ö,et al.Metabolic flux analysis of recombinant protein overproduction in Escherichia coli[J].Biochem Eng J,2005,22(2):167-195.
[18] KLAMT S, KAMP A V. An application programming interface for CellNetAnalyzer[J].Biosystems,2011,105(2):162-168.
[19]黎明,唐奇,李东霞,等.谷氨酸棒杆菌发酵生产1,5-戊二胺的代谢流分析[J].天津科技大学学报,2015(1):9-13.
[20] QUIRÓS M, MARTÍNEZ-MORENO R, ALBIOL J, et al. Metabolic flux analysis during the exponential growth phase of Saccharomyces cerevisiae in wine fermentations[J].Plos One,2013,8(8):e71909.